「原子」の版間の差分
Baudanbau20 (会話 | 投稿記録) m リンク先とリンク文が同一 |
|||
| (2人の利用者による、間の2版が非表示) | |||
| 1行目: | 1行目: | ||
{{Otheruses}} |
{{Otheruses}} |
||
{{Infobox particle |
{{Infobox particle |
||
| 背景色 = |
| 背景色 = |
||
| 名前 = 原子 |
| 名前 = 原子 |
||
| 画像 = [[Image:Helium atom QM.svg|300px|Helium atom ground state]] |
|||
| 画像 = |
|||
| 説明 = [[ヘリウム]]原子の[[原子核]] (赤) と[[電子雲]]の分布 (黒) を描いた模式図。ヘリウム4の原子核 (右上) は実際には電子雲とよく似た球対称である。また、より複雑な原子核は必ずしも球対称とならない。黒い横帯は1[[オングストローム]] ({{val|e=-10|u=m}}または{{val|100|ul=pm}}) の長さを示す。 |
|||
| 説明 = |
|||
| 型数 = |
| 型数 = |
||
| 分類 = 化学元素の最小単位<!-- Smallest recognized division of a chemical element --> |
|||
| 分類 = |
|||
| 組成 = [[陽子]]と[[中性子]]からなる[[原子核]]および[[電子]]<!-- [[Electron]]s and a compact [[atomic nucleus|nucleus]] of [[proton]]s and [[neutron]]s --> |
|||
| 組成 = [[原子核]]と[[電子]]または[[エキゾチック原子]] |
|||
| 統計 = |
| 統計 = |
||
| グループ = |
| グループ = |
||
| 18行目: | 18行目: | ||
| 発見 = |
| 発見 = |
||
| 記号 = |
| 記号 = |
||
| 質量 = {{val|1.67|e=-27}} - {{val|4.52|e=-25|u=kg}} |
|||
| 質量 = |
|||
| 平均寿命 = |
| 平均寿命 = |
||
| 崩壊粒子 = |
| 崩壊粒子 = |
||
| 電荷 = ゼロ(中性)または[[イオン]]電荷<!-- zero (neutral), or [[ion]] charge --> |
|||
| 電荷 = |
|||
| 荷電半径 = 31 pm ([[ヘリウム|He]]) - 298 pm ([[セシウム|Cs]]) ([[原子半径]])<!-- [[Diameter]] range => 62 pm ([[Helium|He]]) to 520 pm ([[Caesium|Cs]]) ([[Atomic radii of the elements (data page)|data page]]) --> |
|||
| 荷電半径 = |
|||
| 電気双極子モーメント = |
| 電気双極子モーメント = |
||
| 電気的分極率 = |
| 電気的分極率 = |
||
| 50行目: | 50行目: | ||
}} |
}} |
||
'''原子'''(げんし、{{Lang-en-short|atom}})は化学的手段では分割できない[[元素]]の最小単位であり、[[陽子]]と[[中性子]]からなる[[原子核]]と、それを取り囲む電磁気的に束縛された[[電子]]の雲から構成される<ref>{{Cite web |url=https://www.nrc.gov/reading-rm/basic-ref/glossary/atom.html |title=Atom {{!}} Glossary {{!}} Basic References {{!}} NRC Library |access-date=2023-10-22 |publisher=[[アメリカ合衆国原子力規制委員会|米国原子力規制委員会]] |quote=''Atom - The smallest particle of an element that cannot be divided or broken up by chemical means. It consists of a central core (or nucleus), containing protons and neutrons, with electrons revolving in orbits in the region surrounding the nucleus.'' |website=NRC.gov}}</ref>。原子は[[化学元素]]の基本粒子であり、化学元素は原子に含まれる陽子の数によって区別される。たとえば、11個の陽子を含む原子は[[ナトリウム]]であり、29個の陽子を含む原子は[[銅]]である。[[中性子]]の数によって元素の[[同位体]]が定義される。 |
|||
{{読み仮名|'''原子'''|げんし|{{lang-el-short|τὸ ἄτομον, ἡ ἄτομος}}、{{lang-en-short|atom}}}}という言葉には以下の3つの異なった意味がある。 |
|||
原子は非常に小さく、直径は通常100[[ピコメートル]](pm)程度である。人間の毛髪の幅は、約100万個の炭素原子を並べた距離に相当する。これは可視光の最短波長よりも小さいため、従来の[[顕微鏡]]では原子を見ることはできない。原子は非常に小さく、[[量子効果]]による作用を受けるため、[[古典物理学]]では原子の挙動を正確に予測することは不可能である。 |
|||
#紀元前5 - 4世紀の[[古代ギリシア]]の[[哲学者]][[レウキッポス]]と[[デモクリトス]]が提唱した、自然を構成する分割不可能な最小単位。[[哲学]]上の概念であり、[[経験的証拠|経験的検証]]によって[[証明]]された[[科学]]上の[[対象]]ではない。''詳細は「[[原子論]]」を参照。'' |
|||
# 19世紀前半に提唱され、20世紀前半に確立された、[[元素]]の最小単位。その実態は[[原子核]]と[[電子]]の[[電磁相互作用]]による[[束縛状態]]である。[[物質]]のひとつの中間単位であり、内部構造を持つため、上述の概念「究極の分割不可能な単位」に該当するものではない。 |
|||
# 上述の原子の概念を拡張し、一般に複数の[[粒子]]の電磁相互作用による束縛状態を原子と定義した時、この意味における原子のうち、原子核と電子のみからなるもの以外を[[異種原子]]と言う。 |
|||
原子の[[質量]]の99.94%以上は原子核にある。原子核の陽子は正の[[電荷]]を、電子は負の電荷を持つが、中性子はあっても電荷を持たない。陽子と電子の数が通常のように等しい場合、原子は電気的に中性である。陽子より電子が多い原子は全体として負の電荷を持ち、陰[[イオン]](または負イオン、アニオン)と呼ばれる。逆に、電子より陽子が多い原子は全体として正の電荷を持ち、陽イオン(または正イオン、カチオン)と呼ばれる。 |
|||
== 概要 == |
|||
[[ドイツ語]]におけるAtomという言葉は、元は[[古代ギリシア語]]の τò ἄτομον や ἡ ἄτομος であり、「分割できないもの」という意味である。物質に分割不可能な最小構成単位が存在するという考えは[[古代ギリシア]]の時代に遡り、またそのような最小構成単位の存在に対する反論も歴史的になされてきた。 |
|||
原子を構成する電子は[[電磁気学|電磁気力]]によって原子核内の陽子に引き寄せられる。原子核内の陽子と中性子は[[核力]]によって互いに引き合っている。この核力は通常、正電荷を帯びた陽子どうしが反発する電磁気力よりも強い。しかし特定の状況下では、反発する電磁気力が核力よりも強くなる。この場合、原子核は[[核分裂反応|分裂]]して、[[核種変換|さまざまな元素が残る]]。これは[[原子核崩壊]]の一形態である。 |
|||
紀元前5~4世紀、[[古代ギリシア]]の哲学者[[デモクリトス]]らは、自然を構成するそれ以上分割できない最小単位として無数の原子と空虚が存在するという[[原子論]]の[[仮説]]を唱えた。[[17世紀]]の[[フランス]]の哲学者[[ルネ・デカルト|デカルト]]は、『哲学原理』において、物質の部分は、どれほど小さくても延長を持っている以上、思惟の上では、さらに分割できる。ゆえに原子(冒頭の1番目の意味の)は存在しないと主張した<ref>デカルト『デカルト・哲学の原理』、井上庄七、水野和久 訳、中央公論社(世界の名著27)、1995年、380頁</ref>。[[18世紀]]の[[ドイツ]]の哲学者[[イマヌエル・カント|カント]]は、『純粋理性批判』において、[[理性]]は原子に対して合理的な真理を確立しえないとした(第二[[アンチノミー]])。 |
|||
原子は[[化学結合]]によって1つまたは複数の他の原子と結合し、[[分子]]や[[結晶]]などの[[化合物]]を形成することができる。自然界で観察されるほとんどの物理的変化は、原子が互いに結合したり分離する能力が引き起こしている。[[化学]]は、こうした変化を研究する学問である。 |
|||
[[近代]]に入り、現代的な意味での[[元素]](化学元素)の概念が確立されると、「原子」はその最小構成単位を意味するようになり、これが現代的な意味での原子となった。当初は空想的な存在であった「原子」は、その後の研究でその存在が確実視されていくと共に、その「原子」が更に内部構造を持つことも明らかになっていった。現代的な意味での原子は、もはや究極の分割不可能な単位ではなく、あくまで元素(これももはや世界の究極の構成要素ではないが)が元素としての性質を保ちつづけることができる限りにおいての最小単位である。 |
|||
== 原子論の歴史 == |
|||
「原子」という言葉が、その原義と矛盾する、物質の一つの構成単位に割り当てられたので、その後「(仮説的な)分割不可能な単位」という概念を指すために「[[素粒子]]」という言葉が新たに造語され用いられている。つまり、かつて「原子論」と呼ばれる分野で行われていた科学的な実験・推察・考察は、現在では「[[素粒子論]]」と呼ばれる分野において行われている。 |
|||
{{Main|原子論 (科学)}} |
|||
=== 哲学において === |
|||
冒頭定義文の2番目の意味での原子(=現代科学における、中間構成単位としての原子)は、先述のとおり[[元素|化学元素]]の最小単位であり、下部構造として[[原子核]]と[[電子]]が存在する。原子核と電子は[[電磁相互作用]]([[クーロンの法則|クーロン力]])によって結びつき、かつ[[量子条件]]に基づく一定の安定した運動エネルギーを持っている。また、原子核は更に[[陽子]]と[[中性子]]から構成され<ref group="注釈">ただし[[軽水素]]の原子核は一つの陽子のみで構成され中性子を含まない。</ref>、その組み合わせに応じて現在約3000から約6000種類の原子の存在が知られている。ここで原子の[[化学]]的性質は、原子核の電荷(=[[陽子]]の数=中性な場合の[[電子]]の数)によってほぼ規程されることが経験的・[[量子力学|理論的]]に知られているため、陽子の数が等しいものは同じ元素を構成する原子として扱われており、2018年現在、118種類の元素(原子)の発見が国際的に認められている。 |
|||
{{Main|原子論<!--Atomism-->}} |
|||
物質が不可分の小さな粒子からできているという基本的な考え方は、多くの古代文化に登場する古い考え方である。アトム(''atom'')という言葉は、[[古代ギリシア語]]で「切断できない」という意味のアトモス(''atomos'')に由来する{{efn|否定語「a-」と「切断」を意味する「{{Lang|grc|τομή}}」の組み合わせ。<!-- a combination of the negative term "a-" and "τομή," the term for "cut" -->}}。この古代の考えは、科学的な推論というよりも、むしろ哲学的な推論に基づいていた。現代の原子論は、こうした古い概念に基づいているわけではない<ref>{{cite book|last1=Pullman|first1=Bernard|title=The Atom in the History of Human Thought|date=1998|publisher=Oxford University Press|location=Oxford, England|isbn=978-0-19-515040-7|pages=31–33|url=https://books.google.com/books?id=IQs5hur-BpgC&q=Leucippus+Democritus+atom&pg=PA56|access-date=25 October 2020|archive-date=5 February 2021|archive-url=https://web.archive.org/web/20210205165029/https://books.google.com/books?id=IQs5hur-BpgC&q=Leucippus+Democritus+atom&pg=PA56|url-status=live}}</ref><ref>[[#refMelsen1952|Melsen (1952). ''From Atomos to Atom'', pp. 18–19]]</ref>。19世紀初頭、科学者[[ジョン・ドルトン]]は、化学元素が重量の離散的な単位で結合しているように見えることに気づき、これを物質の基本単位な単位と考え、その単位を指す言葉として「原子」という言葉を使うことにした<ref>[[#refPullman1998|Pullman (1998). ''The Atom in the History of Human Thought'', p. 198]]: "Dalton reaffirmed |
|||
that atoms are indivisible and indestructible and are the ultimate constituents of matter."</ref>。約1世紀後、ドルトンの原子は、実際には分割不可能ではないことが発見されたが、この言葉が定着した。 |
|||
=== ドルトンの倍数比例の法則 === |
|||
原子の[[原子半径|半径]]は[[1 E-10 m|10<sup>-8</sup>cm]]程度であり、[[質量]]は[[1_E-27_kg|10<sup>-24</sup> - 10<sup>-22</sup>g]]程度である。地球上では原子は通常、複数の原子が[[化学結合]]によって結びついた[[分子]]や[[結晶]]として存在しているが、[[希ガス]]のように1個の原子が単独で存在している場合([[単原子分子]])もあり、宇宙空間のような[[真空]]に近い環境下では希ガス以外の原子も単独で存在している。 |
|||
[[File:A New System of Chemical Philosophy fp.jpg|right|thumb|[[ジョン・ドルトン]]の『化学哲学の新体系(''New System of Chemical Philosophy'')』に描かれたさまざまな原子と分子 (1808年)]] |
|||
1800年代初頭、イギリスの化学者[[ジョン・ドルトン]]は、自身や他の科学者が集めた実験データをまとめ、現在「[[倍数比例の法則]]」として知られる法則を発見した。彼は、ある化学元素を含む化合物について、化合物中の元素の含有量を重量で表現したとき、小さな整数の比率で異なることに気づいた。この法則から、各化学元素が重量の基本単位によって他の元素と結合していることが示唆され、ドルトンはこれらの単位を「原子」と呼ぶことにした。 |
|||
たとえば、[[酸化スズ]]には2種類あり、一方はスズ88.1%と酸素11.9%の灰色の粉末で、もう一方はスズ78.7%と酸素21.3%の白い粉末である。これらの数値を整理すると、灰色粉末にはスズ100 gに対して約13.5 gの酸素が、白色粉末にはスズ100 gに対して約27gの酸素が含まれる。13.5と27の比率は 1:2 である。ドルトンは、これらの酸化物には、スズ原子1個につき1個または2個の酸素原子が存在すると結論づけた([[酸化スズ(II)|SnO]] と [[酸化スズ(IV)|SnO<sub>2</sub>]])<ref>[[#refDalton1817|Dalton (1817). ''A New System of Chemical Philosophy'' vol. 2, p. 36]]</ref><ref>[[#refMelsen1952|Melsen (1952). ''From Atomos to Atom'', p. 137]]</ref>。 |
|||
日常世界がほぼ[[古典論]]による世界であるのに対し、原子・分子レベルでは[[量子論]]が重要になる。すなわち、ミクロスケール・ナノスケールの世界においても原子・分子のスケールに至る手前までは我々の直感的な物質感が概ね通用するが、原子・分子レベルの世界では直感的な物質感はもはや通用しなくなる。また、原子より大きな世界(原子核と電子の相互作用を含む)が[[電磁相互作用]]と[[重力相互作用]]に支配されているのに対し、原子核内部などより小さな世界では[[強い相互作用]]や[[弱い相互作用]]が重要な役割を担っており、原子(原子核)のスケールを境として自然を支配する[[基本相互作用]]の様相が大きく異なっている。 |
|||
ドルトンは[[酸化鉄]]も分析した。酸化鉄には、鉄78.1%と酸素21.9%の黒色粉末と、鉄70.4%と酸素29.6%の赤色粉末がある。この数値を整理すると、黒色粉末には鉄100 gに対して約28 gの酸素が、赤色粉末には鉄100 gに対して約42 gの酸素が含まれる。28と42の比率は 2:3 である。ドルトンは、これらの酸化物には、鉄原子2個につき2個または3個の酸素原子が存在すると結論づけた([[酸化鉄(II)|Fe<sub>2</sub>O<sub>2</sub>]] と [[酸化鉄(III)|Fe<sub>2</sub>O<sub>3</sub>]]){{efn|説明をわかりやすくするため、酸化鉄(II)の式を、従来のFeOではなく「Fe<sub>2</sub>O<sub>2</sub>」と表記した。<!--Iron(II) oxide's formula is written here as "Fe<sub>2</sub>O<sub>2</sub>" rather than the more conventional "FeO" because this better illustrates the explanation.-->}}<ref>[[#refDalton1817|Dalton (1817). ''A New System of Chemical Philosophy'' vol. 2, p. 28]]</ref><ref>[[#refMillington1906|Millington (1906). ''John Dalton'', p. 113]]</ref>。 |
|||
20世紀後半以降、我々にもっとも馴染みのある原子にかかわる事象のひとつは[[原子力]]だが、これは原子核の[[核分裂反応|分裂]]・[[原子核融合|融合]]によってエネルギーを得るものであり、現在の科学における原子が分割できない不変の存在ではないことを端的に表している。 |
|||
最後の例として、[[亜酸化窒素]]は窒素63.3%と酸素36.7%、[[一酸化窒素]]は窒素44.05%と酸素55.95%、そして[[二酸化窒素]]は窒素29.5%と酸素70.5%である。これらの数値を整理すると、亜酸化窒素では窒素140 gに対して酸素が80 g、一酸化窒素では窒素140 gに対して酸素が約160 g、二酸化窒素では窒素140 gに対して酸素が320 g含まれる。80、160、320の比率は 1:2:4 である。これらの酸化物のそれぞれの化学式は、[[亜酸化窒素|N<sub>2</sub>O]]、[[一酸化窒素|NO]]、そして [[二酸化窒素|NO<sub>2</sub>]] である<ref>[[#refDalton1808|Dalton (1808). ''A New System of Chemical Philosophy'' vol. 1, pp. 316–319]]</ref><ref>[[#refHolbrowEtAl2010|Holbrow et al. (2010). ''Modern Introductory Physics'', pp. 65–66]]</ref>。 |
|||
== 歴史 == |
|||
「物質」が「極めて小さく不変の粒子」から成り立つという概念や仮説は、[[紀元前]]5 - 4世紀の[[古代ギリシア]]の[[哲学者]]である[[レウキッポス]]と[[デモクリトス]]の[[原子論]]の頃から存在していた。だが、この考えは当時あまり評価されたとは言えず、その後およそ2000年ほどの間、大半の人々から忘れ去られていた。 |
|||
=== 異性 === |
|||
1803年のイギリスの[[化学者]][[ジョン・ドルトン|ドルトン]]が、近代的な原子説を唱えた。彼は、[[化学反応]]の前後の物質の[[質量]]の変化に着目し、物質には単一原子(現在の原子)と複合原子(現在の分子)がある、との説を述べた。だが、当時の科学者の多くは物質に本当にそのような構成単位があるのか大いに疑っていた。科学者の共同体では「原子が存在するとは信じません」と言う科学者の方が、むしろまともだと考えられていたという<ref>デヴィッド・リンドリー『ボルツマンの原子 理論物理学の夜明け』、松浦俊輔 訳、青土社、2003年、1頁</ref>。 |
|||
科学者たちは、物質の中には、全く同じ化学含有量でありながら異なる性質を持つものがあることを発見した。たとえば、1827年、[[フリードリヒ・ヴェーラー]]は、[[雷酸銀(I)|雷酸銀]]と[[シアン酸銀]]がともに銀107部、炭素12部、窒素14部、酸素12部であることを発見した(現在では、両者の化学式はともにAgCNOであることがわかっている)。1830年、[[イェンス・ヤコブ・ベルセリウス]]は、この現象を説明するために[[異性体|異性]](''isomerism'')という言葉を導入した。1860年、[[ルイ・パスツール]]は、異性体の分子は組成は同じだが、原子の配置が異なるのではないかという仮説を立てた<ref>[[#refPullman1998|Pullman (1998). ''The Atom in the History of Human Thought'', p. 230]]</ref>。 |
|||
1874年、[[ヤコブス・ヘンリクス・ファント・ホッフ]]は、炭素原子が四面体配置で他の原子と結合することを提案した。彼は、これに基づいて有機分子の構造を説明し、化合物がいくつの異性体を持ち得るかを予測することができた。[[ペンタン]](C<sub>5</sub>H<sub>12</sub>)を例に考えてみよう。ファント・ホッフの分子モデリング法によると、ペンタンには3つの配置が可能であると予測でき、科学者たちは実際に3つのペンタンの異性体を発見した<ref>[[#refMelsen1952|Melsen (1952). ''From Atomos to Atom'', pp. 147–148]]</ref><ref>Henry Enfield Roscoe, Carl Schorlemmer (1895). [https://books.google.com/books?id=JU1KAAAAYAAJ&pg=PA121 ''A Treatise on Chemistry'', Volume 3, Part 1, pp. 121–122]</ref>。 |
|||
19世紀後半、[[ルートヴィヒ・ボルツマン]]は、[[気体]]を原子仮説で想定されている「原子」なるものの集合と考えれば、(当時知られていた)[[気体]]の特性の多くが説明できると考えた。「原子」なる仮説的存在が動き回っているとすると、[[温度]]や[[圧力]]の性質も説明しやすいし、[[蒸気機関]]において熱い気体がピストンを押すという仕事をすることも説明しやすかった。 |
|||
{{multiple image |
|||
[[Image:Plum pudding atom.svg|thumb|180px|right|'''[[ブドウパンモデル]]''' [[1904年]]3月にトムソンが発表した原子モデル。 |
|||
| align = center |
|||
正に[[帯電]]した「スープ」の中に、負の[[電荷]]を持つ[[電子]]が埋まっている。 |
|||
| total_width = 600 |
|||
当時はまだ原子核の存在は知られていなかったトレニ |
|||
| footer = [[ヤコブス・ヘンリクス・ファント・ホッフ]]の分子構造モデリング法は、[[ペンタン]] (C<sub>5</sub>H<sub>12</sub>) について3つの異性体の可能性を正しく予測した。 |
|||
[[1911年]]、ラザフォードが行った原子核の存在を示す実験 |
|||
| image1 = Pentane-3D-balls.png |
|||
([[ラザフォード散乱]])により、このモデルは否定された。]] |
|||
| alt1 = |
|||
[[画像:Rutherford atom.svg|thumb|180px|right|長岡半太郎及びラザフォードの原子モデル。正の電荷を持つ原子核の周りに電子が存在するとした。]] |
|||
| caption1 = [[N-ペンタン|n-ペンタン]] |
|||
[[画像:Helium atom QM.svg|thumb|180px|right|現在の原子モデル。[[ヘリウム]]原子<!--Helium atom ground state.-->。電子が雲状に描かれている(→[[電子雲]])。]] |
|||
| image2 = Isopentane-3D-balls.png |
|||
| alt2 = |
|||
| caption2 = [[イソペンタン]] |
|||
| image3 = Neopentane-3D-balls.png |
|||
| caption3 = [[ネオペンタン]] |
|||
}} |
|||
=== ブラウン運動 === |
|||
20世紀初頭に[[アーネスト・ラザフォード|ラザフォード]]と[[フレデリック・ソディ|ソディ]]が発見した[[ウラン]]の[[放射壊変]]は原子の概念を大きく変えた。原子は不変の粒子ではなくなったからである。これに先立つ[[陰極線]]の発見とあわせ、近代的な原子モデルを確立したのが[[ジョセフ・ジョン・トムソン|トムソン]]である。彼の[[ブドウパンモデル]]はちょうど、ぶどう[[パン]]のように、正に帯電した「パン」の中にブドウのように[[電子]]が埋まっているというものだった。一方、[[長岡半太郎]]は正に荷電した[[原子核]]のまわりを電子が回っているとする、惑星系に似た原子モデルを考案した。その後、ラザフォードは実験によって原子核の存在を確認し([[ラザフォード散乱]])、[[ラザフォードの原子模型|惑星型の原子モデル]]を確立した。 |
|||
1827年、イギリスの植物学者[[ロバート・ブラウン]]は、水中に浮遊する花粉粒から流出した微粒子が、明確な理由もなく絶えず揺れ動くことを観察した。1905年、[[アルベルト・アインシュタイン]]は、この[[ブラウン運動]]は[[水]]の分子が微粒子に絶え間なく衝突することによって引き起こされると理論化し、それを記述する数学モデルを開発した<ref name="einstein">{{cite journal|last1=Einstein|first1=A.|title=Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen|journal=Annalen der Physik|volume=322|pages=549–560|year=1905|doi=10.1002/andp.19053220806|bibcode = 1905AnP...322..549E|issue=8 |hdl=10915/2785|url=http://sedici.unlp.edu.ar/bitstream/handle/10915/2785/Documento_completo__.pdf?sequence=1|doi-access=free}}</ref>。このモデルは1908年、フランスの物理学者[[ジャン・ペラン]]によって実験的に検証され、彼はアインシュタインの方程式を使用して、1[[モル]]に含まれる原子の数と原子の大きさを計算した<ref>{{Cite web |title=The Nobel Prize in Physics 1926 |url=https://www.nobelprize.org/prizes/physics/1926/perrin/lecture/ |access-date=2023-02-08 |website=NobelPrize.org |language=en-US}}</ref><ref>[[#refPerrin1909|Perrin (1909). ''Brownian Movement and Molecular Reality'', p. 50]]</ref>。 |
|||
=== 電子の発見 === |
|||
長岡やラザフォードのモデルの妥当性は実験的には確かであったが、一方で原子の安定性を[[理論]]的に説明することは困難であった。原子核のまわりを回る電子は、既知の[[電磁気学]]によれば[[電磁波]]を放出して一瞬のうちに原子核に落ち込んでしまうからである。[[1913年]]、[[ニールス・ボーア]]は原子の安定性を説明するために[[量子条件]]に基づく電子の円軌道モデル([[ボーアの原子模型]])を考案した。ボーアのモデルは実験的に見積もられた原子半径と同程度の原子半径を与え、更に[[ボーアの原子模型#水素原子の輝線スペクトル|水素原子のスペクトル]]をほぼ説明できることを示した。また、[[ゾンマーフェルト]]はボーアのモデルを楕円軌道モデルに拡張し、より実験との整合性の高いモデルとした。量子条件は、当初は原子の安定性を説明するための方便に過ぎないと見做されていたが、その後の[[量子力学]]の発展によって、それまでの物理的世界観を根本から変える自然の基本[[原理]]であることが分かった。 |
|||
{{Main|{{ill2|電磁気理論の歴史|en|History of electromagnetic theory}}}} |
|||
1897年、[[J.J.トムソン]]は、電場や磁場によって[[陰極線]]が偏向されることから、陰極線は電磁波ではなく粒子であることを発見した。彼は、この粒子が[[水素]](最も軽い原子)の1,800倍軽いことを測定した。トムソンは、これらの粒子は陰極の原子から来たもので、[[亜原子粒子]](''subatomic particles'')であると結論づけた。彼はこれらの新しい粒子を微粒子(''corpuscles'')と呼んだが、後に[[電子]](''electrons'')と改名された。トムソンはまた、電子が[[光電効果|光電物質]]や放射性物質から放出される粒子と同一であることも示した<ref name="Thomson">{{cite journal|last=Thomson|first=J.J.|title=On bodies smaller than atoms|journal=The Popular Science Monthly|pages=323–335|date=August 1901|url=https://books.google.com/books?id=3CMDAAAAMBAJ&pg=PA323|access-date=21 June 2009|archive-date=1 December 2016|archive-url=https://web.archive.org/web/20161201152039/https://books.google.com/books?id=3CMDAAAAMBAJ&pg=PA323|url-status=live}}</ref>。やがて、電子が金属線に[[電流]]を流す粒子であることが認識された<ref>[http://library.thinkquest.org/C0111709/English/DC-Circuts/mechanism.html "The Mechanism Of Conduction In Metals"] {{Webarchive|url=https://web.archive.org/web/20121025004809/http://library.thinkquest.org/ |date=25 October 2012 }}, Think Quest.</ref>。トムソンは、これらの電子が測定器の陰極の原子そのものから発生しており、このことは、原子はドルトンが考えていたような不可分なものではないことを意味していると結論づけた。 |
|||
=== 原子核の発見 === |
|||
現在では、原子と[[電子]]の関係については量子力学によって概ね解明されているが、[[原子核]]についてはまだ分からないことが多く、[[原子核物理学]]では理論的・実験的研究が盛んに行われている。また、[[量子力学]]の発展に伴い、当初の原子論が暗黙裡に含んでいた素朴な図式・[[世界観]](球状の何かの想定、モノが絶対的に実在しているという素朴な観念、つまり[[確率論]]的レベルを超えて実在しているという素朴な[[観念]])は根本的に崩壊した。物理学の理論全体としては、原子論は当初となえられていたものとは極めて異質なものになっている。 |
|||
[[File:Geiger-Marsden experiment expectation and result (Japanese).svg|thumb|right|[[ガイガー=マースデンの実験]]<br />(左) 予測される結果:アルファ粒子は[[プラム・プディングモデル]]を通過し、偏向はごくわずかである。<br />(右) 観測された結果:ごく一部のアルファ粒子が強い偏向を示した。]] |
|||
{{Main|ガイガー=マースデンの実験}} |
|||
[[J・J・トムソン|J. J.トムソン]]は、負電荷を帯びた電子は、原子の体積全体に分布する正電荷の海の中に分布していると考えた<ref>[[#refNavarro2012|Navarro (2012). ''A History of the Electron'', p. 94]]</ref>。このモデルは[[プラム・プディングモデル]]として知られている。 |
|||
== 原子の構造 == |
|||
原子は、正の[[電荷]]を帯びた原子核と、負の電荷を帯びた電子から構成されると考えられている。原子核はさらに陽子と電気的に中性な[[中性子]]から構成される(ただし[[水素|<sup>1</sup>H]]と[[リチウム3|<sup>3</sup>Li]]は中性子を含まない)。陽子と中性子の個数の合計を[[質量数]]と呼ぶ。原子核の半径は原子の半径の約10万分の1(1 [[フェムトメートル|fm]]程度)と小さい。なお、一般的な原子の模式図は原子核の大きさを原子に対して数分の1程度に描いているが、これは実態とはかけ離れた[[デフォルメ]]である。原子は硬い球体というよりも、むしろ真空の中に存在する点状の原子核と電子である。但し、電子はしばしば描かれる模式図のように特定の軌道を描いて原子核のまわりを回っているのではなく、原子核のまわりに確率的に分布しており、原子核を電子雲が包むイメージのほうがより現実に近い。 |
|||
[[アーネスト・ラザフォード]]と、同僚の[[ハンス・ガイガー]]と[[アーネスト・マースデン]]は、[[アルファ粒子]]([[ラジウム]]など特定の放射性物質から放出される正電荷を帯びた粒子)の[[電荷質量比]]を測定する装置を製作する際に困難に出会ったことから、トムソンのモデルに疑問を抱いた。アルファ粒子が検出器内の空気によって散乱され、測定の信頼性が低下していた。トムソンの場合、陰極線の研究で同様の問題に遭遇したが、装置内をほぼ完全な真空にして解決していた。ラザフォードは、アルファ粒子が電子よりはるかに重いため、これと同じ問題に出会うとは考えられなかった。トムソンの原子モデルによれば、原子内の正電荷はアルファ粒子を偏向させるほど強い電場を発生させるだけ集中しておらず、また電子は非常に軽いので、はるかに重いアルファ粒子によって簡単に押しのけられるはずである。しかし散乱はあったので、ラザフォードと同僚たちは、この散乱を注意深く調べることにした<ref name="Heilbron2003p64-68">[[#refHeilbron2003|Heilbron (2003). ''Ernest Rutherford and the Explosion of Atoms'', pp. 64–68]]</ref>。 |
|||
=== 原子の大きさと原子半径 === |
|||
原子の大きさの直感的な定義は[[電子雲]]の広がりであり、一般には球状とみなされているが、電子雲は文字通り雲状あるいはもや状のものであり、その境界面を定義することは難しい。特に、[[化学結合]]をして分子を形成している場合等には、どこまでがある原子に属している電子雲かを定義するのは難しい。また、原子が電子を得るか失うかして[[イオン]]となった場合には、原子雲の広がりも当然変化し、原子の大きさも異なってくる。 |
|||
1908年から1913年にかけて、ラザフォードらは、薄い金属箔にアルファ粒子を衝突させる一連の実験を行った。その結果、彼らは、90度以上の角度で偏向を受けるアルファ粒子を発見した。これを説明するために、ラザフォードは、原子の正電荷は、トムソンが考えていたように原子の体積全体に分布しているのではなく、中心にある小さな原子核に集中していると提案した。観測されたようにアルファ粒子を偏向させるほど十分な強い電場を作り出すことができるのは、このような極端な電荷の集中だけである<ref name="Heilbron2003p64-68" />。このモデルは[[ラザフォードの原子模型|ラザフォード・モデル]]として知られている。 |
|||
このような事情のため、原子の大きさを定量的に示す[[原子半径]]にはいくつかの定義があり、場合によって使い分けられる。 |
|||
=== |
=== 同位体の発見 === |
||
{{Main|同位体}} |
|||
原子の[[質量]]を表すのには、[[統一原子質量単位]](u)がしばしば用いられる。これは、質量数12の[[炭素]]原子である<sup>12</sup>C([[炭素12]])1個(ただし、[[静止]]して[[基底状態]]にあり自由な時)の質量を12 uと定義したものであり、1 u = 1.6605402(10)×10<sup>-27</sup> kgである。 |
|||
1913年、[[放射化学|放射化学者]]の[[フレデリック・ソディ]]は、[[放射性崩壊]]の生成物について実験していたとき、[[周期表]]の各位置に数種類の原子が存在することを発見した<ref name="npc1921" />。これらの原子は同じ性質を持っていたが、原子量は異なっていた。[[同位体]](isotopes)という言葉は、このように同じ元素に属する重さの異なる原子を表すのに適切な名前として、{{Ill2|マーガレット・トッド (医師)|en|Margaret Todd (doctor)|label=マーガレット・トッド}}によって命名された。J.J.トムソンは、[[電離気体]]に関する研究を通じて{{Ill2|同位体分離|en|Isotope separation|label=同位体を分離する技術}}を確立し、その後、[[安定同位体]]の発見へとつながった<ref name="prsA_89_1_1913" />。 |
|||
=== ボーア・モデル === |
|||
また、原子の[[相対的]]な質量比を表すものとして[[原子量]]があり、これは先述の<sup>12</sup>C(炭素12)1個の質量を12と定めた場合の他の元素の質量比である。ある原子の原子量の値はその原子一個の質量をuで表した時の値と全く同一であるが、原子量はあくまで比率を表す量であり、単位を付けない[[無次元数]]である。 |
|||
[[File:Bohr atom animation 2.gif|right|thumb|[[ボーア・モデル]]では、電子がある軌道から別の軌道へ瞬時に「量子跳躍」し、その過程でエネルギーを得たり失ったりする。電子が軌道上にあるこの原子モデルは時代遅れとなった。]] |
|||
{{Main|ボーア・モデル}} |
|||
1913年、物理学者[[ニールス・ボーア]]は、原子の電子は原子核の周りを周回しているが、その軌道は有限であり、光子の吸収または放射に対応するエネルギーの離散的な変化でしか軌道間を移行することができないと仮定した原子モデルを提唱した<ref name="stern20050516" />。この量子化は、電子の軌道が安定である理由や{{Efn|通常、円運動する電荷は、加速時に電磁波を放出することで運動エネルギーを失う ([[シンクロトロン放射]]を参照)}}、元素が吸収または放出する電磁波の[[スペクトル線|スペクトル]]が不連続である理由を説明するために考案された<ref name="bohr19221211" />。 |
|||
原子量と質量数はほぼ同程度の大きさとなるが、その定義上必ず整数値をとる質量数とは異なり、<sup>12</sup>C以外の原子の原子量は厳密には小数になる。これは、原子核を構成する陽子と中性子の質量が微妙に異なり、かつそれら核子の結合エネルギーによる[[質量欠損]]が原子により異なるためである。それでも原子の相対質量は、凡そ質量数に近い数値をとる。 |
|||
同じ年の暮れ、[[ヘンリー・モーズリー (物理学者)|ヘンリー・モーズリー]]はニールス・ボーアの理論を支持する新たな実験的証拠を提示した。モーズリーは、これらの結果を基に、[[アーネスト・ラザフォード]]や{{ill2|アントニウス・ファン・デン・ブルーク|en|Antonius van den Broek}}のモデルを改良し、原子は原子核に周期表の原子番号と等しい数の正の{{Ill2|核電荷|en|Nuclear charge}}を持つと[[モーズリーの法則|提案]]した。この実験が行われるまで、[[原子番号]]が物理的かつ実験的な量であることは知られていなかった。今日でも受け入れられている原子モデルは、この原子番号と原子の核電荷が等しいというものである<ref name="Pais">{{Cite book|last=Pais|first=Abraham|year=1986|location=New York|title=Inward Bound: Of Matter and Forces in the Physical World|publisher=Oxford University Press|isbn=978-0-19-851971-3|pages=[https://archive.org/details/inwardboundofmat00pais_0/page/228 228–230]|url=https://archive.org/details/inwardboundofmat00pais_0/page/228}}</ref>。 |
|||
複数の同位体を含む元素では、整数値からさらに離れた値を取る場合がある。これは多くの元素では質量数の異なる原子([[同位体]])が存在し、その存在比率もまちまちなためである。例えば、<sup>12</sup>Cの原子量が厳密に12であるのに対し炭素の原子量は12.011であるが、これは炭素には<sup>12</sup>Cの他に少量の<sup>13</sup>C(更にごく少量の<sup>14</sup>C)が含まれているためである。原子量の概数は計算によって求めることができ、例えば塩素の原子量は35.453であるが、この場合<sup>35</sup>Clの存在比が約76%、<sup>37</sup>Clの存在比が24%となっているため、35×0.76+37×0.24という計算によって概数(35.48となり誤差は約0.1%)が求まる。 |
|||
1916年、[[ギルバート・ニュートン・ルイス]]によって、原子間の[[化学結合]]は、構成電子間の相互作用により形成されると説明された<ref name="jacs38_4_762" />。元素の{{Ill2|化学的性質|en|Chemical property}}は、[[周期律]]にほぼ従って繰り返されることが知られていたことから<ref>{{cite book|last=Scerri|first=Eric R.|title=The periodic table: its story and its significance|publisher=Oxford University Press US|year=2007|isbn=978-0-19-530573-9|pages=[https://archive.org/details/periodictableits0000scer/page/205 205–226]|url=https://archive.org/details/periodictableits0000scer/page/205}}</ref>、1919年、アメリカの化学者[[アーヴィング・ラングミュア]]は、原子内の電子が何らかの方法で結びついているもしくは集まっていれば、この現象を説明できると提案した。原子核を中心に周囲にある[[電子殻]]を電子の集団が占めると考えられた<ref name="jacs41_6_868" />。 |
|||
=== 原子と元素 === |
|||
原子とは、内部に持つ陽子と中性子の各個数の違いで区別される個々の粒子を指す。例えば炭素原子は中性子数の異なる<sup>12</sup>C、<sup>13</sup>C、<sup>14</sup>C類が存在する。一方元素は、中性子数に関わらず、ある特定の陽子数([[原子番号]])を持つ原子のグループを指す。例えば、「炭素は燃焼(酸素と結合)して[[二酸化炭素]]を生成する」と表現した場合の「炭素」や「酸素」は元素を意味する。 |
|||
ボーアの原子モデルは原子の最初で完全な物理モデルであった。これは、原子の全体構造、原子どうしの結合方法、水素のスペクトル線を説明するものである。ボーアのモデルは完全ではなく、より正確なシュレーディンガーモデルにすぐに取って代わられたが、物質が原子で構成されているという疑問を払拭するには十分だった。化学者にとっては、原子という概念は有用な発見的ツールであったが、物理学者にとっては、まだ誰も原子の完全な物理モデルを開発していなかったので、物質が本当に原子からできているのかどうかは疑問であった。 |
|||
=== 周期表 === |
|||
[[周期表|周期表(元素周期表)]]とは、[[元素]]を陽子の数と等しい原子番号の順に並べた表のこと。 |
|||
=== シュレーディンガー・モデル === |
|||
化学的、物理的に似た性質の原子(元素)を見やすくするため、一定の数ごとに折り返してまとめてある。下表は代表的なもので、他にもらせん型や円錐型、ブロック型など複数の形式が考案されている。表の最上段には1から18の数字が振られている。これを元素の族と呼ぶ。それぞれの升目には原子番号と元素記号が記されている。実用性を高めるため[[原子量]]を元素記号の下に記述することが一般的である。この場合、[[安定同位体]]を持たない元素については既知の同位体の中で最も[[半減期]]の長いものや存在比の高いものの質量数をカッコ書きして記載する。また、色分けや記号などを用いて常温での相を表したり、[[遷移元素]]・[[半金属]]元素・[[人工放射性元素]]を表現したりすることもある。 |
|||
{{Main|行列力学}} |
|||
{{周期表}} |
|||
1925年、[[ヴェルナー・ハイゼンベルク]]は、[[量子力学]]の最初の一貫した数学的定式化([[行列力学]])を提唱した<ref name="Pais" />。その1年前、[[ルイ・ド・ブロイ]]が、すべての粒子はある程度[[ド・ブロイ波|波のように振る舞う]]ことを提案していた<ref>{{cite book |title=Introducing Quantum Theory |author1=McEvoy, J. P. |author2=Zarate, Oscar |publisher=Totem Books |year=2004 |isbn=978-1-84046-577-8 |pages=110–114}}</ref>。1926年、[[エルヴィン・シュレーディンガー]]はこの考えを用いて、電子を空間の点ではなく三次元の[[波形]]として記述する原子の数学的モデル、[[シュレーディンガー方程式]]に発展させた<ref>{{cite web |last=Kozłowski |first=Miroslaw |year=2019 |title=The Schrödinger equation A History |url=https://www.researchgate.net/publication/332241721|accessdate=2020-06-16}}</ref>。 |
|||
波形を用いて粒子を記述することの結果として、ある時点における粒子の[[点 (数学)|位置]]と[[運動量]]の両方を正確に求めることは数学的に不可能となる。このことは、1927年に[[ヴェルナー・ハイゼンベルク]]が定式化した[[不確定性原理]]として知られるようになった<ref name="Pais" />。この概念では、位置の測定精度が一定であれば、運動量については可能性のある値の範囲(つまり確率値)しか得られず、逆もまた同様である<ref>{{cite web|author=Chad Orzel|url=https://www.youtube.com/watch?v=TQKELOE9eY4|title=What is the Heisenberg Uncertainty Principle?|website=TED-Ed|date=16 September 2014|via=YouTube|archive-url=https://web.archive.org/web/20150913185956/https://www.youtube.com/watch?v=TQKELOE9eY4|archive-date=13 September 2015|url-status=live|accessdate=2015-10-26}}</ref>。このモデルは、水素よりも大きな原子の特定の構造パターンや[[スペクトル線|スペクトル]]パターンなど、従来のモデルでは説明できなかった原子の挙動に関する観測結果を説明することができた。こうして、原子の惑星型モデルは破棄され、「特定の電子」が最も観測されやすい原子核周辺の[[原子軌道]]ゾーンを記述するモデルが採用された<ref name="brown2007" /><ref name="harrison2000" />。 |
|||
=== 原子の構造模式図 === |
|||
[[ファイル:Bohr-model v Oxygen.png|thumb|一般的な原子の構造模式図]] |
|||
現実の原子は、原子の大きさに比べて原子核が極めて小さく、また電子は確率的に分布しているため、原子の構造を写実的に正確に描くことは困難であり、またそのような描写は原子の構造を理解する上で必ずしも有益ではない。そのため、原子の構造を示す際は人間の頭脳でも把握しやすいようにデフォルメ・再構成した模式図が通常は用いられる。右に示した図はその一例である。この図では[[酸素]]原子のうち最も存在量が多い<sup>16</sup>Oを表している。最内殻([[K殻]])に2個、その外側の殻([[L殻]])に6個の計8個の電子、核内に8個の陽子と8個の中性子の存在を読み取ることができる。 |
|||
=== |
=== 中性子の発見 === |
||
{{ |
{{Main|中性子の発見}} |
||
原子の質量は、[[質量分析法]]の開発によって、より正確に測定できるようになった。この装置は磁石を使ってイオンビームの軌道を偏向させるもので、原子の[[質量電荷比|質量と電荷の比]]によって偏向量が決まる。化学者[[フランシス・ウィリアム・アストン]]はこの装置を使用して、同位体の質量が異なることを示した。これらの同位体の[[原子質量]]は整数の量だけ異なり、{{Ill2|整数則|en|Whole number rule}}として知られている<ref name="pm39_6_449" />。これらの異なる同位体の説明は、1932年に物理学者[[ジェームズ・チャドウィック]]による、陽子(''proton'')とほぼ同じ質量を持つが荷電していない粒子である[[中性子]](''neutron'')の発見を待たなくてはならなかった。そして同位体は、原子核内の陽子数は同じで、中性子の数が異なる元素として説明された<ref name="chadwick1935" />。 |
|||
=== 核分裂反応、素粒子物理学 === |
|||
{{Main|核分裂反応|素粒子物理学|{{ill2|素粒子物理学の歴史|en|History of subatomic physics}}}} |
|||
1938年、ラザフォードの門下生であったドイツの化学者[[オットー・ハーン]]は、[[超ウラン元素]]を得る目的でウラン原子に中性子を照射した。その代わりに、彼の化学実験では生成物として[[バリウム]]の存在が示された<ref name="Bowden" /><ref name="CHF" />。1年後、[[リーゼ・マイトナー]]と甥の[[オットー・フリッシュ]]が、ハーンの結果が最初の実験的な[[核分裂反応]]であることを検証した。1944年、ハーンは[[ノーベル化学賞]]を受賞した<ref name="nature143_3615_239" /><ref name="schroeder" />。ハーンの努力にもかかわらず、マイトナーとフリッシュの貢献は認められなかった<ref name="pt50_9_26" />。 |
|||
1950年代、改良された[[粒子加速器]]と[[粒子検出器]]の開発により、科学者は高エネルギーで運動する原子の影響を研究できるようになった<ref name="kullander2001" />。中性子と陽子は[[ハドロン]]または[[クォーク]]と呼ばれる小さな粒子の複合体であることがわかった。[[素粒子物理学]]における[[標準モデル]]が開発され、これらの[[素粒子]]とその相互作用を支配する力の観点から、原子核の性質を説明することに成功している<ref name="npp1990" />。 |
|||
== 構造 == |
|||
=== 亜原子粒子 === |
|||
{{Main|亜原子粒子}}原子(''atom'')という言葉はもともと、小さな粒子に切断できない粒子を意味するが、現代の科学的用法では、原子はさまざまな[[亜原子粒子]]({{Lang-en-short|subatomic particles}})から構成される物質の基本的な構成要素を指す。原子を構成する粒子は、[[電子]]、[[陽子]]、そして[[中性子]]である。 |
|||
電子は負の[[電荷]]を持ち、質量が {{val|9.11|e=-31|u=kg}} で、これらの粒子の中で圧倒的に小さく、そのため利用可能な技術で大きさを測定することができない<ref>{{cite book|last=Demtröder|first=Wolfgang|year=2002|title=Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics|url=https://archive.org/details/atomsmoleculesph00demt_277|url-access=limited|publisher=Springer|edition=1st|isbn=978-3-540-20631-6|oclc=181435713|pages=[https://archive.org/details/atomsmoleculesph00demt_277/page/n51 39]–42}}</ref>。[[ニュートリノ]]の質量が発見されるまで、電子は正の静止質量が測定された最も軽い粒子であった。通常の条件下において、電子は、正電荷を帯びた原子核に、その反対電荷から生じる引力によって束縛される。原子の電子数がその原子番号より大きい(または小さい)場合、原子は全体として負(または正)に帯電し、帯電した原子は[[イオン]]と呼ばれる。電子は19世紀後半から知られていたが、[[ジョゼフ・ジョン・トムソン|J.J.トムソン]]の貢献が大きかった({{Ill2|素粒子物理学の歴史|en|History of subatomic physics}}を参照)。 |
|||
陽子は正の電荷を持ち、質量は{{val|1.6726|e=-27|u=kg}}、電子の質量の1,836倍である。原子内の陽子の数を[[原子番号]]という。[[アーネスト・ラザフォード]]は、1917-1919年にかけ、アルファ粒子の衝突を受けた窒素から水素原子核と考えられるものが放出されることを観測した。1920年までに、彼は水素原子核が原子内の別個の粒子であると考え、これを[[陽子]]と名付けた。 |
|||
中性子は電荷を持たず、自由質量は {{val|1.6749|e=-27|u=kg}}で、電子の質量の1,839倍である<ref>{{cite book|last=Woan|first=Graham|year=2000|title=The Cambridge Handbook of Physics|publisher=Cambridge University Press|isbn=978-0-521-57507-2|oclc=224032426|page=[https://archive.org/details/cambridgehandboo0000woan/page/8 8]|url=https://archive.org/details/cambridgehandboo0000woan/page/8}}</ref><ref name="2014 CODATA">Mohr, P.J.; Taylor, B.N. and Newell, D.B. (2014), [http://physics.nist.gov/constants "The 2014 CODATA Recommended Values of the Fundamental Physical Constants"] {{Webarchive|url=https://web.archive.org/web/20120211083747/http://physics.nist.gov/cuu/Constants/index.html |date=11 February 2012 }} (Web Version 7.0). The database was developed by J. Baker, M. Douma, and [[:en:Svetlana Kotochigova|S. Kotochigova]]. (2014). National Institute of Standards and Technology, Gaithersburg, Maryland 20899.</ref>。中性子は3つの構成粒子の中で最も重いが、その質量は{{Ill2|核結合エネルギー|en|Nuclear binding energy}}によって減る可能性がある。中性子と陽子(総称して[[核子]]という)は、どちらも {{val|2.5|e=-15|u=m}} 程度の大きさを持つが、これらの粒子の「表面」は明確に定義されていない<ref>{{cite book|last=MacGregor|first=Malcolm H.|year=1992|title=The Enigmatic Electron|publisher=Oxford University Press|isbn=978-0-19-521833-6|oclc=223372888|pages=[https://archive.org/details/astronomyencyclo0000unse/page/33 33–37]|url=https://archive.org/details/astronomyencyclo0000unse/page/33}}</ref>。中性子は1932年にイギリスの物理学者[[ジェームズ・チャドウィック]]によって発見された。 |
|||
物理学の[[標準モデル]]では、電子は内部構造を持たない真の素粒子であり、陽子と中性子は[[クォーク]]と呼ばれる[[素粒子]]から構成される[[複合粒子]]である。原子には2種類のクォークがあり、それぞれが分数の電荷を持っている。陽子は、2個の[[アップクォーク]](それぞれの電荷は+{{sfrac|2|3}})と1個の[[ダウンクォーク]](電荷は−{{sfrac|1|3}})で構成されている。中性子は、1個のアップクォークと2個のダウンクォークで構成されている。この区別で、2種類の粒子の質量と電荷の違いが説明される<ref name="pdg2002" /><ref name="schombert2006" />。 |
|||
クォークは、[[グルーオン]]を介した[[強い相互作用]]([[強い力]]ともいう)によって結合している。陽子と中性子は、原子核の中で[[核力]]によって互いに結びついている。核力は強い力が残留したもので、その範囲や性質は多少異なる(詳しくは[[:en:Nuclear_force#The_nuclear_force_as_a_residual_of_the_strong_force|核力<small>(英語版)</small>]]を参照)。グルーオンは、物理的な力を媒介する素粒子である[[ゲージ粒子]]の一種である<ref name="pdg2002" /><ref name="schombert2006" />。 |
|||
=== 原子核 === |
|||
{{Main|原子核}} |
|||
[[File:Binding energy curve - common isotopes.svg|thumb|さまざまな同位体の[[結合エネルギー]]曲線。核子が原子核から脱出するのに要する結合エネルギーは同位体によって異なる。X軸は原子核中の核子数、Y軸は核子あたりの平均結合エネルギー(MeV)]]<!-- 「結合エネルギー」についてはセクションの最後まで説明されないため、ここで簡単に説明する。 --> |
|||
原子中で、すべての陽子と中性子は結合して、小さな[[原子核]]を構成する。原子核の半径はおよそ <math>1.07 \sqrt[3]{A}</math> [[フェムトメートル]](fm)で、ここに <math>A</math> は核子の総数である<ref>{{cite book|last=Jevremovic|first=Tatjana|year=2005|title=Nuclear Principles in Engineering|url=https://archive.org/details/nuclearprinciple00jevr_450|url-access=limited|publisher=Springer|isbn=978-0-387-23284-3|oclc=228384008|page=[https://archive.org/details/nuclearprinciple00jevr_450/page/n83 63]}}</ref>。原子核の半径は、10<sup>5</sup> fm [[オーダー (物理学)|オーダー]]の原子の半径よりはるかに小さい。核子どうしは、[[核力|強い残留力]]と呼ばれる短距離型の引力ポテンシャルによって結合している。2.5 fm 未満の距離では、この力は正電荷を帯びた陽子どうしが反発し合う[[静電気力]]よりもはるかに強い<ref>{{cite book|last1=Pfeffer|first1=Jeremy I.|last2=Nir|first2=Shlomo|year=2000|title=Modern Physics: An Introductory Text|publisher=Imperial College Press|isbn=978-1-86094-250-1|oclc=45900880|pages=330–336}}</ref>。 |
|||
同じ[[元素]]の原子は、[[原子番号]]と呼ばれる陽子の数が同じである。同じ元素でも、中性子の数が異なることがあり、それによってその元素の[[同位体]]が決まる。陽子と中性子の総数が[[核種]]を決定する。陽子に対する中性子の数が原子核の安定性を決定し、ある種の同位体は[[放射性崩壊]]を起こす<ref name="wenner2007" />。 |
|||
陽子、中性子、電子は[[フェルミ粒子]]({{Lang-en-short|fermion}}、フェルミオン)として分類される。フェルミ粒子は[[パウリの排他原理]]に従っており、複数の陽子のような[[同種粒子|同一]]のフェルミ粒子が同時に同じ量子状態を占めることを禁止される。したがって、原子核内のすべての陽子は、他のすべての陽子とは異なる量子状態をとらなければならず、原子核内のすべての中性子や、[[電子雲]]のすべての電子についても同様である<ref name="raymond" />。 |
|||
陽子の数と中性子の数が異なる原子核は、放射性崩壊によって陽子と中性子の数がより近くなることで、より低いエネルギー状態に変化する可能性がある。その結果、陽子と中性子の数が一致する原子は崩壊に対してより安定するが、原子番号が増えるにつれて、陽子の相互反発にともなう原子核の安定性を維持するために、中性子の割合が増加する<ref name="raymond" />。[[File:Wpdms physics proton proton chain 1.svg|right|thumb|upright|2個の陽子 (p) から1個の陽子と1個の中性子 (n) からなる重水素原子核を形成する核融合プロセスを示す。[[反物質]]電子である[[陽電子]] (e<sup>+</sup>) が、電子[[ニュートリノ]]とともに放出される。]] |
|||
原子核内の陽子と中性子の数を変えることができるが、それには強い力が働くため、非常に高いエネルギーを必要とする。[[核融合反応|核融合]]は、2つの原子核のエネルギー的な衝突などにより、複数の原子粒子が結合してより重い原子核を形成するときに起こる。たとえば、[[太陽]]の中心部では、陽子が相互反発([[クーロン障壁]])を乗り越えて融合し、1つの原子核を形成するために、3-10 keVのエネルギーを必要とする<ref name="mihos2002" />。[[核分裂反応|核分裂]]はその逆のプロセスで、通常は放射性崩壊によって原子核が2つの小さな原子核に分裂する。また、原子核は、高エネルギーの亜原子粒子や光子との衝突によっても変化することがある。これによって原子核内の陽子の数が変わると、原子は別の化学元素に変化する<ref name="lbnl20070330" /><ref name="makhijani_saleska2001" />。 |
|||
核融合反応後の原子核の質量が、個々の粒子の合計質量よりも小さい場合、2つの質量差は、[[アルベルト・アインシュタイン]]の[[質量とエネルギーの等価性|質量とエネルギー等価性]]の式、''e=mc<sup>2</sup>''(ここで ''m'' は質量損失、 ''c'' は[[光速]])で説明されるように、利用可能なエネルギーの一種([[ガンマ線]]や[[ベータ粒子]]の運動エネルギーなど)として放出される。この欠損は新しい原子核の[[結合エネルギー]]の一部であり、融合粒子が分離するためにこのエネルギーを必要とする状態で一緒に留まるのは、このエネルギーの回復不可能な損失のためである<ref>{{cite book|last1=Shultis|first1=J. Kenneth|last2=Faw|first2=Richard E.|title=Fundamentals of Nuclear Science and Engineering|year=2002|publisher=CRC Press|isbn=978-0-8247-0834-4|oclc=123346507|pages=10–17}}</ref>。 |
|||
[[鉄]]や[[ニッケル]]よりも原子番号が小さな原子核(核子数の合計が約60以下)を作り出す2個の原子核の核融合は、通常、[[発熱反応|発熱プロセス]]であり、2つの原子核を融合させるのに必要なエネルギーよりも多くのエネルギーを放出する<ref name="ajp63_7_653" />。[[恒星]]の核融合を自立反応にしているのは、このエネルギー放出プロセスである。より重い原子核では、[[核子]]あたりの結合エネルギーは減少し始める(上のグラフを参照)。このことは、原子番号が約26より大きく、[[質量数]]が約60より大きな原子核を生成する核融合プロセスは[[吸熱反応|吸熱プロセス]]であることを意味する。したがって、より質量が大きな原子核は、恒星の[[静水圧平衡]]を維持するのに必要なエネルギーを生み出す核融合反応を起こすことができない<ref name="raymond" />。 |
|||
=== 電子雲 === |
|||
{{Main|電子配置|電子殻|原子軌道}}{{See also|電気陰性度}}[[File:Potential energy well.svg|right|thumb|[[古典力学]]に従って、各位置 ''x'' に到達するのに必要な最小エネルギー ''V''(''x'') を示すポテンシャル井戸。古典的には、エネルギー ''E'' を持つ粒子は、''x''<sub>1</sub> と ''x''<sub>2</sub> の間の位置範囲に束縛される。]] |
|||
原子内の電子は、[[電磁気学|電磁気力]]によって原子核内の陽子に引き寄せられる。この力によって電子は、小さな原子核を取り囲む[[静電気学|静電]]{{Ill2|ポテンシャル井戸|en|Potential well}}の中に束縛され、電子が脱出するためには外部のエネルギー源が必要となる。電子が原子核に近づくほど、この引力は大きくなる。したがって、ポテンシャル井戸の中心付近に束縛された電子は、それよりも離れた位置にある電子よりも、脱出するのに多くのエネルギーを必要とする。 |
|||
電子は、他の粒子と同様に、[[粒子と波動の二重性|粒子と波]]の両方の性質を持っている。[[電子雲]]は、ポテンシャル井戸の内側にある領域で、各電子が一種の三次元[[定常波|定在波]](原子核に対して相対的に動かない波形)を形成している。この挙動は[[原子軌道]]によって規定される。原子軌道とは、電子の位置を測定したときに、その電子が特定の位置にあるように見える[[確率]]を記述する数学的関数である<ref name="science157_3784_13" />。原子核の周りには、このような離散的な(または[[量子化 (物理学)|量子化]]された)軌道の集合だけが存在する(他の考えられる波動パターンは、より安定した形へと急速に減衰するため)<ref name="Brucat2008" />。軌道は1つまたは複数のリング構造またはノード構造を持つことができ、大きさ、形状、方向がそれぞれ異なる<ref name="manthey2001" />。[[File:Atomic-orbital-clouds spdf m0.png|thumb|upright=1.5|[[水素様原子]]の原子軌道の確率密度と位相を示す3次元の図 ('''g'''軌道とそれ以上は表示されない)]] |
|||
それぞれの原子軌道は、電子の特定の[[エネルギー準位]]に対応している。電子は、新しい量子状態に遷移するのに十分なエネルギーの[[光子]]を吸収することで、その状態をより高いエネルギー準位に変えることができる。同様に、高いエネルギー準位にある電子は、[[自然放出]]によって余剰なエネルギーを光子として放射しながら、低いエネルギー準位に落ちることができる。量子状態のエネルギーの違いによって規定されるこれらの特徴的なエネルギー値が、原子スペクトル線{{Enlink|Spectroscopy#Atoms|英語版|en}}が生じる原因である<ref name="Brucat2008" />。 |
|||
原子から電子を除去または追加するのに必要なエネルギー量(電子結合エネルギー{{Enlink|Ionization energy#Electron binding energy|英語版|en}})は、[[結合エネルギー|核子の結合エネルギー]]よりもはるかに小さい。たとえば、水素原子から[[基底状態]]の電子を取り除くのに必要なエネルギーはわずか 13.6 eV であるのに対し<ref name="herter_8" />、[[重水素]]の原子核を分裂させるのに必要なエネルギーは 223万eV に達する<ref name="pr79_2_282" />。陽子と電子が同数であれば、原子は[[電荷|電気的]]に中性である。電子が不足または過剰な原子は[[イオン]]と呼ばれる。原子核から最も遠い電子は、近くにある別の原子に移動したり、原子間で共有されることがある。この機構により、原子が[[化学結合|結合]]して[[分子]]を構成したり、[[イオン結晶]]やネットワーク[[共有結合]]結晶のような他の種類の化合物と結合することができる<ref>{{cite book|last=Smirnov|first=Boris M.|year=2003|title=Physics of Atoms and Ions|url=https://archive.org/details/physicsatomsions00smir|url-access=limited|publisher=Springer|isbn=978-0-387-95550-6|pages=[https://archive.org/details/physicsatomsions00smir/page/n262 249]–272}}</ref>。 |
|||
== 特性 == |
|||
=== 原子核の性質 === |
|||
{{Main|同位体<!-- Isotope -->|安定同位体<!-- Stable isotope -->|{{ill2|核種のリスト|en|List of nuclides}}|{{ill2|同位体の安定性による元素のリスト|en|List of elements by stability of isotopes}}}} |
|||
定義により、原子核内の陽子の数が同じ2つの原子は同じ[[化学元素]]に属する。陽子の数が同じで中性子の数が異なる原子は、同じ元素の異なる同位体である。たとえば、すべての水素原子は陽子を1個だけ含んでいるが、中性子を含まない同位体([[水素の同位体#水素1(軽水素)|水素1]]。圧倒的に一般的な形。プロチウムとも呼ばれる<ref name="matis2000" />)、中性子を1つ含むもの([[水素の同位体#水素2(重水素)|重水素]])、中性子を2つ含むもの([[水素の同位体#水素3(三重水素)|トリチウム]])、[[水素の同位体|中性子を2つ以上含むもの]]がある。既知の元素は、1陽子の[[水素]]から118陽子の[[オガネソン]]まで、一連の原子番号を形成している<ref name="weiss20061017" />。原子番号82を超える元素の既知の同位体はすべて放射性であるが、83番元素([[ビスマス]])の放射性はわずかであり、事実上無視できる<ref name="s131">{{cite book|last=Sills|first=Alan D.|year=2003|title=Earth Science the Easy Way|publisher=Barron's Educational Series|isbn=978-0-7641-2146-3|oclc=51543743|pages=[https://archive.org/details/earthscienceeasy00alan/page/131 131–134]|url=https://archive.org/details/earthscienceeasy00alan/page/131}}</ref><ref name="dume20030423" />。 |
|||
[[地球]]上には約339の核種が天然に存在し<ref name="lidsay20000730" />、そのうち251(約74%)は崩壊は観測されておらず、「[[安定同位体]]」と呼ばれる。{{ill2|核種のリスト|en|List of nuclides|label=理論的}}に安定な核種は90に過ぎず、他の161核種(合計251)は、理論的にはエネルギー的に可能であるにも関わらず、崩壊は観測されていない。これらも正式には「安定」に分類される。さらに35の放射性核種は半減期が1[[地球の年齢|億年]]以上であり、[[太陽系]]の誕生時から存在していた可能性があるほど長寿命である。これらの286核種の集まりは{{Ill2|原始核種|en|Primordial nuclide}}として知られている。最後に、さらに53の短寿命核種が、原始核種崩壊の娘核種として(例: [[ウラン]]からの[[ラジウム]])、あるいは宇宙線衝突のような地球上の自然エネルギー過程の生成物として(例: 炭素14)、天然に存在することが知られている<ref name="tuli2005" />{{Efn|最近の更新情報については、[[ブルックヘブン国立研究所]]の [http://www.nndc.bnl.gov/chart Interactive Chart of Nuclides] {{Webarchive|url=https://web.archive.org/web/20200725182342/https://www.nndc.bnl.gov/nudat2/ |date=25 July 2020 }} を参照。}}。<!-- {{ill2|核種の一覧|en|List of nuclides}}を参照。これらの数字は[[WP:OR|独自研究]]ではなく、日常的な計算(表を数える)によって導き出されたものである。--> |
|||
80種類の化学元素には、少なくとも1つの[[安定同位体]]が存在する。概して、これらの元素の安定同位体はそれぞれ少数で、1元素あたり平均3.1種類の安定同位体が存在する。26個のモノアイソトピック元素{{Enlink|Monoisotopic element|英語版|en}}は安定同位体が1つしかない。対して、1つの元素で観測された安定同位体の最大数は、[[スズ]]の10である。[[テクネチウム|43]]番、[[プロメチウム|61]]番、そして[[ビスマス|83]]番以降のすべての元素には安定同位体がない<ref name="CRC">CRC Handbook (2002).</ref>{{rp|1–12}}。 |
|||
同位体の安定性は、陽子と中性子の比率に影響を受け、また、量子殻が満たされる([[閉殻]]という)ような中性子と陽子の特定数([[魔法数]])の存在にも影響を受ける。これらの量子殻は、原子核の[[殻模型|殻モデル]]内の一連のエネルギー準位に対応している。スズの陽子50個で満たされた殻のように、充填殻(じゅうてんかく)はその核種に著しい安定性を与える。既知の251の安定核種のうち、陽子数と中性子数がともに奇数であるものは、[[水素2]](重水素)、[[リチウム6]]、[[ホウ素の同位体|ホウ素10]]、[[窒素の同位体|窒素14]]の4つだけである。([[タンタルの同位体|タンタル180m]]は奇数で、観測的には安定しているが、非常に長い半減期で崩壊すると予測されている。)また、天然に存在する放射性奇-奇核種のうち、半減期が10億年を超えるものは、[[カリウム40]]、[[バナジウムの同位体|バナジウム50]]、[[ランタンの同位体|ランタン138]]、[[ルテチウムの同位体|ルテチウム176]]の4つだけである。ほとんどの奇-奇核種は[[ベータ崩壊]]で非常に不安定であるが、これは、崩壊生成物が偶-偶核種であるため、核子対効果{{Enlink|Semi-empirical mass formula#Pairing term|英語版|en}}によってより強く結合することによる<ref>{{cite book |last=Krane |first=K. |year=1988 |title=Introductory Nuclear Physics |url=https://archive.org/details/introductorynucl00kran |url-access=limited |publisher=[[:en:John Wiley & Sons|John Wiley & Sons]] |isbn=978-0-471-85914-7 |pages=[https://archive.org/details/introductorynucl00kran/page/n90 68]}}</ref>。 |
|||
=== 質量 === |
|||
{{Main|原子質量<!-- Atomic mass-->|質量数<!-- mass number -->}} |
|||
原子の質量の大部分は、それを構成する陽子と中性子に由来する。ある原子に含まれるこれらの粒子(核子という)の総数を[[質量数]](''mass number'')という。質量数は数を表す正整数で、(質量の次元を持つではなく)無次元である。質量数の例として、12個の核子(6個の陽子と6個の中性子)を持つ「[[炭素12]]」がある。 |
|||
[[不変質量|静止状態にある原子の実際の質量]]は、[[統一原子質量単位|ダルトン]](Da)の単位(統一原子質量単位(u)ともいう)で表されることが多い。この単位は、[[炭素12]]の自由な中性原子の質量の12分の1と定義され、約{{val|1.66|e=-27|u=kg}}である<ref name="iupac" />。[[水素原子|水素1]](水素の最も軽い同位体であり、最も質量の小さい核種でもある)の原子量は1.007825 Da である<ref name="chieh2001" />。この数を[[原子質量]](''atomic mass'')という。原子の原子質量は、その質量数と原子質量単位の積にほぼ等しく(1%以内)、たとえば窒素14の質量はおよそ14 Daである。しかし(定義により)炭素12の場合を除いては、この数値は正確な整数にならない<ref name="nist_wc" />。最も重い[[安定同位体|安定原子]]は鉛208で<ref name="s131" />、質量は {{val|207.9766521|u=Da}} である<ref name="audi2003" />。 |
|||
最も重い原子でさえ直接扱うには軽すぎるため、化学者は代わりに[[モル]](mole)という単位を使う。どの元素でも、1モルの原子数は常に同じである(約[[:en:Avogadro constant|{{val|6.022|e=23}}]])。この数は、ある元素の原子質量が 1 u であれば、その元素の原子1モルの質量が1グラムに近くなるように選ばれた。[[統一原子質量単位]]の定義から、炭素12原子の原子質量は正確に 12 Da であり、1モルの炭素12原子の質量は正確に 0.012 kg である<ref name="iupac">{{cite book |
|||
|last=Mills |
|||
|first=Ian |
|||
|author2=Cvitaš, Tomislav |
|||
|author3=Homann, Klaus |
|||
|author4=Kallay, Nikola |
|||
|author5=Kuchitsu, Kozo |
|||
|title=Quantities, Units and Symbols in Physical Chemistry |
|||
|publisher=[[:en:International Union of Pure and Applied Chemistry|International Union of Pure and Applied Chemistry]], Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications |
|||
|location=Oxford |
|||
|edition=2nd |
|||
|year=1993 |
|||
|isbn=978-0-632-03583-0 |
|||
|oclc=27011505 |
|||
|url=https://archive.org/details/quantitiesunitss0000unse/page/70 |
|||
|page=[https://archive.org/details/quantitiesunitss0000unse/page/70 70] |
|||
}}</ref>。 |
|||
=== 形状と大きさ === |
|||
{{Main|原子半径<!-- Atomic radius -->}} |
|||
原子には明確な外側の境界がないため、その大きさは通常、[[原子半径]]で表される。原子半径は、原子核から広がる電子雲までの距離を表す尺度である<ref name="Ghosh02">{{cite journal | author = Ghosh, D.C. |author2= Biswas, R. | title = Theoretical calculation of Absolute Radii of Atoms and Ions. Part 1. The Atomic Radii | journal = Int. J. Mol. Sci. | volume = 3 |issue= 11 | pages = 87–113 | year = 2002 | doi=10.3390/i3020087| doi-access = free }}</ref>。これは原子が球形であることを前提としており、真空中や自由空間内の原子のみ当てはまる。原子半径は、2つの原子が[[化学結合]]で結合したときの2つの原子核間の距離から導き出される。この半径は、[[周期表]]上の原子の位置、化学結合の種類、隣接する原子の数([[配位数]])、[[スピン角運動量|スピン]]と呼ばれる[[量子力学]]的性質によって変化する<ref name="aca32_5_751" />。周期表上では、原子の大きさは列を上から下に移動するほど大きくなり、行を横切るにつれて(左から右に移動)小さくなる傾向がある<ref name="dong1998" />。たとえば、最も小さい原子は半径は 31 [[ピコメートル|pm]] の[[ヘリウム]]で、最も大きい原子のひとつは半径 298 pm の[[セシウム]]である<ref name="clem67"> |
|||
{{cite journal |
|||
|last1=Clementi |first1=E. |
|||
|last2=Raimond |first2=D. L. |
|||
|last3=Reinhardt |first3=W. P. |
|||
|year=1967 |
|||
|title=Atomic Screening Constants from SCF Functions. II. Atoms with 37 to 86 Electrons |
|||
|journal=[[Journal of Chemical Physics]] |
|||
|volume=47 |issue=4 |pages=1300–1307 |
|||
|bibcode = 1967JChPh..47.1300C |
|||
|doi=10.1063/1.1712084 |
|||
}}</ref>。 |
|||
[[電場]]のような外力を受けると、原子の形状が[[球対称]]{{Enlink|Spherical symmetry|英語版|en}}から外れることがある。この変形は、[[群論|群論的]]な考察によって示されるように、電場の強さと外殻電子の軌道型に依存する。非球対称性の変形は、たとえば[[結晶]]内において、{{Ill2|結晶対称|en|Crystal symmetry|label=対称性の低い}}格子部位に大きな結晶電場が発生することで誘発される可能性がある<ref name="Bethe1929">{{cite journal|author = Bethe, Hans|title = Termaufspaltung in Kristallen|journal = Annalen der Physik|volume = 3|issue = 2|pages = 133–208|year = 1929|doi = 10.1002/andp.19293950202|bibcode = 1929AnP...395..133B }}</ref><ref name="ZPB1995a">{{cite journal | author = Birkholz, Mario | title = Crystal-field induced dipoles in heteropolar crystals – I. concept | journal = Z. Phys. B | volume = 96 | issue = 3 | pages = 325–332 | year = 1995 | doi = 10.1007/BF01313054 |bibcode = 1995ZPhyB..96..325B | url=https://www.researchgate.net/publication/227050494| citeseerx = 10.1.1.424.5632 | s2cid = 122527743 }}</ref>。[[パイライト]]型化合物中の硫黄イオン<ref name="pssb2008">{{cite journal | author = Birkholz, M. | author2 = Rudert, R. | title = Interatomic distances in pyrite-structure disulfides – a case for ellipsoidal modeling of sulfur ions | journal = Physica Status Solidi B | volume = 245 | issue = 9 | pages = 1858–1864 | year = 2008 | url = https://www.mariobirkholz.de/pssb2008.pdf | doi = 10.1002/pssb.200879532 | bibcode = 2008PSSBR.245.1858B | s2cid = 97824066 | access-date = 2 May 2021 | archive-date = 2 May 2021 | archive-url = https://web.archive.org/web/20210502151542/https://www.mariobirkholz.de/pssb2008.pdf | url-status = live }}</ref>や[[カルコゲン]]イオンでは<ref name="mdpi2014">{{cite journal | author = Birkholz, M. | title = Modeling the Shape of Ions in Pyrite-Type Crystals| journal = Crystals | volume = 4 | issue = 3| pages = 390–403 | year = 2014 | doi = 10.3390/cryst4030390| doi-access = free}}</ref>、顕著な[[楕円体|楕円]]変形が起こることが示されている。 |
|||
原子の大きさは光の波長(400-700 [[ナノメートル|nm]])より数千倍も小さく、従来の[[顕微鏡]]では見ることができないが、[[走査型トンネル顕微鏡]]を使えば個々の原子を観察することができる。原子の微細さを視覚化するために、典型的な人間の毛髪の幅は、約100万個の炭素原子を並べた距離に相当することを考えてみよう<ref name="osu2007" />。一滴の水には約20[[垓]]個<!-- 2 sextillion, 2E21 -->({{val|2|e=21}})の酸素原子と、その2倍の水素原子が含まれている<ref>{{cite book |
|||
|last=Padilla|first=Michael J. |
|||
|author2=Miaoulis, Ioannis|author3= Cyr, Martha|year = 2002 |
|||
|title = Prentice Hall Science Explorer: Chemical Building Blocks |
|||
|publisher = Prentice-Hall, Inc. |
|||
|location = Upper Saddle River, New Jersey |
|||
|isbn = 978-0-13-054091-1 |
|||
|oclc=47925884|page=32 |
|||
|quote=There are 2,000,000,000,000,000,000,000 (that's 2 sextillion) atoms of oxygen in one drop of water—and twice as many atoms of hydrogen.}}</ref>。質量 {{val|2|e=-4|u=kg}} の1[[カラット]]の[[ダイヤモンド]]には、約100垓個<!-- 10 sextillion, 1E22 -->(10<sup>22</sup>)の[[炭素]]原子が含まれている{{Efn|1カラットは200 mg。[[統一原子質量単位|定義]]によれば、炭素12は1 molあたり 0.012 kg である。[[アボガドロ定数]]は1 mol当たり{{val|6|e=23}}個の原子を含むと定義される。}}。リンゴを地球の大きさに拡大すると、リンゴの中の原子は元のリンゴとほぼ同じ大きさになる<ref>{{Cite web |url=https://feynmanlectures.caltech.edu/I_01.html#Ch1-S2-p3 |title=The Feynman Lectures on Physics Vol. I Ch. 1: Atoms in Motion |access-date=3 May 2022 |archive-date=30 July 2022 |archive-url=https://web.archive.org/web/20220730092955/https://www.feynmanlectures.caltech.edu/I_01.html#Ch1-S2-p3 |url-status=live }}</ref>。 |
|||
=== 放射性崩壊 === |
|||
{{Main|放射性崩壊}} |
|||
[[File:Isotopes and half-life.svg|right|thumb|''Z''個の陽子と''N''個の中性子を持つさまざまな同位体の[[半減期]] (T<sub>{{frac|1|2}}</sub>) を示す]] |
|||
すべての元素には、不安定な原子核を持っていて放射性崩壊を起こし、原子核から粒子や電磁波を放出する[[同位体]]が1つ以上存在する。放射性は、原子核の半径が、1 [[フェムトメートル|fm]] オーダーの距離にしか作用しない[[強い力]]の範囲よりも大きい場合に生じる<ref name="splung" />。 |
|||
放射性崩壊の最も一般的な形態は次のとおりである<ref>{{cite book |
|||
|last=L'Annunziata<!-- Note: the single quote mark before the name is correct. --> |
|||
|first=Michael F. |
|||
|year=2003|title=Handbook of Radioactivity Analysis |
|||
|url=https://archive.org/details/handbookradioact00lann|url-access=limited|publisher=Academic Press|isbn=978-0-12-436603-9 |
|||
|oclc=16212955|pages=[https://archive.org/details/handbookradioact00lann/page/n22 3]–56}}</ref><ref name="firestone20000522" />。 |
|||
* [[アルファ崩壊]]: この過程は、原子核がアルファ粒子を放出するときに起こる。アルファ粒子は2個の陽子と2個の中性子からなるヘリウム原子核である。放出された結果、[[原子番号]]がより小さな新しい元素が生成する。 |
|||
* [[ベータ崩壊]](および[[電子捕獲]]): これらの過程は[[弱い力]]によって支配され、中性子から陽子、あるいは陽子から中性子へ変換することによって起こる。中性子から陽子への遷移は電子と[[反ニュートリノ]]の放出を伴い、陽子から中性子への遷移(電子捕獲を除く)は[[陽電子]]と[[ニュートリノ]]の放出を引き起こす。電子または陽電子の放出はベータ粒子と呼ばれる。ベータ崩壊により、原子核の原子番号が1つ増加するか減少する。一方、電子捕獲は陽電子放出よりも多く見られるが、これはベータ崩壊よりも少ないエネルギーですむためである。この形式の崩壊では、原子核から陽電子が放出される代わりに、電子が原子核に吸収される。この過程でもニュートリノが放出され、陽子は中性子に転換する。 |
|||
* [[ガンマ崩壊]]: この過程は、原子核のエネルギー準位がより低い状態に遷移することで起こり、ガンマ線と呼ばれる電磁放射線が放出される。ガンマ線を放射する原子核の[[励起状態]]は、通常、アルファ粒子またはベータ粒子の放出に続いて引き起こされる。したがって、ガンマ崩壊は通常、アルファ崩壊またはベータ崩壊の後に起こる。 |
|||
その他に、稀な種類の[[放射性崩壊]]として、原子核から中性子や陽子、[[核子|原子核]]クラスターが放出されるものや、複数の[[ベータ粒子]]が放出されるものがある。励起核が別の方法でエネルギーを失うことを可能にするガンマ線放出の類似型は、[[内部転換|内部転換である]](ベータ線ではない高速電子を生成し、続いてガンマ線ではない高エネルギー光子を生成する放射性崩壊の形式)。いくつかの大きな原子核は、[[自発核分裂]]と呼ばれる崩壊で、さまざまな質量の2つ以上の荷電した分裂片と数個の中性子に分裂する。 |
|||
それぞれの[[放射性同位元素]]には特徴的な崩壊時間、すなわち[[半減期]]があり、試料の半分が崩壊するのにかかる時間で決まる。これは[[指数関数的減衰|指数関数的な減衰]]過程であり、半減期ごとに残りの同位体の割合が50%ずつ着実に減少してゆく。したがって、半減期が2回経過すると、同位体の25%しか存在しなくなる<ref name="splung" />。 |
|||
=== 磁気モーメント === |
|||
{{Main|{{ill2|電子磁気モーメント|en|Electron magnetic moment}}|核磁気モーメント<!-- Nuclear magnetic moment -->}} |
|||
素粒子には[[スピン角運動量|スピン]]と呼ばれる固有の量子力学的性質が内在している。これは、[[質量中心]]の周りを回転する物体の[[角運動量]]に似ているが、厳密に言えば、これらの粒子は点状であり、回転しているとは言えないと考えられる。スピンは換算[[プランク定数]](ħ)の単位で測定され、電子、陽子、中性子はすべてスピン{{frac|1|2}} ħ または スピン{{frac|1|2}} を持つ。原子の場合、原子核の周りを周回する電子はスピンに加えて軌道[[角運動量]]を持っており、原子核自体は核スピンによる角運動量を持っている<ref name="hornak2006" />。 |
|||
原子が生成する[[磁場]]([[磁気モーメント]])は、古典的に回転する荷電物体が磁場を生成するのと同様に、これらのさまざまな形の角運動量によって決定されるが、最も支配的な寄与は電子スピンによるものである。電子は[[パウリの排他原理]]に従うという性質があるため、2つの電子が同じ[[量子状態]]をとることはなく、束縛電子は互いに対となり、それぞれの対の一方がスピンアップ状態、他方はその反対のスピンダウン状態にある。したがって、これらのスピンは互いに打ち消し合い、偶数の電子を持つ原子では全磁気双極子モーメントがゼロになる<ref name="schroeder2" />。 |
|||
鉄、コバルト、ニッケルなどの[[強磁性]]元素では、電子の数が奇数の場合は[[不対電子]]が生じ、全体としての正味磁気モーメントが生じる。隣接する原子の軌道が重なり合い、不対電子のスピンが揃うことで、より低いエネルギー状態を生じる。これは[[交換相互作用]]として知られる自発過程である。強磁性原子の磁気モーメントが整列すると、その材料は測定可能な巨視的磁場を発生する。[[常磁性]]物質は、磁場が存在しないときには原子の磁気モーメントが[[ランダム]]な方向を向いているが、磁場が存在するときには個々の原子の磁気モーメントが整列する<ref name="schroeder2" /><ref name="goebel20070901" />。 |
|||
原子核は、中性子と陽子の数がそれぞれ偶数の場合はスピンを持たないが、それ以外の奇数の場合はスピンを持つ可能性がある。通常、スピンを持つ原子核は、熱平衡{{Enlink|Thermal equilibrium|英語版|en}}によりランダムな方向を向いているが、ある種の元素では([[キセノン|キセノン129]]など)、核スピン状態のかなりの割合を[[スピン偏極|分極]]させ、同じ方向を向くように整列することが可能である({{Ill2|過分極|en|Hyperpolarization (physics)|label=過分極}}と呼ばれる状態)。この現象は[[核磁気共鳴画像法|核磁気共鳴イメージング]]の分野で応用されている<ref name="yarris1997" /><ref>{{cite book |
|||
|last1=Liang|first1=Z.-P.|last2=Haacke|first2=E.M. |
|||
|editor=Webster, J.G.|year=1999 |
|||
|volume=2 |
|||
|title=Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging |
|||
|publisher=John Wiley & Sons |
|||
|isbn=978-0-471-13946-1|pages=412–426}}</ref>。 |
|||
=== エネルギー準位 === |
|||
{{Main|エネルギー準位|電子軌道|[[:en:Atomic orbital]]}}[[File:Atomic orbital energy levels.svg|thumb|right|原子のエネルギー準位とそのサブ準位を表す模式図 (エネルギー準位の縮尺は一定でない)。[[カドミウム]] (5s<sup>2</sup> 4d<sup>10</sup>) までの原子の基底状態を包括するのに十分である。高いエネルギー準位のs軌道は、低いエネルギー準位のd軌道よりもわずかに低いエネルギーを持つ。なお、図の一番上でも、非束縛電子の状態よりも低いことに注意を要する。]] |
|||
原子内の電子の[[ポテンシャルエネルギー]]は、原子核からの[[距離]]が[[関数の極限#無限遠点における挙動|無限大になる]]につれて相対的に[[負の数|負]]となり、その[[位置]]依存性は距離にほぼ[[反比例]]し、原子核内部で[[最小]]となる。[[量子力学]]モデルでは、束縛電子は原子核を中心とした一連の状態のみをとることができ、それぞれの状態は特定の[[エネルギー準位]]に対応する(理論的な説明は、[[シュレーディンガー方程式#時間に依存しないシュレーディンガー方程式|時間に依存しないシュレーディンガー方程式]]を参照)。エネルギー準位は、電子を原子からの[[イオン化エネルギー|束縛を解くのに必要なエネルギー量]]によって測定することができ、通常は[[電子ボルト]](eV)の単位で表される。束縛電子の最低エネルギー状態を[[基底状態]](すなわち[[定常状態]])と呼び、電子がより高い準位に遷移したときを[[励起状態]]という<ref name="zeghbroeck1998" />。原子核までの(平均)距離が遠くなることから、電子のエネルギーは[[主量子数]](''n'')とともに大きくなる。エネルギーの[[方位量子数]](<math>\ell</math>)依存性は、原子核の[[静電ポテンシャル]]によるものではなく、電子間の相互作用によるものである。 |
|||
[[ボーアモデル|ボーア・モデル]]によれば、電子が{{Ill2|原子内の電子遷移|en|Atomic electron transition|label=2つの異なる状態間を遷移}}するためには(たとえば基底状態から第一励起状態へ)、電子はこれらの準位のポテンシャルエネルギーの差([[シュレーディンガー方程式]]によって正確に計算できる)に一致するエネルギーで[[光子]]を吸収または放出しなくてはならない。電子は粒子のように軌道から軌道へ飛び越える。たとえば、1個の光子が電子に衝突した場合、光子に反応して状態を変える電子は1個だけである(英語版 [[:en:Atomic orbital|Atomic orbital]](電子軌道) を参照)。 |
|||
放出される光子のエネルギーはその[[周波数]]に比例するため、特定のエネルギー準位は[[電磁スペクトル]]の異なるバンドとして現れる<ref>{{cite book |
|||
|last=Fowles|first=Grant R.|year=1989 |
|||
|title=Introduction to Modern Optics |
|||
|url=https://archive.org/details/introductiontomo00fowl_441|url-access=limited|publisher=Courier Dover Publications |
|||
|isbn=978-0-486-65957-2 |
|||
|oclc=18834711|pages=[https://archive.org/details/introductiontomo00fowl_441/page/n233 227]–233}}</ref>。各元素は、核電荷、電子で満たされた[[亜殻]](部分殻)、電子間の電磁相互作用、そしてその他の要因に依存する特徴的なスペクトルを持っている<ref name="martin2007" />。[[File:Fraunhofer lines.svg|right|thumb|upright=1.5|スペクトル吸収線の例 (詳細は[[フラウンホーファー線]]を参照)]] |
|||
[[電磁スペクトル|連続スペクトルのエネルギー]]をガスやプラズマに通過させると、その原子は光子の一部を吸収し、原子内に束縛された電子のエネルギー準位が変化する。引き続いて励起電子は、このエネルギーを光子として自発的に放出してより低いエネルギー準位に戻り、光子はランダムな方向に移動する。こうして原子は、エネルギー出力に一連の暗い{{Ill2|吸収帯|en|Absorption band}}を形成するフィルターのように作用する。(背景の連続スペクトルを含まない視点から原子を見ている観測者は、代わりに原子から放出された光子からの一連の[[スペクトル密度|輝線]]を見ることになる)。{{Ill2|原子スペクトル線|en|Atomic spectral line}}の強度と幅を[[分光法|分光学]]的に測定することで、物質の組成や物理的性質を決定することができる<ref name="avogadro" />。 |
|||
スペクトル線を詳しく調べると、[[微細構造]]分裂を示すものがあることがわかる。これは、[[スピン軌道相互作用]]、すなわち最外殻電子のスピンと運動との相互作用によって起こるものである<ref name="fitzpatrick20070216" />。原子が外部磁場の中にあるとき、スペクトル線は3つ以上の成分に分裂する([[ゼーマン効果]]と呼ばれる現象)。これは、磁場が原子とその電子の磁気モーメントと相互作用することによって起こる。原子の中には、同じエネルギー準位を持つ複数の[[電子配置]]を持つものがあり、それらは単一のスペクトル線として現れる。磁場と原子の相互作用によって、電子配置がわずかに異なるエネルギー準位にシフトし、複数のスペクトル線が生じることもある<ref name="weiss2001" />。また、外部[[電場]]が存在するとき、電子のエネルギー準位が変化することにより、スペクトル線に同様の分裂やシフトが表れることがある。これは[[シュタルク効果]]と呼ばれる現象である<ref>{{cite book |
|||
|last1=Beyer|first1=H.F. |
|||
|last2=Shevelko|first2=V.P. |
|||
|year=2003 |
|||
|title=Introduction to the Physics of Highly Charged Ions |
|||
|publisher=CRC Press|isbn=978-0-7503-0481-8 |
|||
|oclc=47150433|pages=232–236}}</ref>。 |
|||
束縛電子が励起状態にあるときに、適切なエネルギーを持つ光子が相互作用することで、エネルギー準位が一致する光子が[[誘導放出]]されることがある。そのためには、電子が、相互作用する光子のエネルギーと一致するエネルギー差を持った、より低いエネルギー状態に遷移しなくてはならない。その後、放出された光子と相互作用した光子は、位相をそろえながら平行に移動する。言い換えれば、2つの光子の波動パターンは同調する。この物理的特性は、狭い周波数帯域で[[コヒーレンス#コヒーレント光|コヒーレント]]な光エネルギーを放出できる[[レーザー]]発生装置に利用されている<ref name="watkins_sjsu" />。 |
|||
=== 価数と結合挙動 === |
|||
{{Main|原子価|化学結合}} |
|||
原子価とは、原子が他の原子と結合する能力の尺度である。原子価は一般的に、他の原子や[[官能基|原子団]]と形成できる化学結合の数として理解される<ref>{{GoldBookRef|title=valence|file=V06588}}</ref>。非結合状態にある原子の一番外側の電子殻を[[原子価殻]](価電子殻とも)といい、その殻内の電子を[[価電子]]と呼ぶ。価電子の数によって、他の原子との[[化学結合|結合]]挙動が決まる。原子は、その外側の原子価殻を満たす(または空にする)ように、互いに[[化学反応]]する傾向がある<ref name="reusch20070716" />。たとえば、[[塩化ナトリウム]]化合物やその他の化学イオン塩で見られるような原子間での1電子の移動は、閉殻よりも1電子多い原子と、閉殻よりも1電子足りない原子との間で形成される結合に対して有効な[[近似]]である。多くの元素は複数の原子価を持ち、すなわち化合物によって異なる数の電子を共有する傾向がある。したがって、これらの元素間の[[化学結合]]は、単純な電子移動にとどまらず、さまざまな電子共有の形態をとる。たとえば、[[炭素同素体|炭素の同素体]]や[[有機化合物]]などである<ref name="chemguide" />。 |
|||
[[化学元素]]を[[周期表]]で表わすことがよくある。周期表は、元素の化学的性質が繰り返されるように配列された表で、価電子数が同じ元素は表の同じ列にグループを成している。表の水平方向の行は、量子殻電子の充填に対応する。表の右端の元素は、外殻が完全に電子で満たされているため化学的に不活性であり、[[希ガス]]として知られる<ref name="husted20031211" /><ref name="baum2003" />。 |
|||
=== 状態 === |
|||
{{Main|物質の状態|相 (物質)}} |
|||
[[File:Bose Einstein condensate.png|right|thumb|[[ボース=アインシュタイン凝縮]]の兆候。[[ルビジウム]]原子を絶対零度にごく近い温度(170 nK)に冷却することで個々の原子は凝縮し、単一体として振る舞う超原子となった。この図は、原子が密度の低い赤-黄-緑の領域から密度の高い青-白の領域へと凝縮していく様子を、連続した3次元画像で示す<ref>{{Cite journal|last=Anderson|first=M. H.|last2=Ensher|first2=J. R.|last3=Matthews|first3=M. R.|last4=Wieman|first4=C. E.|last5=Cornell|first5=E. A.|date=1995-07-14|title=Observation of Bose-Einstein Condensation in a Dilute Atomic Vapor|url=https://www.science.org/doi/10.1126/science.269.5221.198|journal=Science|volume=269|issue=5221|pages=198–201|language=en|doi=10.1126/science.269.5221.198|issn=0036-8075}}</ref>。 ]] |
|||
たくさんの原子は、[[温度]]や[[圧力]]などの物理的条件によって異なる[[物質の状態|物質状態]]をとる。物質は条件を変えることで、[[固体]]、[[液体]]、[[気体]]、[[プラズマ]]の間を転移することがある<ref>{{cite book |
|||
|last=Goodstein|first=David L.|year=2002 |
|||
|title=States of Matter|url=https://archive.org/details/statesmatter00good_082|url-access=limited|publisher=Courier Dover Publications |
|||
|isbn=978-0-13-843557-8|pages=[https://archive.org/details/statesmatter00good_082/page/n445 436]–438}}</ref>。物質はまた、ある状態のもとで、異なる[[同素体]]が存在することもある。たとえば、固体の炭素は、[[グラファイト]]や[[ダイヤモンド]]のような同素体が存在する<ref name="pu49_7_719" />。{{Ill2|酸素の同素体|en|Allotropes of oxygen|label=二酸素}}や[[オゾン]]のように、気体の同素体も存在する。 |
|||
[[絶対零度]]に近い温度では、原子は[[ボース=アインシュタイン凝縮|ボース=アインシュタイン凝縮体]]を形成する可能性がある。このとき、通常は原子スケールでしか観測されない量子力学的効果が、巨視的スケールで表れる<ref>{{cite book |
|||
|last=Myers|first=Richard|year=2003 |
|||
|title=The Basics of Chemistry|url=https://archive.org/details/basicschemistry00myer|url-access=limited|publisher=Greenwood Press |
|||
|isbn=978-0-313-31664-7 |
|||
|oclc=50164580|page=[https://archive.org/details/basicschemistry00myer/page/n98 85]}}</ref><ref name="nist_bec" />。この過冷却状態にある原子の集団が形成する単一の[[超原子]]の振る舞いが、量子力学的な挙動の基本的な観察を可能とするかも知れない<ref name="colton_fyffe1999" /><ref>{{Cite journal|last=Georgescu|first=Iulia|date=2020-08|title=25 years of BEC|url=https://www.nature.com/articles/s42254-020-0211-7|journal=Nature Reviews Physics|volume=2|issue=8|pages=396–396|language=en|doi=10.1038/s42254-020-0211-7|issn=2522-5820}}</ref>。{{Clear}} |
|||
== 識別 == |
|||
[[File:Atomic resolution Au100.JPG|right|thumb|[[金]]([[ミラー指数|100]])の表面を構成する個々の原子を示す[[走査型トンネル顕微鏡]]像。表面原子はそのバルク[[結晶構造]]から外れ、溝を挟み数原子幅に並んだ列に配置している ([[表面再構成]]を参照)]] |
|||
原子は小さすぎて目で見ることはできないが、[[走査型トンネル顕微鏡]](STM)のような装置を使用して、固体表面の原子を視覚化することができる。この顕微鏡は[[量子トンネル]]現象を利用したもので、それによって、古典的な観点からは乗り越えられないような[[ポテンシャル障壁|障壁]]を粒子が通り抜けることを可能にする。電子は、2つの[[バイアス (電子工学)|バイアス]]電極間の真空を超えて伝播し、 距離に指数関数的に依存するトンネル電流を生成する。一方の電極は、鋭い先端を持つ探針で、理想的には単一原子で終わる。表面の走査の各点で、トンネル電流を設定値に保つように探針の高さを調整する。探針が表面からどれだけ近づいているか、あるいは離れているかを、標高プロファイルとして解釈する。低バイアスの場合、顕微鏡は、密集したエネルギー準位を横切って平均化された電子軌道、つまり[[フェルミ準位]]近傍の電子の[[局所状態密度]]を画像化する<ref name="jacox1997" /><ref name="nf_physics1986" />。距離が関係するため、個々の原子に対応する周期性を観察するためには、両方の電極が極めて安定していなくてはならない。この方法だけでは化学的な特異性を欠き、表面に存在する原子種を特定することはできない。 |
|||
原子は質量によって容易に[[元素分析|識別]]することができる。原子から電子を1つ取り除いて[[イオン化]]すると、[[磁場]]を通過する際に軌道が曲げられる。移動するイオンの軌道が磁場によって曲げられる半径は、原子の質量によって決まる。[[質量分析法]]はこの原理を利用して、イオンの[[質量電荷比]]を測定する。試料に複数の同位体が含まれる場合、質量分析計で異なるイオンビームの強度を測定することで、試料中の各同位体の割合を決定することができる。原子気化法には、[[誘導結合プラズマ発光分析|誘導結合プラズマ発光分析法]]と[[誘導結合プラズマ質量分析法]]があり、どちらもプラズマを使って[[誘導結合プラズマ|試料を気化させて]]分析する<ref name="sab53_13_1739" />。 |
|||
{{Ill2|アトムプローブ|en|Atom probe|label=アトムプローブ・トモグラフィー}}(atom-probe tomograph、アトムプローブ断層撮影法)は、3次元でサブナノメートルの分解能を持ち、[[飛行時間型質量分析法]]を使用して個々の原子を化学的に同定することができる<ref name="rsi39_1_83" />。 |
|||
[[内殻電子]]の結合エネルギーを測定する[[X線光電子分光法]](XPS)や[[オージェ電子分光|オージェ電子分光法]](AES)などの電子放出技術は、試料中に存在する原子種を非破壊的に同定するために使用される。適切な集束をすることで、どちらも特定領域の分析が可能である。もう一つの方法、[[電子エネルギー損失分光法]](EELS)は、[[透過型電子顕微鏡]](TEM)内で[[電子ビーム]]が試料の一部と相互作用したときのエネルギー損失を測定する方法である。 |
|||
[[励起状態]]のスペクトルは、遠方の[[恒星]]の原子組成を分析することにも使われている。恒星からの観測光に含まれる特定の光の[[波長]]を分離し、自由気体原子における量子化された遷移と対応付けることができる。これらの色は、同じ元素を含む{{Ill2|ガス放電ランプ|en|Gas-discharge lamp}}を使って再現することができる<ref name="lochner2007" />。こうして[[ヘリウム]]は、地球で発見される23年前に太陽スペクトルから発見された<ref name="winter2007" />。 |
|||
== 起源と現状 == |
|||
{{Ill2|バリオン物質|en|Baryonic matter}}([[バリオン]]で構成されたあらゆる種類の原子)は、[[観測可能な宇宙]]の全エネルギー密度の約4%を占め、その平均密度は約0.25個/m<sup>3</sup>(主に[[陽子]]と電子)である<ref name="hinshaw20060210" />。[[天の川]]のような[[銀河系]]内では、粒子の濃度ははるかに高く、[[星間物質]](ISM)の物質密度は10<sup>5</sup>-10<sup>9</sup> 原子/m<sup>3</sup> である<ref>{{cite book |
|||
|last1=Choppin|first1=Gregory R. |
|||
|last2=Liljenzin|first2=Jan-Olov|last3=Rydberg|first3=Jan |
|||
|year=2001|title=Radiochemistry and Nuclear Chemistry |
|||
|publisher=Elsevier|isbn=978-0-7506-7463-8 |
|||
|oclc=162592180|page=441}}</ref>。太陽は[[局所泡]](ローカル・バブル)の中にあると考えられているため、[[局所恒星間雲|太陽近傍]]における密度はわずか約10<sup>3</sup>原子/m<sup>3</sup> である<ref name="science259_5093_327" />。恒星はISM内の高密度の雲から形成され、恒星の進化の過程でISMは水素やヘリウムよりも重い元素で着実に濃縮される。 |
|||
天の川銀河に存在するバリオン物質の最大95%は恒星の内部に集中しており、すなわち原子物質にとって不利な条件下にある。銀河系の質量の約10%はバリオン物質の総質量であり<ref>{{cite book |
|||
|last=Lequeux|first=James|year=2005 |
|||
|title=The Interstellar Medium |
|||
|url=https://archive.org/details/interstellarmedi00ryte|url-access=limited|publisher=Springer|isbn=978-3-540-21326-0 |
|||
|oclc=133157789|page=[https://archive.org/details/interstellarmedi00ryte/page/n411 4]}}</ref>、残りは未知の[[暗黒物質]]の質量である<ref name="nigel2000" />。[[恒星の構造|恒星内部]]の[[温度|高温]]は、ほとんどの「原子」を完全に電離させる、つまり原子核から「すべての電子」を分離させる。白色矮星、中性子星、ブラックホールなど、[[コンパクト星|恒星の残骸]](総称してコンパクト星という)では、その表面層を除き、巨大な[[圧力]]が電子殻の形成を不可能にしている。 |
|||
=== 形成 === |
|||
{{Main|元素合成|恒星内元素合成}} |
|||
[[File:Nucleosynthesis periodic table.svg|thumb|600px|各元素の起源を示した周期表。炭素から硫黄までの元素は、小さな恒星で[[アルファ反応]]によって形成される。鉄より重い元素は、大きな恒星で遅い中性子捕獲 ([[s過程]]) によって形成される。鉄より重い元素は、中性子星合体<!-- neutron star mergers -->や超新星で[[r過程]]によって形成される。]] |
|||
電子は[[ビッグバン]]の初期から宇宙に存在していたと考えられている。原子核は[[元素合成|原子核合成]]と呼ばれる反応で形成される。[[ビッグバン原子核合成]]の理論によると、ビッグバンの約3分後から、宇宙に存在する[[ヘリウム]]、[[リチウム]]、[[重水素]]の大部分と、おそらく[[ベリリウム]]と[[ホウ素]]の一部が形成されたという<ref name="ns1794_42" /><ref name="science267_5195_192" /><ref name="hinshaw20051215" />。 |
|||
原子の偏在性と安定性は、その[[結合エネルギー]]に依存する。すなわち、原子のエネルギーは、原子核と電子の非結合系よりもエネルギーが低いことを意味する。[[温度]]が[[イオン化ポテンシャル]]よりはるかに高い場合、物質は[[プラズマ]]の形で存在する。プラズマは、正電荷を帯びたイオン(場合によっては裸の原子核)と電子からなる気体である。温度がイオン化ポテンシャルより下がると、原子は[[統計力学|統計的]]に有利な状態になる。ビッグバンから38万年後([[再結合 (宇宙論)|再結合]]と呼ばれる時期)、膨張する宇宙が十分に冷えて電子が原子核に束縛されるようになり、原子(束縛電子を持つ)が[[荷電粒子]]よりも優位に立つようになった<ref name="abbott20070530" />。 |
|||
ビッグバンでは[[炭素]]やそれより[[原子番号|重い元素]]は生成されなかったが、それ以降、[[恒星]]内部での[[核融合]]プロセスを経て原子核どうしが結合し、さらなる[[ヘリウム]]元素や、([[トリプルアルファ反応]]を経て)炭素から鉄に至る一連の元素を生成した<ref name="mnras106_343" />。詳細は[[恒星内元素合成]]を参照されたい。 |
|||
リチウム6や、ベリリウム、ホウ素などの一部の同位体は、[[宇宙線による核破砕]]によって宇宙空間で生成された<ref name="nature405_656" />。これは、高エネルギーの陽子が原子核に衝突し、大量の核子が放出されることで起こる。 |
|||
鉄より重い元素は、[[超新星]]や合体[[中性子星]]<!-- colliding neutron stars -->では [[r過程]] によって、また[[AGB星]]では [[s過程]] によって生成し、いずれも原子核による[[中性子捕獲]]を伴う<ref name="mashnik2000" />。[[鉛]]などの元素は、主により重い元素の放射性崩壊によって形成された<ref name="kgs20050504" />。 |
|||
=== 地球 === |
|||
[[地球]]とその生息生物を構成する原子のほとんどは、[[太陽系]]を形成するために[[分子雲]]から崩壊した[[星雲]]の中に、現在の形で存在していた。残りの原子は放射性崩壊の結果として生成した。それらの相対的な割合は、[[放射年代測定]]によって[[地球の年齢]]を決定するために使用することができる<ref name="Manuel2001pp511-519">[[#refManuel2001|Manuel (2001). ''Origin of Elements in the Solar System'', pp. 40–430, 511–519]]</ref><ref name="gs190_1_205" />。地球の地殻に含まれる[[ヘリウム]]の大部分(ガス井から採取されるヘリウムの約99%)は、[[アルファ崩壊]]の産物であり、それは[[ヘリウム3]]の存在量が低いことからも示される<ref name="anderson_foulger_meibom2006" />。 |
|||
地球上には、最初には存在せず(つまり「原始」でない)、放射性崩壊の産物でもないような、微量原子がいくつか存在する。[[炭素14]]は、宇宙線によって大気中で絶え間なく生成される<ref name="pennicott2001" />。地球上の原子の中には、実験環境で意図的に、あるいは原子炉や核爆発の副産物として人工的に生成されたものもある<ref name="yarris2001" /><ref name="pr119_6_2000" />。[[超ウラン元素]](原子番号92を超える元素)のうち、地球上に天然に存在するのは[[ネプツニウム]]と[[プルトニウム]]のみである<ref name="poston1998" /><ref name="cz97_10_522" />。超ウラン元素の放射性寿命は現在の地球年齢よりも短いため<ref>{{cite book|last1=Zaider|first1=Marco|last2=Rossi|first2=Harald H.|year=2001|title=Radiation Science for Physicians and Public Health Workers|publisher=Springer|isbn=978-0-306-46403-4|oclc=44110319|page=[https://archive.org/details/radiationscience0000zaid/page/17 17]|url=https://archive.org/details/radiationscience0000zaid/page/17}}</ref>、[[宇宙塵]]によって堆積した可能性のある微量の[[プルトニウム244]]を除いて、これらの元素の特定可能な量はずっと前に崩壊している<ref name="Manuel2001pp511-519" />。ネプツニウムとプルトニウムの天然鉱床は、[[ウラン鉱石]]中で中性子捕獲によって生成される<ref name="ofr_cut" />。 |
|||
地球には約{{val|1.33|e=50}} 個の原子が存在する<ref name="weisenberger" />。[[地球の大気|大気]]中には、[[アルゴン]]、[[ネオン]]、ヘリウムのような[[希ガス]]とよばれる独立原子が少数存在するが、大気の99%は[[二酸化炭素]]、[[二原子分子|二原子]][[酸素]]、[[窒素]]などの分子の形に結合した原子が占める。地球の表面では、圧倒的多数の原子が結合して、[[水]]、[[塩]]、[[ケイ酸塩]]、[[酸化物]]などのさまざまな化合物を形成している。原子が結合して、[[結晶]]や[[金属]]のように個別の分子で構成されていない物質を作り出すこともできる<ref name="pidwirnyf" /><ref name="pnas99_22_13966" />。こうした原子物質はネットワーク状の配列を形成しているが、分子物質に見られるような小規模で断続性の秩序を持たない<ref>{{cite book |
|||
|last=Pauling|first=Linus|year=1960 |
|||
|title=The Nature of the Chemical Bond |
|||
|publisher=Cornell University Press |
|||
|isbn=978-0-8014-0333-0 |
|||
|oclc=17518275|pages=5–10}}</ref>。 |
|||
=== 希少元素と理論的形態 === |
|||
==== 超重元素 ==== |
|||
{{Main|超重元素}} |
|||
原子番号が82([[鉛]])よりも大きな核種はすべて放射性であることが知られている。原子番号92([[ウラン]])を超える核種は、{{Ill2|原始核種|en|Primordial nuclide}}としては地球上に存在しない。一般に重い元素ほど半減期は短い傾向があるが、原子番号[[ダームスタチウム|110]]から[[フレロビウム|114]]の超重元素の比較的長寿命の同位体を含む「[[安定の島]]」<ref name="cern28509" />の存在が考えられている<ref name="KarpovSHE">{{cite journal|last1=Karpov|first1=A. V.|last2=Zagrebaev|first2=V. I.|last3=Palenzuela|first3=Y. M.|last4=Ruiz|first4=L. F.|last5=Greiner|first5=W.|title=Decay properties and stability of the heaviest elements|journal=International Journal of Modern Physics E|date=2012|volume=21|issue=2|pages=1250013-1–1250013-20<!-- Deny Citation Bot-->|doi=10.1142/S0218301312500139|url=http://nrv.jinr.ru/karpov/publications/Karpov12_IJMPE.pdf|bibcode=2012IJMPE..2150013K|display-authors=3|access-date=24 March 2020|archive-date=3 December 2016|archive-url=https://web.archive.org/web/20161203230540/http://nrv.jinr.ru/karpov/publications/Karpov12_IJMPE.pdf|url-status=live}}</ref>。この島で最も安定な核種の半減期は数分から数百万年と予測されている<ref name="physorg">{{cite web |url=http://newscenter.lbl.gov/2009/09/24/114-confirmed/ |title=Superheavy Element 114 Confirmed: A Stepping Stone to the Island of Stability |date=2009 |publisher=[[:en:Lawrence Berkeley National Laboratory|Berkeley Lab]] |access-date=24 March 2020 |archive-date=20 July 2019 |archive-url=https://web.archive.org/web/20190720200414/https://newscenter.lbl.gov/2009/09/24/114-confirmed/ |url-status=live }}</ref>。いずれにせよ、この安定化効果がなければ、[[クーロン]]反発力の増加により(その結果、半減期がますます短くなって[[自発核分裂]]が起こる)、超重元素(''Z'' > 104)は存在しなくなる<ref name="liquiddrop">{{cite journal |last=Möller |first=P. |date=2016 |title=The limits of the nuclear chart set by fission and alpha decay |journal=EPJ Web of Conferences |volume=131 |pages=03002-1–03002-8<!-- Deny Citation Bot--> |url=http://inspirehep.net/record/1502715/files/epjconf-NS160-03002.pdf |doi=10.1051/epjconf/201613103002 |bibcode=2016EPJWC.13103002M |doi-access=free |access-date=24 March 2020 |archive-date=11 March 2020 |archive-url=https://web.archive.org/web/20200311130852/http://inspirehep.net/record/1502715/files/epjconf-NS160-03002.pdf |url-status=live }}</ref>。 |
|||
==== 異種物質 ==== |
|||
{{Main|1=[[エキゾチック物質|異種物質]]}} |
|||
物質の各粒子には、反対の電荷を持つ対応する[[反物質]]粒子がある。たとえば、[[陽電子]]は正電荷を帯びた[[反電子]]の同等物であり、反陽子は負電荷を帯びた[[陽子]]の同等物である。物質粒子と対応する反物質粒子が出会うと、互いに消滅する。このため、物質粒子と反物質粒子の数は不均衡になり、反物質粒子は宇宙では希少なものとなる。この不均衡の最初の原因はまだ完全には解明されていないが、[[バリオン数生成]]の理論で説明が試みられている。結果的には、自然界で反物質原子は発見されていない<ref name="koppes1999" /><ref name="cromie20010816" />。1996年、[[ジュネーヴ|ジュネーブ]]の[[欧州原子核研究機構]](CERN)で水素原子の反物質原子([[反水素]])が合成された<ref name="nature419_6906_439" /><ref name="BBC20021030" />。 |
|||
陽子、中性子、電子のいずれか1つを同じ電荷を持つ他の粒子と置き換えることで、別の[[異種原子]]が作られてきた。たとえば、電子をより質量の大きい[[ミューオン]]と置き換えて、{{Ill2|ミューオン原子|en|Muonic atom}}を形成することができる。この種の原子は、物理学の基本的な予測を検証するために使うことができる<ref name="ns1728_77" /><ref name="psT112_1_20" /><ref name="ripin1998" />。 |
|||
== 関連項目 == |
|||
{{cmn|colwidth=21em| |
|||
* [[量子力学の歴史]] - 現代物理学の根幹をなす量子力学が生まれた歴史的なできごと{{Enlink|History of quantum mechanics|英語版が優れる|en}} |
|||
* {{Ill2|無限回分解可能|en|Infinite divisibility}} - 哲学、物理学、経済学、秩序理論、確率論など、さまざまな分野で語られる話題 |
|||
* {{Ill2|化学の概要|en|Outline of chemistry}} - 化学の概要およびトピックガイド |
|||
* [[運動 (物理学)]] - 物体が時間に対してその位置を変化させること |
|||
* [[原子・亜原子物理学の年表]] |
|||
* [[原子核]] - 原子の中心にある陽子と中性子からなる小さく密な領域 |
|||
* [[放射性同位体]] - 過剰な核エネルギーを持ち、不安定な核種 |
|||
}} |
|||
== 注釈 == |
|||
{{reflist|group="note"}} |
|||
{{notelist}} |
|||
== 脚注 == |
== 脚注 == |
||
{{脚注ヘルプ}} |
{{脚注ヘルプ}} |
||
<!-- this 'empty' section displays references defined elsewhere --> |
|||
=== 注釈 === |
|||
{{reflist|30em|refs= |
|||
{{Notelist}} |
|||
=== 出典 === |
|||
{{Reflist}} |
|||
<!-- unused <ref name=adp322_8_549>{{cite journal|last=Einstein|first=Albert|year=1905|title=Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen|journal=[[:en:Annalen der Physik|Annalen der Physik]]|volume=322|issue=8|pages=549–560|language=de|url=http://www.zbp.univie.ac.at/dokumente/einstein2.pdf|doi=10.1002/andp.19053220806|bibcode=1905AnP...322..549E|archive-url=https://web.archive.org/web/20070718202731/http://www.zbp.univie.ac.at/dokumente/einstein2.pdf|archive-date=18 July 2007|url-status=live|doi-access=free}}</ref> --> |
|||
== 参考文献 == |
|||
<!-- unused <ref name=lee_hoon1995>{{cite web|last=Lee|first=Y.K.|year=1995|author2=Hoon, K.|title=Brownian Motion|url=http://www.doc.ic.ac.uk/~nd/surprise_95/journal/vol4/ykl/report.html|publisher=[[:en:Imperial College|Imperial College]]|archive-url=https://web.archive.org/web/20071218061408/http://www.doc.ic.ac.uk/~nd/surprise_95/journal/vol4/ykl/report.html|archive-date=18 December 2007|url-status=dead}}</ref> --> |
|||
<!-- unused <ref name=e31_2_50>{{cite journal|last=Patterson|first=G.|year=2007 |title=Jean Perrin and the triumph of the atomic doctrine|journal=[[:en:Endeavour (journal)|Endeavour]]|volume=31|issue=2|pages=50–53|doi=10.1016/j.endeavour.2007.05.003|pmid=17602746}}</ref> --> |
|||
<ref name=npc1921>{{cite web|url=http://nobelprize.org/nobel_prizes/chemistry/laureates/1921/soddy-bio.html|title=Frederick Soddy, The Nobel Prize in Chemistry 1921|publisher=[[ノーベル財団]]|access-date=18 January 2008|archive-url=https://web.archive.org/web/20080409210519/http://nobelprize.org/nobel_prizes/chemistry/laureates/1921/soddy-bio.html|archive-date=9 April 2008|url-status=live}}</ref> |
|||
<ref name=prsA_89_1_1913>{{cite journal|doi=10.1098/rspa.1913.0057|last=Thomson|first=Joseph John|title=Rays of positive electricity|url=http://web.lemoyne.edu/~giunta/canal.html|series=A|journal=[[:en:Proceedings of the Royal Society|Proceedings of the Royal Society]]|year=1913|volume=89|issue=607|pages=1–20|bibcode=1913RSPSA..89....1T|doi-access=free|archive-url=https://web.archive.org/web/20161104174348/http://web.lemoyne.edu/~giunta/canal.html|archive-date=4 November 2016|url-status=live}}</ref> |
|||
<ref name=stern20050516>{{cite web|last=Stern|first=David P.|date=16 May 2005|title=The Atomic Nucleus and Bohr's Early Model of the Atom|url=http://www-spof.gsfc.nasa.gov/stargaze/Q5.htm|publisher=[[NASA|NASA]]/[[ゴダード宇宙飛行センター]]|archive-url=https://web.archive.org/web/20070820084047/http://www-spof.gsfc.nasa.gov/stargaze/Q5.htm|archive-date=20 August 2007|url-status=live|accessdate=2022-02-17}}</ref> |
|||
<ref name=bohr19221211>{{cite web|last=Bohr|first=Niels|date=11 December 1922|title=Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture|url=http://nobelprize.org/nobel_prizes/physics/laureates/1922/bohr-lecture.html|publisher=[[ノーベル財団]]|archive-url=https://web.archive.org/web/20080415183736/http://nobelprize.org/nobel_prizes/physics/laureates/1922/bohr-lecture.html|archive-date=15 April 2008|url-status=live|accessdate=2008-02-16}}</ref> |
|||
<ref name=jacs38_4_762>{{cite journal|last=Lewis|first=Gilbert N.|year=1916|title=The Atom and the Molecule|journal=[[:en:Journal of the American Chemical Society|Journal of the American Chemical Society]]|volume=38|issue=4|pages=762–786|doi=10.1021/ja02261a002|s2cid=95865413 |url=https://zenodo.org/record/1429068|archive-url=https://web.archive.org/web/20190825132554/https://zenodo.org/record/1429068/files/article.pdf|archive-date=25 August 2019|url-status=live}}</ref> |
|||
<ref name=jacs41_6_868>{{cite journal|last=Langmuir|first=Irving|year=1919|title=The Arrangement of Electrons in Atoms and Molecules|journal=[[:en:Journal of the American Chemical Society|Journal of the American Chemical Society]]|volume=41|issue=6|pages=868–934|doi=10.1021/ja02227a002|url=https://zenodo.org/record/1429026|archive-url=https://web.archive.org/web/20190621192330/https://zenodo.org/record/1429026|archive-date=21 June 2019|url-status=live}}</ref> |
|||
<!-- |
|||
<ref name=fop17_6_575>{{cite journal|last=Scully|first=Marlan O. |author2=Lamb, Willis E.|author3= Barut, Asim|year=1987|title=On the theory of the Stern-Gerlach apparatus|journal=[[:en:Foundations of Physics|Foundations of Physics]]|volume=17|issue=6|pages=575–583|doi=10.1007/BF01882788|bibcode = 1987FoPh...17..575S |s2cid=122529426 }}</ref> |
|||
--> |
|||
<ref name=brown2007>{{cite web|last=Brown|first=Kevin|year=2007|url=http://www.mathpages.com/home/kmath538/kmath538.htm|title=The Hydrogen Atom|publisher=MathPages|archive-url=https://archive.today/2012.09.05-172648/http://www.mathpages.com/home/kmath538/kmath538.htm|archive-date=5 September 2012|url-status=live|accessdate=2008-01-02}}</ref> |
|||
<ref name=harrison2000>{{cite web|last=Harrison|first=David M.|year=2000|title=The Development of Quantum Mechanics|url=http://www.upscale.utoronto.ca/GeneralInterest/Harrison/DevelQM/DevelQM.html|publisher=[[トロント大学]]| archive-url= https://web.archive.org/web/20071225095938/http://www.upscale.utoronto.ca/GeneralInterest/Harrison/DevelQM/DevelQM.html| archive-date= 25 December 2007 | url-status= live|accessdate=2008-01-02}}</ref> |
|||
<ref name=pm39_6_449>{{cite journal|last=Aston|first=Francis W.|year=1920|title=The constitution of atmospheric neon|journal=[[:en:Philosophical Magazine|Philosophical Magazine]]|volume=39|issue=6|pages=449–455|doi=10.1080/14786440408636058|url=https://zenodo.org/record/1430720|access-date=25 October 2020|archive-date=27 April 2021|archive-url=https://web.archive.org/web/20210427095842/https://zenodo.org/record/1430720|url-status=live}}</ref> |
|||
<ref name=chadwick1935>{{cite web|last=Chadwick|first=James|date=12 December 1935|title=Nobel Lecture: The Neutron and Its Properties|url=http://nobelprize.org/nobel_prizes/physics/laureates/1935/chadwick-lecture.html|publisher=[[ノーベル財団]]|archive-url=https://web.archive.org/web/20071012100351/http://nobelprize.org/nobel_prizes/physics/laureates/1935/chadwick-lecture.html|archive-date=12 October 2007|url-status=live|accessdate=2008-01-02}}</ref> |
|||
<ref name="CHF">{{cite web|title=Otto Hahn, Lise Meitner, and Fritz Strassmann|url=https://www.sciencehistory.org/historical-profile/otto-hahn-lise-meitner-and-fritz-strassmann|website=Science History Institute|date=June 2016|archive-url=https://web.archive.org/web/20180321130950/https://www.sciencehistory.org/historical-profile/otto-hahn-lise-meitner-and-fritz-strassmann|archive-date=21 March 2018|url-status=live|accessdate=2018-03-21}}</ref> |
|||
<ref name=Bowden>{{cite book|last1=Bowden|first1=Mary Ellen|title=Chemical achievers : the human face of the chemical sciences|date=1997|publisher=Chemical Heritage Foundation|location=Philadelphia, PA|isbn=978-0-941901-12-3|chapter=Otto Hahn, Lise Meitner, and Fritz Strassmann|pages=[https://archive.org/details/chemicalachiever0000bowd/page/76 76–80, 125]|chapter-url=https://archive.org/details/chemicalachiever0000bowd/page/76}}</ref> |
|||
<ref name=nature143_3615_239>{{cite journal |last1=Meitner|first1=Lise|last2=Frisch|first2=Otto Robert|year=1939|title=Disintegration of uranium by neutrons: a new type of nuclear reaction|journal=[[:en:Nature (journal)|Nature]]|volume=143 |issue=3615 |pages=239–240 |doi=10.1038/143239a0 |bibcode = 1939Natur.143..239M |s2cid=4113262}}</ref> |
|||
<ref name=schroeder>{{cite web|last=Schroeder|first=M.|title=Lise Meitner – Zur 125. Wiederkehr Ihres Geburtstages|url=http://www.physik3.gwdg.de/~mrs/Vortraege/Lise_Meitner-Vortrag-20031106/|language=de|access-date=4 June 2009|url-status=dead|archive-url=https://web.archive.org/web/20110719034227/http://www.physik3.gwdg.de/~mrs/Vortraege/Lise_Meitner-Vortrag-20031106/|archive-date=19 July 2011}}</ref> |
|||
<ref name=schroeder2>{{cite web |last=Schroeder|first=Paul A. |
|||
|date=25 February 2000 |url=http://www.gly.uga.edu/schroeder/geol3010/magnetics.html |title=Magnetic Properties |publisher=University of Georgia|archive-url = https://web.archive.org/web/20070429150216/http://www.gly.uga.edu/schroeder/geol3010/magnetics.html |archive-date = 29 April 2007|accessdate=2007-12-14}}</ref> |
|||
<ref name=pt50_9_26>{{cite journal|last1=Crawford |first1=E.| year=1997|title=A Nobel tale of postwar injustice|url=https://www.researchgate.net/publication/260861491|journal=[[:en:Physics Today|Physics Today]]|volume=50|issue=9|pages=26–32|doi=10.1063/1.881933|last2=Sime|first2=Ruth Lewin|author-link2=Ruth Lewin Sime|last3=Walker|first3=Mark |bibcode = 1997PhT....50i..26C }}</ref> |
|||
<ref name=kullander2001>{{cite web|last=Kullander|first=Sven|date=28 August 2001|title=Accelerators and Nobel Laureates|url=http://nobelprize.org/nobel_prizes/physics/articles/kullander/|publisher=[[ノーベル財団]]|archive-url=https://web.archive.org/web/20080413064924/http://nobelprize.org/nobel_prizes/physics/articles/kullander/|archive-date=13 April 2008|url-status=live|accessdate=2008-01-31}}</ref> |
|||
<ref name=npp1990>{{cite web|date=17 October 1990|title=The Nobel Prize in Physics 1990|url=http://nobelprize.org/nobel_prizes/physics/laureates/1990/press.html|publisher=[[ノーベル財団]]|archive-url=https://web.archive.org/web/20080514100040/http://nobelprize.org/nobel_prizes/physics/laureates/1990/press.html|archive-date=14 May 2008|url-status=live|accessdate=2008-01-31}}</ref> |
|||
<ref name=pdg2002>{{cite web|author=Particle Data Group|year=2002|url=http://www.particleadventure.org/|title=The Particle Adventure|publisher=Lawrence Berkeley Laboratory| archive-url= https://web.archive.org/web/20070104075936/http://www.particleadventure.org/| archive-date= 4 January 2007 | url-status= live|accessdate=2008-01-03}}</ref> |
|||
<ref name=schombert2006>{{cite web|first=James|last=Schombert|date=18 April 2006|url=http://abyss.uoregon.edu/~js/ast123/lectures/lec07.html|title=Elementary Particles|publisher=University of Oregon|archive-url=https://web.archive.org/web/20110830212645/http://abyss.uoregon.edu/~js/ast123/lectures/lec07.html|archive-date=30 August 2011|url-status=live|accessdate=2008-01-03}}</ref> |
|||
<ref name=wenner2007>{{cite web|last=Wenner|first=Jennifer M.|date=10 October 2007|url=http://serc.carleton.edu/quantskills/methods/quantlit/RadDecay.html|title=How Does Radioactive Decay Work?|publisher=Carleton College|archive-url=https://web.archive.org/web/20080511173156/http://serc.carleton.edu/quantskills/methods/quantlit/RadDecay.html|archive-date=11 May 2008|url-status=live|accessdate=2008-01-09}}</ref> |
|||
<ref name=mihos2002>{{cite web|last=Mihos|first=Chris|date=23 July 2002|url=http://burro.cwru.edu/Academics/Astr221/StarPhys/coulomb.html|title=Overcoming the Coulomb Barrier|publisher=Case Western Reserve University|archive-url=https://web.archive.org/web/20060912013620/http://burro.cwru.edu/Academics/Astr221/StarPhys/coulomb.html|archive-date=12 September 2006|url-status=live|accessdate=2008-02-13}}</ref> |
|||
<ref name=lbnl20070330>{{cite web|author=Staff|date=30 March 2007|url=http://www.lbl.gov/abc/Basic.html|title=ABC's of Nuclear Science|publisher=Lawrence Berkeley National Laboratory| archive-url= https://web.archive.org/web/20061205215708/http://www.lbl.gov/abc/Basic.html| archive-date= 5 December 2006 | url-status= live|accessdate=2008-01-03}}</ref> |
|||
<ref name=makhijani_saleska2001>{{cite web|first=Arjun|last=Makhijani|author2=Saleska, Scott|date=2 March 2001|url=http://www.ieer.org/reports/n-basics.html|title=Basics of Nuclear Physics and Fission|publisher=Institute for Energy and Environmental Research| archive-url= https://web.archive.org/web/20070116045217/http://www.ieer.org/reports/n-basics.html| archive-date= 16 January 2007 | url-status= live|accessdate=2008-01-03}}</ref> |
|||
<ref name=ajp63_7_653>{{cite journal|last=Fewell|first=M.P.|title=The atomic nuclide with the highest mean binding energy|journal=[[:en:American Journal of Physics|American Journal of Physics]]|year=1995|volume=63|issue=7|pages=653–658|bibcode=1995AmJPh..63..653F|doi=10.1119/1.17828}}</ref> |
|||
<ref name="raymond">{{cite web|last=Raymond |first=David |date=7 April 2006 |url=http://physics.nmt.edu/~raymond/classes/ph13xbook/node216.html |archive-url=https://web.archive.org/web/20021201030437/http://physics.nmt.edu/~raymond/classes/ph13xbook/node216.html |url-status=dead |archive-date=1 December 2002 |title=Nuclear Binding Energies |publisher=New Mexico Tech|accessdate=2008-01-03}}</ref> |
|||
<ref name=science157_3784_13>{{cite journal|last=Mulliken|first=Robert S.|title=Spectroscopy, Molecular Orbitals, and Chemical Bonding|journal=[[:en:Science (journal)|Science]] |year=1967|volume=157|issue=3784|pages=13–24|doi=10.1126/science.157.3784.13|pmid=5338306|bibcode = 1967Sci...157...13M }}</ref> |
|||
<ref name=Brucat2008>{{cite web|last=Brucat |first=Philip J. |year=2008 |url=http://www.chem.ufl.edu/~itl/2045/lectures/lec_10.html |title=The Quantum Atom |publisher=University of Florida|archive-url=https://web.archive.org/web/20061207032136/http://www.chem.ufl.edu/~itl/2045/lectures/lec_10.html |archive-date=7 December 2006 |url-status=dead |accessdate=2008-01-04}}</ref> |
|||
<ref name=herter_8>{{cite web|last=Herter |first=Terry |year=2006 |url=http://astrosun2.astro.cornell.edu/academics/courses/astro101/herter/lectures/lec08.htm |title=Lecture 8: The Hydrogen Atom |publisher=Cornell University|url-status=dead |archive-url=https://web.archive.org/web/20120222062433/http://astrosun2.astro.cornell.edu/academics/courses/astro101/herter/lectures/lec08.htm |archive-date=22 February 2012 |accessdate=2008-02-14}}</ref> |
|||
<ref name=pr79_2_282>{{cite journal|last1=Bell|first1=R.E.|title=Gamma-Rays from the Reaction H<sup>1</sup>(n,γ)D<sup>2</sup> and the Binding Energy of the Deuteron|journal=[[:en:Physical Review|Physical Review]]|year=1950|volume=79|issue=2|pages=282–285|doi=10.1103/PhysRev.79.282|last2=Elliott|first2=L.G.|bibcode = 1950PhRv...79..282B }}</ref> |
|||
<ref name=matis2000>{{cite web|last=Matis|first=Howard S.|date=9 August 2000|url=http://www.lbl.gov/abc/wallchart/chapters/02/3.html|title=The Isotopes of Hydrogen|website=Guide to the Nuclear Wall Chart|publisher=Lawrence Berkeley National Lab| archive-url= https://web.archive.org/web/20071218153548/http://www.lbl.gov/abc/wallchart/chapters/02/3.html| archive-date= 18 December 2007 | url-status= live| accessdate=2008-01-02}}</ref> |
|||
<ref name=weiss20061017>{{cite news|last=Weiss|first=Rick|date=17 October 2006|title=Scientists Announce Creation of Atomic Element, the Heaviest Yet|newspaper=Washington Post|url=https://www.washingtonpost.com/wp-dyn/content/article/2006/10/16/AR2006101601083.html|archive-url=https://web.archive.org/web/20110820082130/http://www.washingtonpost.com/wp-dyn/content/article/2006/10/16/AR2006101601083.html|archive-date=20 August 2011|url-status=live}}</ref> |
|||
<ref name=dume20030423>{{cite news|last=Dumé|first=Belle|date=23 April 2003|title=Bismuth breaks half-life record for alpha decay|publisher=Physics World|url=http://physicsworld.com/cws/article/news/17319| archive-url= https://web.archive.org/web/20071214151450/http://physicsworld.com/cws/article/news/17319| archive-date= 14 December 2007 | url-status= live}}</ref> |
|||
<ref name=lidsay20000730>{{cite web|last=Lindsay|first=Don|date=30 July 2000|url=http://www.don-lindsay-archive.org/creation/isotope_list.html|title=Radioactives Missing From The Earth|publisher=Don Lindsay Archive| archive-url= https://web.archive.org/web/20070428225550/http://www.don-lindsay-archive.org/creation/isotope_list.html| archive-date= 28 April 2007 | url-status= live| accessdate=2008-05-23}}</ref> |
|||
<ref name=manthey2001>{{cite web|last=Manthey|first=David|year=2001|url=http://www.orbitals.com/orb/|title=Atomic Orbitals|publisher=Orbital Central| archive-url= https://web.archive.org/web/20080110102801/http://www.orbitals.com/orb/| archive-date= 10 January 2008 | url-status= live|accessdate=2008-01-22}}</ref> |
|||
<ref name=tuli2005>{{cite web|first=Jagdish K.|last=Tuli|date=April 2005|title=Nuclear Wallet Cards|publisher=National Nuclear Data Center, Brookhaven National Laboratory|url=http://nucleus.iaea.org/CIR/CIR/NuclearWalletCards.html|archive-url=https://web.archive.org/web/20111003185243/http://nucleus.iaea.org/CIR/CIR/NuclearWalletCards.html|archive-date=3 October 2011|url-status=live|accessdate=2010-08-06}}</ref> |
|||
<ref name=chieh2001>{{cite web|last=Chieh|first=Chung|date=22 January 2001|url=http://www.science.uwaterloo.ca/~cchieh/cact/nuctek/nuclideunstable.html|title=Nuclide Stability|publisher=University of Waterloo|archive-url=https://web.archive.org/web/20070830110015/http://www.science.uwaterloo.ca/~cchieh/cact/nuctek/nuclideunstable.html|archive-date=30 August 2007|url-status=dead|accessdate=2008-01-04}}</ref> |
|||
<ref name=nist_wc>{{cite web |
|||
|url=http://physics.nist.gov/cgi-bin/Compositions/stand_alone.pl?ele=&ascii=html&isotype=some |
|||
|title=Atomic Weights and Isotopic Compositions for All Elements |
|||
|publisher=National Institute of Standards and Technology |
|||
|access-date=4 January 2007| archive-url= https://web.archive.org/web/20061231212733/http://physics.nist.gov/cgi-bin/Compositions/stand_alone.pl?ele=&ascii=html&isotype=some| archive-date= 31 December 2006 | url-status= live}}</ref> |
|||
<ref name=audi2003>{{cite journal |last1=Audi |first1=G. |title=The Ame2003 atomic mass evaluation (II) |journal=[[:en:Nuclear Physics A|Nuclear Physics A]] |year=2003 |volume=729 |issue=1 |pages=337–676 |url=http://amdc.in2p3.fr/masstables/Ame2003/Ame2003b.pdf |doi=10.1016/j.nuclphysa.2003.11.003 |bibcode=2003NuPhA.729..337A |last2=Wapstra |first2=A.H. |last3=Thibault |first3=C.|archive-url=https://web.archive.org/web/20051016185841/http://amdc.in2p3.fr/masstables/Ame2003/Ame2003b.pdf |archive-date=16 October 2005 |url-status=live }}</ref> |
|||
<ref name=aca32_5_751>{{cite journal|last=Shannon|first=R.D.|title=Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides|journal=[[:en:Acta Crystallographica A|Acta Crystallographica A]]|year=1976|volume=32|issue=5|pages=751–767|doi=10.1107/S0567739476001551|bibcode=1976AcCrA..32..751S|url=http://journals.iucr.org/a/issues/1976/05/00/a12967/a12967.pdf|access-date=25 August 2019|archive-date=14 August 2020|archive-url=https://web.archive.org/web/20200814154832/https://journals.iucr.org/a/issues/1976/05/00/a12967/a12967.pdf|url-status=live}}</ref> |
|||
<ref name=dong1998>{{cite web|last=Dong|first=Judy|year=1998 |url=http://hypertextbook.com/facts/MichaelPhillip.shtml|title=Diameter of an Atom|publisher=The Physics Factbook| archive-url= https://web.archive.org/web/20071104160920/http://hypertextbook.com/facts/MichaelPhillip.shtml| archive-date= 4 November 2007 | url-status= live| accessdate=2007-11-19}}</ref> |
|||
<ref name=osu2007>{{cite web |
|||
|author=Staff |
|||
|year=2007 |
|||
|url=http://oregonstate.edu/terra/2007/02/small-miracles/ |
|||
|title=Small Miracles: Harnessing nanotechnology |
|||
|publisher=Oregon State University |
|||
|archive-url=https://web.archive.org/web/20110521145107/http://oregonstate.edu/terra/2007/02/small-miracles/ |
|||
|archive-date=21 May 2011 |
|||
|url-status=live |
|||
|accessdate=2008-01-07 |
|||
}} – describes the width of a human hair as {{val|e=5|u=nm}} and 10 carbon atoms as spanning 1 nm.</ref> |
|||
<ref name=splung>{{cite web |url=http://www.splung.com/content/sid/5/page/radioactivity |title=Radioactivity |publisher=Splung.com |access-date=19 December 2007| archive-url= https://web.archive.org/web/20071204135150/http://www.splung.com/content/sid/5/page/radioactivity| archive-date= 4 December 2007 | url-status= live}}</ref> |
|||
<ref name=firestone20000522>{{cite web|last=Firestone |first=Richard B. |date=22 May 2000 |url=http://isotopes.lbl.gov/education/decmode.html |title=Radioactive Decay Modes |publisher=Berkeley Laboratory|url-status=dead |archive-url=https://web.archive.org/web/20060929111801/http://isotopes.lbl.gov/education/decmode.html |archive-date=29 September 2006|accessdate=2010-09-08}}</ref> |
|||
<ref name=hornak2006>{{cite web |last=Hornak|first=J.P.|year=2006 |url=http://www.cis.rit.edu/htbooks/nmr/chap-3/chap-3.htm |title=Chapter 3: Spin Physics|website=The Basics of NMR |publisher=Rochester Institute of Technology| archive-url= https://web.archive.org/web/20070203044312/http://www.cis.rit.edu/htbooks/nmr/chap-3/chap-3.htm| archive-date= 3 February 2007 | url-status= live| accessdate=2008-01-07}}</ref> |
|||
<ref name=goebel20070901>{{cite web |last=Goebel |first=Greg |date=1 September 2007 |url=http://www.vectorsite.net/tpqm_04.html |title=<nowiki>[4.3]</nowiki> Magnetic Properties of the Atom |website=Elementary Quantum Physics |publisher=In The Public Domain website|archive-url=https://web.archive.org/web/20110629143026/http://www.vectorsite.net/tpqm_04.html |archive-date=29 June 2011 |url-status=dead| accessdate=2008-01-07}}</ref> |
|||
<ref name=yarris1997>{{cite journal |last=Yarris|first=Lynn|title=Talking Pictures |journal=Berkeley Lab Research Review |date=Spring 1997 |url=http://www.lbl.gov/Science-Articles/Research-Review/Magazine/1997/story1.html| archive-url= https://web.archive.org/web/20080113104939/http://www.lbl.gov/Science-Articles/Research-Review/Magazine/1997/story1.html| archive-date= 13 January 2008 | url-status= live}}</ref> |
|||
<ref name=zeghbroeck1998>{{cite web |
|||
|last=Zeghbroeck |
|||
|first=Bart J. Van |
|||
|year=1998 |
|||
|url=http://physics.ship.edu/~mrc/pfs/308/semicon_book/eband2.htm |
|||
|archive-url=https://web.archive.org/web/20050115030639/http://physics.ship.edu/~mrc/pfs/308/semicon_book/eband2.htm |
|||
|url-status=dead |
|||
|archive-date=15 January 2005 |
|||
|title=Energy levels |
|||
|publisher=Shippensburg University |
|||
|accessdate=2008-01-02 |
|||
}}</ref> |
|||
<ref name=martin2007>{{cite web |last=Martin|first=W.C. |author2=Wiese, W.L.|date=May 2007 |url=http://physics.nist.gov/Pubs/AtSpec/ |title=Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas |publisher=National Institute of Standards and Technology| archive-url= https://web.archive.org/web/20070208113156/http://physics.nist.gov/Pubs/AtSpec/| archive-date= 8 February 2007 | url-status= live| accessdate=2018-11-15}}</ref> |
|||
<ref name=avogadro>{{cite web|url=http://www.avogadro.co.uk/light/bohr/spectra.htm |title=Atomic Emission Spectra – Origin of Spectral Lines |publisher=Avogadro Web Site |access-date=10 August 2006 |url-status=dead |archive-url=https://web.archive.org/web/20060228231025/http://www.avogadro.co.uk/light/bohr/spectra.htm |archive-date=28 February 2006 }}</ref> |
|||
<ref name=fitzpatrick20070216>{{cite web |last=Fitzpatrick |first=Richard |date=16 February 2007 |url=http://farside.ph.utexas.edu/teaching/qm/lectures/node55.html |title=Fine structure |publisher=University of Texas at Austin|archive-url=https://web.archive.org/web/20110927021402/http://farside.ph.utexas.edu/teaching/qm/lectures/node55.html |archive-date=27 September 2011 |url-status=live |accessdate=2008-02-14 }}</ref> |
|||
<ref name=weiss2001>{{cite web |last=Weiss|first=Michael|year=2001 |url=http://math.ucr.edu/home/baez/spin/node8.html |title=The Zeeman Effect |publisher=University of California-Riverside| archive-url= https://web.archive.org/web/20080202143147/http://math.ucr.edu/home/baez/spin/node8.html| archive-date= 2 February 2008 | url-status= live| accessdate=2008-01-02 }}</ref> |
|||
<ref name=watkins_sjsu>{{cite web |last=Watkins |first=Thayer |url=http://www.sjsu.edu/faculty/watkins/stimem.htm |title=Coherence in Stimulated Emission |publisher=San José State University |access-date=23 December 2007 | archive-url= https://web.archive.org/web/20080112234014/http://www.sjsu.edu/faculty/watkins/stimem.htm| archive-date= 12 January 2008 | url-status= live}}</ref> |
|||
<ref name=reusch20070716>{{cite web|last=Reusch |first=William |date=16 July 2007 |url=http://www.cem.msu.edu/~reusch/VirtualText/intro1.htm |title=Virtual Textbook of Organic Chemistry |publisher=Michigan State University|url-status=dead |archive-url=https://web.archive.org/web/20071029211245/http://www.cem.msu.edu/~reusch/VirtualText/intro1.htm |archive-date=29 October 2007| accessdate=2008-01-11 }}</ref> |
|||
<ref name=chemguide>{{cite web |url=http://www.chemguide.co.uk/atoms/bonding/covalent.html |title=Covalent bonding – Single bonds |publisher=chemguide |year=2000|archive-url=https://web.archive.org/web/20081101203444/http://www.chemguide.co.uk/atoms/bonding/covalent.html |archive-date=1 November 2008 |url-status=live |accessdate=2008-11-20 }}</ref> |
|||
<ref name=husted20031211>{{cite web |last=Husted | first=Robert |date=11 December 2003 |url=http://periodic.lanl.gov/default.htm |title=Periodic Table of the Elements |publisher=Los Alamos National Laboratory| archive-url= https://web.archive.org/web/20080110103232/http://periodic.lanl.gov/default.htm| archive-date= 10 January 2008 | url-status= live|display-authors=etal |accessdate=2008-01-11 }}</ref> |
|||
<ref name=baum2003>{{cite magazine |first=Rudy |last=Baum |year=2003 |url=http://pubs.acs.org/cen/80th/elements.html |title=It's Elemental: The Periodic Table |magazine=Chemical & Engineering News|archive-url=https://web.archive.org/web/20110406121140/http://pubs.acs.org/cen/80th/elements.html |archive-date=6 April 2011 |url-status=live }}</ref> |
|||
<ref name=pu49_7_719>{{cite journal |last=Brazhkin|first=Vadim V. |title=Metastable phases, phase transformations, and phase diagrams in physics and chemistry |journal=Physics-Uspekhi |year=2006|volume=49 |issue=7|pages=719–724 |doi=10.1070/PU2006v049n07ABEH006013 |bibcode = 2006PhyU...49..719B |s2cid=93168446 }}</ref> |
|||
<ref name=nist_bec>{{cite news |author=Staff|date=9 October 2001 |title=Bose–Einstein Condensate: A New Form of Matter |publisher=National Institute of Standards and Technology |url=https://www.nist.gov/public_affairs/releases/bec_background.cfm| archive-url= https://web.archive.org/web/20080103192918/https://www.nist.gov/public_affairs/releases/BEC_background.htm| archive-date= 3 January 2008 | url-status= live}}</ref> |
|||
<ref name=colton_fyffe1999>{{cite web |last=Colton|first=Imogen|author2=Fyffe, Jeanette |
|||
|date=3 February 1999 |url=http://www.ph.unimelb.edu.au/~ywong/poster/articles/bec.html |title=Super Atoms from Bose–Einstein Condensation |publisher=The University of Melbourne| archive-url = https://web.archive.org/web/20070829200820/http://www.ph.unimelb.edu.au/~ywong/poster/articles/bec.html| archive-date = 29 August 2007 |accessdate=2008-02-06 }}</ref> |
|||
<ref name=jacox1997>{{cite web |last=Jacox|first=Marilyn|author2=Gadzuk, J. William |url=http://physics.nist.gov/GenInt/STM/stm.html |title=Scanning Tunneling Microscope |publisher=National Institute of Standards and Technology |date=November 1997| archive-url= https://web.archive.org/web/20080107133132/http://physics.nist.gov/GenInt/STM/stm.html| archive-date= 7 January 2008 | url-status= live |accessdate=2008-01-11 }}</ref> |
|||
<ref name=nf_physics1986>{{cite web |url=http://nobelprize.org/nobel_prizes/physics/laureates/1986/index.html |title=The Nobel Prize in Physics 1986 |publisher=The Nobel Foundation |access-date=11 January 2008 |archive-url=https://web.archive.org/web/20080917103215/http://nobelprize.org/nobel_prizes/physics/laureates/1986/index.html |archive-date=17 September 2008 |url-status=live }} In particular, see the Nobel lecture by G. Binnig and H. Rohrer.</ref> |
|||
<ref name=sab53_13_1739>{{cite journal |first1=N.|last1=Jakubowski |title = Sector field mass spectrometers in ICP-MS |journal = Spectrochimica Acta Part B: Atomic Spectroscopy |volume = 53|issue = 13|year = 1998 |doi=10.1016/S0584-8547(98)00222-5|pages = 1739–1763|bibcode = 1998AcSpe..53.1739J |last2=Moens |first2=Luc |last3=Vanhaecke |first3=Frank }}</ref> |
|||
<ref name=rsi39_1_83>{{cite journal |last1=Müller |first1=Erwin W. |author-link1=Erwin Wilhelm Müller |last2=Panitz |first2=John A. |author-link2=J.A. Panitz |last3=McLane |first3=S. Brooks |author-link3=S. Brooks McLane |year=1968 |title=The Atom-Probe Field Ion Microscope |journal=[[:en:Review of Scientific Instruments|Review of Scientific Instruments]] |volume=39 |issue=1 |pages=83–86 |doi=10.1063/1.1683116 |
|||
|bibcode = 1968RScI...39...83M }}</ref> |
|||
<ref name=lochner2007>{{cite web |last=Lochner|first=Jim |author2=Gibb, Meredith|author3= Newman, Phil |date=30 April 2007 |url=http://imagine.gsfc.nasa.gov/docs/science/how_l1/spectral_what.html |title=What Do Spectra Tell Us? |publisher=NASA/Goddard Space Flight Center| archive-url= https://web.archive.org/web/20080116035542/http://imagine.gsfc.nasa.gov/docs/science/how_l1/spectral_what.html| archive-date= 16 January 2008 | url-status= live |accessdate=2008-01-03 }}</ref> |
|||
<ref name=winter2007>{{cite web |last=Winter|first=Mark|year=2007 |url=http://www.webelements.com/webelements/elements/text/He/hist.html |title=Helium|publisher=WebElements| archive-url= https://web.archive.org/web/20071230182148/http://www.webelements.com/webelements/elements/text/He/hist.html| archive-date= 30 December 2007 | url-status= live |accessdate=2008-01-03 }}</ref> |
|||
<ref name=hinshaw20060210>{{cite web |last=Hinshaw|first=Gary |date=10 February 2006 |url=http://map.gsfc.nasa.gov/m_uni/uni_101matter.html |title=What is the Universe Made Of? |publisher=NASA/WMAP| archive-url= https://web.archive.org/web/20071231143948/http://map.gsfc.nasa.gov/m_uni/uni_101matter.html| archive-date= 31 December 2007 | url-status= live |accessdate=2008-01-07 }}</ref> |
|||
<ref name=science259_5093_327>{{cite journal |last=Davidsen|first=Arthur F. |title=Far-Ultraviolet Astronomy on the Astro-1 Space Shuttle Mission |journal=[[:en:Science (journal)|Science]] |year=1993|volume=259 |issue=5093|pages=327–334 |doi=10.1126/science.259.5093.327 |pmid=17832344|bibcode = 1993Sci...259..327D |s2cid=28201406 }}</ref> |
|||
<ref name=nigel2000>{{cite web |first=Nigel|last=Smith|date=6 January 2000 |url=http://physicsworld.com/cws/article/print/809 |title=The search for dark matter |publisher=Physics World| archive-url= https://web.archive.org/web/20080216185952/http://physicsworld.com/cws/article/print/809| archive-date= 16 February 2008 | url-status= live |accessdate=2008-02-14 }}</ref> |
|||
<ref name=ns1794_42>{{cite journal|last=Croswell |first=Ken |title=Boron, bumps and the Big Bang: Was matter spread evenly when the Universe began? Perhaps not; the clues lie in the creation of the lighter elements such as boron and beryllium |journal=New Scientist |year=1991 |issue=1794 |page=42 |url=https://www.newscientist.com/article/mg13217944.700-boron-bumps-and-the-big-bang-was-matter-spread-evenly-whenthe-universe-began-perhaps-not-the-clues-lie-in-the-creation-of-thelighter-elements-such-as-boron-and-beryllium.html|archive-url=https://web.archive.org/web/20080207065342/http://space.newscientist.com/article/mg13217944.700-boron-bumps-and-the-big-bang-was-matter-spread-evenly-whenthe-universe-began-perhaps-not-the-clues-lie-in-the-creation-of-thelighter-elements-such-as-boron-and-beryllium.html |archive-date=7 February 2008 |url-status=dead }}</ref> |
|||
<ref name=science267_5195_192>{{cite journal |last1=Copi |first1=Craig J. |last2=Schramm |first2=DN |last3=Turner |first3=MS |year=1995 |title=Big-Bang Nucleosynthesis and the Baryon Density of the Universe |journal=[[:en:Science (journal)|Science]] |volume=267 |issue=5195 |pages=192–199 |doi=10.1126/science.7809624 |pmid=7809624 |arxiv=astro-ph/9407006 |bibcode=1995Sci...267..192C |s2cid=15613185 |url=https://cds.cern.ch/record/265576 |type=Submitted manuscript|archive-url=https://web.archive.org/web/20190814070006/https://cds.cern.ch/record/265576 |archive-date=14 August 2019 |url-status=live }}</ref> |
|||
<ref name=hinshaw20051215>{{cite web |last=Hinshaw|first=Gary|date=15 December 2005 |url=http://map.gsfc.nasa.gov/m_uni/uni_101bbtest2.html |title=Tests of the Big Bang: The Light Elements |publisher=NASA/WMAP| archive-url= https://web.archive.org/web/20080117021252/http://map.gsfc.nasa.gov/m_uni/uni_101bbtest2.html| archive-date= 17 January 2008 | url-status= live |accessdate=2008-01-13 }}</ref> |
|||
<ref name=abbott20070530>{{cite web|last=Abbott |first=Brian |date=30 May 2007 |url=http://www.haydenplanetarium.org/universe/duguide/exgg_wmap.php |title=Microwave (WMAP) All-Sky Survey |publisher=Hayden Planetarium|url-status=dead |archive-url=https://web.archive.org/web/20130213023246/http://www.haydenplanetarium.org/universe/duguide/exgg_wmap.php |archive-date=13 February 2013 |accessdate=2008-01-13 }}</ref> |
|||
<ref name=mnras106_343>{{cite journal |title=The synthesis of the elements from hydrogen |first=F. |last=Hoyle |journal=[[:en:Monthly Notices of the Royal Astronomical Society|Monthly Notices of the Royal Astronomical Society]] |volume=106|issue=5 |pages=343–383|year=1946 |bibcode=1946MNRAS.106..343H |doi=10.1093/mnras/106.5.343|doi-access=free }}</ref> |
|||
<ref name=nature405_656>{{cite journal |last1=Knauth|first1=D.C. |title=Newly synthesized lithium in the interstellar medium |journal=[[:en:Nature (journal)|Nature]] |year=2000|volume=405|pages=656–658 |doi=10.1038/35015028 |last2=Knauth|first2=D.C. |last3=Lambert|first3=David L. |last4=Crane|first4=P. |pmid=10864316 |issue=6787|bibcode = 2000Natur.405..656K |s2cid=4397202 }}</ref> |
|||
<ref name=mashnik2000>{{cite arXiv |last=Mashnik|first=Stepan G. |title=On Solar System and Cosmic Rays Nucleosynthesis and Spallation Processes |eprint=astro-ph/0008382 |year=2000 }}</ref> |
|||
<ref name=kgs20050504>{{cite web |author=Kansas Geological Survey |date=4 May 2005 |title=Age of the Earth |url=http://www.kgs.ku.edu/Extension/geotopics/earth_age.html |publisher=University of Kansas|archive-url=https://web.archive.org/web/20080705052359/http://www.kgs.ku.edu/Extension/geotopics/earth_age.html |archive-date=5 July 2008 |url-status=dead |accessdate=2008-01-14 }}</ref> |
|||
<ref name=gs190_1_205>{{cite journal |last=Dalrymple |first=G. Brent |title=The age of the Earth in the twentieth century: a problem (mostly) solved |journal=Geological Society, London, Special Publications |year=2001 |volume=190 |issue=1 |pages=205–221 |doi=10.1144/GSL.SP.2001.190.01.14 |url=http://sp.lyellcollection.org/cgi/content/abstract/190/1/205|bibcode=2001GSLSP.190..205D |s2cid=130092094 |archive-url=https://web.archive.org/web/20071111141237/http://sp.lyellcollection.org/cgi/content/abstract/190/1/205 |archive-date=11 November 2007 |url-status=live }}</ref> |
|||
<ref name=anderson_foulger_meibom2006>{{cite web |last=Anderson|first=Don L. |author-link=Don L. Anderson |author2=Foulger, G.R.|author3= Meibom, Anders |date=2 September 2006 |url=http://www.mantleplumes.org/HeliumFundamentals.html |title=Helium: Fundamental models |publisher=MantlePlumes.org| archive-url= https://web.archive.org/web/20070208194933/http://www.mantleplumes.org/HeliumFundamentals.html| archive-date= 8 February 2007 | url-status= live |accessdate=2008-01-14 }}</ref> |
|||
<ref name=pennicott2001>{{cite news |last=Pennicott|first=Katie|date=10 May 2001 |title=Carbon clock could show the wrong time |publisher=PhysicsWeb |url=http://physicsworld.com/cws/article/news/2676| archive-url= https://web.archive.org/web/20071215103132/http://physicsworld.com/cws/article/news/2676| archive-date= 15 December 2007 | url-status= live}}</ref> |
|||
<ref name=yarris2001>{{cite news |last=Yarris |first=Lynn |date=27 July 2001 |title=New Superheavy Elements 118 and 116 Discovered at Berkeley Lab |publisher=Berkeley Lab |url=http://enews.lbl.gov/Science-Articles/Archive/elements-116-118.html|archive-url=https://web.archive.org/web/20080109103538/http://enews.lbl.gov/Science-Articles/Archive/elements-116-118.html |archive-date=9 January 2008 |url-status=dead}}</ref> |
|||
<ref name=pr119_6_2000>{{cite journal |author=Diamond, H |year=1960 |title=Heavy Isotope Abundances in Mike Thermonuclear Device |journal=[[:en:Physical Review|Physical Review]] |volume=119 |issue=6 |pages=2000–2004 |doi=10.1103/PhysRev.119.2000 |bibcode = 1960PhRv..119.2000D |display-authors=etal}}</ref> |
|||
<ref name=poston1998>{{cite magazine |last=Poston |first=John W. Sr. |date=23 March 1998 |title=Do transuranic elements such as plutonium ever occur naturally? |magazine=Scientific American |url=http://www.scientificamerican.com/article/do-transuranic-elements-s/|archive-url=https://web.archive.org/web/20150327001605/http://www.scientificamerican.com/article/do-transuranic-elements-s/ |archive-date=27 March 2015 |url-status=live }}</ref> |
|||
<ref name=cz97_10_522>{{cite journal |last=Keller|first=C. |title=Natural occurrence of lanthanides, actinides, and superheavy elements |journal=Chemiker Zeitung |year=1973|volume=97|issue=10|pages=522–530 |osti=4353086 }}</ref> |
|||
<ref name=ofr_cut>{{cite web|url=http://www.oklo.curtin.edu.au/index.cfm |title=Oklo Fossil Reactors |publisher=Curtin University of Technology |access-date=15 January 2008 |archive-url=https://web.archive.org/web/20071218194159/http://www.oklo.curtin.edu.au/index.cfm |archive-date=18 December 2007 |url-status=dead }}</ref> |
|||
<ref name=weisenberger>{{cite web |last=Weisenberger |first=Drew |url=http://education.jlab.org/qa/mathatom_05.html |title=How many atoms are there in the world? |publisher=Jefferson Lab |access-date=16 January 2008 |archive-url=https://web.archive.org/web/20071022185850/http://education.jlab.org/qa/mathatom_05.html |archive-date=22 October 2007 |url-status=live }}</ref> |
|||
<ref name=pidwirnyf>{{cite web |last=Pidwirny|first=Michael |url=http://www.physicalgeography.net/fundamentals/contents.html |title=Fundamentals of Physical Geography |publisher=University of British Columbia Okanagan |access-date=16 January 2008 | archive-url= https://web.archive.org/web/20080121080709/http://www.physicalgeography.net/fundamentals/contents.html| archive-date= 21 January 2008 | url-status= live}}</ref> |
|||
<ref name=pnas99_22_13966>{{cite journal |last=Anderson|first=Don L. |title=The inner inner core of Earth |journal=[[:en:Proceedings of the National Academy of Sciences|Proceedings of the National Academy of Sciences]] |year=2002|volume=99|issue=22|pages=13966–13968 |doi=10.1073/pnas.232565899 |pmid=12391308 |pmc=137819|bibcode = 2002PNAS...9913966A |doi-access=free }}</ref> |
|||
<ref name=cern28509>{{cite journal |title=Second postcard from the island of stability |author=Anonymous|journal=CERN Courier |date=2 October 2001 |url=http://cerncourier.com/cws/article/cern/28509| archive-url= https://web.archive.org/web/20080203031237/http://cerncourier.com/cws/article/cern/28509| archive-date= 3 February 2008 | url-status= live}}</ref> |
|||
<ref name=koppes1999>{{cite news |last=Koppes |first=Steve |date=1 March 1999 |title=Fermilab Physicists Find New Matter-Antimatter Asymmetry |publisher=University of Chicago |url=http://www-news.uchicago.edu/releases/99/990301.ktev.shtml|archive-url=https://web.archive.org/web/20080719211849/http://www-news.uchicago.edu/releases/99/990301.ktev.shtml |archive-date=19 July 2008 |url-status=live }}</ref> |
|||
<ref name=cromie20010816>{{cite web |last=Cromie |first=William J. |date=16 August 2001 |title=A lifetime of trillionths of a second: Scientists explore antimatter |website=Harvard University Gazette |url=http://news.harvard.edu/gazette/2001/08.16/antimatter.html|archive-url=https://web.archive.org/web/20060903172020/http://www.news.harvard.edu/gazette/2001/08.16/antimatter.html |archive-date=3 September 2006 |url-status=live |accessdate=2008-01-14 }}</ref> |
|||
<ref name=nature419_6906_439>{{cite journal |last=Hijmans|first=Tom W. |title=Particle physics: Cold antihydrogen |journal=[[:en:Nature (journal)|Nature]] |year=2002|volume=419 |pages=439–440|doi=10.1038/419439a |
|||
|pmid=12368837 |issue=6906 |bibcode = 2002Natur.419..439H |doi-access=free}}</ref> |
|||
<ref name=BBC20021030>{{cite news|author=Staff|date=30 October 2002|title=Researchers 'look inside' antimatter|work=BBC News|url=http://news.bbc.co.uk/2/hi/science/nature/2375717.stm|archive-url=https://web.archive.org/web/20070222204339/http://news.bbc.co.uk/2/hi/science/nature/2375717.stm|archive-date=22 February 2007|url-status=live}}</ref> |
|||
<ref name=ns1728_77>{{cite journal|last=Barrett |first=Roger |title=The Strange World of the Exotic Atom |journal=New Scientist |year=1990 |issue=1728 |pages=77–115 |url=http://media.newscientist.com/article/mg12717284.600-the-strange-world-of-the-exotic-atom-physicists-can-nowmake-atoms-and-molecules-containing-negative-particles-other-than-electronsand-use-them-not-just-to-test-theories-but-also-to-fight-cancer-.html|archive-url=https://web.archive.org/web/20071221164440/http://media.newscientist.com/article/mg12717284.600-the-strange-world-of-the-exotic-atom-physicists-can-nowmake-atoms-and-molecules-containing-negative-particles-other-than-electronsand-use-them-not-just-to-test-theories-but-also-to-fight-cancer-.html |archive-date=21 December 2007 |url-status=dead }}</ref> |
|||
<ref name=psT112_1_20>{{cite journal|last=Indelicato|first=Paul|title=Exotic Atoms|journal=[[:en:Physica Scripta|Physica Scripta]]|year=2004|volume=T112|issue=1|pages=20–26|doi=10.1238/Physica.Topical.112a00020|arxiv=physics/0409058|bibcode=2004PhST..112...20I|s2cid=11134265|url=https://hal.archives-ouvertes.fr/hal-00002825|archive-url=https://web.archive.org/web/20181104170051/https://hal.archives-ouvertes.fr/hal-00002825|archive-date=4 November 2018|url-status=live}}</ref> |
|||
<ref name=ripin1998>{{cite web |last=Ripin|first=Barrett H.|date=July 1998 |url=http://www.aps.org/publications/apsnews/199807/experiment.cfm.html |archive-url=https://archive.today/2012.07.23-135110/http://www.aps.org/publications/apsnews/199807/experiment.cfm.html |url-status=dead |archive-date=23 July 2012 |title=Recent Experiments on Exotic Atoms |publisher=American Physical Society |accessdate=2008-02-15 }}</ref> |
|||
}} |
|||
== 参考書目 == |
|||
* デヴィッド・リンドリー『ボルツマンの原子 理論物理学の夜明け』、[[松浦俊輔]] 訳、[[青土社]]、2003年 |
* デヴィッド・リンドリー『ボルツマンの原子 理論物理学の夜明け』、[[松浦俊輔]] 訳、[[青土社]]、2003年 |
||
* {{cite book |
|||
|author=Oliver Manuel |year=2001 |
|||
|title=Origin of Elements in the Solar System: Implications of Post-1957 Observations |
|||
|publisher=Springer|isbn=978-0-306-46562-8 |
|||
|oclc=228374906 |ref=refManuel2001}} |
|||
* {{cite book |author=Andrew G. van Melsen |translator=Henry J. Koren |year=2004 |orig-year=1952 |title=From Atomos to Atom: The History of the Concept Atom |publisher=Dover Publications |isbn=0-486-49584-1 |ref=refMelsen1952}} |
|||
* {{cite book |author=J.P. Millington |year=1906 |title=John Dalton |publisher=J. M. Dent & Co. (London); E. P. Dutton & Co. (New York) |url=https://archive.org/details/in.ernet.dli.2015.30924/ |ref=refMillington1906}} |
|||
* {{cite book|author1=Charles H. Holbrow |author2=James N. Lloyd |author3=Joseph C. Amato |author4=Enrique Galvez |author5=M. Elizabeth Parks |year=2010 |title=Modern Introductory Physics |publisher=Springer Science & Business Media |isbn=978-0-387-79079-4 |ref=refHolbrowEtAl2010}} |
|||
* {{cite book |
|||
|author=John Dalton |
|||
|year=1808 |
|||
|title=A New System of Chemical Philosophy vol. 1 |
|||
|url=https://library.si.edu/digital-library/book/newsystemofchemi12dalt |
|||
|ref=refDalton1808}} |
|||
* {{cite book |
|||
|author=John Dalton |
|||
|year=1817 |
|||
|title=A New System of Chemical Philosophy vol. 2 |
|||
|url=https://library.si.edu/digital-library/book/newsystemofchemi21dalt |
|||
|ref=refDalton1817}} |
|||
* {{cite book |
|||
|author=John L. Heilbron |
|||
|year=2003 |
|||
|title=Ernest Rutherford and the Explosion of Atoms |
|||
|publisher=[[:en:Oxford University Press|Oxford University Press]] |
|||
|isbn=0-19-512378-6 |
|||
|ref=refHeilbron2003 |
|||
}} |
|||
* {{cite book |
|||
|author=Jaume Navarro |
|||
|year=2012 |
|||
|title=A History of the Electron: J. J. and G. P. Thomson |
|||
|publisher=Cambridge University Press |
|||
|isbn=978-1-107-00522-8 |
|||
|ref=refNavarro2012 |
|||
}} |
|||
* {{cite book|author=Bernard Pullman |translator=Axel Reisinger |year=1998 |title=The Atom in the History of Human Thought |publisher=Oxford University Press |isbn=0-19-511447-7 |ref=refPullman1998}} |
|||
* {{cite book |
|||
|author=Jean Perrin |
|||
|year=1910 |
|||
|orig-year=1909 |
|||
|title=Brownian Movement and Molecular Reality |
|||
|translator=F. Soddy |
|||
|publisher=Taylor and Francis |
|||
|url=https://archive.org/details/brownianmovement00perr |
|||
|ref=refPerrin1909 |
|||
}} |
|||
== |
== 推薦文献 == |
||
{{ |
{{refbegin}} |
||
* {{cite book |
|||
* [[原子論]] |
|||
|last=Gangopadhyaya|first=Mrinalkanti |
|||
* [[原子模型]] |
|||
|title=Indian Atomism: History and Sources |
|||
* [[原子軌道]] |
|||
|publisher=Humanities Press|year=1981 |
|||
* [[原子核]] |
|||
|location=Atlantic Highlands, New Jersey |
|||
* [[素粒子]] |
|||
|isbn=978-0-391-02177-8 |
|||
* [[エキゾチック原子]] |
|||
|oclc=10916778}} |
|||
* [[量子力学]] |
|||
* {{cite book |
|||
* [[陽子]] - [[中性子]] - [[電子]] |
|||
|last=Iannone|first=A. Pablo|year=2001 |
|||
* [[同素体]] |
|||
|title=Dictionary of World Philosophy |
|||
* [[同位体]] |
|||
|publisher=Routledge|isbn=978-0-415-17995-9 |
|||
* [[同重体]] |
|||
|oclc=44541769}} |
|||
* [[同余体]] |
|||
* {{cite book |
|||
* [[原子エネルギー]] |
|||
|last=King|first=Richard|year=1999 |
|||
|title=Indian philosophy: an introduction to Hindu and Buddhist thought |
|||
|publisher=Edinburgh University Press |
|||
|isbn=978-0-7486-0954-3}} |
|||
* {{cite book |
|||
|last=McEvilley|first=Thomas |
|||
|title=The shape of ancient thought: comparative studies in Greek and Indian philosophies |
|||
|publisher=Allworth Press|year=2002 |
|||
|isbn=978-1-58115-203-6}} |
|||
* {{cite book |
|||
|last=Siegfried|first=Robert|year=2002 |
|||
|title=From Elements to Atoms: A History of Chemical Composition |
|||
|publisher=Diane|isbn=978-0-87169-924-4 |
|||
|oclc=186607849}} |
|||
* {{cite book|last=Teresi|first=Dick|publisher=Simon & Schuster|title=Lost Discoveries: The Ancient Roots of Modern Science|year=2003|isbn=978-0-7432-4379-7|url=https://books.google.com/books?id=pheL_ubbXD0C|pages=213–214|access-date=25 October 2020|archive-date=4 August 2020|archive-url=https://web.archive.org/web/20200804145606/https://books.google.com/books?id=pheL_ubbXD0C|url-status=live}} |
|||
* {{cite book |
|||
|last=Wurtz|first=Charles Adolphe|year=1881 |
|||
|title=The Atomic Theory |
|||
|publisher=D. Appleton and company |
|||
|location=New York |
|||
|isbn=978-0-559-43636-9}} |
|||
{{refend}} |
|||
== 外部リンク == |
== 外部リンク == |
||
* {{Kotobank}} |
* {{Kotobank}} |
||
{{SisterlinksN}} |
|||
{{粒子の一覧}} |
{{Portal bar|物理学|化学}}{{粒子の一覧}} |
||
{{物質構造}} |
{{物質構造}} |
||
{{化学}} |
|||
<!-- {{biological organisation}} --> |
|||
{{Normdaten}} |
{{Normdaten}} |
||
{{DEFAULTSORT:けんし}} |
{{DEFAULTSORT:けんし}} |
||
[[Category:原子|*]] |
[[Category:原子|*]] |
||
2023年11月18日 (土) 14:06時点における版
| 原子 | |
|---|---|
 | |
| 分類 | 化学元素の最小単位 |
| 組成 | 陽子と中性子からなる原子核および電子 |
| 相互作用 |
弱い相互作用 強い相互作用 電磁相互作用 重力相互作用 |
| 反粒子 | 反原子 |
| 理論化 | ジョン・ドルトン(19世紀) |
| 質量 | 1.67×10−27 - 4.52×10−25 kg |
| 電荷 | ゼロ(中性)またはイオン電荷 |
| 荷電半径 | 31 pm (He) - 298 pm (Cs) (原子半径) |
原子(げんし、英: atom)は化学的手段では分割できない元素の最小単位であり、陽子と中性子からなる原子核と、それを取り囲む電磁気的に束縛された電子の雲から構成される[1]。原子は化学元素の基本粒子であり、化学元素は原子に含まれる陽子の数によって区別される。たとえば、11個の陽子を含む原子はナトリウムであり、29個の陽子を含む原子は銅である。中性子の数によって元素の同位体が定義される。
原子は非常に小さく、直径は通常100ピコメートル(pm)程度である。人間の毛髪の幅は、約100万個の炭素原子を並べた距離に相当する。これは可視光の最短波長よりも小さいため、従来の顕微鏡では原子を見ることはできない。原子は非常に小さく、量子効果による作用を受けるため、古典物理学では原子の挙動を正確に予測することは不可能である。
原子の質量の99.94%以上は原子核にある。原子核の陽子は正の電荷を、電子は負の電荷を持つが、中性子はあっても電荷を持たない。陽子と電子の数が通常のように等しい場合、原子は電気的に中性である。陽子より電子が多い原子は全体として負の電荷を持ち、陰イオン(または負イオン、アニオン)と呼ばれる。逆に、電子より陽子が多い原子は全体として正の電荷を持ち、陽イオン(または正イオン、カチオン)と呼ばれる。
原子を構成する電子は電磁気力によって原子核内の陽子に引き寄せられる。原子核内の陽子と中性子は核力によって互いに引き合っている。この核力は通常、正電荷を帯びた陽子どうしが反発する電磁気力よりも強い。しかし特定の状況下では、反発する電磁気力が核力よりも強くなる。この場合、原子核は分裂して、さまざまな元素が残る。これは原子核崩壊の一形態である。
原子は化学結合によって1つまたは複数の他の原子と結合し、分子や結晶などの化合物を形成することができる。自然界で観察されるほとんどの物理的変化は、原子が互いに結合したり分離する能力が引き起こしている。化学は、こうした変化を研究する学問である。
原子論の歴史
哲学において
物質が不可分の小さな粒子からできているという基本的な考え方は、多くの古代文化に登場する古い考え方である。アトム(atom)という言葉は、古代ギリシア語で「切断できない」という意味のアトモス(atomos)に由来する[注釈 1]。この古代の考えは、科学的な推論というよりも、むしろ哲学的な推論に基づいていた。現代の原子論は、こうした古い概念に基づいているわけではない[2][3]。19世紀初頭、科学者ジョン・ドルトンは、化学元素が重量の離散的な単位で結合しているように見えることに気づき、これを物質の基本単位な単位と考え、その単位を指す言葉として「原子」という言葉を使うことにした[4]。約1世紀後、ドルトンの原子は、実際には分割不可能ではないことが発見されたが、この言葉が定着した。
ドルトンの倍数比例の法則

1800年代初頭、イギリスの化学者ジョン・ドルトンは、自身や他の科学者が集めた実験データをまとめ、現在「倍数比例の法則」として知られる法則を発見した。彼は、ある化学元素を含む化合物について、化合物中の元素の含有量を重量で表現したとき、小さな整数の比率で異なることに気づいた。この法則から、各化学元素が重量の基本単位によって他の元素と結合していることが示唆され、ドルトンはこれらの単位を「原子」と呼ぶことにした。
たとえば、酸化スズには2種類あり、一方はスズ88.1%と酸素11.9%の灰色の粉末で、もう一方はスズ78.7%と酸素21.3%の白い粉末である。これらの数値を整理すると、灰色粉末にはスズ100 gに対して約13.5 gの酸素が、白色粉末にはスズ100 gに対して約27gの酸素が含まれる。13.5と27の比率は 1:2 である。ドルトンは、これらの酸化物には、スズ原子1個につき1個または2個の酸素原子が存在すると結論づけた(SnO と SnO2)[5][6]。
ドルトンは酸化鉄も分析した。酸化鉄には、鉄78.1%と酸素21.9%の黒色粉末と、鉄70.4%と酸素29.6%の赤色粉末がある。この数値を整理すると、黒色粉末には鉄100 gに対して約28 gの酸素が、赤色粉末には鉄100 gに対して約42 gの酸素が含まれる。28と42の比率は 2:3 である。ドルトンは、これらの酸化物には、鉄原子2個につき2個または3個の酸素原子が存在すると結論づけた(Fe2O2 と Fe2O3)[注釈 2][7][8]。
最後の例として、亜酸化窒素は窒素63.3%と酸素36.7%、一酸化窒素は窒素44.05%と酸素55.95%、そして二酸化窒素は窒素29.5%と酸素70.5%である。これらの数値を整理すると、亜酸化窒素では窒素140 gに対して酸素が80 g、一酸化窒素では窒素140 gに対して酸素が約160 g、二酸化窒素では窒素140 gに対して酸素が320 g含まれる。80、160、320の比率は 1:2:4 である。これらの酸化物のそれぞれの化学式は、N2O、NO、そして NO2 である[9][10]。
異性
科学者たちは、物質の中には、全く同じ化学含有量でありながら異なる性質を持つものがあることを発見した。たとえば、1827年、フリードリヒ・ヴェーラーは、雷酸銀とシアン酸銀がともに銀107部、炭素12部、窒素14部、酸素12部であることを発見した(現在では、両者の化学式はともにAgCNOであることがわかっている)。1830年、イェンス・ヤコブ・ベルセリウスは、この現象を説明するために異性(isomerism)という言葉を導入した。1860年、ルイ・パスツールは、異性体の分子は組成は同じだが、原子の配置が異なるのではないかという仮説を立てた[11]。
1874年、ヤコブス・ヘンリクス・ファント・ホッフは、炭素原子が四面体配置で他の原子と結合することを提案した。彼は、これに基づいて有機分子の構造を説明し、化合物がいくつの異性体を持ち得るかを予測することができた。ペンタン(C5H12)を例に考えてみよう。ファント・ホッフの分子モデリング法によると、ペンタンには3つの配置が可能であると予測でき、科学者たちは実際に3つのペンタンの異性体を発見した[12][13]。
ブラウン運動
1827年、イギリスの植物学者ロバート・ブラウンは、水中に浮遊する花粉粒から流出した微粒子が、明確な理由もなく絶えず揺れ動くことを観察した。1905年、アルベルト・アインシュタインは、このブラウン運動は水の分子が微粒子に絶え間なく衝突することによって引き起こされると理論化し、それを記述する数学モデルを開発した[14]。このモデルは1908年、フランスの物理学者ジャン・ペランによって実験的に検証され、彼はアインシュタインの方程式を使用して、1モルに含まれる原子の数と原子の大きさを計算した[15][16]。
電子の発見
1897年、J.J.トムソンは、電場や磁場によって陰極線が偏向されることから、陰極線は電磁波ではなく粒子であることを発見した。彼は、この粒子が水素(最も軽い原子)の1,800倍軽いことを測定した。トムソンは、これらの粒子は陰極の原子から来たもので、亜原子粒子(subatomic particles)であると結論づけた。彼はこれらの新しい粒子を微粒子(corpuscles)と呼んだが、後に電子(electrons)と改名された。トムソンはまた、電子が光電物質や放射性物質から放出される粒子と同一であることも示した[17]。やがて、電子が金属線に電流を流す粒子であることが認識された[18]。トムソンは、これらの電子が測定器の陰極の原子そのものから発生しており、このことは、原子はドルトンが考えていたような不可分なものではないことを意味していると結論づけた。
原子核の発見

(左) 予測される結果:アルファ粒子はプラム・プディングモデルを通過し、偏向はごくわずかである。
(右) 観測された結果:ごく一部のアルファ粒子が強い偏向を示した。
J. J.トムソンは、負電荷を帯びた電子は、原子の体積全体に分布する正電荷の海の中に分布していると考えた[19]。このモデルはプラム・プディングモデルとして知られている。
アーネスト・ラザフォードと、同僚のハンス・ガイガーとアーネスト・マースデンは、アルファ粒子(ラジウムなど特定の放射性物質から放出される正電荷を帯びた粒子)の電荷質量比を測定する装置を製作する際に困難に出会ったことから、トムソンのモデルに疑問を抱いた。アルファ粒子が検出器内の空気によって散乱され、測定の信頼性が低下していた。トムソンの場合、陰極線の研究で同様の問題に遭遇したが、装置内をほぼ完全な真空にして解決していた。ラザフォードは、アルファ粒子が電子よりはるかに重いため、これと同じ問題に出会うとは考えられなかった。トムソンの原子モデルによれば、原子内の正電荷はアルファ粒子を偏向させるほど強い電場を発生させるだけ集中しておらず、また電子は非常に軽いので、はるかに重いアルファ粒子によって簡単に押しのけられるはずである。しかし散乱はあったので、ラザフォードと同僚たちは、この散乱を注意深く調べることにした[20]。
1908年から1913年にかけて、ラザフォードらは、薄い金属箔にアルファ粒子を衝突させる一連の実験を行った。その結果、彼らは、90度以上の角度で偏向を受けるアルファ粒子を発見した。これを説明するために、ラザフォードは、原子の正電荷は、トムソンが考えていたように原子の体積全体に分布しているのではなく、中心にある小さな原子核に集中していると提案した。観測されたようにアルファ粒子を偏向させるほど十分な強い電場を作り出すことができるのは、このような極端な電荷の集中だけである[20]。このモデルはラザフォード・モデルとして知られている。
同位体の発見
1913年、放射化学者のフレデリック・ソディは、放射性崩壊の生成物について実験していたとき、周期表の各位置に数種類の原子が存在することを発見した[21]。これらの原子は同じ性質を持っていたが、原子量は異なっていた。同位体(isotopes)という言葉は、このように同じ元素に属する重さの異なる原子を表すのに適切な名前として、マーガレット・トッドによって命名された。J.J.トムソンは、電離気体に関する研究を通じて同位体を分離する技術を確立し、その後、安定同位体の発見へとつながった[22]。
ボーア・モデル

1913年、物理学者ニールス・ボーアは、原子の電子は原子核の周りを周回しているが、その軌道は有限であり、光子の吸収または放射に対応するエネルギーの離散的な変化でしか軌道間を移行することができないと仮定した原子モデルを提唱した[23]。この量子化は、電子の軌道が安定である理由や[注釈 3]、元素が吸収または放出する電磁波のスペクトルが不連続である理由を説明するために考案された[24]。
同じ年の暮れ、ヘンリー・モーズリーはニールス・ボーアの理論を支持する新たな実験的証拠を提示した。モーズリーは、これらの結果を基に、アーネスト・ラザフォードやアントニウス・ファン・デン・ブルークのモデルを改良し、原子は原子核に周期表の原子番号と等しい数の正の核電荷を持つと提案した。この実験が行われるまで、原子番号が物理的かつ実験的な量であることは知られていなかった。今日でも受け入れられている原子モデルは、この原子番号と原子の核電荷が等しいというものである[25]。
1916年、ギルバート・ニュートン・ルイスによって、原子間の化学結合は、構成電子間の相互作用により形成されると説明された[26]。元素の化学的性質は、周期律にほぼ従って繰り返されることが知られていたことから[27]、1919年、アメリカの化学者アーヴィング・ラングミュアは、原子内の電子が何らかの方法で結びついているもしくは集まっていれば、この現象を説明できると提案した。原子核を中心に周囲にある電子殻を電子の集団が占めると考えられた[28]。
ボーアの原子モデルは原子の最初で完全な物理モデルであった。これは、原子の全体構造、原子どうしの結合方法、水素のスペクトル線を説明するものである。ボーアのモデルは完全ではなく、より正確なシュレーディンガーモデルにすぐに取って代わられたが、物質が原子で構成されているという疑問を払拭するには十分だった。化学者にとっては、原子という概念は有用な発見的ツールであったが、物理学者にとっては、まだ誰も原子の完全な物理モデルを開発していなかったので、物質が本当に原子からできているのかどうかは疑問であった。
シュレーディンガー・モデル
1925年、ヴェルナー・ハイゼンベルクは、量子力学の最初の一貫した数学的定式化(行列力学)を提唱した[25]。その1年前、ルイ・ド・ブロイが、すべての粒子はある程度波のように振る舞うことを提案していた[29]。1926年、エルヴィン・シュレーディンガーはこの考えを用いて、電子を空間の点ではなく三次元の波形として記述する原子の数学的モデル、シュレーディンガー方程式に発展させた[30]。
波形を用いて粒子を記述することの結果として、ある時点における粒子の位置と運動量の両方を正確に求めることは数学的に不可能となる。このことは、1927年にヴェルナー・ハイゼンベルクが定式化した不確定性原理として知られるようになった[25]。この概念では、位置の測定精度が一定であれば、運動量については可能性のある値の範囲(つまり確率値)しか得られず、逆もまた同様である[31]。このモデルは、水素よりも大きな原子の特定の構造パターンやスペクトルパターンなど、従来のモデルでは説明できなかった原子の挙動に関する観測結果を説明することができた。こうして、原子の惑星型モデルは破棄され、「特定の電子」が最も観測されやすい原子核周辺の原子軌道ゾーンを記述するモデルが採用された[32][33]。
中性子の発見
原子の質量は、質量分析法の開発によって、より正確に測定できるようになった。この装置は磁石を使ってイオンビームの軌道を偏向させるもので、原子の質量と電荷の比によって偏向量が決まる。化学者フランシス・ウィリアム・アストンはこの装置を使用して、同位体の質量が異なることを示した。これらの同位体の原子質量は整数の量だけ異なり、整数則として知られている[34]。これらの異なる同位体の説明は、1932年に物理学者ジェームズ・チャドウィックによる、陽子(proton)とほぼ同じ質量を持つが荷電していない粒子である中性子(neutron)の発見を待たなくてはならなかった。そして同位体は、原子核内の陽子数は同じで、中性子の数が異なる元素として説明された[35]。
核分裂反応、素粒子物理学
1938年、ラザフォードの門下生であったドイツの化学者オットー・ハーンは、超ウラン元素を得る目的でウラン原子に中性子を照射した。その代わりに、彼の化学実験では生成物としてバリウムの存在が示された[36][37]。1年後、リーゼ・マイトナーと甥のオットー・フリッシュが、ハーンの結果が最初の実験的な核分裂反応であることを検証した。1944年、ハーンはノーベル化学賞を受賞した[38][39]。ハーンの努力にもかかわらず、マイトナーとフリッシュの貢献は認められなかった[40]。
1950年代、改良された粒子加速器と粒子検出器の開発により、科学者は高エネルギーで運動する原子の影響を研究できるようになった[41]。中性子と陽子はハドロンまたはクォークと呼ばれる小さな粒子の複合体であることがわかった。素粒子物理学における標準モデルが開発され、これらの素粒子とその相互作用を支配する力の観点から、原子核の性質を説明することに成功している[42]。
構造
亜原子粒子
原子(atom)という言葉はもともと、小さな粒子に切断できない粒子を意味するが、現代の科学的用法では、原子はさまざまな亜原子粒子(英: subatomic particles)から構成される物質の基本的な構成要素を指す。原子を構成する粒子は、電子、陽子、そして中性子である。
電子は負の電荷を持ち、質量が 9.11×10−31 kg で、これらの粒子の中で圧倒的に小さく、そのため利用可能な技術で大きさを測定することができない[43]。ニュートリノの質量が発見されるまで、電子は正の静止質量が測定された最も軽い粒子であった。通常の条件下において、電子は、正電荷を帯びた原子核に、その反対電荷から生じる引力によって束縛される。原子の電子数がその原子番号より大きい(または小さい)場合、原子は全体として負(または正)に帯電し、帯電した原子はイオンと呼ばれる。電子は19世紀後半から知られていたが、J.J.トムソンの貢献が大きかった(素粒子物理学の歴史を参照)。
陽子は正の電荷を持ち、質量は1.6726×10−27 kg、電子の質量の1,836倍である。原子内の陽子の数を原子番号という。アーネスト・ラザフォードは、1917-1919年にかけ、アルファ粒子の衝突を受けた窒素から水素原子核と考えられるものが放出されることを観測した。1920年までに、彼は水素原子核が原子内の別個の粒子であると考え、これを陽子と名付けた。
中性子は電荷を持たず、自由質量は 1.6749×10−27 kgで、電子の質量の1,839倍である[44][45]。中性子は3つの構成粒子の中で最も重いが、その質量は核結合エネルギーによって減る可能性がある。中性子と陽子(総称して核子という)は、どちらも 2.5×10−15 m 程度の大きさを持つが、これらの粒子の「表面」は明確に定義されていない[46]。中性子は1932年にイギリスの物理学者ジェームズ・チャドウィックによって発見された。
物理学の標準モデルでは、電子は内部構造を持たない真の素粒子であり、陽子と中性子はクォークと呼ばれる素粒子から構成される複合粒子である。原子には2種類のクォークがあり、それぞれが分数の電荷を持っている。陽子は、2個のアップクォーク(それぞれの電荷は+2/3)と1個のダウンクォーク(電荷は−1/3)で構成されている。中性子は、1個のアップクォークと2個のダウンクォークで構成されている。この区別で、2種類の粒子の質量と電荷の違いが説明される[47][48]。
クォークは、グルーオンを介した強い相互作用(強い力ともいう)によって結合している。陽子と中性子は、原子核の中で核力によって互いに結びついている。核力は強い力が残留したもので、その範囲や性質は多少異なる(詳しくは核力(英語版)を参照)。グルーオンは、物理的な力を媒介する素粒子であるゲージ粒子の一種である[47][48]。
原子核

原子中で、すべての陽子と中性子は結合して、小さな原子核を構成する。原子核の半径はおよそ フェムトメートル(fm)で、ここに は核子の総数である[49]。原子核の半径は、105 fm オーダーの原子の半径よりはるかに小さい。核子どうしは、強い残留力と呼ばれる短距離型の引力ポテンシャルによって結合している。2.5 fm 未満の距離では、この力は正電荷を帯びた陽子どうしが反発し合う静電気力よりもはるかに強い[50]。
同じ元素の原子は、原子番号と呼ばれる陽子の数が同じである。同じ元素でも、中性子の数が異なることがあり、それによってその元素の同位体が決まる。陽子と中性子の総数が核種を決定する。陽子に対する中性子の数が原子核の安定性を決定し、ある種の同位体は放射性崩壊を起こす[51]。
陽子、中性子、電子はフェルミ粒子(英: fermion、フェルミオン)として分類される。フェルミ粒子はパウリの排他原理に従っており、複数の陽子のような同一のフェルミ粒子が同時に同じ量子状態を占めることを禁止される。したがって、原子核内のすべての陽子は、他のすべての陽子とは異なる量子状態をとらなければならず、原子核内のすべての中性子や、電子雲のすべての電子についても同様である[52]。
陽子の数と中性子の数が異なる原子核は、放射性崩壊によって陽子と中性子の数がより近くなることで、より低いエネルギー状態に変化する可能性がある。その結果、陽子と中性子の数が一致する原子は崩壊に対してより安定するが、原子番号が増えるにつれて、陽子の相互反発にともなう原子核の安定性を維持するために、中性子の割合が増加する[52]。

原子核内の陽子と中性子の数を変えることができるが、それには強い力が働くため、非常に高いエネルギーを必要とする。核融合は、2つの原子核のエネルギー的な衝突などにより、複数の原子粒子が結合してより重い原子核を形成するときに起こる。たとえば、太陽の中心部では、陽子が相互反発(クーロン障壁)を乗り越えて融合し、1つの原子核を形成するために、3-10 keVのエネルギーを必要とする[53]。核分裂はその逆のプロセスで、通常は放射性崩壊によって原子核が2つの小さな原子核に分裂する。また、原子核は、高エネルギーの亜原子粒子や光子との衝突によっても変化することがある。これによって原子核内の陽子の数が変わると、原子は別の化学元素に変化する[54][55]。
核融合反応後の原子核の質量が、個々の粒子の合計質量よりも小さい場合、2つの質量差は、アルベルト・アインシュタインの質量とエネルギー等価性の式、e=mc2(ここで m は質量損失、 c は光速)で説明されるように、利用可能なエネルギーの一種(ガンマ線やベータ粒子の運動エネルギーなど)として放出される。この欠損は新しい原子核の結合エネルギーの一部であり、融合粒子が分離するためにこのエネルギーを必要とする状態で一緒に留まるのは、このエネルギーの回復不可能な損失のためである[56]。
鉄やニッケルよりも原子番号が小さな原子核(核子数の合計が約60以下)を作り出す2個の原子核の核融合は、通常、発熱プロセスであり、2つの原子核を融合させるのに必要なエネルギーよりも多くのエネルギーを放出する[57]。恒星の核融合を自立反応にしているのは、このエネルギー放出プロセスである。より重い原子核では、核子あたりの結合エネルギーは減少し始める(上のグラフを参照)。このことは、原子番号が約26より大きく、質量数が約60より大きな原子核を生成する核融合プロセスは吸熱プロセスであることを意味する。したがって、より質量が大きな原子核は、恒星の静水圧平衡を維持するのに必要なエネルギーを生み出す核融合反応を起こすことができない[52]。
電子雲

原子内の電子は、電磁気力によって原子核内の陽子に引き寄せられる。この力によって電子は、小さな原子核を取り囲む静電ポテンシャル井戸の中に束縛され、電子が脱出するためには外部のエネルギー源が必要となる。電子が原子核に近づくほど、この引力は大きくなる。したがって、ポテンシャル井戸の中心付近に束縛された電子は、それよりも離れた位置にある電子よりも、脱出するのに多くのエネルギーを必要とする。
電子は、他の粒子と同様に、粒子と波の両方の性質を持っている。電子雲は、ポテンシャル井戸の内側にある領域で、各電子が一種の三次元定在波(原子核に対して相対的に動かない波形)を形成している。この挙動は原子軌道によって規定される。原子軌道とは、電子の位置を測定したときに、その電子が特定の位置にあるように見える確率を記述する数学的関数である[58]。原子核の周りには、このような離散的な(または量子化された)軌道の集合だけが存在する(他の考えられる波動パターンは、より安定した形へと急速に減衰するため)[59]。軌道は1つまたは複数のリング構造またはノード構造を持つことができ、大きさ、形状、方向がそれぞれ異なる[60]。

それぞれの原子軌道は、電子の特定のエネルギー準位に対応している。電子は、新しい量子状態に遷移するのに十分なエネルギーの光子を吸収することで、その状態をより高いエネルギー準位に変えることができる。同様に、高いエネルギー準位にある電子は、自然放出によって余剰なエネルギーを光子として放射しながら、低いエネルギー準位に落ちることができる。量子状態のエネルギーの違いによって規定されるこれらの特徴的なエネルギー値が、原子スペクトル線 (en:英語版) が生じる原因である[59]。
原子から電子を除去または追加するのに必要なエネルギー量(電子結合エネルギー (en:英語版) )は、核子の結合エネルギーよりもはるかに小さい。たとえば、水素原子から基底状態の電子を取り除くのに必要なエネルギーはわずか 13.6 eV であるのに対し[61]、重水素の原子核を分裂させるのに必要なエネルギーは 223万eV に達する[62]。陽子と電子が同数であれば、原子は電気的に中性である。電子が不足または過剰な原子はイオンと呼ばれる。原子核から最も遠い電子は、近くにある別の原子に移動したり、原子間で共有されることがある。この機構により、原子が結合して分子を構成したり、イオン結晶やネットワーク共有結合結晶のような他の種類の化合物と結合することができる[63]。
特性
原子核の性質
定義により、原子核内の陽子の数が同じ2つの原子は同じ化学元素に属する。陽子の数が同じで中性子の数が異なる原子は、同じ元素の異なる同位体である。たとえば、すべての水素原子は陽子を1個だけ含んでいるが、中性子を含まない同位体(水素1。圧倒的に一般的な形。プロチウムとも呼ばれる[64])、中性子を1つ含むもの(重水素)、中性子を2つ含むもの(トリチウム)、中性子を2つ以上含むものがある。既知の元素は、1陽子の水素から118陽子のオガネソンまで、一連の原子番号を形成している[65]。原子番号82を超える元素の既知の同位体はすべて放射性であるが、83番元素(ビスマス)の放射性はわずかであり、事実上無視できる[66][67]。
地球上には約339の核種が天然に存在し[68]、そのうち251(約74%)は崩壊は観測されておらず、「安定同位体」と呼ばれる。理論的に安定な核種は90に過ぎず、他の161核種(合計251)は、理論的にはエネルギー的に可能であるにも関わらず、崩壊は観測されていない。これらも正式には「安定」に分類される。さらに35の放射性核種は半減期が1億年以上であり、太陽系の誕生時から存在していた可能性があるほど長寿命である。これらの286核種の集まりは原始核種として知られている。最後に、さらに53の短寿命核種が、原始核種崩壊の娘核種として(例: ウランからのラジウム)、あるいは宇宙線衝突のような地球上の自然エネルギー過程の生成物として(例: 炭素14)、天然に存在することが知られている[69][注釈 4]。
80種類の化学元素には、少なくとも1つの安定同位体が存在する。概して、これらの元素の安定同位体はそれぞれ少数で、1元素あたり平均3.1種類の安定同位体が存在する。26個のモノアイソトピック元素 (en:英語版) は安定同位体が1つしかない。対して、1つの元素で観測された安定同位体の最大数は、スズの10である。43番、61番、そして83番以降のすべての元素には安定同位体がない[70]:1–12。
同位体の安定性は、陽子と中性子の比率に影響を受け、また、量子殻が満たされる(閉殻という)ような中性子と陽子の特定数(魔法数)の存在にも影響を受ける。これらの量子殻は、原子核の殻モデル内の一連のエネルギー準位に対応している。スズの陽子50個で満たされた殻のように、充填殻(じゅうてんかく)はその核種に著しい安定性を与える。既知の251の安定核種のうち、陽子数と中性子数がともに奇数であるものは、水素2(重水素)、リチウム6、ホウ素10、窒素14の4つだけである。(タンタル180mは奇数で、観測的には安定しているが、非常に長い半減期で崩壊すると予測されている。)また、天然に存在する放射性奇-奇核種のうち、半減期が10億年を超えるものは、カリウム40、バナジウム50、ランタン138、ルテチウム176の4つだけである。ほとんどの奇-奇核種はベータ崩壊で非常に不安定であるが、これは、崩壊生成物が偶-偶核種であるため、核子対効果 (en:英語版) によってより強く結合することによる[71]。
質量
原子の質量の大部分は、それを構成する陽子と中性子に由来する。ある原子に含まれるこれらの粒子(核子という)の総数を質量数(mass number)という。質量数は数を表す正整数で、(質量の次元を持つではなく)無次元である。質量数の例として、12個の核子(6個の陽子と6個の中性子)を持つ「炭素12」がある。
静止状態にある原子の実際の質量は、ダルトン(Da)の単位(統一原子質量単位(u)ともいう)で表されることが多い。この単位は、炭素12の自由な中性原子の質量の12分の1と定義され、約1.66×10−27 kgである[72]。水素1(水素の最も軽い同位体であり、最も質量の小さい核種でもある)の原子量は1.007825 Da である[73]。この数を原子質量(atomic mass)という。原子の原子質量は、その質量数と原子質量単位の積にほぼ等しく(1%以内)、たとえば窒素14の質量はおよそ14 Daである。しかし(定義により)炭素12の場合を除いては、この数値は正確な整数にならない[74]。最も重い安定原子は鉛208で[66]、質量は 207.9766521 Da である[75]。
最も重い原子でさえ直接扱うには軽すぎるため、化学者は代わりにモル(mole)という単位を使う。どの元素でも、1モルの原子数は常に同じである(約6.022×1023)。この数は、ある元素の原子質量が 1 u であれば、その元素の原子1モルの質量が1グラムに近くなるように選ばれた。統一原子質量単位の定義から、炭素12原子の原子質量は正確に 12 Da であり、1モルの炭素12原子の質量は正確に 0.012 kg である[72]。
形状と大きさ
原子には明確な外側の境界がないため、その大きさは通常、原子半径で表される。原子半径は、原子核から広がる電子雲までの距離を表す尺度である[76]。これは原子が球形であることを前提としており、真空中や自由空間内の原子のみ当てはまる。原子半径は、2つの原子が化学結合で結合したときの2つの原子核間の距離から導き出される。この半径は、周期表上の原子の位置、化学結合の種類、隣接する原子の数(配位数)、スピンと呼ばれる量子力学的性質によって変化する[77]。周期表上では、原子の大きさは列を上から下に移動するほど大きくなり、行を横切るにつれて(左から右に移動)小さくなる傾向がある[78]。たとえば、最も小さい原子は半径は 31 pm のヘリウムで、最も大きい原子のひとつは半径 298 pm のセシウムである[79]。
電場のような外力を受けると、原子の形状が球対称 (en:英語版) から外れることがある。この変形は、群論的な考察によって示されるように、電場の強さと外殻電子の軌道型に依存する。非球対称性の変形は、たとえば結晶内において、対称性の低い格子部位に大きな結晶電場が発生することで誘発される可能性がある[80][81]。パイライト型化合物中の硫黄イオン[82]やカルコゲンイオンでは[83]、顕著な楕円変形が起こることが示されている。
原子の大きさは光の波長(400-700 nm)より数千倍も小さく、従来の顕微鏡では見ることができないが、走査型トンネル顕微鏡を使えば個々の原子を観察することができる。原子の微細さを視覚化するために、典型的な人間の毛髪の幅は、約100万個の炭素原子を並べた距離に相当することを考えてみよう[84]。一滴の水には約20垓個(2×1021)の酸素原子と、その2倍の水素原子が含まれている[85]。質量 2×10−4 kg の1カラットのダイヤモンドには、約100垓個(1022)の炭素原子が含まれている[注釈 5]。リンゴを地球の大きさに拡大すると、リンゴの中の原子は元のリンゴとほぼ同じ大きさになる[86]。
放射性崩壊

すべての元素には、不安定な原子核を持っていて放射性崩壊を起こし、原子核から粒子や電磁波を放出する同位体が1つ以上存在する。放射性は、原子核の半径が、1 fm オーダーの距離にしか作用しない強い力の範囲よりも大きい場合に生じる[87]。
放射性崩壊の最も一般的な形態は次のとおりである[88][89]。
- アルファ崩壊: この過程は、原子核がアルファ粒子を放出するときに起こる。アルファ粒子は2個の陽子と2個の中性子からなるヘリウム原子核である。放出された結果、原子番号がより小さな新しい元素が生成する。
- ベータ崩壊(および電子捕獲): これらの過程は弱い力によって支配され、中性子から陽子、あるいは陽子から中性子へ変換することによって起こる。中性子から陽子への遷移は電子と反ニュートリノの放出を伴い、陽子から中性子への遷移(電子捕獲を除く)は陽電子とニュートリノの放出を引き起こす。電子または陽電子の放出はベータ粒子と呼ばれる。ベータ崩壊により、原子核の原子番号が1つ増加するか減少する。一方、電子捕獲は陽電子放出よりも多く見られるが、これはベータ崩壊よりも少ないエネルギーですむためである。この形式の崩壊では、原子核から陽電子が放出される代わりに、電子が原子核に吸収される。この過程でもニュートリノが放出され、陽子は中性子に転換する。
- ガンマ崩壊: この過程は、原子核のエネルギー準位がより低い状態に遷移することで起こり、ガンマ線と呼ばれる電磁放射線が放出される。ガンマ線を放射する原子核の励起状態は、通常、アルファ粒子またはベータ粒子の放出に続いて引き起こされる。したがって、ガンマ崩壊は通常、アルファ崩壊またはベータ崩壊の後に起こる。
その他に、稀な種類の放射性崩壊として、原子核から中性子や陽子、原子核クラスターが放出されるものや、複数のベータ粒子が放出されるものがある。励起核が別の方法でエネルギーを失うことを可能にするガンマ線放出の類似型は、内部転換である(ベータ線ではない高速電子を生成し、続いてガンマ線ではない高エネルギー光子を生成する放射性崩壊の形式)。いくつかの大きな原子核は、自発核分裂と呼ばれる崩壊で、さまざまな質量の2つ以上の荷電した分裂片と数個の中性子に分裂する。
それぞれの放射性同位元素には特徴的な崩壊時間、すなわち半減期があり、試料の半分が崩壊するのにかかる時間で決まる。これは指数関数的な減衰過程であり、半減期ごとに残りの同位体の割合が50%ずつ着実に減少してゆく。したがって、半減期が2回経過すると、同位体の25%しか存在しなくなる[87]。
磁気モーメント
素粒子にはスピンと呼ばれる固有の量子力学的性質が内在している。これは、質量中心の周りを回転する物体の角運動量に似ているが、厳密に言えば、これらの粒子は点状であり、回転しているとは言えないと考えられる。スピンは換算プランク定数(ħ)の単位で測定され、電子、陽子、中性子はすべてスピン1⁄2 ħ または スピン1⁄2 を持つ。原子の場合、原子核の周りを周回する電子はスピンに加えて軌道角運動量を持っており、原子核自体は核スピンによる角運動量を持っている[90]。
原子が生成する磁場(磁気モーメント)は、古典的に回転する荷電物体が磁場を生成するのと同様に、これらのさまざまな形の角運動量によって決定されるが、最も支配的な寄与は電子スピンによるものである。電子はパウリの排他原理に従うという性質があるため、2つの電子が同じ量子状態をとることはなく、束縛電子は互いに対となり、それぞれの対の一方がスピンアップ状態、他方はその反対のスピンダウン状態にある。したがって、これらのスピンは互いに打ち消し合い、偶数の電子を持つ原子では全磁気双極子モーメントがゼロになる[91]。
鉄、コバルト、ニッケルなどの強磁性元素では、電子の数が奇数の場合は不対電子が生じ、全体としての正味磁気モーメントが生じる。隣接する原子の軌道が重なり合い、不対電子のスピンが揃うことで、より低いエネルギー状態を生じる。これは交換相互作用として知られる自発過程である。強磁性原子の磁気モーメントが整列すると、その材料は測定可能な巨視的磁場を発生する。常磁性物質は、磁場が存在しないときには原子の磁気モーメントがランダムな方向を向いているが、磁場が存在するときには個々の原子の磁気モーメントが整列する[91][92]。
原子核は、中性子と陽子の数がそれぞれ偶数の場合はスピンを持たないが、それ以外の奇数の場合はスピンを持つ可能性がある。通常、スピンを持つ原子核は、熱平衡 (en:英語版) によりランダムな方向を向いているが、ある種の元素では(キセノン129など)、核スピン状態のかなりの割合を分極させ、同じ方向を向くように整列することが可能である(過分極と呼ばれる状態)。この現象は核磁気共鳴イメージングの分野で応用されている[93][94]。
エネルギー準位

原子内の電子のポテンシャルエネルギーは、原子核からの距離が無限大になるにつれて相対的に負となり、その位置依存性は距離にほぼ反比例し、原子核内部で最小となる。量子力学モデルでは、束縛電子は原子核を中心とした一連の状態のみをとることができ、それぞれの状態は特定のエネルギー準位に対応する(理論的な説明は、時間に依存しないシュレーディンガー方程式を参照)。エネルギー準位は、電子を原子からの束縛を解くのに必要なエネルギー量によって測定することができ、通常は電子ボルト(eV)の単位で表される。束縛電子の最低エネルギー状態を基底状態(すなわち定常状態)と呼び、電子がより高い準位に遷移したときを励起状態という[95]。原子核までの(平均)距離が遠くなることから、電子のエネルギーは主量子数(n)とともに大きくなる。エネルギーの方位量子数()依存性は、原子核の静電ポテンシャルによるものではなく、電子間の相互作用によるものである。
ボーア・モデルによれば、電子が2つの異なる状態間を遷移するためには(たとえば基底状態から第一励起状態へ)、電子はこれらの準位のポテンシャルエネルギーの差(シュレーディンガー方程式によって正確に計算できる)に一致するエネルギーで光子を吸収または放出しなくてはならない。電子は粒子のように軌道から軌道へ飛び越える。たとえば、1個の光子が電子に衝突した場合、光子に反応して状態を変える電子は1個だけである(英語版 Atomic orbital(電子軌道) を参照)。
放出される光子のエネルギーはその周波数に比例するため、特定のエネルギー準位は電磁スペクトルの異なるバンドとして現れる[96]。各元素は、核電荷、電子で満たされた亜殻(部分殻)、電子間の電磁相互作用、そしてその他の要因に依存する特徴的なスペクトルを持っている[97]。

連続スペクトルのエネルギーをガスやプラズマに通過させると、その原子は光子の一部を吸収し、原子内に束縛された電子のエネルギー準位が変化する。引き続いて励起電子は、このエネルギーを光子として自発的に放出してより低いエネルギー準位に戻り、光子はランダムな方向に移動する。こうして原子は、エネルギー出力に一連の暗い吸収帯を形成するフィルターのように作用する。(背景の連続スペクトルを含まない視点から原子を見ている観測者は、代わりに原子から放出された光子からの一連の輝線を見ることになる)。原子スペクトル線の強度と幅を分光学的に測定することで、物質の組成や物理的性質を決定することができる[98]。
スペクトル線を詳しく調べると、微細構造分裂を示すものがあることがわかる。これは、スピン軌道相互作用、すなわち最外殻電子のスピンと運動との相互作用によって起こるものである[99]。原子が外部磁場の中にあるとき、スペクトル線は3つ以上の成分に分裂する(ゼーマン効果と呼ばれる現象)。これは、磁場が原子とその電子の磁気モーメントと相互作用することによって起こる。原子の中には、同じエネルギー準位を持つ複数の電子配置を持つものがあり、それらは単一のスペクトル線として現れる。磁場と原子の相互作用によって、電子配置がわずかに異なるエネルギー準位にシフトし、複数のスペクトル線が生じることもある[100]。また、外部電場が存在するとき、電子のエネルギー準位が変化することにより、スペクトル線に同様の分裂やシフトが表れることがある。これはシュタルク効果と呼ばれる現象である[101]。
束縛電子が励起状態にあるときに、適切なエネルギーを持つ光子が相互作用することで、エネルギー準位が一致する光子が誘導放出されることがある。そのためには、電子が、相互作用する光子のエネルギーと一致するエネルギー差を持った、より低いエネルギー状態に遷移しなくてはならない。その後、放出された光子と相互作用した光子は、位相をそろえながら平行に移動する。言い換えれば、2つの光子の波動パターンは同調する。この物理的特性は、狭い周波数帯域でコヒーレントな光エネルギーを放出できるレーザー発生装置に利用されている[102]。
価数と結合挙動
原子価とは、原子が他の原子と結合する能力の尺度である。原子価は一般的に、他の原子や原子団と形成できる化学結合の数として理解される[103]。非結合状態にある原子の一番外側の電子殻を原子価殻(価電子殻とも)といい、その殻内の電子を価電子と呼ぶ。価電子の数によって、他の原子との結合挙動が決まる。原子は、その外側の原子価殻を満たす(または空にする)ように、互いに化学反応する傾向がある[104]。たとえば、塩化ナトリウム化合物やその他の化学イオン塩で見られるような原子間での1電子の移動は、閉殻よりも1電子多い原子と、閉殻よりも1電子足りない原子との間で形成される結合に対して有効な近似である。多くの元素は複数の原子価を持ち、すなわち化合物によって異なる数の電子を共有する傾向がある。したがって、これらの元素間の化学結合は、単純な電子移動にとどまらず、さまざまな電子共有の形態をとる。たとえば、炭素の同素体や有機化合物などである[105]。
化学元素を周期表で表わすことがよくある。周期表は、元素の化学的性質が繰り返されるように配列された表で、価電子数が同じ元素は表の同じ列にグループを成している。表の水平方向の行は、量子殻電子の充填に対応する。表の右端の元素は、外殻が完全に電子で満たされているため化学的に不活性であり、希ガスとして知られる[106][107]。
状態

たくさんの原子は、温度や圧力などの物理的条件によって異なる物質状態をとる。物質は条件を変えることで、固体、液体、気体、プラズマの間を転移することがある[109]。物質はまた、ある状態のもとで、異なる同素体が存在することもある。たとえば、固体の炭素は、グラファイトやダイヤモンドのような同素体が存在する[110]。二酸素やオゾンのように、気体の同素体も存在する。
絶対零度に近い温度では、原子はボース=アインシュタイン凝縮体を形成する可能性がある。このとき、通常は原子スケールでしか観測されない量子力学的効果が、巨視的スケールで表れる[111][112]。この過冷却状態にある原子の集団が形成する単一の超原子の振る舞いが、量子力学的な挙動の基本的な観察を可能とするかも知れない[113][114]。
識別

原子は小さすぎて目で見ることはできないが、走査型トンネル顕微鏡(STM)のような装置を使用して、固体表面の原子を視覚化することができる。この顕微鏡は量子トンネル現象を利用したもので、それによって、古典的な観点からは乗り越えられないような障壁を粒子が通り抜けることを可能にする。電子は、2つのバイアス電極間の真空を超えて伝播し、 距離に指数関数的に依存するトンネル電流を生成する。一方の電極は、鋭い先端を持つ探針で、理想的には単一原子で終わる。表面の走査の各点で、トンネル電流を設定値に保つように探針の高さを調整する。探針が表面からどれだけ近づいているか、あるいは離れているかを、標高プロファイルとして解釈する。低バイアスの場合、顕微鏡は、密集したエネルギー準位を横切って平均化された電子軌道、つまりフェルミ準位近傍の電子の局所状態密度を画像化する[115][116]。距離が関係するため、個々の原子に対応する周期性を観察するためには、両方の電極が極めて安定していなくてはならない。この方法だけでは化学的な特異性を欠き、表面に存在する原子種を特定することはできない。
原子は質量によって容易に識別することができる。原子から電子を1つ取り除いてイオン化すると、磁場を通過する際に軌道が曲げられる。移動するイオンの軌道が磁場によって曲げられる半径は、原子の質量によって決まる。質量分析法はこの原理を利用して、イオンの質量電荷比を測定する。試料に複数の同位体が含まれる場合、質量分析計で異なるイオンビームの強度を測定することで、試料中の各同位体の割合を決定することができる。原子気化法には、誘導結合プラズマ発光分析法と誘導結合プラズマ質量分析法があり、どちらもプラズマを使って試料を気化させて分析する[117]。
アトムプローブ・トモグラフィー(atom-probe tomograph、アトムプローブ断層撮影法)は、3次元でサブナノメートルの分解能を持ち、飛行時間型質量分析法を使用して個々の原子を化学的に同定することができる[118]。
内殻電子の結合エネルギーを測定するX線光電子分光法(XPS)やオージェ電子分光法(AES)などの電子放出技術は、試料中に存在する原子種を非破壊的に同定するために使用される。適切な集束をすることで、どちらも特定領域の分析が可能である。もう一つの方法、電子エネルギー損失分光法(EELS)は、透過型電子顕微鏡(TEM)内で電子ビームが試料の一部と相互作用したときのエネルギー損失を測定する方法である。
励起状態のスペクトルは、遠方の恒星の原子組成を分析することにも使われている。恒星からの観測光に含まれる特定の光の波長を分離し、自由気体原子における量子化された遷移と対応付けることができる。これらの色は、同じ元素を含むガス放電ランプを使って再現することができる[119]。こうしてヘリウムは、地球で発見される23年前に太陽スペクトルから発見された[120]。
起源と現状
バリオン物質(バリオンで構成されたあらゆる種類の原子)は、観測可能な宇宙の全エネルギー密度の約4%を占め、その平均密度は約0.25個/m3(主に陽子と電子)である[121]。天の川のような銀河系内では、粒子の濃度ははるかに高く、星間物質(ISM)の物質密度は105-109 原子/m3 である[122]。太陽は局所泡(ローカル・バブル)の中にあると考えられているため、太陽近傍における密度はわずか約103原子/m3 である[123]。恒星はISM内の高密度の雲から形成され、恒星の進化の過程でISMは水素やヘリウムよりも重い元素で着実に濃縮される。
天の川銀河に存在するバリオン物質の最大95%は恒星の内部に集中しており、すなわち原子物質にとって不利な条件下にある。銀河系の質量の約10%はバリオン物質の総質量であり[124]、残りは未知の暗黒物質の質量である[125]。恒星内部の高温は、ほとんどの「原子」を完全に電離させる、つまり原子核から「すべての電子」を分離させる。白色矮星、中性子星、ブラックホールなど、恒星の残骸(総称してコンパクト星という)では、その表面層を除き、巨大な圧力が電子殻の形成を不可能にしている。
形成

電子はビッグバンの初期から宇宙に存在していたと考えられている。原子核は原子核合成と呼ばれる反応で形成される。ビッグバン原子核合成の理論によると、ビッグバンの約3分後から、宇宙に存在するヘリウム、リチウム、重水素の大部分と、おそらくベリリウムとホウ素の一部が形成されたという[126][127][128]。
原子の偏在性と安定性は、その結合エネルギーに依存する。すなわち、原子のエネルギーは、原子核と電子の非結合系よりもエネルギーが低いことを意味する。温度がイオン化ポテンシャルよりはるかに高い場合、物質はプラズマの形で存在する。プラズマは、正電荷を帯びたイオン(場合によっては裸の原子核)と電子からなる気体である。温度がイオン化ポテンシャルより下がると、原子は統計的に有利な状態になる。ビッグバンから38万年後(再結合と呼ばれる時期)、膨張する宇宙が十分に冷えて電子が原子核に束縛されるようになり、原子(束縛電子を持つ)が荷電粒子よりも優位に立つようになった[129]。
ビッグバンでは炭素やそれより重い元素は生成されなかったが、それ以降、恒星内部での核融合プロセスを経て原子核どうしが結合し、さらなるヘリウム元素や、(トリプルアルファ反応を経て)炭素から鉄に至る一連の元素を生成した[130]。詳細は恒星内元素合成を参照されたい。
リチウム6や、ベリリウム、ホウ素などの一部の同位体は、宇宙線による核破砕によって宇宙空間で生成された[131]。これは、高エネルギーの陽子が原子核に衝突し、大量の核子が放出されることで起こる。
鉄より重い元素は、超新星や合体中性子星では r過程 によって、またAGB星では s過程 によって生成し、いずれも原子核による中性子捕獲を伴う[132]。鉛などの元素は、主により重い元素の放射性崩壊によって形成された[133]。
地球
地球とその生息生物を構成する原子のほとんどは、太陽系を形成するために分子雲から崩壊した星雲の中に、現在の形で存在していた。残りの原子は放射性崩壊の結果として生成した。それらの相対的な割合は、放射年代測定によって地球の年齢を決定するために使用することができる[134][135]。地球の地殻に含まれるヘリウムの大部分(ガス井から採取されるヘリウムの約99%)は、アルファ崩壊の産物であり、それはヘリウム3の存在量が低いことからも示される[136]。
地球上には、最初には存在せず(つまり「原始」でない)、放射性崩壊の産物でもないような、微量原子がいくつか存在する。炭素14は、宇宙線によって大気中で絶え間なく生成される[137]。地球上の原子の中には、実験環境で意図的に、あるいは原子炉や核爆発の副産物として人工的に生成されたものもある[138][139]。超ウラン元素(原子番号92を超える元素)のうち、地球上に天然に存在するのはネプツニウムとプルトニウムのみである[140][141]。超ウラン元素の放射性寿命は現在の地球年齢よりも短いため[142]、宇宙塵によって堆積した可能性のある微量のプルトニウム244を除いて、これらの元素の特定可能な量はずっと前に崩壊している[134]。ネプツニウムとプルトニウムの天然鉱床は、ウラン鉱石中で中性子捕獲によって生成される[143]。
地球には約1.33×1050 個の原子が存在する[144]。大気中には、アルゴン、ネオン、ヘリウムのような希ガスとよばれる独立原子が少数存在するが、大気の99%は二酸化炭素、二原子酸素、窒素などの分子の形に結合した原子が占める。地球の表面では、圧倒的多数の原子が結合して、水、塩、ケイ酸塩、酸化物などのさまざまな化合物を形成している。原子が結合して、結晶や金属のように個別の分子で構成されていない物質を作り出すこともできる[145][146]。こうした原子物質はネットワーク状の配列を形成しているが、分子物質に見られるような小規模で断続性の秩序を持たない[147]。
希少元素と理論的形態
超重元素
原子番号が82(鉛)よりも大きな核種はすべて放射性であることが知られている。原子番号92(ウラン)を超える核種は、原始核種としては地球上に存在しない。一般に重い元素ほど半減期は短い傾向があるが、原子番号110から114の超重元素の比較的長寿命の同位体を含む「安定の島」[148]の存在が考えられている[149]。この島で最も安定な核種の半減期は数分から数百万年と予測されている[150]。いずれにせよ、この安定化効果がなければ、クーロン反発力の増加により(その結果、半減期がますます短くなって自発核分裂が起こる)、超重元素(Z > 104)は存在しなくなる[151]。
異種物質
物質の各粒子には、反対の電荷を持つ対応する反物質粒子がある。たとえば、陽電子は正電荷を帯びた反電子の同等物であり、反陽子は負電荷を帯びた陽子の同等物である。物質粒子と対応する反物質粒子が出会うと、互いに消滅する。このため、物質粒子と反物質粒子の数は不均衡になり、反物質粒子は宇宙では希少なものとなる。この不均衡の最初の原因はまだ完全には解明されていないが、バリオン数生成の理論で説明が試みられている。結果的には、自然界で反物質原子は発見されていない[152][153]。1996年、ジュネーブの欧州原子核研究機構(CERN)で水素原子の反物質原子(反水素)が合成された[154][155]。
陽子、中性子、電子のいずれか1つを同じ電荷を持つ他の粒子と置き換えることで、別の異種原子が作られてきた。たとえば、電子をより質量の大きいミューオンと置き換えて、ミューオン原子を形成することができる。この種の原子は、物理学の基本的な予測を検証するために使うことができる[156][157][158]。
関連項目
- 量子力学の歴史 - 現代物理学の根幹をなす量子力学が生まれた歴史的なできごと (en:英語版が優れる)
- 無限回分解可能 - 哲学、物理学、経済学、秩序理論、確率論など、さまざまな分野で語られる話題
- 化学の概要 - 化学の概要およびトピックガイド
- 運動 (物理学) - 物体が時間に対してその位置を変化させること
- 原子・亜原子物理学の年表
- 原子核 - 原子の中心にある陽子と中性子からなる小さく密な領域
- 放射性同位体 - 過剰な核エネルギーを持ち、不安定な核種
注釈
- ^ 否定語「a-」と「切断」を意味する「τομή」の組み合わせ。
- ^ 説明をわかりやすくするため、酸化鉄(II)の式を、従来のFeOではなく「Fe2O2」と表記した。
- ^ 通常、円運動する電荷は、加速時に電磁波を放出することで運動エネルギーを失う (シンクロトロン放射を参照)
- ^ 最近の更新情報については、ブルックヘブン国立研究所の Interactive Chart of Nuclides Archived 25 July 2020 at the Wayback Machine. を参照。
- ^ 1カラットは200 mg。定義によれば、炭素12は1 molあたり 0.012 kg である。アボガドロ定数は1 mol当たり6×1023個の原子を含むと定義される。
脚注
- ^ “Atom | Glossary | Basic References | NRC Library”. NRC.gov. 米国原子力規制委員会. 2023年10月22日閲覧。 “Atom - The smallest particle of an element that cannot be divided or broken up by chemical means. It consists of a central core (or nucleus), containing protons and neutrons, with electrons revolving in orbits in the region surrounding the nucleus.”
- ^ Pullman, Bernard (1998). The Atom in the History of Human Thought. Oxford, England: Oxford University Press. pp. 31–33. ISBN 978-0-19-515040-7. オリジナルの5 February 2021時点におけるアーカイブ。 25 October 2020閲覧。
- ^ Melsen (1952). From Atomos to Atom, pp. 18–19
- ^ Pullman (1998). The Atom in the History of Human Thought, p. 198: "Dalton reaffirmed that atoms are indivisible and indestructible and are the ultimate constituents of matter."
- ^ Dalton (1817). A New System of Chemical Philosophy vol. 2, p. 36
- ^ Melsen (1952). From Atomos to Atom, p. 137
- ^ Dalton (1817). A New System of Chemical Philosophy vol. 2, p. 28
- ^ Millington (1906). John Dalton, p. 113
- ^ Dalton (1808). A New System of Chemical Philosophy vol. 1, pp. 316–319
- ^ Holbrow et al. (2010). Modern Introductory Physics, pp. 65–66
- ^ Pullman (1998). The Atom in the History of Human Thought, p. 230
- ^ Melsen (1952). From Atomos to Atom, pp. 147–148
- ^ Henry Enfield Roscoe, Carl Schorlemmer (1895). A Treatise on Chemistry, Volume 3, Part 1, pp. 121–122
- ^ Einstein, A. (1905). “Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen”. Annalen der Physik 322 (8): 549–560. Bibcode: 1905AnP...322..549E. doi:10.1002/andp.19053220806. hdl:10915/2785.
- ^ “The Nobel Prize in Physics 1926” (英語). NobelPrize.org. 2023年2月8日閲覧。
- ^ Perrin (1909). Brownian Movement and Molecular Reality, p. 50
- ^ Thomson, J.J. (August 1901). “On bodies smaller than atoms”. The Popular Science Monthly: 323–335. オリジナルの1 December 2016時点におけるアーカイブ。 21 June 2009閲覧。.
- ^ "The Mechanism Of Conduction In Metals" Archived 25 October 2012 at the Wayback Machine., Think Quest.
- ^ Navarro (2012). A History of the Electron, p. 94
- ^ a b Heilbron (2003). Ernest Rutherford and the Explosion of Atoms, pp. 64–68
- ^ “Frederick Soddy, The Nobel Prize in Chemistry 1921”. ノーベル財団. 9 April 2008時点のオリジナルよりアーカイブ。18 January 2008閲覧。
- ^ Thomson, Joseph John (1913). “Rays of positive electricity”. Proceedings of the Royal Society. A 89 (607): 1–20. Bibcode: 1913RSPSA..89....1T. doi:10.1098/rspa.1913.0057. オリジナルの4 November 2016時点におけるアーカイブ。.
- ^ Stern, David P. (16 May 2005). “The Atomic Nucleus and Bohr's Early Model of the Atom”. NASA/ゴダード宇宙飛行センター. 20 August 2007時点のオリジナルよりアーカイブ。2022年2月17日閲覧。
- ^ Bohr, Niels (11 December 1922). “Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture”. ノーベル財団. 15 April 2008時点のオリジナルよりアーカイブ。2008年2月16日閲覧。
- ^ a b c Pais, Abraham (1986). Inward Bound: Of Matter and Forces in the Physical World. New York: Oxford University Press. pp. 228–230. ISBN 978-0-19-851971-3
- ^ Lewis, Gilbert N. (1916). “The Atom and the Molecule”. Journal of the American Chemical Society 38 (4): 762–786. doi:10.1021/ja02261a002. オリジナルの25 August 2019時点におけるアーカイブ。.
- ^ Scerri, Eric R. (2007). The periodic table: its story and its significance. Oxford University Press US. pp. 205–226. ISBN 978-0-19-530573-9
- ^ Langmuir, Irving (1919). “The Arrangement of Electrons in Atoms and Molecules”. Journal of the American Chemical Society 41 (6): 868–934. doi:10.1021/ja02227a002. オリジナルの21 June 2019時点におけるアーカイブ。.
- ^ McEvoy, J. P.; Zarate, Oscar (2004). Introducing Quantum Theory. Totem Books. pp. 110–114. ISBN 978-1-84046-577-8
- ^ Kozłowski, Miroslaw (2019年). “The Schrödinger equation A History”. 2020年6月16日閲覧。
- ^ Chad Orzel (16 September 2014). “What is the Heisenberg Uncertainty Principle?”. TED-Ed. 13 September 2015時点のオリジナルよりアーカイブ。2015年10月26日閲覧。
- ^ Brown, Kevin (2007年). “The Hydrogen Atom”. MathPages. 5 September 2012時点のオリジナルよりアーカイブ。2008年1月2日閲覧。
- ^ Harrison, David M. (2000年). “The Development of Quantum Mechanics”. トロント大学. 25 December 2007時点のオリジナルよりアーカイブ。2008年1月2日閲覧。
- ^ Aston, Francis W. (1920). “The constitution of atmospheric neon”. Philosophical Magazine 39 (6): 449–455. doi:10.1080/14786440408636058. オリジナルの27 April 2021時点におけるアーカイブ。 25 October 2020閲覧。.
- ^ Chadwick, James (12 December 1935). “Nobel Lecture: The Neutron and Its Properties”. ノーベル財団. 12 October 2007時点のオリジナルよりアーカイブ。2008年1月2日閲覧。
- ^ Bowden, Mary Ellen (1997). “Otto Hahn, Lise Meitner, and Fritz Strassmann”. Chemical achievers : the human face of the chemical sciences. Philadelphia, PA: Chemical Heritage Foundation. pp. 76–80, 125. ISBN 978-0-941901-12-3
- ^ “Otto Hahn, Lise Meitner, and Fritz Strassmann”. Science History Institute (June 2016). 21 March 2018時点のオリジナルよりアーカイブ。2018年3月21日閲覧。
- ^ Meitner, Lise; Frisch, Otto Robert (1939). “Disintegration of uranium by neutrons: a new type of nuclear reaction”. Nature 143 (3615): 239–240. Bibcode: 1939Natur.143..239M. doi:10.1038/143239a0.
- ^ Schroeder, M.. “Lise Meitner – Zur 125. Wiederkehr Ihres Geburtstages” (ドイツ語). 19 July 2011時点のオリジナルよりアーカイブ。4 June 2009閲覧。
- ^ Crawford, E.; Sime, Ruth Lewin; Walker, Mark (1997). “A Nobel tale of postwar injustice”. Physics Today 50 (9): 26–32. Bibcode: 1997PhT....50i..26C. doi:10.1063/1.881933.
- ^ Kullander, Sven (28 August 2001). “Accelerators and Nobel Laureates”. ノーベル財団. 13 April 2008時点のオリジナルよりアーカイブ。2008年1月31日閲覧。
- ^ “The Nobel Prize in Physics 1990”. ノーベル財団 (17 October 1990). 14 May 2008時点のオリジナルよりアーカイブ。2008年1月31日閲覧。
- ^ Demtröder, Wolfgang (2002). Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics (1st ed.). Springer. pp. 39–42. ISBN 978-3-540-20631-6. OCLC 181435713
- ^ Woan, Graham (2000). The Cambridge Handbook of Physics. Cambridge University Press. p. 8. ISBN 978-0-521-57507-2. OCLC 224032426
- ^ Mohr, P.J.; Taylor, B.N. and Newell, D.B. (2014), "The 2014 CODATA Recommended Values of the Fundamental Physical Constants" Archived 11 February 2012 at the Wayback Machine. (Web Version 7.0). The database was developed by J. Baker, M. Douma, and S. Kotochigova. (2014). National Institute of Standards and Technology, Gaithersburg, Maryland 20899.
- ^ MacGregor, Malcolm H. (1992). The Enigmatic Electron. Oxford University Press. pp. 33–37. ISBN 978-0-19-521833-6. OCLC 223372888
- ^ a b Particle Data Group (2002年). “The Particle Adventure”. Lawrence Berkeley Laboratory. 4 January 2007時点のオリジナルよりアーカイブ。2008年1月3日閲覧。
- ^ a b Schombert, James (18 April 2006). “Elementary Particles”. University of Oregon. 30 August 2011時点のオリジナルよりアーカイブ。2008年1月3日閲覧。
- ^ Jevremovic, Tatjana (2005). Nuclear Principles in Engineering. Springer. p. 63. ISBN 978-0-387-23284-3. OCLC 228384008
- ^ Pfeffer, Jeremy I.; Nir, Shlomo (2000). Modern Physics: An Introductory Text. Imperial College Press. pp. 330–336. ISBN 978-1-86094-250-1. OCLC 45900880
- ^ Wenner, Jennifer M. (10 October 2007). “How Does Radioactive Decay Work?”. Carleton College. 11 May 2008時点のオリジナルよりアーカイブ。2008年1月9日閲覧。
- ^ a b c Raymond, David (7 April 2006). “Nuclear Binding Energies”. New Mexico Tech. 1 December 2002時点のオリジナルよりアーカイブ。2008年1月3日閲覧。
- ^ Mihos, Chris (23 July 2002). “Overcoming the Coulomb Barrier”. Case Western Reserve University. 12 September 2006時点のオリジナルよりアーカイブ。2008年2月13日閲覧。
- ^ Staff (30 March 2007). “ABC's of Nuclear Science”. Lawrence Berkeley National Laboratory. 5 December 2006時点のオリジナルよりアーカイブ。2008年1月3日閲覧。
- ^ Makhijani, Arjun (2 March 2001). “Basics of Nuclear Physics and Fission”. Institute for Energy and Environmental Research. 16 January 2007時点のオリジナルよりアーカイブ。2008年1月3日閲覧。
- ^ Shultis, J. Kenneth; Faw, Richard E. (2002). Fundamentals of Nuclear Science and Engineering. CRC Press. pp. 10–17. ISBN 978-0-8247-0834-4. OCLC 123346507
- ^ Fewell, M.P. (1995). “The atomic nuclide with the highest mean binding energy”. American Journal of Physics 63 (7): 653–658. Bibcode: 1995AmJPh..63..653F. doi:10.1119/1.17828.
- ^ Mulliken, Robert S. (1967). “Spectroscopy, Molecular Orbitals, and Chemical Bonding”. Science 157 (3784): 13–24. Bibcode: 1967Sci...157...13M. doi:10.1126/science.157.3784.13. PMID 5338306.
- ^ a b Brucat, Philip J. (2008年). “The Quantum Atom”. University of Florida. 7 December 2006時点のオリジナルよりアーカイブ。2008年1月4日閲覧。
- ^ Manthey, David (2001年). “Atomic Orbitals”. Orbital Central. 10 January 2008時点のオリジナルよりアーカイブ。2008年1月22日閲覧。
- ^ Herter, Terry (2006年). “Lecture 8: The Hydrogen Atom”. Cornell University. 22 February 2012時点のオリジナルよりアーカイブ。2008年2月14日閲覧。
- ^ Bell, R.E.; Elliott, L.G. (1950). “Gamma-Rays from the Reaction H1(n,γ)D2 and the Binding Energy of the Deuteron”. Physical Review 79 (2): 282–285. Bibcode: 1950PhRv...79..282B. doi:10.1103/PhysRev.79.282.
- ^ Smirnov, Boris M. (2003). Physics of Atoms and Ions. Springer. pp. 249–272. ISBN 978-0-387-95550-6
- ^ Matis, Howard S. (9 August 2000). “The Isotopes of Hydrogen”. Guide to the Nuclear Wall Chart. Lawrence Berkeley National Lab. 18 December 2007時点のオリジナルよりアーカイブ。2008年1月2日閲覧。
- ^ Weiss, Rick (17 October 2006). “Scientists Announce Creation of Atomic Element, the Heaviest Yet”. Washington Post. オリジナルの20 August 2011時点におけるアーカイブ。
- ^ a b Sills, Alan D. (2003). Earth Science the Easy Way. Barron's Educational Series. pp. 131–134. ISBN 978-0-7641-2146-3. OCLC 51543743
- ^ Dumé, Belle (23 April 2003). “Bismuth breaks half-life record for alpha decay”. Physics World. オリジナルの14 December 2007時点におけるアーカイブ。
- ^ Lindsay, Don (30 July 2000). “Radioactives Missing From The Earth”. Don Lindsay Archive. 28 April 2007時点のオリジナルよりアーカイブ。2008年5月23日閲覧。
- ^ Tuli, Jagdish K. (April 2005). “Nuclear Wallet Cards”. National Nuclear Data Center, Brookhaven National Laboratory. 3 October 2011時点のオリジナルよりアーカイブ。2010年8月6日閲覧。
- ^ CRC Handbook (2002).
- ^ Krane, K. (1988). Introductory Nuclear Physics. John Wiley & Sons. pp. 68. ISBN 978-0-471-85914-7
- ^ a b Mills, Ian; Cvitaš, Tomislav; Homann, Klaus; Kallay, Nikola; Kuchitsu, Kozo (1993). Quantities, Units and Symbols in Physical Chemistry (2nd ed.). Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications. p. 70. ISBN 978-0-632-03583-0. OCLC 27011505
- ^ Chieh, Chung (22 January 2001). “Nuclide Stability”. University of Waterloo. 30 August 2007時点のオリジナルよりアーカイブ。2008年1月4日閲覧。
- ^ “Atomic Weights and Isotopic Compositions for All Elements”. National Institute of Standards and Technology. 31 December 2006時点のオリジナルよりアーカイブ。4 January 2007閲覧。
- ^ Audi, G.; Wapstra, A.H.; Thibault, C. (2003). “The Ame2003 atomic mass evaluation (II)”. Nuclear Physics A 729 (1): 337–676. Bibcode: 2003NuPhA.729..337A. doi:10.1016/j.nuclphysa.2003.11.003. オリジナルの16 October 2005時点におけるアーカイブ。.
- ^ Ghosh, D.C.; Biswas, R. (2002). “Theoretical calculation of Absolute Radii of Atoms and Ions. Part 1. The Atomic Radii”. Int. J. Mol. Sci. 3 (11): 87–113. doi:10.3390/i3020087.
- ^ Shannon, R.D. (1976). “Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides”. Acta Crystallographica A 32 (5): 751–767. Bibcode: 1976AcCrA..32..751S. doi:10.1107/S0567739476001551. オリジナルの14 August 2020時点におけるアーカイブ。 25 August 2019閲覧。.
- ^ Dong, Judy (1998年). “Diameter of an Atom”. The Physics Factbook. 4 November 2007時点のオリジナルよりアーカイブ。2007年11月19日閲覧。
- ^ Clementi, E.; Raimond, D. L.; Reinhardt, W. P. (1967). “Atomic Screening Constants from SCF Functions. II. Atoms with 37 to 86 Electrons”. Journal of Chemical Physics 47 (4): 1300–1307. Bibcode: 1967JChPh..47.1300C. doi:10.1063/1.1712084.
- ^ Bethe, Hans (1929). “Termaufspaltung in Kristallen”. Annalen der Physik 3 (2): 133–208. Bibcode: 1929AnP...395..133B. doi:10.1002/andp.19293950202.
- ^ Birkholz, Mario (1995). “Crystal-field induced dipoles in heteropolar crystals – I. concept”. Z. Phys. B 96 (3): 325–332. Bibcode: 1995ZPhyB..96..325B. doi:10.1007/BF01313054.
- ^ Birkholz, M.; Rudert, R. (2008). “Interatomic distances in pyrite-structure disulfides – a case for ellipsoidal modeling of sulfur ions”. Physica Status Solidi B 245 (9): 1858–1864. Bibcode: 2008PSSBR.245.1858B. doi:10.1002/pssb.200879532. オリジナルの2 May 2021時点におけるアーカイブ。 2 May 2021閲覧。.
- ^ Birkholz, M. (2014). “Modeling the Shape of Ions in Pyrite-Type Crystals”. Crystals 4 (3): 390–403. doi:10.3390/cryst4030390.
- ^ Staff (2007年). “Small Miracles: Harnessing nanotechnology”. Oregon State University. 21 May 2011時点のオリジナルよりアーカイブ。2008年1月7日閲覧。 – describes the width of a human hair as 105 nm and 10 carbon atoms as spanning 1 nm.
- ^ Padilla, Michael J.; Miaoulis, Ioannis; Cyr, Martha (2002). Prentice Hall Science Explorer: Chemical Building Blocks. Upper Saddle River, New Jersey: Prentice-Hall, Inc.. p. 32. ISBN 978-0-13-054091-1. OCLC 47925884. "There are 2,000,000,000,000,000,000,000 (that's 2 sextillion) atoms of oxygen in one drop of water—and twice as many atoms of hydrogen."
- ^ “The Feynman Lectures on Physics Vol. I Ch. 1: Atoms in Motion”. 30 July 2022時点のオリジナルよりアーカイブ。3 May 2022閲覧。
- ^ a b “Radioactivity”. Splung.com. 4 December 2007時点のオリジナルよりアーカイブ。19 December 2007閲覧。
- ^ L'Annunziata, Michael F. (2003). Handbook of Radioactivity Analysis. Academic Press. pp. 3–56. ISBN 978-0-12-436603-9. OCLC 16212955
- ^ Firestone, Richard B. (22 May 2000). “Radioactive Decay Modes”. Berkeley Laboratory. 29 September 2006時点のオリジナルよりアーカイブ。2010年9月8日閲覧。
- ^ Hornak, J.P. (2006年). “Chapter 3: Spin Physics”. The Basics of NMR. Rochester Institute of Technology. 3 February 2007時点のオリジナルよりアーカイブ。2008年1月7日閲覧。
- ^ a b Schroeder, Paul A. (25 February 2000). “Magnetic Properties”. University of Georgia. 29 April 2007時点のオリジナルよりアーカイブ。2007年12月14日閲覧。
- ^ Goebel, Greg (1 September 2007). “[4.3] Magnetic Properties of the Atom”. Elementary Quantum Physics. In The Public Domain website. 29 June 2011時点のオリジナルよりアーカイブ。2008年1月7日閲覧。
- ^ Yarris, Lynn (Spring 1997). “Talking Pictures”. Berkeley Lab Research Review. オリジナルの13 January 2008時点におけるアーカイブ。.
- ^ Liang, Z.-P.; Haacke, E.M. (1999). Webster, J.G.. ed. Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging. 2. John Wiley & Sons. pp. 412–426. ISBN 978-0-471-13946-1
- ^ Zeghbroeck, Bart J. Van (1998年). “Energy levels”. Shippensburg University. 15 January 2005時点のオリジナルよりアーカイブ。2008年1月2日閲覧。
- ^ Fowles, Grant R. (1989). Introduction to Modern Optics. Courier Dover Publications. pp. 227–233. ISBN 978-0-486-65957-2. OCLC 18834711
- ^ Martin, W.C. (May 2007). “Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas”. National Institute of Standards and Technology. 8 February 2007時点のオリジナルよりアーカイブ。2018年11月15日閲覧。
- ^ “Atomic Emission Spectra – Origin of Spectral Lines”. Avogadro Web Site. 28 February 2006時点のオリジナルよりアーカイブ。10 August 2006閲覧。
- ^ Fitzpatrick, Richard (16 February 2007). “Fine structure”. University of Texas at Austin. 27 September 2011時点のオリジナルよりアーカイブ。2008年2月14日閲覧。
- ^ Weiss, Michael (2001年). “The Zeeman Effect”. University of California-Riverside. 2 February 2008時点のオリジナルよりアーカイブ。2008年1月2日閲覧。
- ^ Beyer, H.F.; Shevelko, V.P. (2003). Introduction to the Physics of Highly Charged Ions. CRC Press. pp. 232–236. ISBN 978-0-7503-0481-8. OCLC 47150433
- ^ Watkins, Thayer. “Coherence in Stimulated Emission”. San José State University. 12 January 2008時点のオリジナルよりアーカイブ。23 December 2007閲覧。
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). オンライン版: (2006-) "valence".
- ^ Reusch, William (16 July 2007). “Virtual Textbook of Organic Chemistry”. Michigan State University. 29 October 2007時点のオリジナルよりアーカイブ。2008年1月11日閲覧。
- ^ “Covalent bonding – Single bonds”. chemguide (2000年). 1 November 2008時点のオリジナルよりアーカイブ。2008年11月20日閲覧。
- ^ Husted, Robert (11 December 2003). “Periodic Table of the Elements”. Los Alamos National Laboratory. 10 January 2008時点のオリジナルよりアーカイブ。2008年1月11日閲覧。
- ^ Baum, Rudy (2003). “It's Elemental: The Periodic Table”. Chemical & Engineering News. オリジナルの6 April 2011時点におけるアーカイブ。.
- ^ Anderson, M. H.; Ensher, J. R.; Matthews, M. R.; Wieman, C. E.; Cornell, E. A. (1995-07-14). “Observation of Bose-Einstein Condensation in a Dilute Atomic Vapor” (英語). Science 269 (5221): 198–201. doi:10.1126/science.269.5221.198. ISSN 0036-8075.
- ^ Goodstein, David L. (2002). States of Matter. Courier Dover Publications. pp. 436–438. ISBN 978-0-13-843557-8
- ^ Brazhkin, Vadim V. (2006). “Metastable phases, phase transformations, and phase diagrams in physics and chemistry”. Physics-Uspekhi 49 (7): 719–724. Bibcode: 2006PhyU...49..719B. doi:10.1070/PU2006v049n07ABEH006013.
- ^ Myers, Richard (2003). The Basics of Chemistry. Greenwood Press. p. 85. ISBN 978-0-313-31664-7. OCLC 50164580
- ^ Staff (9 October 2001). “Bose–Einstein Condensate: A New Form of Matter”. National Institute of Standards and Technology. オリジナルの3 January 2008時点におけるアーカイブ。
- ^ Colton, Imogen (3 February 1999). “Super Atoms from Bose–Einstein Condensation”. The University of Melbourne. 29 August 2007時点のオリジナルよりアーカイブ。2008年2月6日閲覧。
- ^ Georgescu, Iulia (2020-08). “25 years of BEC” (英語). Nature Reviews Physics 2 (8): 396–396. doi:10.1038/s42254-020-0211-7. ISSN 2522-5820.
- ^ Jacox, Marilyn (November 1997). “Scanning Tunneling Microscope”. National Institute of Standards and Technology. 7 January 2008時点のオリジナルよりアーカイブ。2008年1月11日閲覧。
- ^ “The Nobel Prize in Physics 1986”. The Nobel Foundation. 17 September 2008時点のオリジナルよりアーカイブ。11 January 2008閲覧。 In particular, see the Nobel lecture by G. Binnig and H. Rohrer.
- ^ Jakubowski, N.; Moens, Luc; Vanhaecke, Frank (1998). “Sector field mass spectrometers in ICP-MS”. Spectrochimica Acta Part B: Atomic Spectroscopy 53 (13): 1739–1763. Bibcode: 1998AcSpe..53.1739J. doi:10.1016/S0584-8547(98)00222-5.
- ^ Müller, Erwin W.; Panitz, John A.; McLane, S. Brooks (1968). “The Atom-Probe Field Ion Microscope”. Review of Scientific Instruments 39 (1): 83–86. Bibcode: 1968RScI...39...83M. doi:10.1063/1.1683116.
- ^ Lochner, Jim (30 April 2007). “What Do Spectra Tell Us?”. NASA/Goddard Space Flight Center. 16 January 2008時点のオリジナルよりアーカイブ。2008年1月3日閲覧。
- ^ Winter, Mark (2007年). “Helium”. WebElements. 30 December 2007時点のオリジナルよりアーカイブ。2008年1月3日閲覧。
- ^ Hinshaw, Gary (10 February 2006). “What is the Universe Made Of?”. NASA/WMAP. 31 December 2007時点のオリジナルよりアーカイブ。2008年1月7日閲覧。
- ^ Choppin, Gregory R.; Liljenzin, Jan-Olov; Rydberg, Jan (2001). Radiochemistry and Nuclear Chemistry. Elsevier. p. 441. ISBN 978-0-7506-7463-8. OCLC 162592180
- ^ Davidsen, Arthur F. (1993). “Far-Ultraviolet Astronomy on the Astro-1 Space Shuttle Mission”. Science 259 (5093): 327–334. Bibcode: 1993Sci...259..327D. doi:10.1126/science.259.5093.327. PMID 17832344.
- ^ Lequeux, James (2005). The Interstellar Medium. Springer. p. 4. ISBN 978-3-540-21326-0. OCLC 133157789
- ^ Smith, Nigel (6 January 2000). “The search for dark matter”. Physics World. 16 February 2008時点のオリジナルよりアーカイブ。2008年2月14日閲覧。
- ^ Croswell, Ken (1991). “Boron, bumps and the Big Bang: Was matter spread evenly when the Universe began? Perhaps not; the clues lie in the creation of the lighter elements such as boron and beryllium”. New Scientist (1794): 42. オリジナルの7 February 2008時点におけるアーカイブ。.
- ^ Copi, Craig J.; Schramm, DN; Turner, MS (1995). “Big-Bang Nucleosynthesis and the Baryon Density of the Universe”. Science 267 (5195): 192–199. arXiv:astro-ph/9407006. Bibcode: 1995Sci...267..192C. doi:10.1126/science.7809624. PMID 7809624. オリジナルの14 August 2019時点におけるアーカイブ。.
- ^ Hinshaw, Gary (15 December 2005). “Tests of the Big Bang: The Light Elements”. NASA/WMAP. 17 January 2008時点のオリジナルよりアーカイブ。2008年1月13日閲覧。
- ^ Abbott, Brian (30 May 2007). “Microwave (WMAP) All-Sky Survey”. Hayden Planetarium. 13 February 2013時点のオリジナルよりアーカイブ。2008年1月13日閲覧。
- ^ Hoyle, F. (1946). “The synthesis of the elements from hydrogen”. Monthly Notices of the Royal Astronomical Society 106 (5): 343–383. Bibcode: 1946MNRAS.106..343H. doi:10.1093/mnras/106.5.343.
- ^ Knauth, D.C.; Knauth, D.C.; Lambert, David L.; Crane, P. (2000). “Newly synthesized lithium in the interstellar medium”. Nature 405 (6787): 656–658. Bibcode: 2000Natur.405..656K. doi:10.1038/35015028. PMID 10864316.
- ^ Mashnik, Stepan G. (2000). "On Solar System and Cosmic Rays Nucleosynthesis and Spallation Processes". arXiv:astro-ph/0008382。
- ^ Kansas Geological Survey (4 May 2005). “Age of the Earth”. University of Kansas. 5 July 2008時点のオリジナルよりアーカイブ。2008年1月14日閲覧。
- ^ a b Manuel (2001). Origin of Elements in the Solar System, pp. 40–430, 511–519
- ^ Dalrymple, G. Brent (2001). “The age of the Earth in the twentieth century: a problem (mostly) solved”. Geological Society, London, Special Publications 190 (1): 205–221. Bibcode: 2001GSLSP.190..205D. doi:10.1144/GSL.SP.2001.190.01.14. オリジナルの11 November 2007時点におけるアーカイブ。.
- ^ Anderson, Don L. (2 September 2006). “Helium: Fundamental models”. MantlePlumes.org. 8 February 2007時点のオリジナルよりアーカイブ。2008年1月14日閲覧。
- ^ Pennicott, Katie (10 May 2001). “Carbon clock could show the wrong time”. PhysicsWeb. オリジナルの15 December 2007時点におけるアーカイブ。
- ^ Yarris, Lynn (27 July 2001). “New Superheavy Elements 118 and 116 Discovered at Berkeley Lab”. Berkeley Lab. オリジナルの9 January 2008時点におけるアーカイブ。
- ^ Diamond, H (1960). “Heavy Isotope Abundances in Mike Thermonuclear Device”. Physical Review 119 (6): 2000–2004. Bibcode: 1960PhRv..119.2000D. doi:10.1103/PhysRev.119.2000.
- ^ Poston, John W. Sr. (23 March 1998). “Do transuranic elements such as plutonium ever occur naturally?”. Scientific American. オリジナルの27 March 2015時点におけるアーカイブ。.
- ^ Keller, C. (1973). “Natural occurrence of lanthanides, actinides, and superheavy elements”. Chemiker Zeitung 97 (10): 522–530. OSTI 4353086.
- ^ Zaider, Marco; Rossi, Harald H. (2001). Radiation Science for Physicians and Public Health Workers. Springer. p. 17. ISBN 978-0-306-46403-4. OCLC 44110319
- ^ “Oklo Fossil Reactors”. Curtin University of Technology. 18 December 2007時点のオリジナルよりアーカイブ。15 January 2008閲覧。
- ^ Weisenberger, Drew. “How many atoms are there in the world?”. Jefferson Lab. 22 October 2007時点のオリジナルよりアーカイブ。16 January 2008閲覧。
- ^ Pidwirny, Michael. “Fundamentals of Physical Geography”. University of British Columbia Okanagan. 21 January 2008時点のオリジナルよりアーカイブ。16 January 2008閲覧。
- ^ Anderson, Don L. (2002). “The inner inner core of Earth”. Proceedings of the National Academy of Sciences 99 (22): 13966–13968. Bibcode: 2002PNAS...9913966A. doi:10.1073/pnas.232565899. PMC 137819. PMID 12391308.
- ^ Pauling, Linus (1960). The Nature of the Chemical Bond. Cornell University Press. pp. 5–10. ISBN 978-0-8014-0333-0. OCLC 17518275
- ^ Anonymous (2 October 2001). “Second postcard from the island of stability”. CERN Courier. オリジナルの3 February 2008時点におけるアーカイブ。.
- ^ Karpov, A. V.; Zagrebaev, V. I.; Palenzuela, Y. M. et al. (2012). “Decay properties and stability of the heaviest elements”. International Journal of Modern Physics E 21 (2): 1250013-1–1250013-20. Bibcode: 2012IJMPE..2150013K. doi:10.1142/S0218301312500139. オリジナルの3 December 2016時点におけるアーカイブ。 24 March 2020閲覧。.
- ^ “Superheavy Element 114 Confirmed: A Stepping Stone to the Island of Stability”. Berkeley Lab (2009年). 20 July 2019時点のオリジナルよりアーカイブ。24 March 2020閲覧。
- ^ Möller, P. (2016). “The limits of the nuclear chart set by fission and alpha decay”. EPJ Web of Conferences 131: 03002-1–03002-8. Bibcode: 2016EPJWC.13103002M. doi:10.1051/epjconf/201613103002. オリジナルの11 March 2020時点におけるアーカイブ。 24 March 2020閲覧。.
- ^ Koppes, Steve (1 March 1999). “Fermilab Physicists Find New Matter-Antimatter Asymmetry”. University of Chicago. オリジナルの19 July 2008時点におけるアーカイブ。
- ^ Cromie, William J. (16 August 2001). “A lifetime of trillionths of a second: Scientists explore antimatter”. Harvard University Gazette. 3 September 2006時点のオリジナルよりアーカイブ。2008年1月14日閲覧。
- ^ Hijmans, Tom W. (2002). “Particle physics: Cold antihydrogen”. Nature 419 (6906): 439–440. Bibcode: 2002Natur.419..439H. doi:10.1038/419439a. PMID 12368837.
- ^ Staff (30 October 2002). “Researchers 'look inside' antimatter”. BBC News. オリジナルの22 February 2007時点におけるアーカイブ。
- ^ Barrett, Roger (1990). “The Strange World of the Exotic Atom”. New Scientist (1728): 77–115. オリジナルの21 December 2007時点におけるアーカイブ。.
- ^ Indelicato, Paul (2004). “Exotic Atoms”. Physica Scripta T112 (1): 20–26. arXiv:physics/0409058. Bibcode: 2004PhST..112...20I. doi:10.1238/Physica.Topical.112a00020. オリジナルの4 November 2018時点におけるアーカイブ。.
- ^ Ripin, Barrett H. (July 1998). “Recent Experiments on Exotic Atoms”. American Physical Society. 23 July 2012時点のオリジナルよりアーカイブ。2008年2月15日閲覧。
参考書目
- デヴィッド・リンドリー『ボルツマンの原子 理論物理学の夜明け』、松浦俊輔 訳、青土社、2003年
- Oliver Manuel (2001). Origin of Elements in the Solar System: Implications of Post-1957 Observations. Springer. ISBN 978-0-306-46562-8. OCLC 228374906
- Andrew G. van Melsen Henry J. Koren訳 (2004). From Atomos to Atom: The History of the Concept Atom. Dover Publications. ISBN 0-486-49584-1
- J.P. Millington (1906). John Dalton. J. M. Dent & Co. (London); E. P. Dutton & Co. (New York)
- Charles H. Holbrow; James N. Lloyd; Joseph C. Amato; Enrique Galvez; M. Elizabeth Parks (2010). Modern Introductory Physics. Springer Science & Business Media. ISBN 978-0-387-79079-4
- John Dalton (1808). A New System of Chemical Philosophy vol. 1
- John Dalton (1817). A New System of Chemical Philosophy vol. 2
- John L. Heilbron (2003). Ernest Rutherford and the Explosion of Atoms. Oxford University Press. ISBN 0-19-512378-6
- Jaume Navarro (2012). A History of the Electron: J. J. and G. P. Thomson. Cambridge University Press. ISBN 978-1-107-00522-8
- Bernard Pullman Axel Reisinger訳 (1998). The Atom in the History of Human Thought. Oxford University Press. ISBN 0-19-511447-7
- Jean Perrin F. Soddy訳 (1910). Brownian Movement and Molecular Reality. Taylor and Francis
推薦文献
- Gangopadhyaya, Mrinalkanti (1981). Indian Atomism: History and Sources. Atlantic Highlands, New Jersey: Humanities Press. ISBN 978-0-391-02177-8. OCLC 10916778
- Iannone, A. Pablo (2001). Dictionary of World Philosophy. Routledge. ISBN 978-0-415-17995-9. OCLC 44541769
- King, Richard (1999). Indian philosophy: an introduction to Hindu and Buddhist thought. Edinburgh University Press. ISBN 978-0-7486-0954-3
- McEvilley, Thomas (2002). The shape of ancient thought: comparative studies in Greek and Indian philosophies. Allworth Press. ISBN 978-1-58115-203-6
- Siegfried, Robert (2002). From Elements to Atoms: A History of Chemical Composition. Diane. ISBN 978-0-87169-924-4. OCLC 186607849
- Teresi, Dick (2003). Lost Discoveries: The Ancient Roots of Modern Science. Simon & Schuster. pp. 213–214. ISBN 978-0-7432-4379-7. オリジナルの4 August 2020時点におけるアーカイブ。 25 October 2020閲覧。
- Wurtz, Charles Adolphe (1881). The Atomic Theory. New York: D. Appleton and company. ISBN 978-0-559-43636-9


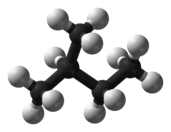

![{\displaystyle 1.07{\sqrt[{3}]{A}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a74a6ca6998768195969eef75ca046e8431c29d3)

