神経ステロイド
神経ステロイド[1](Neurosteroid)は、内因性または外因性のステロイドで、リガンド依存性のイオンチャネルや細胞表面の受容体との相互作用により、神経の興奮性を急速に変化させる事から、神経刺激性ステロイドまたは神経活性ステロイド(Neuroactive steroid)とも呼ばれている[2][3]。神経ステロイドという言葉は、フランスの生理学者であるÉtienne-Émile Baulieuによって作られた造語で、脳内で合成されるステロイドを指す[4][5]。神経刺激性ステロイドとは、脳内で合成されたり、内分泌腺で合成されたりして、血流に乗って脳に到達し、脳機能に影響を与えるステロイドを指す[6]。神経刺激性ステロイドという言葉は、1992年にSteven PaulとRobert Purdyによって初めて作られた。これらのステロイドの中には、神経細胞膜の受容体への作用に加えて、核内ステロイドホルモン受容体を介して遺伝子発現に作用するものもある。神経ステロイドは、鎮静作用からてんかん[7]や外傷性脳損傷の治療に至るまで、幅広い臨床応用が期待されている[8][9]。内因性神経ステロイドであるアロプレグナノロンの合成アナログであるガナキソロンは、てんかんの治療薬として研究されている[10]。
分類
[編集]活性と構造の違いから、神経ステロイドは幾つかのグループに大別される[4]。
抑制性神経ステロイド
[編集]これらの神経ステロイドは、神経伝達を抑制する作用を持つ。GABAA受容体(特にδサブユニットを含むアイソフォーム)の陽性アロステリック調節因子として作用し、抗うつ作用、抗不安作用、ストレス軽減作用、報酬作用[11]、向社会性作用[12]、抗攻撃性作用[13]、性欲増進作用[12]、鎮静作用、睡眠増進作用[14]、認知・記憶抹消作用[要出典]、鎮痛作用[15]、麻酔作用、抗痙攣作用、神経保護作用、神経原性作用[注 1]等の作用がある[4]。
主な例としては、テトラヒドロデオキシコルチコステロン(THDOC)、アンドロスタンの3α-アンドロスタンジオール、コレスタンのコレステロール、プレグナン類のプレグナノロン、アロプレグナノロン(3α,5α-THP)等がある[16][17]。
興奮性神経ステロイド
[編集]これらの神経ステロイドは、神経伝達において興奮作用を有する。GABAA受容体の強力な陰性アロステリック調節因子、NMDA受容体の弱い陽性アロステリック調節因子、および/またはσ1受容体の作動薬として作用し、主に抗うつ作用、不安神経症、認知・記憶増強作用、痙攣作用、神経保護作用、神経原性作用等の作用がある[4]。
主な例としては、プレグナン類の硫酸プレグネノロン(PS)、エピプレグナノロン、イソプレグナノロン、アンドロスタン類のデヒドロエピアンドロステロン(DHEA)、硫酸デヒドロエピアンドロステロン(DHEA-S)、コレスタン類の24(S)-ヒドロキシコレステロール(NMDA受容体選択性、非常に強力)等がある[18]。
フェロモン
[編集]フェロモンは、鋤鼻(じょび)受容体細胞の活性化を介して、脳の活動、特に視床下部の機能に影響を与える神経ステロイドである[19][20][21]。
フェロモンには、アンドロスタン類のアンドロスタジエノール、アンドロスタジエノン、アンドロステノール、アンドロステノンや、エストラン類のエストラテトラエノール等がある。
その他の神経ステロイド
[編集]また、プレグネノロン[22]、プロゲステロン[23][24]、エストラジオール[6]、コルチコステロン等の内因性ステロイドも神経ステロイドの一種である。しかし、これらの神経ステロイドは、上記のものとは異なり、GABAAやNMDA受容体を調節する事はなく、代わりに様々な他の細胞表面受容体や非ゲノム標的に影響を与える。また、プレグネノロン、プロゲステロン、コルチコステロン、デオキシコルチコステロン、DHEA、テストステロンなどの多くの内因性ステロイドは、(他の)神経ステロイドに代謝され、いわゆる神経ステロイド前駆体として効果的に機能する。
生合成
[編集]神経ステロイドの生合成は、コレステロールから始まり、プレグネノロンに変換され、さらに他のすべての内因性ステロイドに変換される。神経ステロイドは、脳内で局所的に合成された後、あるいは末梢由来の副腎ステロイドや性腺ステロイドが変換されて生成される。神経ステロイドは、末梢から取り込まれたコレステロールやステロイド前駆体から、特に髄鞘グリア細胞に蓄積される[25][26]。抑制性神経ステロイドの生合成には5α-還元酵素I型と3α-ヒドロキシステロイド脱水素酵素が、興奮性神経ステロイドの生成には3β-ヒドロキシ-Δ5-ステロイドデヒドロゲナーゼとヒドロキシステロイド硫酸基転移酵素が関与している[4]。
作用
[編集]神経ステロイドの主な生物学的機能としては、神経の可塑性[27]、学習・記憶プロセス[28]、行動[29][30]、発作感受性[31]、ストレス・不安・抑うつ[12][32]に対する反応等の調節が知られている。また、神経ステロイドは、様々な性的二形行動や情動反応にも重要な役割を果たしていると思われる[30]。
急性ストレスは、アロプレグナノロンのような抑制性の神経ステロイドの濃度を上昇させ、これらの神経ステロイドは、ストレスの影響の多くを打ち消す事が知られている[33]。これはエンドルフィンの場合と同様で、エンドルフィンはストレスや身体的な痛みに反応して分泌され、そのような状態の負の主観的な影響を打ち消す。このように、神経調節物質の生物学的機能の一つは、感情の恒常性を維持する事であると考えられている[29][34]。慢性的なストレスは、アロプレグナノロンの減少、アロプレグナノロンのストレス応答性の変化、精神疾患、視床下部-下垂体-副腎軸の調節障害などと関連していると言われている[32][33]。
月経前症候群(PMS)、月経前不快気分障害(PMDD)、産後うつ病(PPD)、産後精神病、無症候性てんかん等の様々な女性特有の症状には、月経周期や妊娠中の抑制性神経ステロイドの濃度の変動が重要な役割を果たしていると考えられる[35][36][37]。また、男女の思春期や女性の更年期に起こる気分、不安、性欲の変化にも、神経ステロイド濃度の変化が関与しているのではないかと考えられている[4][38][39]。
抑制性の神経ステロイド、すなわちアロプレグナノロンの濃度が上昇すると、ネガティブな気分、不安、苛立ち、攻撃性等の逆説的な作用が生じる[40][41][42][43]。これは、ベンゾジアゼピン系、バルビツール酸系、エタノール[35][43]等の他のGABAA受容体の陽性アロステリック調節因子と同様に、これらの神経ステロイドが二相性のU字型作用を有する為と考えられる。中程度の濃度(黄体期レベルにほぼ相当する総アロプロゲステロン1.5〜2nM/Lの範囲)ではGABAA受容体の活性を阻害し、低濃度および高濃度では受容体の活性を促進する[41][42]。
生理活性
[編集]シグマ1受容体
[編集]| 化合物 | Ki (nM) | 作用 | 動物種 | 出典 |
|---|---|---|---|---|
| プロゲステロン | 268 | 阻害薬 | モルモット | [45][46] |
| デスオキシコルチコステロン | 938 | 未知 | モルモット | [45][46] |
| テストステロン | 1,014 | 未知 | モルモット | [45][46] |
| プレグネノロン | ND | 作動薬 | ND | ND |
| 硫酸プレグネノロン | 3,198 | 作動薬 | モルモット | [45][46] |
| デヒドロエピアンドロステロン | 3,700 | 作動薬 | ? | [46] |
| 硫酸デヒドロエピアンドロステロン | ND | 作動薬 | ND | ND |
| コルチコステロン | 4,074 | 未知 | モルモット | [45] |
治療への応用
[編集]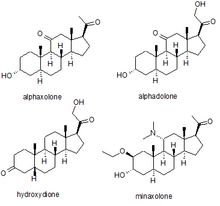
麻酔
[編集]いくつかの合成神経ステロイドは、外科手術を行う際の全身麻酔を目的とした鎮静薬として使用されてきた。代表的なものとしては、アルファキソロン、アルファドロン、ヒドロキシジオン、ミナキソロン等が挙げられる。最初に登場したのはヒドロキシジオンで、5β-プレグナンジオンの21-ヒドロキシ誘導体をエステル化したものである。ヒドロキシジオンは安全性が高く、有用な麻酔薬である事が判ったが、水溶性が低い為か、注射すると疼痛や刺激性が感じられた。この為、新しい神経活性ステロイドが開発された。次に発売されたのは、アルファキソロンとアルファドロンの合剤であった。この薬は、稀に重篤な毒性反応を示した為、人間への使用は中止されたが、獣医学ではまだ使用されている。次にヒトの医療に導入された神経ステロイド系麻酔薬は、合剤の約3倍の効力を持ち、同合剤で見られた毒性の問題はなく、良好な安全性プロファイルを維持している新薬のミナキソロンであった。しかし、この薬剤も、臨床使用上の問題ではなく、動物実験で発がん性の可能性が示唆され、代替薬がある事から、リスクの可能性が市場に残しておくメリットを上回ると判断され、最終的に販売中止となった。
ガナキソロン
[編集]
プロゲステロンの代謝物であるアロプレグナノロンの類似体である神経ステロイドのガナキソロンは、動物モデルを用いた研究が盛んに行われており、現在、てんかんの治療薬として臨床試験が行われている。ガナキソロンを含む神経ステロイドは、動物モデルにおいて幅広い活性を示す[47]。また、他のGABAA受容体調節薬、特にベンゾジアゼピン系薬剤と比較して、長期間の使用でも耐性が生じないという利点がある[48][49]。
成人の部分発作患者を対象とした第II相無作為化プラセボ対照試験(10週間)において、安全性、忍容性、有効性が確認された[10]。また、104週間のオープンラベル延長試験でも引き続き有効性が確認された。また、非臨床試験の結果から、妊娠中の使用についてもリスクが低いことが示唆されている。本薬は、てんかんの治療に加えて、幅広い神経疾患および精神疾患の治療にも応用できる可能性がある。現在、心的外傷後ストレス障害および脆弱X症候群を対象とした概念実証試験が進行中である。
月経てんかん
[編集]月経てんかんの治療法として、発作(英語版)頻度が増加する月経周期の期間にガナキソロン等の神経活性ステロイドを用いる、いわゆる「神経ステロイド補充療法」が提案されている[7]。また、アロプレグナノロンへのプロドラッグとして確実な挙動を示す微粉末プロゲステロンも、同様に月経てんかんの治療法として提案されている[50]。
アロプレグナノロン
[編集]アロプレグナノロン(SAGE-547)は、超難治性てんかん重積状態、産後うつ病、本態性振戦の静脈内投与の治療薬として開発されていた[51][52]。
その他の応用
[編集]4,16-アンドロスタジエン-3β-オール(PH94B)は、合成フェロモンまたはフェリンと呼ばれる神経ステロイドで、女性の不安障害の治療薬として研究されている[20][21][53]。
3β-メトキシプレグネノロン(MAP-4343、プレグネノロン3β-メチルエーテル)は、プレグネノロンと同様に微小管結合タンパク質2(MAP2)と相互作用する合成神経活性ステロイドおよびプレグネノロン誘導体であり、脳・脊髄損傷やうつ病の治療などの臨床使用を目指して開発中である[54][55][56][57]。
抗うつ作用での役割
[編集]フルオキセチンやフルボキサミンなどの抗うつ薬は、一般的に選択的セロトニン再取り込み阻害薬(SSRI)として作用する事でうつ病に影響を与えると考えられているが、セロトニンの再取り込みに影響を及ぼさない用量で、特定の神経ステロイド(うつ病患者では頻繁に欠乏している)の濃度を正常化する事も判明している。このことから、うつ病に対するこれらの薬剤の有効性には、神経ステロイドが関与する別の作用もあると考えられる[58][59]。
神経ステロイドへのベンゾジアゼピンの作用
[編集]ベンゾジアゼピン系薬剤は、輸送タンパク質(TSPO;「末梢ベンゾジアゼピン受容体」)への作用により、神経ステロイドの代謝に影響を与える可能性がある[60]。ベンゾジアゼピンのGABAA受容体に対する薬理作用は、神経ステロイドの薬理作用と類似している。個々のベンゾジアゼピン系薬剤が神経ステロイド濃度を変化させる能力に影響を与える要因は、個々のベンゾジアゼピン系薬剤がTSPOと相互作用するか否かに依存する可能性がある。また、ベンゾジアゼピン系薬剤の中には、神経ステロイド生成酵素を阻害し、神経ステロイドの合成を低下させるものがある[61]。
関連項目
[編集]注釈
[編集]- ^ neurogenic effects
出典
[編集]- ^ “neurosteroidの意味・使い方・読み方 | Weblio英和辞書”. ejje.weblio.jp. 2021年10月9日閲覧。
- ^ Paul SM, Purdy RH (March 1992). “Neuroactive steroids”. FASEB Journal 6 (6): 2311-2322. doi:10.1096/fasebj.6.6.1347506. PMID 1347506.
- ^ Lan NC, Gee KW (December 1994). “Neuroactive steroid actions at the GABAA receptor”. Hormones and Behavior 28 (4): 537-544. doi:10.1006/hbeh.1994.1052. PMID 7729823.
- ^ a b c d e f Reddy DS (2010). “Neurosteroids: endogenous role in the human brain and therapeutic potentials”. Progress in Brain Research 186: 113-137. doi:10.1016/B978-0-444-53630-3.00008-7. PMC 3139029. PMID 21094889.
- ^ Reddy DS, Rogawski MA (2012). "Neurosteroids - Endogenous Regulators of Seizure Susceptibility and Role in the Treatment of Epilepsy". In Noebels JL, Avoli M, Rogawski MA, et al. (eds.). Jasper's Basic Mechanisms of the Epilepsies [Internet]. 4th edition. Bethesda (MD): National Center for Biotechnology Information (US). National Center for Biotechnology Information (US).
- ^ a b Srivastava DP, Waters EM, Mermelstein PG, Kramár EA, Shors TJ, Liu F (November 2011). "Rapid estrogen signaling in the brain: implications for the fine-tuning of neuronal circuitry". The Journal of Neuroscience. 31 (45): 16056–16063. doi:10.1523/JNEUROSCI.4097-11.2011. PMC 3245715. PMID 22072656。
- ^ a b Reddy DS, Rogawski MA (April 2009). “Neurosteroid replacement therapy for catamenial epilepsy”. Neurotherapeutics 6 (2): 392-401. doi:10.1016/j.nurt.2009.01.006. PMC 2682439. PMID 19332335.
- ^ Morrow AL (October 2007). “Recent developments in the significance and therapeutic relevance of neuroactive steroids--Introduction to the special issue”. Pharmacology & Therapeutics 116 (1): 1-6. doi:10.1016/j.pharmthera.2007.04.003. PMC 2047816. PMID 17531324.
- ^ Dubrovsky BO (February 2005). “Steroids, neuroactive steroids and neurosteroids in psychopathology”. Progress in Neuro-Psychopharmacology & Biological Psychiatry 29 (2): 169-192. doi:10.1016/j.pnpbp.2004.11.001. PMID 15694225.
- ^ a b Bialer M, Johannessen SI, Levy RH, Perucca E, Tomson T, White HS (Jan 2013). “Progress report on new antiepileptic drugs: a summary of the Eleventh Eilat Conference (EILAT XI)”. Epilepsy Research 103 (1): 2-30. doi:10.1016/j.eplepsyres.2012.10.001. PMID 23219031.
- ^ Rougé-Pont F, Mayo W, Marinelli M, Gingras M, Le Moal M, Piazza PV (July 2002). "The neurosteroid allopregnanolone increases dopamine release and dopaminergic response to morphine in the rat nucleus accumbens". The European Journal of Neuroscience. 16 (1): 169–173. doi:10.1046/j.1460-9568.2002.02084.x. PMID 12153544. S2CID 9953445。
- ^ a b c Frye CA (December 2009). “Neurosteroids' effects and mechanisms for social, cognitive, emotional, and physical functions”. Psychoneuroendocrinology 34 Suppl 1: S143-161. doi:10.1016/j.psyneuen.2009.07.005. PMC 2898141. PMID 19656632.
- ^ Pinna G, Costa E, Guidotti A (February 2005). “Changes in brain testosterone and allopregnanolone biosynthesis elicit aggressive behavior”. Proceedings of the National Academy of Sciences of the United States of America 102 (6): 2135-2140. Bibcode: 2005PNAS..102.2135P. doi:10.1073/pnas.0409643102. PMC 548579. PMID 15677716.
- ^ Terán-Pérez G, Arana-Lechuga Y, Esqueda-León E, Santana-Miranda R, Rojas-Zamorano JÁ, Velázquez Moctezuma J (October 2012). "Steroid hormones and sleep regulation". Mini Reviews in Medicinal Chemistry. 12 (11): 1040–1048. doi:10.2174/138955712802762167. PMID 23092405。
- ^ Patte-Mensah C, Meyer L, Taleb O, Mensah-Nyagan AG (February 2014). “Potential role of allopregnanolone for a safe and effective therapy of neuropathic pain”. Progress in Neurobiology 113: 70-78. doi:10.1016/j.pneurobio.2013.07.004. PMID 23948490.
- ^ Hénin J, Salari R, Murlidaran S, Brannigan G (2014). "A predicted binding site for cholesterol on the GABAA receptor". Biophys. J. 106 (9): 1938–1949. Bibcode:2014BpJ...106.1938H. doi:10.1016/j.bpj.2014.03.024. PMC 4017285. PMID 24806926。
- ^ Levitan, Irena; Singh, Dev K.; Rosenhouse-Dantsker, Avia (2014). “Cholesterol binding to ion channels”. Frontiers in Physiology 5: 65. doi:10.3389/fphys.2014.00065. ISSN 1664-042X. PMC 3935357. PMID 24616704.
- ^ Paul, S. M.; Doherty, J. J.; Robichaud, A. J.; Belfort, G. M.; Chow, B. Y.; Hammond, R. S.; Crawford, D. C.; Linsenbardt, A. J. et al. (2013). “The Major Brain Cholesterol Metabolite 24(S)-Hydroxycholesterol Is a Potent Allosteric Modulator of N-Methyl-D-Aspartate Receptors”. Journal of Neuroscience 33 (44): 17290-17300. doi:10.1523/JNEUROSCI.2619-13.2013. ISSN 0270-6474. PMC 3812502. PMID 24174662.
- ^ Christopher H. Hawkes; Richard L. Doty (12 February 2009). The Neurology of Olfaction. Cambridge University Press. pp. 37-. ISBN 978-0-521-68216-9
- ^ a b Monti-Bloch L, Jennings-White C, Dolberg DS, Berliner DL (1994). “The human vomeronasal system”. Psychoneuroendocrinology 19 (5-7): 673-686. doi:10.1016/0306-4530(94)90049-3. PMID 7938363.
- ^ a b Liebowitz MR, Salman E, Nicolini H, Rosenthal N, Hanover R, Monti L (June 2014). “Effect of an acute intranasal aerosol dose of PH94B on social and performance anxiety in women with social anxiety disorder”. The American Journal of Psychiatry 171 (6): 675-682. doi:10.1176/appi.ajp.2014.12101342. PMID 24700254.
- ^ Marx CE, Bradford DW, Hamer RM, Naylor JC, Allen TB, Lieberman JA, Strauss JL, Kilts JD (September 2011). “Pregnenolone as a novel therapeutic candidate in schizophrenia: emerging preclinical and clinical evidence”. Neuroscience 191: 78-90. doi:10.1016/j.neuroscience.2011.06.076. PMID 21756978.
- ^ Baulieu E, Schumacher M (2000). “Progesterone as a neuroactive neurosteroid, with special reference to the effect of progesterone on myelination”. Steroids 65 (10-11): 605-612. doi:10.1016/s0039-128x(00)00173-2. PMID 11108866.
- ^ Thomas P, Pang Y (2012). “Membrane progesterone receptors: evidence for neuroprotective, neurosteroid signaling and neuroendocrine functions in neuronal cells”. Neuroendocrinology 96 (2): 162-171. doi:10.1159/000339822. PMC 3489003. PMID 22687885.
- ^ Agís-Balboa RC, Pinna G, Zhubi A, Maloku E, Veldic M, Costa E, Guidotti A (September 2006). "Characterization of brain neurons that express enzymes mediating neurosteroid biosynthesis". Proceedings of the National Academy of Sciences of the United States of America. 103 (39): 14602–14607. Bibcode:2006PNAS..10314602A. doi:10.1073/pnas.0606544103. PMC 1600006. PMID 16984997。
- ^ Mellon SH, Griffin LD (2002). “Neurosteroids: biochemistry and clinical significance”. Trends in Endocrinology and Metabolism 13 (1): 35-43. doi:10.1016/S1043-2760(01)00503-3. PMID 11750861.
- ^ Benarroch EE (March 2007). “Neurosteroids: endogenous modulators of neuronal excitability and plasticity”. Neurology 68 (12): 945-947. doi:10.1212/01.wnl.0000257836.09570.e1. PMID 17372131.
- ^ Vallée M, Mayo W, Koob GF, Le Moal M (2001). "Neurosteroids in learning and memory processes". International Review of Neurobiology. 46: 273–320. doi:10.1016/s0074-7742(01)46066-1. ISBN 9780123668462. PMID 11599303。
- ^ a b Engel SR, Grant KA (2001). “Neurosteroids and behavior”. International Review of Neurobiology 46: 321-348. doi:10.1016/S0074-7742(01)46067-3. ISBN 9780123668462. PMID 11599304.
- ^ a b King SR (2008). “Emerging roles for neurosteroids in sexual behavior and function”. Journal of Andrology 29 (5): 524-533. doi:10.2164/jandrol.108.005660. PMID 18567641.
- ^ Joshi S, Rajasekaran K, Kapur J (June 2013). “GABAergic transmission in temporal lobe epilepsy: the role of neurosteroids”. Experimental Neurology 244: 36-42. doi:10.1016/j.expneurol.2011.10.028. PMC 3319002. PMID 22101060.
- ^ a b Girdler SS, Klatzkin R (October 2007). “Neurosteroids in the context of stress: implications for depressive disorders”. Pharmacology & Therapeutics 116 (1): 125-139. doi:10.1016/j.pharmthera.2007.05.006. PMC 2650267. PMID 17597217.
- ^ a b Bali A, Jaggi AS (Jan 2014). “Multifunctional aspects of allopregnanolone in stress and related disorders”. Progress in Neuro-Psychopharmacology & Biological Psychiatry 48: 64-78. doi:10.1016/j.pnpbp.2013.09.005. PMID 24044974.
- ^ Gunn BG, Cunningham L, Mitchell SG, Swinny JD, Lambert JJ, Belelli D (Jan 2015). “GABAA receptor-acting neurosteroids: a role in the development and regulation of the stress response”. Frontiers in Neuroendocrinology 36: 28-48. doi:10.1016/j.yfrne.2014.06.001. PMC 4349499. PMID 24929099.
- ^ a b Bäckström T, Andersson A, Andreé L, Birzniece V, Bixo M, Björn I, Haage D, Isaksson M, Johansson IM, Lindblad C, Lundgren P, Nyberg S, Odmark IS, Strömberg J, Sundström-Poromaa I, Turkmen S, Wahlström G, Wang M, Wihlbäck AC, Zhu D, Zingmark E (December 2003). "Pathogenesis in menstrual cycle-linked CNS disorders". Annals of the New York Academy of Sciences. 1007 (1): 42–53. Bibcode:2003NYASA1007...42B. doi:10.1196/annals.1286.005. PMID 14993039. S2CID 20995334。
- ^ Guille C, Spencer S, Cavus I, Epperson CN (July 2008). “The role of sex steroids in catamenial epilepsy and premenstrual dysphoric disorder: implications for diagnosis and treatment”. Epilepsy & Behavior 13 (1): 12-24. doi:10.1016/j.yebeh.2008.02.004. PMC 4112568. PMID 18346939.
- ^ Finocchi C, Ferrari M (May 2011). “Female reproductive steroids and neuronal excitability”. Neurological Sciences 32 Suppl 1: S31-35. doi:10.1007/s10072-011-0532-5. PMID 21533709.
- ^ Genazzani AR, Bernardi F, Monteleone P, Luisi S, Luisi M (2000). “Neuropeptides, neurotransmitters, neurosteroids, and the onset of puberty”. Annals of the New York Academy of Sciences 900 (1): 1-9. Bibcode: 2000NYASA.900....1G. doi:10.1111/j.1749-6632.2000.tb06210.x. PMID 10818386.
- ^ Melcangi RC, Panzica G, Garcia-Segura LM (September 2011). “Neuroactive steroids: focus on human brain”. Neuroscience 191: 1-5. doi:10.1016/j.neuroscience.2011.06.024. hdl:10261/61590. PMID 21704130.
- ^ Andréen L, Sundström-Poromaa I, Bixo M, Nyberg S, Bäckström T (August 2006). "Allopregnanolone concentration and mood--a bimodal association in postmenopausal women treated with oral progesterone". Psychopharmacology. 187 (2): 209–221. doi:10.1007/s00213-006-0417-0. PMID 16724185. S2CID 1933116。
- ^ a b Bäckström T, Haage D, Löfgren M, Johansson IM, Strömberg J, Nyberg S, Andréen L, Ossewaarde L, van Wingen GA, Turkmen S, Bengtsson SK (September 2011). "Paradoxical effects of GABA-A modulators may explain sex steroid induced negative mood symptoms in some persons". Neuroscience. 191: 46–54. doi:10.1016/j.neuroscience.2011.03.061. PMID 21600269. S2CID 38928854。
- ^ a b Andréen L, Nyberg S, Turkmen S, van Wingen G, Fernández G, Bäckström T (September 2009). "Sex steroid induced negative mood may be explained by the paradoxical effect mediated by GABAA modulators". Psychoneuroendocrinology. 34 (8): 1121–1132. doi:10.1016/j.psyneuen.2009.02.003. PMID 19272715. S2CID 22259026。
- ^ a b Bäckström T, Bixo M, Johansson M, Nyberg S, Ossewaarde L, Ragagnin G, Savic I, Strömberg J, Timby E, van Broekhoven F, van Wingen G (February 2014). "Allopregnanolone and mood disorders". Progress in Neurobiology. 113: 88–94. doi:10.1016/j.pneurobio.2013.07.005. PMID 23978486. S2CID 207407084。
- ^ Maurice T, Urani A, Phan VL, Romieu P (2001). “The interaction between neuroactive steroids and the sigma1 receptor function: behavioral consequences and therapeutic opportunities”. Brain Res. Brain Res. Rev. 37 (1-3): 116-132. doi:10.1016/s0165-0173(01)00112-6. PMID 11744080.
- ^ a b c d e Su TP, London ED, Jaffe JH (1988). “Steroid binding at sigma receptors suggests a link between endocrine, nervous, and immune systems”. Science 240 (4849): 219-221. Bibcode: 1988Sci...240..219S. doi:10.1126/science.2832949. PMID 2832949.
- ^ a b c d e Takebayashi M, Hayashi T, Su TP (2004). “A perspective on the new mechanism of antidepressants: neuritogenesis through sigma-1 receptors”. Pharmacopsychiatry 37 Suppl 3: S208-213. doi:10.1055/s-2004-832679. PMID 15547787.
- ^ Rogawski MA, Reddy DS, 2004. Neurosteroids: endogenous modulators of seizure susceptibility. In: Rho, J.M., Sankar, R., Cavazos, J. (Eds.), Epilepsy: Scientific Foundations of Clinical Practice. Marcel Dekker, New York, 2004;319-355.
- ^ Kokate TG, Yamaguchi S, Pannell LK, Rajamani U, Carroll DM, Grossman AB, Rogawski MA (November 1998). “Lack of anticonvulsant tolerance to the neuroactive steroid pregnanolone in mice”. The Journal of Pharmacology and Experimental Therapeutics 287 (2): 553-558. PMID 9808680.
- ^ Reddy DS, Rogawski MA (December 2000). “Chronic treatment with the neuroactive steroid ganaxolone in the rat induces anticonvulsant tolerance to diazepam but not to itself”. The Journal of Pharmacology and Experimental Therapeutics 295 (3): 1241-1248. PMID 11082461.
- ^ Orrin Devinsky; Steven Schachter; Steven Pacia (1 January 2005). Complementary and Alternative Therapies for Epilepsy. Demos Medical Publishing. pp. 378-. ISBN 978-1-934559-08-6
- ^ “Brexanolone - Sage Therapeutics - AdisInsight”. 2021年10月10日閲覧。
- ^ “Our Programs - SAGE Therapeutics”. web.archive.org (2017年7月29日). 2021年10月10日閲覧。
- ^ Griebel G, Holmes A (September 2013). “50 years of hurdles and hope in anxiolytic drug discovery”. Nature Reviews. Drug Discovery 12 (9): 667-687. doi:10.1038/nrd4075. PMC 4176700. PMID 23989795.
- ^ “Pregnenolone methyl ether - Mapreg - AdisInsight”. 2021年10月10日閲覧。
- ^ Duchossoy Y, David S, Baulieu EE, Robel P (2011). “Treatment of experimental spinal cord injury with 3β-methoxy-pregnenolone”. Brain Res. 1403: 57-66. doi:10.1016/j.brainres.2011.05.065. PMID 21704982.
- ^ Bianchi M, Baulieu EE (2012). “3β-Methoxy-pregnenolone (MAP4343) as an innovative therapeutic approach for depressive disorders”. Proc. Natl. Acad. Sci. U.S.A. 109 (5): 1713-1718. Bibcode: 2012PNAS..109.1713B. doi:10.1073/pnas.1121485109. PMC 3277154. PMID 22307636.
- ^ Baulieu ÉÉ (2015). "From steroid hormones to depressive states and senile dementias: New mechanistic, therapeutical and predictive approaches". Comptes Rendus Biologies. 338 (8–9): 613–616. doi:10.1016/j.crvi.2015.06.003. PMID 26251072。
- ^ Uzunova V, Sheline Y, Davis JM, Rasmusson A, Uzunov DP, Costa E, Guidotti A (March 1998). “Increase in the cerebrospinal fluid content of neurosteroids in patients with unipolar major depression who are receiving fluoxetine or fluvoxamine”. Proceedings of the National Academy of Sciences of the United States of America 95 (6): 3239-2344. Bibcode: 1998PNAS...95.3239U. doi:10.1073/pnas.95.6.3239. PMC 19726. PMID 9501247.
- ^ Pinna G, Costa E, Guidotti A (June 2006). “Fluoxetine and norfluoxetine stereospecifically and selectively increase brain neurosteroid content at doses that are inactive on 5-HT reuptake”. Psychopharmacology 186 (3): 362-372. doi:10.1007/s00213-005-0213-2. PMID 16432684.
- ^ Dhir A, Rogawski MA (April 2012). “Role of neurosteroids in the anticonvulsant activity of midazolam”. British Journal of Pharmacology 165 (8): 2684-2691. doi:10.1111/j.1476-5381.2011.01733.x. PMC 3423249. PMID 22014182.
- ^ Usami N, Yamamoto T, Shintani S, Ishikura S, Higaki Y, Katagiri Y, Hara A (April 2002). “Substrate specificity of human 3(20)alpha-hydroxysteroid dehydrogenase for neurosteroids and its inhibition by benzodiazepines”. Biological & Pharmaceutical Bulletin 25 (4): 441-445. doi:10.1248/bpb.25.441. PMID 11995921.
関連文献
[編集]- Akk G, Shu HJ, Wang C, Steinbach JH, Zorumski CF, Covey DF, Mennerick S (December 2005). “Neurosteroid access to the GABAA receptor”. The Journal of Neuroscience 25 (50): 11605-11613. doi:10.1523/JNEUROSCI.4173-05.2005. PMC 6726021. PMID 16354918.
- Wang JM, Johnston PB, Ball BG, Brinton RD (May 2005). “The neurosteroid allopregnanolone promotes proliferation of rodent and human neural progenitor cells and regulates cell-cycle gene and protein expression”. The Journal of Neuroscience 25 (19): 4706-4718. doi:10.1523/JNEUROSCI.4520-04.2005. PMC 6724768. PMID 15888646.
- Dong E, Matsumoto K, Uzunova V, Sugaya I, Takahata H, Nomura H, Watanabe H, Costa E, Guidotti A (February 2001). “Brain 5alpha-dihydroprogesterone and allopregnanolone synthesis in a mouse model of protracted social isolation”. Proceedings of the National Academy of Sciences of the United States of America 98 (5): 2849-2854. Bibcode: 2001PNAS...98.2849D. doi:10.1073/pnas.051628598. PMC 30228. PMID 11226329.
- Melcangi RC, Celotti F, Martini L (March 1994). “Progesterone 5-alpha-reduction in neuronal and in different types of glial cell cultures: type 1 and 2 astrocytes and oligodendrocytes”. Brain Research 639 (2): 202-206. doi:10.1016/0006-8993(94)91731-0. PMID 8205473.
- Corpéchot C, Robel P, Axelson M, Sjovall J, Baulieu EE (August 1981). "Characterization and measurement of dehydroepiandrosterone sulfate in rat brain". Proceedings of the National Academy of Sciences of the United States of America. 78 (8): 4704–4707. Bibcode:1981PNAS...78.4704C. doi:10.1073/pnas.78.8.4704. PMC 320231. PMID 6458035。
- Reddy D, Rogawski MA (2012). "Neurosteroids — Endogenous regulators of seizure susceptibility and role in the treatment of epilepsy". In Noebels JL, Avoli M, Rogawski MA, et al. (eds.). Jasper's Basic Mechanisms of the Epilepsies (4th ed.). Bethesda (MD): National Center for Biotechnology Information. PMID 22787590。
