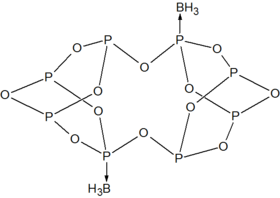六酸化四リン
表示
| 六酸化四リン | |
|---|---|
 リンは橙色、酸素は赤色で示している。
| |

| |
別称 | |
| 識別情報 | |
| CAS登録番号 | 1314-24-5 |
| PubChem | 123290 |
| ChemSpider | 109897 |
| UNII | 0LTR52K7HK |
| ChEBI | |
| |
| |
| 特性 | |
| 化学式 | P4O6 |
| モル質量 | 219.88 g mol−1 |
| 外観 | 無色の単斜晶または液体 |
| 密度 | 2.135 g/cm3 |
| 融点 |
23.8 °C, 297 K, 75 °F |
| 沸点 |
173.1 °C, 446 K, 344 °F |
| 水への溶解度 | 反応する |
| 酸解離定数 pKa | 9.4 |
| 構造 | |
| 分子の形 | 本文参照 |
| 双極子モーメント | 0 |
| 危険性 | |
| EU分類 | Toxic (T+) |
| NFPA 704 | |
| 関連する物質 | |
| その他の陰イオン | 三硫化リン |
| その他の陽イオン | 三酸化二窒素 三酸化二ヒ素 三酸化アンチモン |
| 関連物質 | 五酸化二リン 亜リン酸 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
六酸化四リン(ろくさんかよんリン、Tetraphosphorus hexoxide)は、分子式P4O6で表される化合物。三酸化リン (Phosphorus trioxide) や三酸化二リンとも呼ばれる。無色の固体であり、アダマンタンに関連する構造を持つ。形式上は亜リン酸(H3PO3)の無水物であるが、酸の脱水により得ることはできない。白色でワックス状であり、ニンニクの臭いのする結晶および非常に有毒な固体である[1]。
調製
[編集]空気がわずかに供給されている状態でリンを低温で燃焼させることにより得られる。
- P4 + 3 O2 → P4O6
副生成物には赤リン亜酸化物が含まれる[1]。
化学的性質
[編集]水と反応して亜リン酸を形成する。つまり、六酸化四リンは亜リン酸の無水物である[2]。
- P4O6 + 6 H2O → 4 H3PO3
- P4O6 + 6 HCl → 2 H3PO3 + 2 PCl3
塩素または臭素と反応してそれぞれ対応するハロゲン化リンを形成し、密閉された管内で要素と反応し四ヨウ化二リンを形成する[1]。
195Kでオゾンと反応し、不安定な化合物P4O18を生成する[3]。

P4O18は238K以上の溶液中で分解し、O2ガスを放出する。乾燥したP4O18の分解は爆発的である。
不均化反応では、P4O6を密閉された管内で710Kで加熱すると、P(III)とP(V)が混合したP4O8に変換される。副生成物として赤リンが生成される[3]。
配位子として
[編集]
P4O6は、亜リン酸エステルに相当する遷移金属の配位子である。図の錯体はP4O6·Fe(CO)4である[4]。BH3を用いると、二量体付加体が生成される[3]。
出典
[編集]- ^ a b c A. F. Holleman; Wiberg, Egon; Wiberg, Nils (2001). Inorganic Chemistry. Boston: Academic Press. ISBN 0-12-352651-5
- ^ グリーンウッド, ノーマン; アーンショウ, アラン (1997). Chemistry of the Elements (英語) (2nd ed.). バターワース=ハイネマン. ISBN 978-0-08-037941-8。
- ^ a b c .Catherine E. Housecroft; Alan G. Sharpe (2008). “Chapter 15: The group 15 elements”. Inorganic Chemistry, 3rd Edition. Pearson. p. 473. ISBN 978-0-13-175553-6
- ^ M. Jansen & J. Clade (November 1996). “Tetracarbonyl(tetraphosphorus hexaoxide)iron”. Acta Crystallogr. C 52 (11): 2650–2652. doi:10.1107/S0108270196004398.