オキソカーボン
オキソカーボン (oxocarbon) または炭素酸化物 (oxide of carbon) とは、炭素と酸素のみの無機化合物である[1][2]。
最も単純なオキソカーボンは一酸化炭素 (CO) と二酸化炭素 (CO2) である。そのほかに亜酸化炭素 (C3O2) や無水メリト酸など、多くの安定または準安定のオキソカーボンが知られている。
 |
|||||||
| CO 一酸化炭素 |
CO2 二酸化炭素 |
C3O2 亜酸化炭素 |
C12O9 無水メリト酸 |
この4つのほかにも、膨大な数のオキソカーボンが知られていて、そのほとんどは1960年代以降に合成された。なかには常温で安定なものもあるが、極低温下でしか存在できないものもあり、温度を上げると単純なオキソカーボンに分解する。多くのオキソカーボンは本質的に不安定であり、反応中間体として瞬間的に現れることを除けば、気相中またはマトリックス分離法におけるマトリックス内でしか存在できない。
年々新たなオキソカーボンが見つかっている。酸化黒鉛や非共有結合性の分子構造をもつ安定な炭素酸化物のポリマーの存在から、まだまだ多くのオキソカーボンが存在すると思われる[3][4]。
概要
[編集]二酸化炭素 (CO2) は広く天然に存在し、炭素を含む物質を燃やしたり、ビールやパンなどを発酵させることにより、古来から人は知らず知らずのうちにCO2を生産していた。17・18世紀のころから、当時の化学者は二酸化炭素が化学物質とみなすようになった。
一酸化炭素 (CO) も燃焼反応により生成し、鉱石から鉄を製錬するのに大昔から役にたっていた。二酸化炭素と同じく、中世から西洋の錬金術師や化学者に研究されてきた。その元素組成は1800年William Cruikshankにより解明された。
亜酸化炭素 (C3O2) は1873年、一酸化炭素に電流を通すことでBrodieにより発見された[5]。
4番目の酸化物、無水メリト酸 (C12O9) は1830年にリービッヒとヴェーラーがメライトの研究の過程で得ていたと思われるが、はじめて直接に言及したのはMeyerとSteinerであり、1913年のことであった[6][7][8]。
Brodieは1859年に、炭素原子と酸素原子を2:1から3:1の割合で含む酸化黒鉛と呼ばれる化合物を発見した。その性質の分子構造が解明されたのはここ数年[いつ?]のことであり、ナノテクノロジーの研究課題となった[3]。
極限的な条件でしか存在を確認できないほど不安定な酸化物の例として、一酸化二炭素ラジカル (:C=C=O)、三酸化炭素 (CO3)[9]、四酸化炭素 (CO4)[10][11]、1,2-ジオキセタンジオン (C2O4)[12][13]が挙げられる。これら反応性が高い炭素酸化物のいくつかは、星間物質である分子雲中に回転分光法により検知された[14]。
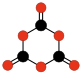
理論的には存在が予想されるが、まだ確認されていないオキソカーボンがある。無水シュウ酸 (C2O3)、エチレンジオン (C2O2)[15] や、1,3-ジオキセタンジオン (C2O4) の二量体[16]や1,3,5-トリオキサントリオン (C3O6) の三量体[16][17]などの一酸化炭素の直線形または環状のポリマーであるポリケトン (-CO-)n[18]がそうである。
 |
 |
 |
|||||||
| C2O3 無水シュウ酸 |
C2O4 1,2-ジオキセタンジオン |
C2O4 1,3-ジオキセタンジオン |
C3O6 1,3,5-トリオキサントリオン |
C2O2 エチレンジオン |
一般構造
[編集]通常は炭素原子は四価であり酸素は二価であるから、ほとんどのオキソカーボンも炭素は4つの原子と共有結合を形成し、酸素は2つの原子と同様に結合している。さらに炭素原子同士は任意の長さの炭素鎖また炭素骨格を形成できるのに対して、3つの酸素原子が連なった鎖を見かけるのは稀である。よって電気的に中性なオキソカーボンは一般に、酸素原子 (-O-, =O) またはペルオキシド基 (-O-O-) と結合した炭素骨格からなる。
一酸化二炭素 (C2O) などいくつかのオキソカーボンは不飽和炭素原子を持つが、このような化合物は一般に非常に反応性が高すぎて単離することが難しい[19]。電子を余分に持っていたり失ったりすると、負に帯電した一価の酸素 (-O−) や正に帯電した三価の酸素 (≡O+)、または負に帯電した三価の炭素 (≡C−) が現れる。一酸化炭素 (-C≡O+) はそのような原子を持っている[20]。負に帯電した酸素原子はほとんどのオキソカーボンアニオンで見られる。
直線形二酸化物
[編集]一般式CnO2またはO=(C=)nOで表される炭素酸化物は、枝分かれしていない炭素原子の鎖を持ち、その両端に酸素原子がくっついている構造を持つ。
- CO2 または O=C=O、二酸化炭素
- C2O2 または O=C=C=O、極端に不安定なエチレンジオン[15]
- C3O2 または O=C=C=C=O, 準安定な亜酸化炭素または二酸化三炭素
- C4O2 または O=C=C=C=C=O, 二酸化四炭素または1,2,3-ブタトリンエン-1,4-ジオン[21]
- C5O2 または O=C=C=C=C=C=O、二酸化五炭素[22]、この溶液は常温で安定であり、純物質は−90 °C以下で安定である[23]。
n = 7[23]:p.97、17、19、21[24]:p.95のものなど、さらに多くの炭素原子を含んだものが低圧力気相中または極低温のマトリックス内で微量検出された。
直線形一酸化物
[編集]オキソカーボンのほかのグループに直線形炭素一酸化物 (CnO) がある。その中で純粋な状態で常温で安定なものは一酸化炭素 (CO) のみであると考えられている。直線形炭素二酸化物を極低温マトリックス中で光分解するとCOを失い、C2OやC4O[19]やC6O[23]などの炭素原子を偶数個含んだ一酸化物が微量得られる。n = 9以上のものはアルゴン中でC3O2を放電することで得られる[25]。CO、C2O、C3Oは星間物質中に見つかった。
nが偶数のとき分子は三重項状態(クムレンのような)にあると考えられている。すなわち、鎖を構成する原子同士は二重結合によって繋がり、先頭の原子のみ空軌道を持つような構造を持つ。このときの構造式は:C=C=O、:C=C=C=C=O、一般に:(C=)nと表される。nが奇数のとき、三重項構造は一重項状態(アセチレンのような)と共鳴していると考えられている。このとき炭素は負に帯電し酸素は正に帯電しているので、分子全体が極性を持つ。その構造式は-C≡C-C≡O+、-C≡C-C≡C-C≡O+、一般に-(C≡C-)n/2C≡O+と表されると考えられる[25]。一酸化炭素はこのパターンに当てはまり、本来の構造に最も近い構造式は-C≡O+である[20]。
ラジアレン型環状ポリケトン
[編集]電気的に中性なラジアレン型のオキソカーボン (CnOn or (CO)n) が多数知られている[26]。これらは一酸化炭素の環状ポリマーとみることができる。理論的な研究によると、エチレンジオン (C2O2 or O=C=C=O) やシクロプロパントリオン (C3O3) は存在しえない[15][18]。一方、C4O4、C5O5、C6O6は存在するが、かなり不安定であると思われ[18]、今のところほんのわずかな量しか合成できていない[27][28]。
 |
 |
 |
 |
||||
| (CO)3 シクロプロパントリオン |
(CO)4 シクロブタンテトロン |
(CO)5 シクロペンタンペントン |
(CO)6 シクロヘキサンヘキソン |
一方、これらオキソカーボンのアニオンはかなり安定であり、いくつかは19世紀に既に知られていた[26][26]。たとえば
- C2O2−
2、アセチレンジオラート (Weiss and Büchner, 1963)[29] - C3O2−
3、デルタート (Eggerding and West, 1976)[30][31] - C4O2−
4, スクエラート (Cohen and others, 1959)[32] - C5O2−
5, クロコナート (Gmelin, 1825)[33] - C6O2−
6、ロジゾナート (Heller, 1837)[34][35]
などがある。同じく化学式 C6O6 をもつテトラヒドロキシベンゾキノン (C6O4−
6) やヘキサヒドロキシベンゼン (C6O6−
6)[36]のアニオンも安定である。これらのアニオンの芳香族性の詳細について理論面から研究されている[37][38]。
脚注
[編集]- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). オンライン版: (1995) "Oxocarbons".
- ^ R. West, editor (1980). Oxocarbons. New York: Academic Press
- ^ a b William S. Hummers Jr., and Richard E. Offeman (1958). “Preparation of Graphitic Oxide”. J. Am. Chem. Soc. 80 (6): 1339-1339. doi:10.1021/ja01539a017.
- ^ A. W. Snow, H. Haubenstock, N.-L. Yang (1978). “Poly(carbon suboxide). Characterization, Polymerization, and Radical Structure”. Macromolecules 11 (1): 77–86. doi:10.1021/ma60061a015.
- ^ Brodie B. C. (1873). “Note on the Synthesis of Marsh-Gas and Formic Acid, and on the Electric Decomposition of Carbonic Oxide”. Proceedings of the Royal Society (London) 21 (139–147): 245–247. doi:10.1098/rspl.1872.0052. JSTOR 113037.
- ^ J. Liebig, F. Wöhler (1830). “Ueber die Zusammensetzung der Honigsteinsäure”. Poggendorfs Annalen der Physik und Chemie 94 (2): 161–164.
- ^ Meyer H, Steiner K (1913). “Über ein neues Kohlenoxyd C12O9 (A new carbon oxide C12O9)”. Berichte der Deutschen Chemischen Gesellschaft 46: 813–815. doi:10.1002/cber.191304601105.
- ^ Bugge (1914). “Chemie: En neues Kohenoxyd. Review of Meyer and Steiner's discovery of C12O9”. Naturwissenschaftliche Wochenschrift 13/29 (12): 188.
- ^ DeMore W. B., Jacobsen C. W. (1969). “Formation of carbon trioxide in the photolysis of ozone in liquid carbon dioxide”. Journal of Physical Chemistry 73 (9): 2935–2938. doi:10.1021/j100843a026.
- ^ Laurence Y. Yeung, Mitchio Okumura, Jeffrey T. Paci, George C. Schatz, Jianming Zhang and Timothy K. Minton (2009). “Hyperthermal O-Atom Exchange Reaction O2 + CO2 through a CO4 Intermediate”. J. Am. Chem. Soc. 131 (39): 13940–13942. doi:10.1021/ja903944k.
- ^ Corey S. Jamieson, Alexander M. Mebel, Ralf I. Kaiser (2007). “Novel detection of the C2v isomer of carbon tetraoxide (CO4)”. Chem. Phys. Lett. 440 (1–3): 105–109. doi:10.1016/j.cplett.2007.04.043.
- ^ Herman F. Cordes, Herbert P. Richter, Carl A. Heller (1969). “Mass spectrometric evidence for the existence of 1,2-dioxetanedione (carbon dioxide dimer) Chemiluminescent intermediate”. J. Am. Chem. Soc. 91 (25): 7209. doi:10.1021/ja01053a065.
- ^ Richard Bos, Neil W. Barnett, Gail A. Dyson, Kieran F. Lim, Richard A. Russell and Simon P. Watson (2004). “Studies on the mechanism of the peroxyoxalate chemiluminescence reaction: Part 1. Confirmation of 1,2-dioxetanedione as an intermediate using 13C nuclear magnetic resonance spectroscopy”. Analytica Chimica Acta 502 (2): 141-147. doi:10.1016/j.aca.2003.10.014.
- ^ H. M. Pickett E. A. Cohen B. J. Drouin J. C. Pearson (2003年). “Submillimeter, Millimeter, and Microwave Spectral Line Catalog” (pdf). NASA/JPL. 2011年8月29日閲覧。
- ^ a b c Detlef Schröder; Christoph Heinemann, Helmut Schwarz, Jeremy N. Harvey, Suresh Dua, Stephen J. Blanksby, John H. Bowie (1998). “Ethylenedione: An Intrinsically Short-Lived Molecule”. Chemistry - A European Journal 4 (12): 2550–2557. doi:10.1002/(SICI)1521-3765(19981204)4:12<2550::AID-CHEM2550>3.0.CO;2-E.
- ^ a b Errol Lewars(1996), Polymers and oligomers of carbon dioxide: ab initio and semiempirical calculations. Journal of Molecular Structure: THEOCHEM, Volume 363, Number 1, pp. 1–15
- ^ Shirel Matthew L., Pulay Peter (1999). “Stability of Novel Oxo- and Chloro-Substituted Trioxanes”. J. Am. Chem. Soc. 121 (37): 8544–8548. doi:10.1021/ja984451j.
- ^ a b c Haijun Jiao and Hai-Shun Wu (2003). “Are Neutral Oxocarbons Stable?”. J. Org. Chem. 68: 1475-1479. doi:10.1021/jo026243m.
- ^ a b Günter Maier and Hans Peter Reisenauer (2001). “Carbenes in Matrices: Specrospcopy, Structure, and Photochemical Behavior”. In Udo H. Brinker (ed.). Advances in carbene chemistry. Elsevier. pp. 135. ISBN 9780444508928
- ^ a b W. Kutzelnigg (2002). Einführung in die Theoretische Chemie. Wiley-VCH. ISBN 3-527-30609-9
- ^ Günther Maier, Hans Peter Reisenauer, Heinz Balli, Willy Brandt, Rudolf Janoschek (1990). “C4O2 (1,2,3-Butatriene-1,4-dione), the First Dioxide of Carbon with an Even Number of C Atoms”. Angew. Chem. Int. Ed. 29 (8): 905–908. doi:10.1002/anie.199009051.
- ^ Günther Maier, Hans Peter Reisenauer, Ulrich Schäfer, and Heinz Balli (1988). “C5O2 (1,2,3,4-Pentatetraene-1,5-dione), a New Oxide of Carbon”. Angew. Chem. Int. Ed. 27 (4): 566–568. doi:10.1002/anie.198805661.
- ^ a b c Frank W. Eastwood (1997). “Gas Phase Pyrolytic Methods for the Preparation of Carbon-Hydrogen and Carbon-Hydrogen-Oxygen Compounds”. In Yannick Vallée. Gas Phase Reactions in Organic Synthesis. CRC Press. ISBN 9789056990817
- ^ Roman Reusch (2005). Absorptionsspektroskopie von langen Kohlenstoff-Kettenmolekülen und deren Oxide in kryogenen Matrizen (Thesis). Ruprecht-Karls-Universität Heidelberg.
- ^ a b Ogata Teruhiko, Tatamitani Yoshio (2008). “The Simplest Linear-Carbon-Chain Growth by Atomic-Carbon Addition and Ring Opening Reactions”. J. Phys. Chem. A 112 (43): 10713–10715. doi:10.1021/jp806725s. PMID 18834097.
- ^ a b c Gunther Seitz, Peter Imming (1992). “Oxocarbons and pseudooxocarbons”. Chem. Rev. 92 (6): 1227–1260. doi:10.1021/cr00014a004.
- ^ Detlef Schröder,; Helmut Schwarz, Suresh Dua, Stephen J. Blanksby and John H. Bowie (May 1999). “Mass spectrometric studies of the oxocarbons CnOn (n = 3–6)”. International Journal of Mass Spectrometry 188 (1–2): 17–25. doi:10.1016/S1387-3806(98)14208-2.
- ^ Richard B. Wyrwas and Caroline Chick Jarrold (2006), Production of C6O6- from Oligomerization of CO on Molybdenum Anions. J. Am. Chem. Soc. volume 128 issue 42, pages 13688–13689. doi:10.1021/ja0643927
- ^ Werner Büchner, E. Weiss (1963) Zur Kenntnis der sogenannten «Alkalicarbonyle» I Die Kristallstruktur des Kalium-acetylendiolats, KOC≡COK. Helvetica Chimica Acta, Volume 46 Issue 4, Pages 1121–1127. doi:10.1002/hlca.19630460404
- ^ David Eggerding and Robert West (1976), Synthesis and Properties of Deltic Acid (Dihydroxycyclopropenone) and the Deltate Ion J. American Chemical Society, volume 98, p, 3641–3644. doi:10.1021/ja00428a043
- ^ Eggerding David, West Robert (1975). “Synthesis of Dihydroxycyclopropenone (Deltic Acid)”. J. American Chemical Society 97 (1): 207–208. doi:10.1021/ja00834a047.
- ^ Cohen Sidney, Lacher John R., Park Joseph D. (1959). “Diketocyclobutanediol”. J. American Chemical Society 81 (13): 3480. doi:10.1021/ja01522a083.
- ^ Leopold Gmelin (1825), Ueber einige merkwürdige, bei der Darstellung des Kaliums nach der Brunner'schen Methode, erhaltene Substanzen. Poggendorfs Annalen der Physik und Chemie, volume 4, p. 31. Online version accessed on 2009-07-08.
- ^ Johann Florian Heller (1837), Die Rhodizonsäure, eine aus den Produkten der Kaliumbereitung gewonnene neue Säure, und ihre chemischen Verhältnisse, Justus Liebigs Annalen der Pharmacie, volume 24, issue 1, pp. 1–16. Online version accessed on 2009-07-08.
- ^ Carl Löwig (1839), Chemie der organischen Verbindungen. F. Schultess, Zürich.
- ^ Haiyan Chen, Michel Armand, Matthieu Courty, Meng Jiang, Clare P. Grey, Franck Dolhem, Jean-Marie Tarascon, and Philippe Poizot (2009), Lithium Salt of Tetrahydroxybenzoquinone: Toward the Development of a Sustainable Li-Ion Battery J. Am. Chem. Soc., 131 (25), pp. 8984–8988 doi:10.1021/ja9024897
- ^ R. West, J. Niu (1969, Non-benzenoid aromatics. Vol. 1. Edited by J. Snyder. Academic Press New York.
- ^ Schleyer, P. v. R.; Najafian, K.; Kiran, B.; Jiao, H. (2000). “Are Oxocarbon Dianions Aromatic?”. J. Org. Chem. 65 (2): 426–431. doi:10.1021/jo991267n. PMID 10813951.
