二酸化硫黄
| 二酸化硫黄 | |
|---|---|

| |

| |

| |
別称
| |
| 識別情報 | |
| CAS登録番号 | 7446-09-5 |
| ChemSpider | 1087 |
| EC番号 | 231-195-2 |
| E番号 | E220 (防腐剤) |
| 国連/北米番号 | 1079, 2037 |
| RTECS番号 | WS4550000 |
| |
| |
| 特性 | |
| 化学式 | SO2 |
| モル質量 | 64.07 g mol-1 |
| 外観 | 無色気体 |
| 密度 | |
| 融点 |
-72.4 ℃ (200.75 K)[要出典] |
| 沸点 |
-10 ℃ (263 K)[1] |
| 水への溶解度 | 9.4 g/100 mL (25 ℃) |
| 蒸気圧 |
|
| 酸解離定数 pKa | 1.81 |
| 構造 | |
| 分子の形 | 折れ線形(O-S-O 結合角は120度)[2] |
| 双極子モーメント | 1.63 D |
| 危険性 | |
| GHSピクトグラム |  
|
| GHSシグナルワード | 警告(WARNING) |
| Hフレーズ | H314, H331 |
| Pフレーズ | P260, P261, P264, P271, P280, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P311, P321, P363, P403+233 |
| NFPA 704 | |
| 引火点 | 不燃性 |
| 関連する物質 | |
| 関連物質 | |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
二酸化硫黄(にさんかいおう、英: sulfur dioxide)は、化学式SO2の無機化合物である。常温では刺激臭を有する気体。気体は別名亜硫酸ガス[3]。化石燃料の燃焼などで大量に排出される硫黄酸化物の一種であり、きちんとした処理を行わない排出ガスは大気汚染や環境問題の一因となる。
二酸化硫黄は火山活動や工業活動により産出される。石炭や石油は多量の硫黄化合物を含んでおり、この硫黄化合物が燃焼することで発生する。また、火山活動でも発生する。二酸化硫黄は二酸化窒素などの存在下で酸化され硫酸となり、酸性雨の原因となる[4]。空気よりも重い。
合成
[編集]二酸化硫黄は硫黄の完全燃焼により発生する。
硫化水素や他の有機硫黄化合物の燃焼においても似たような反応が進行し、二酸化硫黄が発生する。
黄鉄鉱や閃亜鉛鉱、辰砂鉱石などの硫化鉱の加熱によっても発生する。
セメント製造の際には、無水硫酸カルシウムをコークスと加熱しケイ酸カルシウムを生産するが、二酸化硫黄が副生成物として発生する。
熱濃硫酸と銅とを反応させると、二酸化硫黄を発生させることができる。
この他にもチオ硫酸ナトリウムと酸の反応、亜硫酸ナトリウムと硫酸の反応、亜硫酸水素ナトリウムの熱分解などによっても発生する。
反応
[編集]二酸化窒素との酸化還元反応により、一酸化窒素と三酸化硫黄が生成する。
構造
[編集]
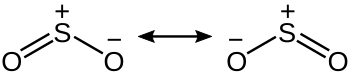
二酸化硫黄はC2v対称の折れ線形構造である。電子に着目すると、硫黄原子の形式酸化数は+4、電荷は0で、5つの電子対を持っている。分子軌道法の点から見ると多くの電子対が結合に関与しており、典型的な超原子価化合物であると言われていたが、実際にはオゾン類似の比較的単純な結合構造であることが判明している。
硫黄酸化物の一酸化硫黄と二酸化硫黄のS-O結合長は、一酸化硫黄SO (148.1 pm)、二酸化硫黄SO2 (143.1 pm) とOの数が増えるにつれて短くなっているが、酸素の同素体の二酸素とオゾンのO-O結合長は、二酸素O2 (120.7 pm)、オゾンO3 (127.8 pm) と長くなっている。さらに、結合解離エネルギーが一酸化硫黄と二酸化硫黄ではSO (524 kJ mol-1)、SO2 (548 kJ mol-1) と大きくなっているのに対し、二酸素とオゾンではO2 (490 kJ mol-1)、O3 (297 kJ mol-1) と小さくなっている。これに関しては、オゾンの各O-O結合が1.5重結合[5]であるのに対し、二酸化硫黄の場合はd軌道の混成による超原子価構造によりS=O二重結合となっている証拠であると説明された時代もあった(現在でもその誤った説明がなされている書籍などもある)。しかしながら硫黄を含む超原子価化合物(と呼ばれていた分子)の場合、理論計算(自然結合軌道を用いる)ではd軌道の結合への寄与は無視出来る程度に小さいことが少なくとも1980年代には判明しており[6][7][8][9][10]、この解釈が誤りなのは明らかである。つまり、硫黄原子の3d軌道は結合に関与するにはエネルギー的に高すぎであり[11]、2本のS-O σ結合とO-S-O鎖を繋ぐ三中心四電子π結合からなるルイス構造が最適な描写である(この結果S-O結合の結合次数は1.5となる)[5]。近年の実験により、二酸化硫黄のS-O結合はオゾンと同じように1.5重結合であるが、電気陰性度の違いにより硫黄原子が+2価、酸素原子が-1に近くなる事による両者の間のイオン結合的な力が働き、これが加算されることで2重結合なみの結合エネルギーとなっている事が判明している[12][13][14]。
用途
[編集]二酸化硫黄には抗菌作用があるため、食品添加物として酒やドライフルーツの保存料、漂白剤、酸化防止剤に使われている。腐敗を防ぐためというより、見た目を保つために用いられることが多い。ドライフルーツは独特の風味を持つが、二酸化硫黄もその一因となっている。ワイン製造にも重要な役割を果たしており、ワイン中にもppm単位で存在している。抗菌剤や酸化防止剤の役割を果たし、雑菌の繁殖や酸化を防ぎ、酸性度を一定に保つ手助けをしている。
二酸化硫黄は還元剤としても用いられる。水の存在下で還元的な脱色作用を示すため、紙や衣服などの漂白剤として用いられる。しかし空気中の酸素により再酸化が起こるため、この漂白作用は長くは続かない。
二酸化硫黄は硫酸の生産にも用いられる。この場合二酸化硫黄の酸化により三酸化硫黄を合成し、ここから硫酸が合成される。この方法は接触法として知られている。
クロード・リブ (Claude Ribbe) の『ナポレオンの犯罪 The Crime of Napoleon』によると、二酸化硫黄は19世紀の初めまで、フランス皇帝によりハイチの奴隷の反乱の鎮圧に用いられていた。
二酸化硫黄は肺の伸縮に関する受容体の信号を止め、ヘーリング・ブロイエル反射を止める。
フロンの開発に先立ち、二酸化硫黄は家庭用冷蔵庫の冷媒に用いられていた。
昆虫の標本を作る際、酢酸エチルを使うと体毛がぬれたり体色が変化したり油が染みでたりすることのある昆虫の殺虫剤として用いられている。
排出量
[編集]人為的なもの
[編集]アメリカ合衆国のEPAが2002年に報告したデータ[15]によると、アメリカ合衆国の二酸化硫黄排出量の変遷は以下のようになっている(単位:S/T)。
| 年 | 排出量 |
|---|---|
| 1970年 | 31,161 |
| 1980年 | 25,905 |
| 1990年 | 23,678 |
| 1996年 | 18,859 |
| 1997年 | 19,363 |
| 1998年 | 19,491 |
| 1999年 | 18,867 |
主にEPAの酸性雨対策プログラムの主導により、アメリカ合衆国の二酸化硫黄排出量は1983年から2002年の間で約33%減少した。これは排気ガスの脱硫技術が進み、硫黄を含む燃料を燃焼させても硫黄酸化物を回収できるようになったためである。特に酸化カルシウムは二酸化硫黄と反応し、亜硫酸カルシウムになることで二酸化硫黄を吸着する。
2006年現在、中華人民共和国が世界で最も二酸化硫黄を排出している国である。2005年の排出量は2549万トンであった。この排出量を2000年のものと比較すると約27%増加しており、アメリカ合衆国の1980年の排出量に相当する。
自然発生的なもの
[編集]火山自体や噴火の規模にもよるが、火口などからは相当量の二酸化硫黄が放出される。日本の桜島は、2011年12月に125回も爆発的な噴火を記録する活発な時期を迎えていたが、この際に観測された平均放出量は日量1,800tから2,900tと推計されている[16]。
1991年に発生したフィリピンのピナツボ山の噴火では1500万から2千万トンの二酸化硫黄が放出された。成層圏に達した二酸化硫黄は硫酸エアロゾルを形成し、長期間にわたり地表の日射量を減少させ穀物の収穫量に影響を与える(例:夏のない年、1993年米騒動)こともある。影響が出始める量は500万トン以上と推計されている[17]。
水への溶解度の温度依存性
[編集]| 温度 | 溶解度 |
|---|---|
| 0 ℃ | 22 g/100ml |
| 10 ℃ | 15 g/100ml |
| 20 ℃ | 11 g/100ml |
| 25 ℃ | 9.4 g/100ml |
| 30 ℃ | 8 g/100ml |
| 40 ℃ | 6.5 g/100ml |
| 50 ℃ | 5 g/100ml |
| 60 ℃ | 4 g/100ml |
| 70 ℃ | 3.5 g/100ml |
| 80 ℃ | 3.4 g/100ml |
| 90 ℃ | 3.5 g/100ml |
| 100 ℃ | 3.7 g/100ml |
毒性
[編集]二酸化硫黄は呼吸器を刺激し、せき、気管支喘息、気管支炎などの障害を引き起こす[18]。
0.5 ppm 以上でにおいを感じ、30-40 ppm 以上で呼吸困難を引き起こし、100 ppm の濃度下に50〜70分以上留まると危険。400 ppm 以上の場合、数分で生命に危険が及ぶ。500 ppm を超えると嗅覚が冒され、むしろ臭気を感じなくなる。高濃度の地域に短時間いるよりも、低濃度地域に長時間いる場合の被害のほうが多い。
代表的な例として、日本における第二次世界大戦後の四大公害事件とされ、1961年頃より発生した四日市ぜんそくがあげられる。1960〜70年代に高濃度の汚染を日本各地に引き起こしたが、工場等の固定発生源や石油の使用による発生も脱硫装置により対策が進められた結果、汚染が改善された。また足尾銅山鉱毒事件も有名である。海外では1952年に数週間で一万人以上が死亡したロンドンスモッグがある。
19世紀半ばのクリミア戦争ではセバストーポリの戦いでイギリス軍が化学兵器として使用したのではないかとも言われている。
2007年現在、日本では二酸化硫黄の環境基準は1時間値の1日平均が 0.04 ppm 以下であり、かつ1時間値が 0.1 ppm 以下であることとされている。
参考文献
[編集]- ^ a b “3.2 Properties of inorganic compounds ; Part 4: Silicon - Zirconium” (英語). Kaye and Laby Online (based on 16th edition (published 1995)). イギリス国立物理学研究所 (1995年). 2017年6月20日時点のオリジナルよりアーカイブ。2022年1月18日閲覧。
- ^ Table of Geometries based on VSEPR
- ^ "二酸化イオウ". 岩波理化学辞典 (第3版増補版第3刷 ed.). 岩波書店. 5 November 1982. p. 974.
- ^ Dr. Mike Thompson, Winchester College, UK http://www.chm.bris.ac.uk/motm/so2/so2h.htm
- ^ a b グリーンウッド, ノーマン; アーンショウ, アラン (1997). Chemistry of the Elements (英語) (2nd ed.). バターワース=ハイネマン. ISBN 978-0-08-037941-8。 p. 700
- ^ Kutzelnigg, W. (1984). “Chemical Bonding in Higher Main Group Elements”. Angew. Chem. Int. Ed. 23: 272-295. doi:10.1002/anie.198402721.
- ^ Reed, A. E.; Weinhold, F. (1986). “On the role of d orbitals in sulfur hexafluoride”. J. Am. Chem. Soc. 108: 3586-3593. doi:10.1021/ja00273a006.
- ^ Mezey, P. G.; Haas, E. C. (1982). “The propagation of basis set error and geometry optimization in ab initio calculations. A statistical analysis of the sulfur d‐orbital problem”. J. Chem. Phys. 77: 870. doi:10.1063/1.443903.
- ^ Gilheany, D. G. (1994). “Ylides, phosphoniumNo d Orbitals but Walsh Diagrams and Maybe Banana Bonds: Chemical Bonding in Phosphines, Phosphine Oxides, and Phosphonium Ylides”. Chem. Rev. 94: 1339-1374. doi:10.1021/cr00029a008.
- ^ Dobado, J. A.; Martinez-Garcia, H.; Molina, J. M.; Sundberg, M. R. (2000). “Chemical Bonding in Hypervalent Molecules Revised. 3. Application of the Atoms in Molecules Theory to Y3X-CH2 (X = N, P, or As; Y = H or F) and H2X-CH2 (X = O, S, or Se) Ylides”. J. Am. Chem. Soc. 122: 1144-1149. doi:10.1021/ja992672z.
- ^ Stefan, T.; Janoschek, R. (2000). “How relevant are S=O and P=O Double Bonds for the Description of the Acid Molecules H2SO3, H2SO4, and H3PO4, respectively?”. J. Mol. Model. 6 (2): 282-288. doi:10.1007/PL00010730.
- ^ Powers, D.; Olson, H. G. (1980). “Determination of S-O bond order in sulfur dioxide and dimethyl sulfite using a low‐energy particle‐accelerator technique”. J. Chem. Phys. 73: 2271. doi:10.1063/1.440376.
- ^ Jürgensen, A.; Cavell, R. G. (2000). “A comparison of the oxygen 1s photoabsorption spectra of SO2 and NO2”. Chem. Phys. 257: 123. doi:10.1016/S0301-0104(00)00147-6.
- ^ Grabowsky, S.; Luger, P.; Buschmann, J.; Schneider, T.; Schirmeister, T.; Sobolev, A. N.; Jayatilaka, D. (2012). “The Significance of Ionic Bonding in Sulfur Dioxide: Bond Orders from X-ray Diffraction Data”. Angew. Chem. Int. Ed. 51: 6776-6779. doi:10.1002/anie.201200745.
- ^ “アーカイブされたコピー”. 2008年12月25日時点のオリジナルよりアーカイブ。2008年12月18日閲覧。
- ^ 桜島の火山活動解説資料(平成22年1月)福岡管区気象台火山監視・情報センター,鹿児島地方気象台
- ^ “トンガ噴火は日本に「令和の米騒動」引き起こすか? 米教授が指摘する“圧倒的に少ない”物質とは”. AERA.com (2022年1月20日). 2022年1月24日閲覧。
- ^ 大気中の二酸化硫黄(SO2),浜松市
関連項目
[編集]外部リンク
[編集]- 有毒ガス(お鉢平・有毒温泉)(大雪山物語)
- United States Environmental Protection Agency Sulfur Dioxide page
- International Chemical Safety Card 0074
- IARC Monograph "Sulfur Dioxide and some Sulfites, Bisulfites and Metabisulfites"
- NIOSH Pocket Guide to Chemical Hazards
- Food Intolerance Network - Sulfite factsheet
- Sulfur Dioxide, Molecule of the Month
- 『二酸化硫黄』 - コトバンク












