フェロセン
| フェロセン | |
|---|---|

|
|

| |
bis(η5-cyclopentadienyl)iron(II) | |
別称 フェロセン ビス(シクロペンタジエニル)鉄 | |
| 識別情報 | |
| CAS登録番号 | 102-54-5 |
| PubChem | 11985121 |
| ChEBI | |
| |
| 特性 | |
| 化学式 | C10H10Fe |
| モル質量 | 186.04 g/mol |
| 外観 | 明橙色結晶 |
| 匂い | ショウノウ様 |
| 密度 | 1.49 g/cm3 |
| 融点 |
174 °C |
| 沸点 |
249 °C |
| 水への溶解度 | 不溶 |
| 他の有機溶媒への溶解度 | 可溶 |
| 危険性 | |
| GHSピクトグラム |   
|
| GHSシグナルワード | Warning |
| Hフレーズ | H228, H302, H411 |
| Pフレーズ | P210, P240, P241, P264, P270, P273, P280, P301+312, P330, P370+378, P391, P501[1] |
| NFPA 704 | |
| 関連する物質 | |
| 関連物質 | コバルトセン ニッケロセン クロモセン ビス(ベンゼン)クロム |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
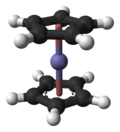
フェロセン (英: ferrocene) は、化学式が Fe(C5H5)2 で表される鉄のシクロペンタジエニル錯体である。水には不溶である。可燃性であり、人体への刺激性が強いので取り扱いには注意を要する。鉄(II)イオンにシクロペンタジエニルアニオンが上下2個配位結合している。このように上下から中央の原子を挟んだ形状の化合物は、サンドイッチ化合物と呼ばれている[2]。
フェロセンは極めて安定な酸化還元特性を示すため、Fe(III)/Fe(II) の酸化還元電位はサイクリック・ボルタンメトリー測定の際に基準として用いられる。
歴史
[編集]
フェロセンは偶然の中から発見された化合物である。1951年に、デュケイン大学の Pauson と Kealy が酸化的カップリングによるフルバレンの合成を目的として臭化シクロペンタジエニルマグネシウムと酸化鉄(III)を反応させたところ、「非常に安定な薄オレンジ色の粉末」が得られることを報告した。この安定性はシクロペンタジエニルの負電荷が主な原因であったが、発見当時は η5 のサンドイッチ構造を取っているとの認識はなされていなかった[3]。
1952年、ロバート・バーンズ・ウッドワードとジェフリー・ウィルキンソンはフェロセンの反応性を検証することで、構造を推定した[4]。同じく1952年にはエルンスト・オットー・フィッシャーがこの2者とは独立に、フェロセンがサンドイッチ構造であると推定すると共に他のメタロセンの合成に着手した[5]。最終的にはNMRスペクトル解析とX線結晶構造解析によりフェロセンの構造が決定された[6][7]。この独特なサンドイッチ構造はdブロック元素と炭化水素とが形成する錯体として非常に面白い研究対象であり、フェロセンの発見は有機金属化学のさきがけとなった。
ミュンヘン大学のエルンスト・オットー・フィッシャーと、インペリアル・カレッジ・ロンドンのジェフリー・ウィルキンソンは有機金属化学に対する貢献が認められ、1973年にノーベル化学賞を共同受賞した。
シクロペンタジエニルナトリウムと無水塩化鉄(II)をエーテル系の溶媒中で反応させることで、より効率的にフェロセンが得られることが判明している。
構造と結合
[編集]5員環内部の炭素–炭素結合の距離は1.40 Å、Fe–C結合の距離は2.04 Åである。X線結晶構造解析(単斜晶系空間群)は、2つのCp環が互い違いのねじれ配座を取っていることを示しているが、気相電子回折[8]と計算研究[9]によって、気相では2つのCp環はエクリプス(重なり)配座を取っていることが明らかにされている。ねじれ配座は結晶充填のために凝集相において最も安定であると考えられている。ねじれ配座の点群はD5d、エクリプス配座の点群はD5hである。
2つのCp環はCp(重心)–Fe–Cp(重心)軸の周りを低障壁で回転する。これは、1Hならびに13C核磁気共鳴分光法を用いたフェロセンの置換誘導体の測定によって観測されている。例えば、メチルフェロセン(CH3C5H4FeC5H5)はC5H5環について一重線を示す[10]。
フェロセンの中心にある鉄原子は、通常+2の酸化状態を取っていることがメスバウアー分光法により示されている。一方、2つのシクロペンタジエニル環はそれぞれ−1の負電荷を帯びているが、これはシクロペンタジエンがアニオンとなることで生じた余剰電子が、5つのπ軌道に分散することでシクロペンタジエン環が6π電子系となり、その結果環が芳香族性を帯び安定性が増すためである。これらのπ電子によりシクロペンタジエニル環は中央の金属と共有結合を形成しており、Fe2+の6つのd電子と併せ、18電子則を満たす錯体を形成している。このためフェロセンは特に安定である。
物理的性質
[編集]フェロセンは空気中で安定なオレンジ色の固体である。対称性が良く分子全体として中性であることから、ベンゼンなどの通常の有機溶媒には可溶であるが、水には不溶である。
フェロセンは通常100 °C程度で昇華する。減圧下で加熱すると容易に昇華する。昇華に関しての、圧力と温度との関連を以下に示す[11]。
| 圧力 (Pa) | 1 | 10 | 100 |
|---|---|---|---|
| 温度 (K) | 298 | 323 | 353 |
化学的性質
[編集]求電子剤との反応性
[編集]フェロセンは芳香族に独特の多くの反応が進行することが知られており、様々な誘導体が合成可能である。最もよく知られている誘導体は、1-置換、1,1'-置換、1,2-置換体である。例えば、フェロセンを塩化アルミニウムと Me2NPCl2 と熱ヘプタン中で反応させると、ジクロロフェロセニルホスフィンが生成する[12]。またフェニルジクロロホスフィンと同様の条件で反応させるとP,P-ジフェロセニル-P-フェニルホスフィンが生成する[13]。アニソールと同様にフェロセンを硫化リンと反応させると、ジチアジフォスフィタンジスルフィドが生成する[14]。
リン酸を触媒とした無水酢酸(または塩化アセチル)によるフリーデル・クラフツ反応は、学生実験にしばしば利用される。
リチオ化
[編集]フェロセンはブチルリチウムなどにより容易に脱プロトン化され、求電子剤である1,1'-ジリチオフェロセンとなる。1,1'-ジリチオフェロセンはセレニウムジエチルジチオカルバメートと反応し、セレニウムと2つのシクロペンタジエニル環が一直線上に並んだフェロセノファンが得られる[15]。フェロセノファンの開環熱重合によりポリ(フェロセニルホスフィン)が得られる[16][17]。
酸化還元特性
[編集]主要な芳香族炭化水素とは異なり、フェロセンは飽和カロメル電極 (SCE) に対し約0.5 Vという低い電位で1電子酸化が進行する。電気化学的に酸化されやすい化合物としては、他に電子豊富なアニリンなどの芳香族アミンやピロール、チオフェンなどの複素環式化合物などが挙げられる。しかしアニリンのようなアミンやチオフェンを酸化するとポリアニリンやポリチオフェンなどのポリマーが生成するが、フェロセンを酸化しても安定なカチオンが生成するだけで重合は起こらない。
シクロペンタジエニル環を化学修飾することで、酸化還元電位を調節することが可能である。カルボン酸などの電子求引基を導入すると電位はアノード側へと移動する。一方メチル基などの電子供与基を導入すると電位はカソード側へと移動する。このため、デカメチルフェロセンはフェロセンより酸化されやすい。またフェロセンは酸化還元電位測定において、非水溶性の内部標準物質としてもしばしば用いられる。
フェロセンは FeCl3 により酸化され、青色のフェロセニウムイオン [Fe(C5H5)2]+ が生成する。このフェロセニウムイオンは [PF6]- 塩として単離することが可能である。フェロセニウム塩はしばしば酸化剤として用いられる。フェロセニウム塩が酸化剤として用いられる理由として、反応の結果生成するフェロセンが化学的に安定であり、容易に単離可能であるという点が挙げられる[18]。
フェロセンとその誘導体の応用
[編集]フェロセン自体の応用利用はそれほど多くない。しかしながら上述のように合成法が確立されているため、非常に数多くの誘導体が合成され応用が検討されている。
燃料への添加
[編集]フェロセンとその誘導体はアンチノック剤としてガソリンに添加されることがあるが、以前用いられていたテトラエチル鉛より安全だと考えられている[19]。イギリスでは Halford で購入可能であるが、このフェロセン添加ガソリンは無鉛ガソリン車だけでなく、有鉛ガソリンの利用を前提とした古い車のエンジンに対しても利用可能である[20]。しかしながら、フェロセン由来の鉄の沈殿が生成することがあり、これが導電性のスパークプラグ表面に付着すると故障の原因になる。ディーゼル車では、すすの減少に効果がある。
医療
[編集]ある種のフェロセニウム塩は抗がん剤としての利用が検討されており、タモキシフェンのフェロセニウム塩が試験的に研究されている[21]。この薬剤では、タモキシフェンをエストロゲン結合部位と結合させ、細胞毒性を発現させることを狙っている[22][23][24]。
物質化学
[編集]有機化学反応によりフェロセンを修飾し、ビニルフェロセンが合成可能である。このビニルフェロセンはアルデヒド、ホスホニウム塩、水酸化ナトリウムを用いたウィッティヒ反応により合成される[25]。ビニルフェロセンからはポリマーが合成可能である。
配位子
[編集]キラルなフェロセニルホスフィン類は遷移金属が触媒する反応で配位子として用いられることがある。医薬品や農薬の合成にも用いられている。1,1'-ビス(ジフェニルホスフィノ)フェロセン (dppf) は2つのホスフィン部位を持っており,パラジウムカップリング反応の配位子としてよく用いられる。
その他
[編集]珍しい例としては、分子機械の部品に利用されたことがある。フェロセンの二つのシクロペンタジエニル環が容易に回転することを利用し、1,1',3,3'-置換フェロセンを中心に持つ「ハサミ型分子」 (Muraoka, T., Kinbara, K. & Aida, T., "Mechanical twisting of a guest by a photoresponsive host", Nature 440, 512-515 (2006). (閲覧には購読が必要))の回転軸として利用されている。
誘導体
[編集]鉄の代わりに他の金属を用いたり、シクロペンタジエンの代わりに他の炭化水素を用いることで様々な誘導体が合成可能である。例えばインデンをシクロペンタジエンの代わりに用いると、ビスベンゾフェロセンが得られる[26]。
また Fe(η5-C5H5)(CO)2 (η1-ピロール) をシクロヘキサン中で加熱することにより、フェロセンの炭素が1つ窒素に置換されたアザフェロセン Fe(η5-C5H5)(η5-C4H4N) が得られる[27]。この化合物をベンゼン中で還流すると、フェロセンへと変換される[28]。
置換が容易なため、構造的に興味が持たれる各種誘導体が合成されている。例として、シクロペンタジエンに5つのフェロセンが結合したペンタフェロセニルシクロペンタジエニル環などが挙げられる[29]。
脚注
[編集]- ^ Ferrocene 1GHS Classification
- ^ R. Dagani (3 December 2001). "Fifty Years of Ferrocene Chemistry" (要登録). Chemical and Engineering News, 79 (49): 37-38. 記事
- ^ a b Kealy, T. J.; Pauson, P. L. (1951). “A New Type of Organo-Iron Compound”. Nature 168 (4285): 1039. Bibcode: 1951Natur.168.1039K. doi:10.1038/1681039b0.
- ^ G. Wilkinson, M. Rosenblum, M. C. Whiting, R. B. Woodward (1952). "The Structure of Iron Bis-Cyclopentadienyl". Journal of the American Chemical Society 74: 2125 - 2126. DOI:10.1021/ja01128a527
- ^ E. O. Fischer, W. Pfab (1952). "Zur Kristallstruktur der Di-Cyclopentadienyl-Verbindungen des zweiwertigen Eisens, Kobalts und Nickels". Z. Naturforsch. B 7: 377 - 379.
- ^ J. Dunitz, L. Orgel, A. Rich (1956). "The crystal structure of ferrocene". Acta Crystallographica 9: 373–5. DOI:10.1107/S0365110X56001091
- ^ Pierre Laszlo, Roald Hoffmann, (2000). "Ferrocene: Ironclad History or Rashomon Tale?". Angewandte Chemie International Edition 39: 123 - 124. 記事
- ^ Haaland, A.; Nilsson, J. E. (1968). “The Determination of Barriers to Internal Rotation by Means of Electron Diffraction. Ferrocene and Ruthenocene”. Acta Chem. Scand. 22: 2653–2670. doi:10.3891/acta.chem.scand.22-2653.
- ^ Coriani, Sonia; Haaland, Arne; Helgaker, Trygve; Jørgensen, Poul (2006). “The Equilibrium Structure of Ferrocene”. ChemPhysChem 7: 245–249. doi:10.1002/cphc.200500339.
- ^ Abel, E. W.; Long, N. J.; Orrell, K. G.; Osborne, A. G.; Sik, V. (1991). “Dynamic NMR studies of ring rotation in substituted ferrocenes and ruthenocenes”. J. Org. Chem. 403: 195–208. doi:10.1016/0022-328X(91)83100-I.
- ^ Monte, M. J. S.; Santos, L. M. N. B. F.; Fulem, M.; Fonseca, J. M. S. & Sousa, C. A. D., (2006). "New static apparatus and vapor pressure of reference materials: Naphthalene, benzoic acid, benzophenone, and ferrocene", J. Chem. Eng. Data, 51, 757-766
- ^ G.R. Knox, P.L. Pauson and D. Willison (1992). "Ferrocene derivatives. 27. Ferrocenyldimethylphosphine". Organometallics 11 (8): 2930 - 2933. DOI:10.1021/om00044a038.
- ^ G.P. Sollott, H.E. Mertwoy, S. Portnoy and J.L. Snead, J. Org. Chem., 1963, 28, 1090 - 1092. DOI:10.1021/jo01039a055.
- ^ M.R.StJ. Foreman, A.M.Z. Slawin and J.D. Woollins, J. Chem. Soc., Dalton Trans., 1996, 3653 - 3658. DOI:10.1039/DT9960003653.
- ^ Ron Rulkens, Derek P. Gates, David Balaishis, John K. Pudelski, Douglas F. McIntosh, Alan J. Lough, and Ian Manners, J. Am. Chem. Soc., 1997, 119, 10976. DOI:10.1021/ja972043u
- ^ Paloma Gómez-Elipe, Rui Resendes, Peter M. Macdonald, and Ian Manners, J. Am. Chem. Soc., 1998, 120, 8348. DOI:10.1021/ja981429h.
- ^ Timothy J. Peckham, Jason A. Massey, Charles H. Honeyman, and Ian Manners, Macromolecules, 1999, 32, 2830. DOI:10.1021/ma981329w
- ^ N. G. Connelly, W. E. Geiger (1996). "Chemical Redox Agents for Organometallic Chemistry". Chemical Reviews 96: 877-910. DOI:10.1021/cr940053x
- ^ Application of fuel additives (International Conference on Automotive Technology, Istanbul, 26/11/2004) Archived 2006年5月5日, at the Wayback Machine.
- ^ アメリカ合衆国特許第 4,104,036号
- ^ Top S; Vessières A; Leclercq G; Quivy J; Tang J; Vaissermann J; Huché M; Jaouen G, (2003). Chemistry 9(21): 5223-36 記事
- ^ Ron Dagani (16 Sep 2002). "The Bio Side of Organometallics". Chemical and Engineering News 80 (37): 23-29. 記事.
- ^ S. Top, B. Dauer, J. Vaissermann and G. Jaouen (1997). "Facile route to ferrocifen, 1-[4-(2-dimethylaminoethoxy)]-1-(phenyl-2-ferrocenyl-but-1-ene), first organometallic analogue of tamoxifen, by the McMurry reaction". Journal of Organometallic Chemistry 541: 355-361. DOI:10.1016/S0022-328X(97)00086-7.
- ^ S. Top, A. Vessières, G. Leclercq, J. Quivy, J. Tang, J. Vaissermann, M. Huché and G. Jaouen (2003). "Synthesis, Biochemical Properties and Molecular Modelling Studies of Organometallic Specific Estrogen Receptor Modulators (SERMs), the Ferrocifens and Hydroxyferrocifens: Evidence for an Antiproliferative Effect of Hydroxyferrocifens on both Hormone-Dependent and Hormone-Independent Breast Cancer Cell Lines". Chemistry, a European Journal 9: 5223-5236. DOI:10.1002/chem.200305024.
- ^ Liu, Wan-yi; Xu, Qi-hai; Ma, Yong-xiang; Liang, Yong-min; Dong, Ning-li; Guan, De-peng,J. Organomet. Chem., 2001, 625, 128 - 132 DOI:10.1016/S0022-328X(00)00927-X
- ^ B.R. Waldbaum and R.C. Kerber, Inorg. Chim. Acta, 1999, 291, 109 - 126. DOI:/10.1016/S0020-1693(99)00123-1
- ^ J. Zakrzewski and C. Gianotti, J. Organomet. Chem., 1990, 388, 175 - 180. DOI:10.1016/0022-328X(90)85359-7
- ^ A. Efraty, N. Jubran and A. Goldman, Inorg. Chem., 1982, 21, 868 - 873. DOI:10.1021/ic00133a006
- ^ Y. Yu, A.D. Bond, P. W. Leonard, K. P. C. Vollhardt, G. D. Whitener (2006). "Syntheses, Structures, and Reactivity of Radial Oligocyclopentadienyl Metal Complexes: Penta(ferrocenyl)cyclopentadienyl and Congeners". Angewandte Chemie International Edition 45 (11): 1794 - 1799. DOI:10.1002/anie.200504047.
参考文献
[編集]- フェロセンの発見(構造は間違っている)
- Kealy, T. J., Pauson, P. L. (1951). "A New Type of Organo-iron Compound". Nature 168: 1039-40. DOI:10.1038/1681039b0.
- Miller, S. A., Tebboth, J. A., Tremaine, J. F. (1952). "114. Dicyclopentadienyliron". Journal of the Chemical Society: 632-635. DOI:10.1039/JR9520000632
- 正確な構造の報告
- Wilkinson, G., Rosenblum, M., Whiting, M. C., Woodward, R. B. (1952). "The Structure of Iron Bis-Cyclopentadienyl". Journal of the American Chemical Society 74: 2125-2126. DOI:10.1021/ja01128a527.
- Fischer, E. O., Pfab, W. (1952). "Cyclopentadien-Metallkomplexe, ein neuer typ metallorganischer Verbindungen". Zeitschrift für Naturforschung B, 7: 377-379.
- その他
- Dunitz, J. D., Orgel, L. E. (1953). "Bis-Cyclopentadienyl - A Molecular Sandwich". Nature 171: 121-122. DOI:10.1038/171121a0
- Pauson, P. L. (2001). "Ferrocene-how it all began". Journal of Organometallic Chemistry: 637-639. DOI:10.1016/S0022-328X(01)01126-3.
- Gerard Jaouen (ed.) (2006). Bioorganometallics: Biomolecules, Labeling, Medicine. Weinheim: Wiley-VCH. ISBN 978-3-527-30990-0.(生体内におけるフェロセンおよびその誘導体の役割について論じている)
外部リンク
[編集]- 国際化学物質安全性カード フェロセン (ICSC:1512) 日本語版(国立医薬品食品衛生研究所による), 英語版

