n-ブチルリチウム
| n-ブチルリチウム | |
|---|---|
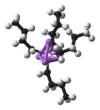 n-ブチルリチウム4量体
|
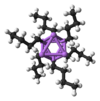 n-ブチルリチウム6量体
|
 n-ブチルリチウム6量体中のブチル基とリチウムとの間の非局在化結合
| |
butyllithium, tetra-μ3-butyl-tetralithium | |
別称 NBL, BuLi, 1-lithiobutane | |
| 識別情報 | |
| CAS登録番号 | 109-72-8 |
| PubChem | 61028 |
| ChemSpider | 10254339 |
| J-GLOBAL ID | 200907048859068700 |
| |
| |
| 特性 | |
| 化学式 | C4H9Li |
| モル質量 | 64.06 g mol−1 |
| 外観 | 黄褐色の液体 通常は溶液で用いる |
| 密度 | 0.765 g/cm³(液体、25 ℃) |
| 融点 |
−76 °C |
| 沸点 |
分解 |
| 水への溶解度 | 激しく反応する |
| シクロヘキサンへの溶解度 | 可溶 |
| ジエチルエーテルへの溶解度 | 可溶 |
| 酸解離定数 pKa | > 35 |
| 構造 | |
| 分子の形 | 四量体(溶液中) |
| 双極子モーメント | 0.97 D |
| 危険性 | |
| 主な危険性 | 空気中で発火 腐食性のLiOHへと分解 |
| 関連する物質 | |
| 関連する有機リチウム化合物 | sec-ブチルリチウム tert-ブチルリチウム ヘキシルリチウム メチルリチウム |
| 関連物質 | 水酸化リチウム |
| 出典 | |
| Encyclopedia of Reagents for Organic Synthesis; Vol. 1, pp. 899–907. | |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
n-ブチルリチウム(英: n-butyllithium)は有機合成上で重要な有機リチウム化合物である。n-BuLiと略記される。ポリブタジエンやスチレン・ブタジエンゴムなどを得るアニオン重合の開始剤として広く用いられている。有機合成化学においては強塩基、プロトン引き抜き剤やリチオ化剤として広く用いられている。n-ブチルリチウムを含む有機リチウム化合物全体の、世界での年間生産量及び消費量は約1,800トンと見積もられている。
性質
[編集]
ブチルリチウム及びその溶液は発火性を持つため、空気へ晒さないよう注意しなければならない。水と激しく反応してブタンと水酸化リチウムを与える。
二酸化炭素 () とも反応し、吉草酸リチウムを生成する。
炭素とリチウムの電気陰性度が大きく異なるため、炭素−リチウム結合は非常に大きく分極しているが、イオン性結合ではない(電気陰性度: C = 2.55, Li = 0.98)。電荷分離の正確な状態は知られていないが、55–90% と推測されている。それにもかかわらず、ブチルリチウムはしばしばブチルアニオンとリチウムイオンのように振る舞うと考えられることがある(下図参照)。
しかしながらこのモデルは、n-BuLiがイオン性ではないという点で厳密には正しくない。固体状態ではもちろん、溶液中においてもn-BuLiは炭素−リチウム結合を持つ他の有機リチウム化合物と同じようにクラスターを形成している。n-BuLiの場合、ジエチルエーテル中では4量体を、シクロヘキサン中では6量体を形成している。炭素−リチウム相互作用は2中心2電子結合ではない。4量体クラスターではリチウムとCH2Rが立方体の頂点に交互に配置されている。等価な表現としてLi4と[CH2R]4とがそれぞれ四面体をなし互いに交差しているとも表せる。このような固体状態での構造は、非極性溶媒中でも維持されている。4量体リチウムクラスターの周りにある電子不足の多くの炭素鎖は、4中心2電子結合によりリチウムを安定化している。リチウムが非占有軌道を使って多くの炭素鎖に配位するという性質と同じく、n-BuLiは溶液中で他のσドナーに配位可能である。
生産
[編集]標準的な生産法は臭化ブチルや塩化ブチルと金属リチウムとを反応させるというものである。
ただし X = Cl, Br
この反応は金属リチウム中に 1% のナトリウムを入れておくことで加速される。この反応ではベンゼン、シクロヘキサン、ジエチルエーテルなどが溶媒として用いられる。臭化ブチルが前駆体となった場合、反応物は臭化リチウムとブチルリチウムが混在してクラスターを形成した、一様な溶液となる。一方塩化リチウムとの錯形成能は比較的弱いため、塩化ブチルとリチウムの反応では塩化リチウムの沈殿が生成する。
反応
[編集]ハロゲン - リチウム交換反応
[編集]n-BuLiはハロゲン化アルキルやハロゲン化アリールなどの有機ハロゲン化物、特に臭化物と交換反応を起こし、新たな有機リチウム化合物を生成する。
このようにして生成した有機リチウム化合物 (RLi) は通常単離されることなく用いられる。RLiは求核性のある炭素原子を持つこととなる。これらの反応はエーテル系溶媒中、−78 ℃で行われることが多い。
トランスメタル化反応
[編集]似たような反応として、2つの有機金属化合物がその金属を交換するトランスメタル化反応が挙げられる。このような反応の例として多く挙げられるのはリチウムとスズの交換反応である。
ただし Ar: アリール基(芳香族置換基)、Me: メチル基
リチオ化
[編集]n-BuLiの最も特徴的な性質の1つは、その塩基性である。tert-ブチルリチウム (t-BuLi) と sec-ブチルリチウム (s-BuLi) はより強い塩基として用いられる。n-BuLiは、電子の非局在化により共役塩基が多少安定化されている炭化水素の水素原子を引き抜くことができる。アセチレン (H−C≡C−R) やメチルホスフィン (H−CH2PR2)、フェロセン (H−C5H4) などがその例として挙げられる。ブタンの安定性と揮発性から、この脱水素化反応は便利であると言える。n-BuLiの速度論的な塩基性は反応溶媒に依存する。
テトラメチルエチレンジアミン (TMEDA) やDABCOといったリチウムイオンへの配位能を持つ化合物は炭素-リチウム結合を分極させ、リチオ化を促進する。このような添加剤はリチオ化された化合物を単離するのに有用である。有名な例としてジリチオフェロセンが挙げられる。
THFの分解
[編集]テトラヒドロフラン(THF)はブチルリチウムによって分解する。特にTMEDAの存在下では、THFの酸素に隣接する4つのプロトンのうちの一つを引き抜く。この過程は、ブチルリチウムが消費されてブタンになり、逆向きの環化付加反応を引き起こしてアセトアルデヒドのエノラートとエチレンを与える。そのため、THF溶液中でのn-ブチルリチウムの反応はドライアイス/アセトンの冷却バスで-78 ℃のような極低温で行うことが多いが、0℃や-20℃で行うことも可能である。
アルデヒドやケトンの生成
[編集]n-BuLiを含む有機リチウム化合物は特定のアルデヒドやケトンの生成にも用いられる。1つの例として、有機リチウム化合物と2置換アミドとの反応が挙げられる。
アルケン合成
[編集]有機リチウム化合物はアルケンの生成にも用いられる。加熱するとβ水素脱離を起こし、アルケンと水素化リチウムを生成する。
用途
[編集]ブチルリチウムの最大の用途は上述のようにアニオン重合における重合開始剤である。特に近年はエコタイヤ向けの溶液重合スチレン-ブタジエンゴム(Solution styrene-butadiene rubber、S-SBR)向けの重合開始剤としての需要が増加している[1]。
プロトン引き抜き剤として医薬や農薬、また様々なファインケミカル製品の製造に利用されている。一般的には極低温反応装置が必要であるが、近年はマイクロリアクターの利用により極低温を回避した反応例も増加している。
最近増加している用途は半導体ケミカルである。モリブデンアミド、ジルコニウムアミドやハフニウムアミドなどALD (原子層堆積)用の金属モノマーがHigh-K材料の高比誘電率膜の素材として用いられており、これらの合成にブチルリチウムが使用されている。
安全性
[編集]ブチルリチウムは空気と水に非常に敏感であり、空気に晒すとしばしば発火する。取り扱う際には不活性ガス下で、活性を落とさないように保存、取扱を行わなければいけない。
参考文献
[編集]- ChemExper Chemical Directory
- 岡野一哉 (2016). “ブチルリチウム”. 有機合成化学協会誌 74 (4): 374–377. https://doi.org/10.5059/yukigoseikyokaishi.74.374
- FMC Lithium manufacturer's product sheets
- Environmental Chemistry directory
- Weissenbacher, Anderson, Ishikawa, Organometallics, July 1998, p681.7002, Chemicals Economics Handbook SRI International
- HPV test plan, submitted by FMC Lithium to EPA
- Ovaska, T. V. e-EROS Encyclopedia of Reagents for Organic Synthesis "n-butyllithium." Wiley and sons. 2006. DOI: [1]
- Elschenbroich, C.; Salzer, A. Organometallics: a Concise Introduction 1st ed. 1989: VHC publishers, New York.
- Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements, 2nd ed. 1997: Butterworth-Heinemann, Boston.
- Brandsma, L.; Verkraijsse, H. D. "Preparative Polar Organometallic Chemistry I"; Springer-Verlag: Berlin, 1987.
脚注
[編集]- ^ ”溶液重合ゴムのイノベーション“ https://arc.asahi-kasei.co.jp/report/arc_report/pdf/rs-989.pdf
関連項目
[編集]- sec-ブチルリチウム
- tert-ブチルリチウム
- メチルリチウム
- フェニルリチウム
- グリニャール試薬:有機マグネシウム試薬










