区画モデル (くかくモデル、英 : Compartmental model )は、単純かつ一般的な感染症の数理モデル化 (英語版 ) S 、I 、R という区画は、それぞれS usceptible〈感受性保持者〉、I nfectious〈感染者〉、R ecovered〈免疫保持者〉を表す。個体は感染状態の進行にともなって、区画間を移行する。具体的な区画モデルは、例えばSIRモデル、SIESモデルなどと呼ばれるが、こうしたモデルの名称となるラベルの順番は通常、区画間の移行のパターンを示している。例えば、SEISは、感受性(susceptible)、曝露(exposed)、感染(infectious)、そして再び感受性(susceptible)の順に感染状態が進行することを意味する。
こういったモデルの起源は20世紀初頭であり、1927年のカーマック (英語版 ) マッケンドリック (英語版 ) [ 1]
モデルは(決定論的である)常微分方程式 を用いて実行されることが多いが、確率論的(ランダム)な枠組みを用いることも可能である。確率論的モデルはより現実的ではあるが解析がはるかに複雑である。
モデルは、病気がどのように広がるか、感染者の総数、流行の期間などを予測し、再生産数 などの様々な疫学的パラメータを推定しようとする。このようなモデルは、異なる公衆衛生上の介入 が流行の結果にどのように影響を与えるかを示すことができる。例えば、与えられた集団に限られた数のワクチン を接種するために最も効率的な手法は何かを示すことができる。
SIRモデル は最も単純な区画モデルの1つであり、多くのモデルはこの基本形から派生している。本モデルは3つの区画で構成されている。
S
感受性(s usceptible)個体の数。感受性個体と感染個体が「感染性接触」すると、感受性個体が病気に感染し、感染性区画に移行する。
I
感染(i nfectious)個体数のこと。感染した個体であり、感受性個体を感染させる可能性がある。
R
隔離(r emoved)(免疫のある)個体、または死亡した個体の数。これらは、感染から回復して隔離区画に入った個体、または死亡した個体である。死亡者数は総人口に対して無視できるほどの数であると仮定している。この区画を「回復(r ecovered)」または「抵抗性(r esistant)」と呼ぶこともある。 このモデルは、麻疹 、おたふくかぜ 、風疹 といった、回復が持続的な抵抗性をもたらし、ヒトからヒトへ感染する感染症について合理的に予測可能である[要出典 。
空間SIRモデルシミュレーション。個々のセルは隣接した8つの区画を感染させることができる。 これらの変数(S 、I 、R )は、特定の時間に各区画にいる人の数を表す。感受性個体、感染個体、隔離個体の数が(総人口サイズが一定であっても)時間とともに変化する可能性があることを表すために、正確な数をt(時間)の関数S (t )、I (t )、R (t ) とする。特定の集団における特定の疾患については、これらの関数は、可能性のあるアウトブレイク を予測し、それらを制御下に置くために働くかもしれない[要出典 。
t の変数関数で表わされるように、本モデルは各区画内の数が時間の経過とともに変動するという意味で動的である。この動的な側面の重要性は、1968年にワクチンが導入される前の英国の麻疹のように、感染期間が短い風土病 において最も明白である。このような病気は、感受性保持者数(S(t ))が時間の経過とともに変化するため、何度も流行する傾向がある。伝染病 が流行すると、より多くの感受性保持者が感染区画に入るため、感受性保持者の数が急激に減少し、彼らは感染区画と隔離区画に入ることになる。生まれた子どもが感受性区画に入るなどして、感受性個体の数が回復するまでは、病気が再び流行することはできない。
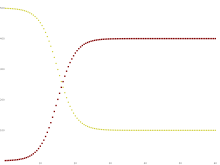
黄色=感受性、えび茶色 =感染、鴨の羽色 =回復 集団の各メンバーは、通常、感受性区画から感染性区画へ、そして隔離区画へと進行する。これは以下のような、箱が異なる区画を表し、矢印が区画間の遷移を表すフロー図として示すことができる。
SIR compartment model モデルを完全に明確に記述するためには、矢印を区画間の遷移速度でラベル付けするべきである。S とI の間では、遷移速度をd(S/N)/dt = -βSI/N2 と仮定する。ここで、N は総人口、βは時間当たりの1人当たりの平均接触数に感受性保持者と感染者の間の接触における病気の伝播確率を乗じたもの、SI/N2 は感受性保持者と感染者の間の接触のうち、感受性保持者が感染することになる接触の割合である(これは数学的には、分子間のランダムな衝突が化学反応を引き起こし、分率が2つの反応物の濃度に比例するという化学の質量作用の法則に似ている)。
I とR の間では、遷移速度は感染個体数に比例すると仮定し、これをγI とする。これは、任意の時間間隔dt において感染個体が回復する確率が単純にγdt であると仮定していることと等価である。ある個体が平均的な時間間隔D で感染している場合、γ = 1/D となる。これは、個人が感染状態にある時間の長さが指数分布 を持つランダム変数であるという仮定と等価である。この「古典的」SIRモデルは、I-R遷移速度のためにより複雑で現実的な分布(例えば、アーラン分布 [ 2]
感染区画からの除去(隔離)がない特別な場合 (γ=0) では、SIRモデルは、すべての個体が最終的に感染するロジスティック 解を持つ非常に単純なSIモデルに簡約される。
[ 編集 ] 伝染病(例えばインフルエンザ )の動態は、出生と死亡の動態よりもはるかに速いことが多いため、単純な区画モデルでは出生と死亡が省略されることが多い。先に述べたいわゆる人口動態(出生および死亡)を考慮しないSIRシステムは以下の一組の常微分方程式で表わすことができる[ 3]
d
S
d
t
=
−
β
I
S
N
,
d
I
d
t
=
β
I
S
N
−
γ
I
,
d
R
d
t
=
γ
I
.
{\displaystyle {\begin{aligned}&{\frac {dS}{dt}}=-{\frac {\beta IS}{N}},\\[6pt]&{\frac {dI}{dt}}={\frac {\beta IS}{N}}-\gamma I,\\[6pt]&{\frac {dR}{dt}}=\gamma I.\end{aligned}}}
上式において、
S
{\displaystyle S}
I
{\displaystyle I}
R
{\displaystyle R}
N
{\displaystyle N}
このモデルは、ウィリアム・オグルヴィ・カーマック とアンダーソン・グレイ・マッケンドリック によって、現在カーマック・マッケンドリック理論 と呼ばれているものの特別な場合として初めて提案されたものであり、マッケンドリックがロナルド・ロス と共に行った研究に続いて行われた。
このシステムは非線形 であるが、陰関数形式でその解析解 を導出することが可能である[ 4] ギレスピー・アルゴリズム (英語版 ) モンテカルロ法 がある。
第1に、
d
S
d
t
+
d
I
d
t
+
d
R
d
t
=
0
{\displaystyle {\frac {dS}{dt}}+{\frac {dI}{dt}}+{\frac {dR}{dt}}=0}
から、
S
(
t
)
+
I
(
t
)
+
R
(
t
)
=
一定
=
N
{\displaystyle S(t)+I(t)+R(t)={\text{一定}}=N}
となる。この式は数学的に人口
N
{\displaystyle N}
ここで留意すべきは、上記の関係は3つの変数のうち2つに関する式だけを調べる必要があることを示唆している点である。
第2に、伝染病クラスの動態が比率
R
0
=
β
γ
,
{\displaystyle R_{0}={\frac {\beta }{\gamma }},}
いわゆる基本再生産数 (基本再生産率とも)に依存することに注目する。この比率は、すべての対象者が感受性である集団における1つの感染からの新規感染(これらの新規感染は二次感染と呼ばれることもある)の予想数として導き出される[ 5] [ 6]
T
c
=
β
−
1
{\displaystyle T_{c}=\beta ^{-1}}
T
r
=
γ
−
1
{\displaystyle T_{r}=\gamma ^{-1}}
T
r
/
T
c
{\displaystyle T_{r}/T_{c}}
1つ目の微分方程式を3つ目の微分方程式で割って、変数を分離 して積分 すると以下のようになる。
S
(
t
)
=
S
(
0
)
e
−
R
0
(
R
(
t
)
−
R
(
0
)
)
/
N
{\displaystyle S(t)=S(0)e^{-R_{0}(R(t)-R(0))/N}}
上式において、
S
(
0
)
{\displaystyle S(0)}
R
(
0
)
{\displaystyle R(0)}
s
0
=
S
(
0
)
/
N
{\displaystyle s_{0}=S(0)/N}
t
→
∞
{\displaystyle t\to \infty }
s
∞
=
S
(
∞
)
/
N
{\displaystyle s_{\infty }=S(\infty )/N}
r
∞
=
R
(
∞
)
/
N
{\displaystyle r_{\infty }=R(\infty )/N}
s
∞
=
1
−
r
∞
=
s
0
e
−
R
0
(
r
∞
−
r
0
)
{\displaystyle s_{\infty }=1-r_{\infty }=s_{0}e^{-R_{0}(r_{\infty }-r_{0})}}
となる(ここで留意すべきは、感染区画はこの極限において空になる点である)。この超越方程式 (英語版 ) ランベルトW 関数 の観点において解を持つ[ 7]
s
∞
=
1
−
r
∞
=
−
R
0
−
1
W
(
−
s
0
R
0
e
−
R
0
(
1
−
r
0
)
)
{\displaystyle s_{\infty }=1-r_{\infty }=-R_{0}^{-1}\,W(-s_{0}R_{0}e^{-R_{0}(1-r_{0})})}
となる。これは、エピデミック の終わりには、
s
0
=
0
{\displaystyle s_{0}=0}
基本再生産数 の役割は極めて重要である。実際、感染者に関する方程式を
d
I
d
t
=
(
R
0
S
N
−
1
)
γ
I
{\displaystyle {\frac {dI}{dt}}=\left(R_{0}{\frac {S}{N}}-1\right)\gamma I}
と書き換えると、もし
R
0
>
N
S
(
0
)
{\displaystyle R_{0}>{\frac {N}{S(0)}}}
ならば、
d
I
d
t
(
0
)
>
0
{\displaystyle {\frac {dI}{dt}}(0)>0}
となる。すなわち、(人口のかなりの割合に達することができる)感染者数の増加を伴う相応のエピデミック なアウトブレイク があるだろう。逆に、もし
R
0
<
N
S
(
0
)
{\displaystyle R_{0}<{\frac {N}{S(0)}}}
ならば、
d
I
d
t
(
0
)
<
0
{\displaystyle {\frac {dI}{dt}}(0)<0}
となる。すなわち、感受性保持者集団の初期の規模とは無関係に、この病気が相応のエピデミックなアウトブレイクを引き起こすことはあり得ない。結果として、基本再生産数が極めて重要であることは明らかである。
ここで留意すべきは、上述したモデルにおいて、関数
F
=
β
I
{\displaystyle F=\beta I}
は、感受性保持者の区画から感染者の区画への遷移速度をモデル化し、これを感染力と呼ぶ。しかしながら、伝染病の多くのグループについては、感染力は感染者の絶対数に依存せず、(一定総人口に対する
N
{\displaystyle N}
F
=
β
I
N
{\displaystyle F=\beta {\frac {I}{N}}}
Capassoと、その後、他の著者らは、伝染過程をより現実的にモデル化するために、非線形感染力を提案した[要出典 。
2014年は、Harkoと共著者らは、SIRモデルの厳密な解析解を導出した[ 4]
S
(
u
)
=
S
(
t
)
{\displaystyle {\mathcal {S}}(u)=S(t)}
t
=
N
β
∫
u
1
d
u
∗
u
∗
I
(
u
∗
)
,
ρ
=
γ
N
β
,
{\displaystyle t={\frac {N}{\beta }}\int _{u}^{1}{\frac {du^{*}}{u^{*}{\mathcal {I}}(u^{*})}},\quad \rho ={\frac {\gamma N}{\beta }},}
に関して、次のような時間パラメータ化に対応する。
S
(
u
)
=
S
(
0
)
u
{\displaystyle {\mathcal {S}}(u)=S(0)u}
I
(
u
)
=
N
−
R
(
u
)
−
S
(
u
)
{\displaystyle {\mathcal {I}}(u)=N-{\mathcal {R}}(u)-{\mathcal {S}}(u)}
R
(
u
)
=
R
(
0
)
−
ρ
ln
(
u
)
{\displaystyle {\mathcal {R}}(u)=R(0)-\rho \ln(u)}
初期条件は
t
=
N
β
∫
u
1
d
u
∗
u
∗
I
(
u
∗
)
,
ρ
=
γ
N
β
{\displaystyle t={\frac {N}{\beta }}\int _{u}^{1}{\frac {du^{*}}{u^{*}{\mathcal {I}}(u^{*})}},\quad \rho ={\frac {\gamma N}{\beta }}}
であり、
u
T
{\displaystyle u_{T}}
I
(
u
T
)
=
0
{\displaystyle {\mathcal {I}}(u_{T})=0}
上述した
R
∞
{\displaystyle R_{\infty }}
u
T
=
e
−
(
R
∞
−
R
(
0
)
)
/
ρ
(
=
S
∞
/
S
(
0
)
{\displaystyle u_{T}=e^{-(R_{\infty }-R(0))/\rho }(=S_{\infty }/S(0)}
S
(
0
)
≠
0
)
{\displaystyle S(0)\neq 0)}
I
∞
=
0
{\displaystyle I_{\infty }=0}
Millerによって見出された等価な解析解[ 8] [ 9]
S
(
t
)
=
S
(
0
)
e
−
ξ
(
t
)
I
(
t
)
=
N
−
S
(
t
)
−
R
(
t
)
R
(
t
)
=
R
(
0
)
+
ρ
ξ
(
t
)
ξ
(
t
)
=
β
N
∫
0
t
I
(
t
∗
)
d
t
∗
{\displaystyle {\begin{aligned}S(t)&=S(0)e^{-\xi (t)}\\[8pt]I(t)&=N-S(t)-R(t)\\[8pt]R(t)&=R(0)+\rho \xi (t)\\[8pt]\xi (t)&={\frac {\beta }{N}}\int _{0}^{t}I(t^{*})\,dt^{*}\end{aligned}}}
が得られる。
ここで、
ξ
(
t
)
{\displaystyle \xi (t)}
t
{\displaystyle t}
e
−
ξ
(
t
)
=
u
{\displaystyle e^{-\xi (t)}=u}
事実上、同じ結果はカーマックとマッケンドリックの最初の論文にも見出すことができる[ 1]
これらの解は、元の微分方程式の右辺のすべての項が
I
{\displaystyle I}
I
{\displaystyle I}
d
/
d
τ
{\displaystyle d/d\tau }
d
τ
=
I
d
t
{\displaystyle d\tau =Idt}
τ
=
∫
I
d
t
{\displaystyle \tau =\int Idt}
d
R
/
d
τ
=
{\displaystyle dR/d\tau =}
τ
{\displaystyle \tau }
R
{\displaystyle R}
ξ
{\displaystyle \xi }
死亡率
μ
{\displaystyle \mu }
Λ
{\displaystyle \Lambda }
d
S
d
t
=
Λ
−
μ
S
−
β
I
S
N
d
I
d
t
=
β
I
S
N
−
γ
I
−
μ
I
d
R
d
t
=
γ
I
−
μ
R
{\displaystyle {\begin{aligned}{\frac {dS}{dt}}&=\Lambda -\mu S-{\frac {\beta IS}{N}}\\[8pt]{\frac {dI}{dt}}&={\frac {\beta IS}{N}}-\gamma I-\mu I\\[8pt]{\frac {dR}{dt}}&=\gamma I-\mu R\end{aligned}}}
であり、このモデルに対する感染症の無い平衡解(disease-free equilibrium: DFE)は
(
S
(
t
)
,
I
(
t
)
,
R
(
t
)
)
=
(
Λ
μ
,
0
,
0
)
{\displaystyle \left(S(t),I(t),R(t)\right)=\left({\frac {\Lambda }{\mu }},0,0\right)}
である。
この場合、基本再生産数
R
0
=
β
Λ
μ
(
μ
+
γ
)
{\displaystyle R_{0}={\frac {\beta \Lambda }{\mu (\mu +\gamma )}}}
を導出することができ、これは閾値特性を有さない。実際、生物学的に意味を持つ初期値から独立に、以下を示すことができる。
R
0
≤
1
⇒
lim
t
→
∞
(
S
(
t
)
,
I
(
t
)
,
R
(
t
)
)
=
DFE
=
(
Λ
μ
,
0
,
0
)
{\displaystyle R_{0}\leq 1\Rightarrow \lim _{t\to \infty }(S(t),I(t),R(t))={\textrm {DFE}}=\left({\frac {\Lambda }{\mu }},0,0\right)}
R
0
>
1
,
I
(
0
)
>
0
⇒
lim
t
→
∞
(
S
(
t
)
,
I
(
t
)
,
R
(
t
)
)
=
EE
=
(
γ
+
μ
β
,
μ
β
(
R
0
−
1
)
,
γ
β
(
R
0
−
1
)
)
{\displaystyle R_{0}>1,I(0)>0\Rightarrow \lim _{t\to \infty }(S(t),I(t),R(t))={\textrm {EE}}=\left({\frac {\gamma +\mu }{\beta }},{\frac {\mu }{\beta }}\left(R_{0}-1\right),{\frac {\gamma }{\beta }}\left(R_{0}-1\right)\right)}
点EEはエンデミック な平衡解(Endemic Equilibrium)と呼ばれる(疫病は根絶されず、母集団に留まる)。ヒューリスティックな論証 (英語版 )
R
0
{\displaystyle R_{0}}
黄色=感受性, えび茶色=感染 風邪 やインフルエンザ などの感染症の中には、長期的な免疫 が得られないものがある。このような感染症は、感染から回復しても免疫力が得られず、再び感受性となる。
SIS区画モデル モデルは
d
S
d
t
=
−
β
S
I
N
+
γ
I
d
I
d
t
=
β
S
I
N
−
γ
I
{\displaystyle {\begin{aligned}{\frac {dS}{dt}}&=-{\frac {\beta SI}{N}}+\gamma I\\[6pt]{\frac {dI}{dt}}&={\frac {\beta SI}{N}}-\gamma I\end{aligned}}}
である。
ここで留意すべきは、総人口をN で表わすと、
d
S
d
t
+
d
I
d
t
=
0
⇒
S
(
t
)
+
I
(
t
)
=
N
{\displaystyle {\frac {dS}{dt}}+{\frac {dI}{dt}}=0\Rightarrow S(t)+I(t)=N}
が成り立つことである。すると、
d
I
d
t
=
(
β
−
γ
)
I
−
β
N
I
2
{\displaystyle {\frac {dI}{dt}}=(\beta -\gamma )I-{\frac {\beta }{N}}I^{2}}
となる。すなわち、感染の動態はロジスティック関数 で支配されている。
∀
I
(
0
)
>
0
{\displaystyle \forall I(0)>0}
β
γ
≤
1
⇒
lim
t
→
+
∞
I
(
t
)
=
0
,
β
γ
>
1
⇒
lim
t
→
+
∞
I
(
t
)
=
(
1
−
γ
β
)
N
{\displaystyle {\begin{aligned}&{\frac {\beta }{\gamma }}\leq 1\Rightarrow \lim _{t\to +\infty }I(t)=0,\\[6pt]&{\frac {\beta }{\gamma }}>1\Rightarrow \lim _{t\to +\infty }I(t)=\left(1-{\frac {\gamma }{\beta }}\right)N\end{aligned}}}
基本再生産数が1よりも大きいような、(変数の変換
I
=
y
−
1
{\displaystyle I=y^{-1}}
[ 10]
I
(
t
)
=
I
∞
1
+
V
e
−
χ
t
{\displaystyle I(t)={\frac {I_{\infty }}{1+Ve^{-\chi t}}}}
上式において、
I
∞
=
(
1
−
γ
/
β
)
N
{\displaystyle I_{\infty }=(1-\gamma /\beta )N}
χ
=
β
−
γ
{\displaystyle \chi =\beta -\gamma }
V
=
I
∞
/
I
0
−
1
{\displaystyle V=I_{\infty }/I_{0}-1}
S
(
t
)
=
N
−
I
(
t
)
{\displaystyle S(t)=N-I(t)}
特殊な場合として、
γ
=
0
{\displaystyle \gamma =0}
R
=
0
{\displaystyle R=0}
[ 11]
S
=
N
−
I
{\displaystyle S=N-I}
d
I
d
t
∝
I
⋅
(
N
−
I
)
.
{\displaystyle {\frac {dI}{dt}}\propto I\cdot (N-I).}
と簡約される。
長期的には、このモデルでは、すべての個体が感染することになる。
SIRDモデルの模式図。初期値
S
(
0
)
=
997
,
I
(
0
)
=
3
,
R
(
0
)
=
0
{\displaystyle S(0)=997,I(0)=3,R(0)=0}
β
=
0.4
{\displaystyle \beta =0.4}
γ
=
0.035
{\displaystyle \gamma =0.035}
μ
=
0.005
{\displaystyle \mu =0.005}
SIRDモデルのアニメーション。初期値
S
(
0
)
=
997
,
I
(
0
)
=
3
,
R
(
0
)
=
0
{\textstyle S(0)=997,I(0)=3,R(0)=0}
β
=
0.5
{\textstyle \beta =0.5}
γ
=
0.035
{\textstyle \gamma =0.035}
μ
=
0.005
{\textstyle \mu =0.005}
社会距離拡大戦略 (ソーシャル・ディスタンシング)」など)によって感染率を下げる(「カーブを平らにする」としばしば言われる)ことしかできない。このアニメーションは、感染率を76%減少させた場合(
β
=
0.5
{\textstyle \beta =0.5}
β
=
0.12
{\textstyle \beta =0.12}
「感受性-感染-回復-死亡モデル」(Susceptible-Infectious-Recovered-Deceased-Model)は、「回復」(具体的には、病気を生き延びて免疫を得た個体を意味する)と「死亡」を区別する[ 12]
d
S
d
t
=
−
β
I
S
N
,
d
I
d
t
=
β
I
S
N
−
γ
I
−
μ
I
,
d
R
d
t
=
γ
I
,
d
D
d
t
=
μ
I
,
{\displaystyle {\begin{aligned}&{\frac {dS}{dt}}=-{\frac {\beta IS}{N}},\\[6pt]&{\frac {dI}{dt}}={\frac {\beta IS}{N}}-\gamma I-\mu I,\\[6pt]&{\frac {dR}{dt}}=\gamma I,\\[6pt]&{\frac {dD}{dt}}=\mu I,\end{aligned}}}
上式において、
β
,
γ
,
μ
{\displaystyle \beta ,\gamma ,\mu }
麻疹 を含む多くの感染症では、新生児は感受性区間へは入らず、生後数か月間は母体由来の抗体(胎盤 を介して、さらに初乳 を介して伝達される)による保護のために、病気に対する免疫を持っている。これは受動免疫 と呼ばれる。この追加の詳細は、モデルの最初にMクラス(母体由来の免疫)を含めることによって示すことができる。
MSIR compartmental model これを数学的に示すために、追加の区間M (t ) が追加される。これにより、次のような微分方程式が得られる。
d
M
d
T
=
Λ
−
δ
M
−
μ
M
d
S
d
T
=
δ
M
−
β
S
I
N
−
μ
S
d
I
d
T
=
β
S
I
N
−
γ
I
−
μ
I
d
R
d
T
=
γ
I
−
μ
R
{\displaystyle {\begin{aligned}{\frac {dM}{dT}}&=\Lambda -\delta M-\mu M\\[8pt]{\frac {dS}{dT}}&=\delta M-{\frac {\beta SI}{N}}-\mu S\\[8pt]{\frac {dI}{dT}}&={\frac {\beta SI}{N}}-\gamma I-\mu I\\[8pt]{\frac {dR}{dT}}&=\gamma I-\mu R\end{aligned}}}
結核 といった感染症にかかったことのある人の中には、完全に回復することはなく、病気自体には罹患していないものの、感染症を抱え続けている 人もいる。彼らはその後、再び感染区画に移動し、(結核のように)症状に苦しむかもしれない。または彼らは症状に苦しんでいない間、キャリア状態で他の人に感染し続けるかもしれない。最も有名な例は、22人を腸チフス に感染させたメアリー・マロン であろう。キャリア区画はCとラベル付けされる。
多くの重要な感染症では、個体は感染しているが、まだ発症していない潜伏期間が存在する。この期間中、個体は区画E(exposed)にいる。
SEIR compartmental model 潜伏期間がパラメータ
a
{\displaystyle a}
a
−
1
{\displaystyle a^{-1}}
Λ
{\displaystyle \Lambda }
μ
{\displaystyle \mu }
d
S
d
t
=
μ
N
−
μ
S
−
β
I
N
S
d
E
d
t
=
β
I
N
S
−
(
μ
+
a
)
E
d
I
d
t
=
a
E
−
(
γ
+
μ
)
I
d
R
d
t
=
γ
I
−
μ
R
.
{\displaystyle {\begin{aligned}{\frac {dS}{dt}}&=\mu N-\mu S-\beta {\frac {I}{N}}S\\[8pt]{\frac {dE}{dt}}&=\beta {\frac {I}{N}}S-(\mu +a)E\\[8pt]{\frac {dI}{dt}}&=aE-(\gamma +\mu )I\\[8pt]{\frac {dR}{dt}}&=\gamma I-\mu R.\end{aligned}}}
ここで、
S
+
E
+
I
+
R
=
N
{\displaystyle S+E+I+R=N}
N
{\displaystyle N}
このモデルについて、基本再生産数は
R
0
=
a
μ
+
a
β
μ
+
γ
{\displaystyle R_{0}={\frac {a}{\mu +a}}{\frac {\beta }{\mu +\gamma }}}
である。
SIRモデルと同様に、この場合においても、感染症の無い平衡解(DFE: N ,0,0,0)とエンデミックな平衡解(EE)があり、生物学的に意味を持つ初期条件とは独立に以下を示すことができる。
(
S
(
0
)
,
E
(
0
)
,
I
(
0
)
,
R
(
0
)
)
∈
{
(
S
,
E
,
I
,
R
)
∈
[
0
,
N
]
4
:
S
≥
0
,
E
≥
0
,
I
≥
0
,
R
≥
0
,
S
+
E
+
I
+
R
=
N
}
{\displaystyle \left(S(0),E(0),I(0),R(0)\right)\in \left\{(S,E,I,R)\in [0,N]^{4}:S\geq 0,E\geq 0,I\geq 0,R\geq 0,S+E+I+R=N\right\}}
これは
R
0
≤
1
⇒
lim
t
→
+
∞
(
S
(
t
)
,
E
(
t
)
,
I
(
t
)
,
R
(
t
)
)
=
D
F
E
=
(
N
,
0
,
0
,
0
)
,
{\displaystyle R_{0}\leq 1\Rightarrow \lim _{t\to +\infty }\left(S(t),E(t),I(t),R(t)\right)=DFE=(N,0,0,0),}
R
0
>
1
,
I
(
0
)
>
0
⇒
lim
t
→
+
∞
(
S
(
t
)
,
E
(
t
)
,
I
(
t
)
,
R
(
t
)
)
=
E
E
{\displaystyle R_{0}>1,I(0)>0\Rightarrow \lim _{t\to +\infty }\left(S(t),E(t),I(t),R(t)\right)=EE}
を満たす。
接触率
β
(
t
)
{\displaystyle \beta (t)}
d
E
1
d
t
=
β
(
t
)
I
1
−
(
γ
+
a
)
E
1
d
I
1
d
t
=
a
E
1
−
(
γ
+
μ
)
I
1
{\displaystyle {\begin{aligned}{\frac {dE_{1}}{dt}}&=\beta (t)I_{1}-(\gamma +a)E_{1}\\[8pt]{\frac {dI_{1}}{dt}}&=aE_{1}-(\gamma +\mu )I_{1}\end{aligned}}}
が安定なことである(すなわち、複素平面における単位円内にフロケの固有値を持つ)。
SEISモデルは、最後に免疫が獲得できないことを除けば、SEIRモデル(上)と同様である。
S
→
E
→
I
→
S
{\displaystyle {\color {blue}{{\mathcal {S}}\to {\mathcal {E}}\to {\mathcal {I}}\to {\mathcal {S}}}}}
このモデルでは、感染は免疫を残さないので、回復した個体は再び感受性のある状態に戻り、S (t' ) 区画に後退する。以下の微分方程式はこのモデルを記述している。
d
S
d
T
=
Λ
−
β
S
I
N
−
μ
S
+
γ
I
d
E
d
T
=
β
S
I
N
−
(
ϵ
+
μ
)
E
d
I
d
T
=
ε
E
−
(
γ
+
μ
)
I
{\displaystyle {\begin{aligned}{\frac {dS}{dT}}&=\Lambda -{\frac {\beta SI}{N}}-\mu S+\gamma I\\[6pt]{\frac {dE}{dT}}&={\frac {\beta SI}{N}}-(\epsilon +\mu )E\\[6pt]{\frac {dI}{dT}}&=\varepsilon E-(\gamma +\mu )I\end{aligned}}}
受動免疫の要因と潜伏期間を持つ疾患の場合には、MSEIRモデルが存在する。
M
→
S
→
E
→
I
→
R
{\displaystyle \color {blue}{{\mathcal {M}}\to {\mathcal {S}}\to {\mathcal {E}}\to {\mathcal {I}}\to {\mathcal {R}}}}
d
M
d
T
=
Λ
−
δ
M
−
μ
M
d
S
d
T
=
δ
M
−
β
S
I
N
−
μ
S
d
E
d
T
=
β
S
I
N
−
(
ε
+
μ
)
E
d
I
d
T
=
ε
E
−
(
γ
+
μ
)
I
d
R
d
T
=
γ
I
−
μ
R
{\displaystyle {\begin{aligned}{\frac {dM}{dT}}&=\Lambda -\delta M-\mu M\\[6pt]{\frac {dS}{dT}}&=\delta M-{\frac {\beta SI}{N}}-\mu S\\[6pt]{\frac {dE}{dT}}&={\frac {\beta SI}{N}}-(\varepsilon +\mu )E\\[6pt]{\frac {dI}{dT}}&=\varepsilon E-(\gamma +\mu )I\\[6pt]{\frac {dR}{dT}}&=\gamma I-\mu R\end{aligned}}}
MSEIRSモデルはMSEIRに似ているが、Rクラスの免疫は一時的なものであり、一時的な免疫が終了すると個人は再び感受性を取り戻すことになる。
M
→
S
→
E
→
I
→
R
→
S
{\displaystyle {\color {blue}{{\mathcal {M}}\to {\mathcal {S}}\to {\mathcal {E}}\to {\mathcal {I}}\to {\mathcal {R}}\to {\mathcal {S}}}}}
[ 編集 ] 病気にかかる確率は時間的に一定ではないことはよく知られている。風邪ウイルス といった季節性のある病気もあり、これらは冬季に流行しやすくなる。麻疹 、おたふくかぜ 、風疹 などの小児の病気では、学校暦 との相関関係が強く、学校が休みの間はかかる確率が激減する。
結果として、多くの疾患では、周期的に(季節的に)変化する接触率
F
=
β
(
t
)
I
N
,
β
(
t
+
T
)
=
β
(
t
)
{\displaystyle F=\beta (t){\frac {I}{N}},\quad \beta (t+T)=\beta (t)}
を持つ感染力を考慮する必要がある(周期Tは1年に等しい)。
したがって、モデルは
d
S
d
t
=
μ
N
−
μ
S
−
β
(
t
)
I
N
S
d
I
d
t
=
β
(
t
)
I
N
S
−
(
γ
+
μ
)
I
{\displaystyle {\begin{aligned}{\frac {dS}{dt}}&=\mu N-\mu S-\beta (t){\frac {I}{N}}S\\[8pt]{\frac {dI}{dt}}&=\beta (t){\frac {I}{N}}S-(\gamma +\mu )I\end{aligned}}}
となる(回復の動態は簡単に
R
=
N
−
S
−
I
{\displaystyle R=N-S-I}
もし
1
T
∫
0
T
β
(
t
)
μ
+
γ
d
t
<
1
⇒
lim
t
→
+
∞
(
S
(
t
)
,
I
(
t
)
)
=
D
F
E
=
(
N
,
0
)
,
{\displaystyle {\frac {1}{T}}\int _{0}^{T}{\frac {\beta (t)}{\mu +\gamma }}\,dt<1\Rightarrow \lim _{t\to +\infty }(S(t),I(t))=DFE=(N,0),}
ならば容易に理解できるが、この積分が1よりも大きい場合、病気は消えず、こういった共鳴が存在するかもしれない。例えば、周期的に変化する接触率をシステムの「入力」として考えると、出力は周期が入力の周期の倍数である周期関数であることがわかる。これにより、いくつかの感染症の多年に1回の(通常は2年に1回の)流行の発生を、接触率の振動の周期と、エンデミックな平衡解近傍の減衰振動の疑似周期との間の相互作用として説明することができるようになった。驚くべきことに、いくつかの場合では、その挙動は準周期的なものであったり、カオス的なものであったりすることもある。
SIRモデルは、予防接種 をモデル化するために修正することができる。典型的には、これらはSIRモデルに予防接種を受けた個人のための追加の区画
V
{\displaystyle V}
[要出典 。
伝染病が発生している状況において、主要な課題の1つは、予防策を講じ、可能であれば、集団予防接種体制の確立によって、伝染病を根絶することである。新生児に接種率
P
∈
(
0
,
1
)
{\displaystyle P\in (0,1)}
d
S
d
t
=
ν
N
(
1
−
P
)
−
μ
S
−
β
I
N
S
d
I
d
t
=
β
I
N
S
−
(
μ
+
γ
)
I
d
V
d
t
=
ν
N
P
−
μ
V
{\displaystyle {\begin{aligned}{\frac {dS}{dt}}&=\nu N(1-P)-\mu S-\beta {\frac {I}{N}}S\\[8pt]{\frac {dI}{dt}}&=\beta {\frac {I}{N}}S-(\mu +\gamma )I\\[8pt]{\frac {dV}{dt}}&=\nu NP-\mu V\end{aligned}}}
上式において、
V
{\displaystyle V}
lim
t
→
+
∞
V
(
t
)
=
N
P
{\displaystyle \lim _{t\to +\infty }V(t)=NP}
であることはすぐに分かる、したがって
S
{\displaystyle S}
I
{\displaystyle I}
R
0
(
1
−
P
)
≤
1
⇒
lim
t
→
+
∞
(
S
(
t
)
,
I
(
t
)
)
=
D
F
E
=
(
N
(
1
−
P
)
,
0
)
{\displaystyle R_{0}(1-P)\leq 1\Rightarrow \lim _{t\to +\infty }\left(S(t),I(t)\right)=DFE=\left(N\left(1-P\right),0\right)}
R
0
(
1
−
P
)
>
1
,
I
(
0
)
>
0
⇒
lim
t
→
+
∞
(
S
(
t
)
,
I
(
t
)
)
=
E
E
=
(
N
R
0
(
1
−
P
)
,
N
(
R
0
(
1
−
P
)
−
1
)
)
{\displaystyle R_{0}(1-P)>1,\quad I(0)>0\Rightarrow \lim _{t\to +\infty }\left(S(t),I(t)\right)=EE=\left({\frac {N}{R_{0}(1-P)}},N\left(R_{0}(1-P)-1\right)\right)}
を満たす。
つまり
P
<
P
∗
=
1
−
1
R
0
{\displaystyle P<P^{*}=1-{\frac {1}{R_{0}}}}
ならば、予防接種計画は病気の根絶には成功せず、それどころか、ワクチン接種をしなかった場合よりは低いレベルではあるが、流行し続けることになる。つまり、この数理モデルは、基本再生産数 が18ほど高い病気を根絶するためには、少なくとも94.4%の新生児にワクチンを接種する必要があることを示唆している。
現代社会は、「合理的な」免除、すなわち、感染からの知覚されるリスクとワクチンから損害を受けることによるリスクを「合理的」に比較した結果として、子供に予防接種受けさせないという家族の決断に直面している。この行動が本当に合理的であるかどうか、すなわち、それが等しく病気の根絶をもたらすことができるかどうかを評価するため、単に予防接種率が感染者数の増加関数
P
=
P
(
I
)
,
P
′
(
I
)
>
0
{\displaystyle P=P(I),\quad P'(I)>0}
であると仮定することができる。
このような場合、根絶条件は
P
(
0
)
≥
P
∗
{\displaystyle P(0)\geq P^{*}}
となる。すなわち、ベースライン予防接種率は、免除の場合は満たされない、「強制接種」の閾値以上でなければならない。このように、「合理的」な免除は、ワクチン接種率が高いために発生率が低い現状のみに基づいており、接種率の低下による将来の感染症再燃を考慮していないため、近視眼的である可能性がある。
新生児以外にも率ρで予防接種を行う場合、感受性保持者と予防接種済みの人についての方程式は
d
S
d
t
=
μ
N
(
1
−
P
)
−
μ
S
−
ρ
S
−
β
I
N
S
d
V
d
t
=
μ
N
P
+
ρ
S
−
μ
V
{\displaystyle {\begin{aligned}{\frac {dS}{dt}}&=\mu N(1-P)-\mu S-\rho S-\beta {\frac {I}{N}}S\\[8pt]{\frac {dV}{dt}}&=\mu NP+\rho S-\mu V\end{aligned}}}
と修正されなければならず、ここから次のような根絶条件が得られる。
P
≥
1
−
(
1
+
ρ
μ
)
1
R
0
{\displaystyle P\geq 1-\left(1+{\frac {\rho }{\mu }}\right){\frac {1}{R_{0}}}}
パルス予防接種戦略 (英語版 )
d
S
d
t
=
μ
N
−
μ
S
−
β
I
N
S
,
S
(
n
T
+
)
=
(
1
−
p
)
S
(
n
T
−
)
,
n
=
0
,
1
,
2
,
…
d
V
d
t
=
−
μ
V
,
V
(
n
T
+
)
=
V
(
n
T
−
)
+
p
S
(
n
T
−
)
,
n
=
0
,
1
,
2
,
…
{\displaystyle {\begin{aligned}{\frac {dS}{dt}}&=\mu N-\mu S-\beta {\frac {I}{N}}S,\quad S(nT^{+})=(1-p)S(nT^{-}),&&n=0,1,2,\ldots \\[8pt]{\frac {dV}{dt}}&=-\mu V,\quad V(nT^{+})=V(nT^{-})+pS(nT^{-}),&&n=0,1,2,\ldots \end{aligned}}}
I = 0
S
∗
(
t
)
=
1
−
p
1
−
(
1
−
p
)
E
−
μ
T
E
−
μ
M
O
D
(
t
,
T
)
{\displaystyle S^{*}(t)=1-{\frac {p}{1-(1-p)E^{-\mu T}}}E^{-\mu MOD(t,T)}}
で与えられ、根絶条件が
R
0
∫
0
T
S
∗
(
t
)
d
t
<
1
{\displaystyle R_{0}\int _{0}^{T}S^{*}(t)\,dt<1}
であることが容易にわかる。
年齢は集団における疾病伝播率、特に接触率に深く影響する。この接触率は、感受性保持者と感染者の接触の有効性を要約する。
S
(
t
)
=
∫
0
a
M
s
(
t
,
a
)
d
a
{\displaystyle S(t)=\int _{0}^{a_{M}}s(t,a)\,da}
I
(
t
)
=
∫
0
a
M
i
(
t
,
a
)
d
a
{\displaystyle I(t)=\int _{0}^{a_{M}}i(t,a)\,da}
R
(
t
)
=
∫
0
a
M
r
(
t
,
a
)
d
a
{\displaystyle R(t)=\int _{0}^{a_{M}}r(t,a)\,da}
(
a
M
≤
+
∞
{\displaystyle a_{M}\leq +\infty }
s
(
t
,
a
)
,
i
(
t
,
a
)
,
r
(
t
,
a
)
{\displaystyle s(t,a),i(t,a),r(t,a)}
積分微分方程式 で記述される。
∂
t
s
(
t
,
a
)
+
∂
a
s
(
t
,
a
)
=
−
μ
(
a
)
s
(
a
,
t
)
−
s
(
a
,
t
)
∫
0
a
M
k
(
a
,
a
1
;
t
)
i
(
a
1
,
t
)
d
a
1
{\displaystyle \partial _{t}s(t,a)+\partial _{a}s(t,a)=-\mu (a)s(a,t)-s(a,t)\int _{0}^{a_{M}}k(a,a_{1};t)i(a_{1},t)\,da_{1}}
∂
t
i
(
t
,
a
)
+
∂
a
i
(
t
,
a
)
=
s
(
a
,
t
)
∫
0
a
M
k
(
a
,
a
1
;
t
)
i
(
a
1
,
t
)
d
a
1
−
μ
(
a
)
i
(
a
,
t
)
−
γ
(
a
)
i
(
a
,
t
)
{\displaystyle \partial _{t}i(t,a)+\partial _{a}i(t,a)=s(a,t)\int _{0}^{a_{M}}{k(a,a_{1};t)i(a_{1},t)da_{1}}-\mu (a)i(a,t)-\gamma (a)i(a,t)}
∂
t
r
(
t
,
a
)
+
∂
a
r
(
t
,
a
)
=
−
μ
(
a
)
r
(
a
,
t
)
+
γ
(
a
)
i
(
a
,
t
)
{\displaystyle \partial _{t}r(t,a)+\partial _{a}r(t,a)=-\mu (a)r(a,t)+\gamma (a)i(a,t)}
上式において、
F
(
a
,
t
,
i
(
⋅
,
⋅
)
)
=
∫
0
a
M
k
(
a
,
a
1
;
t
)
i
(
a
1
,
t
)
d
a
1
{\displaystyle F(a,t,i(\cdot ,\cdot ))=\int _{0}^{a_{M}}k(a,a_{1};t)i(a_{1},t)\,da_{1}}
は感染力であり、これは、当然、年齢間の相互作用に依存する。
新生児の初期条件(すなわち、a=0の場合)によって複雑さが付加される。この初期条件は感染区分および隔離区分については
i
(
t
,
0
)
=
r
(
t
,
0
)
=
0
{\displaystyle i(t,0)=r(t,0)=0}
と明快であるが、感受性を持つ新生児の密度については非局所的である。
s
(
t
,
0
)
=
∫
0
a
M
(
φ
s
(
a
)
s
(
a
,
t
)
+
φ
i
(
a
)
i
(
a
,
t
)
+
φ
r
(
a
)
r
(
a
,
t
)
)
d
a
{\displaystyle s(t,0)=\int _{0}^{a_{M}}\left(\varphi _{s}(a)s(a,t)+\varphi _{i}(a)i(a,t)+\varphi _{r}(a)r(a,t)\right)\,da}
上式において、
φ
j
(
a
)
,
j
=
s
,
i
,
r
{\displaystyle \varphi _{j}(a),j=s,i,r}
さらに、現在の総人口
n
(
t
,
a
)
=
s
(
t
,
a
)
+
i
(
t
,
a
)
+
r
(
t
,
a
)
{\displaystyle n(t,a)=s(t,a)+i(t,a)+r(t,a)}
∂
t
n
(
t
,
a
)
+
∂
a
n
(
t
,
a
)
=
−
μ
(
a
)
n
(
a
,
t
)
{\displaystyle \partial _{t}n(t,a)+\partial _{a}n(t,a)=-\mu (a)n(a,t)}
が得られる。
3つの伝染病クラスにおいて出生率が等しい最も単純な場合において、人口均衡を保つためには、出生率
φ
(
.
)
{\displaystyle \varphi (.)}
μ
(
a
)
{\displaystyle \mu (a)}
1
=
∫
0
a
M
φ
(
a
)
exp
(
−
∫
0
a
μ
(
q
)
d
q
)
d
a
{\displaystyle 1=\int _{0}^{a_{M}}\varphi (a)\exp \left(-\int _{0}^{a}{\mu (q)dq}\right)\,da}
と人口均衡
n
∗
(
a
)
=
C
exp
(
−
∫
0
a
μ
(
q
)
d
q
)
,
{\displaystyle n^{*}(a)=C\exp \left(-\int _{0}^{a}\mu (q)\,dq\right),}
が満たされなけばならず、これによって自動的に感染症の無い解
D
F
S
(
a
)
=
(
n
∗
(
a
)
,
0
,
0
)
.
{\displaystyle DFS(a)=(n^{*}(a),0,0).}
の存在が保証される。
基本再生産数は、適切な関数演算子のスペクトル半径として計算することができる。
[ 編集 ] AIDS やB型肝炎 といった一部の病気の場合、感染した両親の子どもが感染した状態で生まれることがある。このような母親からの伝染は垂直感染と呼ばれる。 感染区画への追加メンバーの流入は、感染区画に新生児の一部を含めることで、モデル内で考慮することができる[ 13]
ヒトからヒトへ間接的に伝染する病気(例えば、マラリア は蚊が媒介する)は媒介生物を介して伝播される。これらの場合、感染はヒトから昆虫 へと移行し、伝染モデルは両方の種を含まなければならず、一般的には直接感染のモデルよりも多くの区画を必要とする[ 13] [ 14]
伝染病をモデル化する際に考慮する必要があるその他の事象としては、以下のようなものがある[ 13]
非一様混合
変動のある感染力
空間的に不均一な分布
マクロパラサイトによって引き起こされる疾患 ここで提示された決定論的モデルは、十分に大きな母集団の場合にのみ有効であることを強調することが重要であり[要出典 、そのようなものとして慎重に使用されるべきである[ 15]
より正確には、これらのモデルは熱力学的極限 においてのみ有効であり、ここでは母集団は実質的に無限大である。確率モデルでは、システム内で感染者の数が1人以下になる確率が有限であるため、上述した長期的なエンデミックな平衡解は成り立たない。真のシステムでは、感染する宿主がいないので、病原体は伝播しないかもしれない。しかし、決定論的平均場モデルでは、感染者数は実数、すなわち、感染した宿主の非整数値を取ることができ、モデル内の宿主の数は1以下であっても、0以上であってもよく、それによってモデル内の病原体が伝播することが可能となる。
^ a b Kermack, W. O.; McKendrick, A. G. (1927). “A Contribution to the Mathematical Theory of Epidemics”. Proceedings of the Royal Society A 115 (772): 700–721. Bibcode : 1927RSPSA.115..700K . doi :10.1098/rspa.1927.0118 .
^ Krylova, O.; Earn, DJ (May 15, 2013). “Effects of the infectious period distribution on predicted transitions in childhood disease dynamics” . J R Soc Interface 10 (84). doi :10.1098/rsif.2013.0098 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3673147/ June 13, 2020 閲覧。 ^ Hethcote H (2000). “The Mathematics of Infectious Diseases”. SIAM Review 42 (4): 599–653. Bibcode : 2000SIAMR..42..599H . doi :10.1137/s0036144500371907 . ^ a b Harko, Tiberiu; Lobo, Francisco S. N.; Mak, M. K. (2014). “Exact analytical solutions of the Susceptible-Infected-Recovered (SIR) epidemic model and of the SIR model with equal death and birth rates” (英語). Applied Mathematics and Computation 236 : 184–194. arXiv :1403.2160 . Bibcode : 2014arXiv1403.2160H . doi :10.1016/j.amc.2014.03.030 .
^ Bailey, Norman T. J. (1975). The mathematical theory of infectious diseases and its applications (2nd ed.). London: Griffin. ISBN 0-85264-231-8 ^ Sonia Altizer; Nunn, Charles (2006). Infectious diseases in primates: behavior, ecology and evolution . Oxford Series in Ecology and Evolution. Oxford [Oxfordshire]: Oxford University Press. ISBN 0-19-856585-2 ^ “Mathematica, Version 12.1 ”. Champaign IL, 2020. 2020年6月26日 閲覧。 ^ Miller, J.C. (2012). “A note on the derivation of epidemic final sizes” . Bulletin of Mathematical Biology 74 (9): section 4.1. doi :10.1007/s11538-012-9749-6 . PMC 3506030 . PMID 22829179 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3506030/ . ^ Miller, J.C. (2017). “Mathematical models of SIR disease spread with combined non-sexual and sexual transmission routes” . Infectious Disease Modelling 2 (1): section 2.1.3. doi :10.1016/j.idm.2016.12.003 . PMC 5963332 . PMID 29928728 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5963332/ . ^ Hethcote, Herbert W. (1989). “Three Basic Epidemiological Models”. In Levin, Simon A.; Hallam, Thomas G.; Gross, Louis J.. Applied Mathematical Ecology . Biomathematics. 18 . Berlin: Springer. pp. 119–144. doi :10.1007/978-3-642-61317-3_5 . ISBN 3-540-19465-7 ^ (p. 19) The SI Model ^ Amenaghawon Osemwinyen, Aboubakary Diakhaby (2015). “Mathematical Modelling of the Transmission Dynamics of Ebola Virus” . Applied and Computational Mathematics 4 (4): 313–320. doi :10.11648/j.acm.20150404.19 . https://www.researchgate.net/publication/280141961 . ^ a b c Brauer, F.; Castillo-Chávez, C. (2001). Mathematical Models in Population Biology and Epidemiology . NY: Springer. ISBN 0-387-98902-1
^ For more information on this type of model see Anderson, R. M. , ed (1982). Population Dynamics of Infectious Diseases: Theory and Applications . London-New York: Chapman and Hall. ISBN 0-412-21610-8
^ Bartlett MS (1957). “Measles periodicity and community size”. Journal of the Royal Statistical Society, Series A 120 (1): 48–70. doi :10.2307/2342553 . JSTOR 2342553 .
May, Robert M.; Anderson, Roy M. (1991). Infectious diseases of humans: dynamics and control . Oxford: Oxford University Press. ISBN 0-19-854040-X Capasso, V. (1993). Mathematical Structure of Epidemic Systems . Berlin: Springer. ISBN 3-540-56526-4 Vynnycky, E.; White, R. G., eds (2010). An Introduction to Infectious Disease Modelling . Oxford: Oxford University Press. ISBN 978-0-19-856576-5 








![{\displaystyle {\begin{aligned}&{\frac {dS}{dt}}=-{\frac {\beta IS}{N}},\\[6pt]&{\frac {dI}{dt}}={\frac {\beta IS}{N}}-\gamma I,\\[6pt]&{\frac {dR}{dt}}=\gamma I.\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/28d01e644243422377f85bfc75ccc78aa51127d9)







































![{\displaystyle {\begin{aligned}S(t)&=S(0)e^{-\xi (t)}\\[8pt]I(t)&=N-S(t)-R(t)\\[8pt]R(t)&=R(0)+\rho \xi (t)\\[8pt]\xi (t)&={\frac {\beta }{N}}\int _{0}^{t}I(t^{*})\,dt^{*}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6f6ac0eda5b1278f31690939cdfa1f4daa6b1762)











![{\displaystyle {\begin{aligned}{\frac {dS}{dt}}&=\Lambda -\mu S-{\frac {\beta IS}{N}}\\[8pt]{\frac {dI}{dt}}&={\frac {\beta IS}{N}}-\gamma I-\mu I\\[8pt]{\frac {dR}{dt}}&=\gamma I-\mu R\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0dad81f67db0f075bec720950feaeeb653916028)





![{\displaystyle {\begin{aligned}{\frac {dS}{dt}}&=-{\frac {\beta SI}{N}}+\gamma I\\[6pt]{\frac {dI}{dt}}&={\frac {\beta SI}{N}}-\gamma I\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/605895c64d824511c45ba20ba151ce5b1cec12fc)



![{\displaystyle {\begin{aligned}&{\frac {\beta }{\gamma }}\leq 1\Rightarrow \lim _{t\to +\infty }I(t)=0,\\[6pt]&{\frac {\beta }{\gamma }}>1\Rightarrow \lim _{t\to +\infty }I(t)=\left(1-{\frac {\gamma }{\beta }}\right)N\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5712553adb4501cb39856cb018354ad30ce1a3f4)



















![{\displaystyle {\begin{aligned}&{\frac {dS}{dt}}=-{\frac {\beta IS}{N}},\\[6pt]&{\frac {dI}{dt}}={\frac {\beta IS}{N}}-\gamma I-\mu I,\\[6pt]&{\frac {dR}{dt}}=\gamma I,\\[6pt]&{\frac {dD}{dt}}=\mu I,\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1211c5146940bacb8a0df97780330a2599eb4625)

![{\displaystyle {\begin{aligned}{\frac {dM}{dT}}&=\Lambda -\delta M-\mu M\\[8pt]{\frac {dS}{dT}}&=\delta M-{\frac {\beta SI}{N}}-\mu S\\[8pt]{\frac {dI}{dT}}&={\frac {\beta SI}{N}}-\gamma I-\mu I\\[8pt]{\frac {dR}{dT}}&=\gamma I-\mu R\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/07401153970a3f9f70f53e3c6ccd16bfe72c87e8)



![{\displaystyle {\begin{aligned}{\frac {dS}{dt}}&=\mu N-\mu S-\beta {\frac {I}{N}}S\\[8pt]{\frac {dE}{dt}}&=\beta {\frac {I}{N}}S-(\mu +a)E\\[8pt]{\frac {dI}{dt}}&=aE-(\gamma +\mu )I\\[8pt]{\frac {dR}{dt}}&=\gamma I-\mu R.\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bc79ccdb111aeb1f9000625bce95416611414cd9)


![{\displaystyle \left(S(0),E(0),I(0),R(0)\right)\in \left\{(S,E,I,R)\in [0,N]^{4}:S\geq 0,E\geq 0,I\geq 0,R\geq 0,S+E+I+R=N\right\}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3190cc59889dab0e9167d4241c117e8a2cefe0e0)



![{\displaystyle {\begin{aligned}{\frac {dE_{1}}{dt}}&=\beta (t)I_{1}-(\gamma +a)E_{1}\\[8pt]{\frac {dI_{1}}{dt}}&=aE_{1}-(\gamma +\mu )I_{1}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e4e137f34047a193685ff0b616c6f86e702f677b)

![{\displaystyle {\begin{aligned}{\frac {dS}{dT}}&=\Lambda -{\frac {\beta SI}{N}}-\mu S+\gamma I\\[6pt]{\frac {dE}{dT}}&={\frac {\beta SI}{N}}-(\epsilon +\mu )E\\[6pt]{\frac {dI}{dT}}&=\varepsilon E-(\gamma +\mu )I\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c400c2e342e82c152cacef3141dc8e5840826218)

![{\displaystyle {\begin{aligned}{\frac {dM}{dT}}&=\Lambda -\delta M-\mu M\\[6pt]{\frac {dS}{dT}}&=\delta M-{\frac {\beta SI}{N}}-\mu S\\[6pt]{\frac {dE}{dT}}&={\frac {\beta SI}{N}}-(\varepsilon +\mu )E\\[6pt]{\frac {dI}{dT}}&=\varepsilon E-(\gamma +\mu )I\\[6pt]{\frac {dR}{dT}}&=\gamma I-\mu R\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8bf59ff982500a2b882e26d1635ecf9efb74110e)


![{\displaystyle {\begin{aligned}{\frac {dS}{dt}}&=\mu N-\mu S-\beta (t){\frac {I}{N}}S\\[8pt]{\frac {dI}{dt}}&=\beta (t){\frac {I}{N}}S-(\gamma +\mu )I\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6fc5024950a3e4b440788219d6c97f29cab91895)




![{\displaystyle {\begin{aligned}{\frac {dS}{dt}}&=\nu N(1-P)-\mu S-\beta {\frac {I}{N}}S\\[8pt]{\frac {dI}{dt}}&=\beta {\frac {I}{N}}S-(\mu +\gamma )I\\[8pt]{\frac {dV}{dt}}&=\nu NP-\mu V\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/63771aa3a5908cf37d4614cbdc9d655f2d734f10)






![{\displaystyle {\begin{aligned}{\frac {dS}{dt}}&=\mu N(1-P)-\mu S-\rho S-\beta {\frac {I}{N}}S\\[8pt]{\frac {dV}{dt}}&=\mu NP+\rho S-\mu V\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b556735b37a851da6eeffe357d39ef0e64a20187)

![{\displaystyle {\begin{aligned}{\frac {dS}{dt}}&=\mu N-\mu S-\beta {\frac {I}{N}}S,\quad S(nT^{+})=(1-p)S(nT^{-}),&&n=0,1,2,\ldots \\[8pt]{\frac {dV}{dt}}&=-\mu V,\quad V(nT^{+})=V(nT^{-})+pS(nT^{-}),&&n=0,1,2,\ldots \end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fa20fd9c5facbd652241be938c9ac9fb3dae0204)




















