「代謝」の版間の差分
Mariobanana (会話 | 投稿記録) 不自然な箇所での文章の分割・体言止め、「が知られている」を消して体言止めにしてしまうなど不適切な編集がなされていたため取り消し Narmas-Tomo (会話) による ID:91800500 の版を取り消し タグ: 取り消し |
→top: 修正不十分 |
||
| (3人の利用者による、間の11版が非表示) | |||
| 1行目: | 1行目: | ||
{{Otheruses|生物における一連の化学反応|日本の建築運動|メタボリズム|古いものから新しいものへ次々と入れ替わること|新陳代謝}} |
|||
{{出典の明記|date=2010年6月}} |
|||
{{Expand English|Metabolism|date=2020年9月}} |
|||
[[File:Metabolism.png|thumb|生命を維持するために細胞内で起こる代謝という化学反応を図示した。]] |
|||
[[Image:ATP-3D-vdW.png|thumb|right|280px|エネルギー代謝の中心的中間体である[[補酵素]]、[[アデノシン三リン酸]]の[[空間充填モデル]]。]] |
|||
[[File:ATP-3D-vdW.png|thumb|right|エネルギー代謝の過程で中心的な役割を果たす中間体である[[アデノシン三リン酸]] (ATP) の分子構造。]] |
|||
{{Biochemistry sidebar}}'''代謝'''(たいしゃ、{{lang-en|metabolism}})とは、[[生命]]の維持のために[[有機体]]が行う、外界から取り入れた[[無機物]]や[[有機化合物]]を素材として行う一連の[[合成]]や[[化学反応]]のことであり、[[新陳代謝]]の略称である<ref name="SeikagakuDic776-9">[[#生化学辞典(2版)|生化学辞典第2版、p.776-777 【代謝】]]</ref>。これらの経路によって有機体はその[[成長]]と[[生殖]]を可能にし、その体系を維持している。代謝は大きく'''[[異化_(生物学)|異化]]''' (catabolism) と'''[[同化_(生物学)|同化]]''' (anabolism) の2つに区分される<ref name="SeikagakuDic776-9" />。異化は物質を分解することによって[[エネルギー]]を得る過程であり、例えば[[細胞呼吸]]がある<ref name="SeikagakuDic776-9" />。同化はエネルギーを使って物質を合成する過程であり、例えば[[タンパク質]]・[[核酸]]・[[多糖]]・[[脂質]]の合成がある<ref name="SeikagakuDic776-9" />。 |
|||
{{Biochemistry sidebar}} |
|||
'''代謝'''(たいしゃ、{{Lang-en-short|metabolism}})とは、生物の[[生命|生存]]と機能に不可欠な一連の[[化学反応]]である。代謝の主な機能は大きく3つあり、食物を細胞プロセスを実行するための[[エネルギー]]に変換すること、食物を[[タンパク質]]、[[脂質]]、[[核酸]]および一部の[[炭水化物]]の合成に必要な構成成分に変換すること、そして{{Ill2|代謝廃棄物|en|Metabolic waste}}を排出することである。酵素が触媒するこれらの反応によって生物は成長し、繁殖し、構造を維持し、環境に対応することができる。また、代謝という言葉は、[[消化]]、細胞内外・細胞間の物質輸送など、生体内で起こるすべての化学反応の全体を指すこともある。この文脈において、上記のような細胞内で起こる一連の反応を'''中間代謝'''({{Lang-en-short|intermediary metabolism}})と呼ぶ。 |
|||
代謝の化学反応は[[代謝経路]]によって体系づけられ、1つの[[化学物質]]は他の化学物質から[[酵素]]によって変換される。酵素は[[触媒]]として、[[熱力学]]的に不利な反応を有利に進めるため極めて重要な存在である。また、酵素は、細胞の環境もしくは他の細胞からの信号([[シグナル伝達]])の変化に反応することにより代謝経路の調節も行う。 |
|||
代謝反応は、化合物の''分解''を伴う'''[[異化作用]]'''(例:[[細胞呼吸]]によるグルコースからピルビン酸への変換)と、化合物(タンパク質、糖質、脂質、核酸など)の''合成''を伴う'''[[同化作用]]'''([[生合成]]ともいう)に大別される。一般に、異化作用はエネルギーを放出し、同化作用はエネルギーを消費する。 |
|||
有機体の代謝はその物質の[[栄養価]]の高さがどれだけか、また、毒性の高さがどれだけかを決定する。例えば、いくつかの[[原核生物]]は[[硫化水素]]を使って栄養を得ているが、この気体は[[動物]]にとっては[[毒]]であることが知られている<ref name="Physiology1">{{cite journal |author=Friedrich C |title=Physiology and genetics of sulfur-oxidizing bacteria |journal=Adv Microb Physiol |volume=39 |issue= |pages=235–89 |year=1998 |pmid=9328649 |doi=10.1016/S0065-2911(08)60018-1}}</ref>。また、代謝速度はその有機体がどれだけの食物を必要としているかに影響を与える。 |
|||
'''[[代謝経路]]'''は、ある化学物質が別の化学物質に変換される一連の化学反応で、それぞれの段階は特定の[[酵素]]によって促進される。'''酵素'''は、エネルギーを必要とし、自然には起こらない望ましい反応を、エネルギーを放出する{{Ill2|自然過程<!-- or 自発過程 -->|en|Spontaneous process|label=自発的な反応}}と{{Ill2|カップリング (物理学)|en|Coupling (physics)|label=結びつける}}ことで、生物が推進することを可能にするため、極めて重要な役割を担っている。酵素は[[触媒]]として働き、反応速度を速めるとともに、[[細胞]]の環境の変化や他の細胞からの[[細胞シグナル伝達|シグナル]]に応答するなど、代謝反応を[[代謝経路#調節|調節]]することができる。 |
|||
== 目的 == |
|||
代謝の目的は、以下の4つが挙げられる<ref name="SeikagakuDic776-9" />。 |
|||
#エネルギーを獲得する |
|||
#摂取した栄養素を、生体を構成するための[[前駆体]]へ転換する |
|||
#前駆体から生体の成分を合成する |
|||
#細胞が使う生理活性物質を合成または分解する |
|||
どの物質が[[栄養素|栄養]]になり、どの物質が[[毒]]になるかは、その生物に固有の代謝系によって決まる。たとえば、ある種の[[原核生物]]は[[硫化水素]]を栄養とすることができるが、このガスは動物にとっては有毒なものである<ref name="Physiology1">{{cite book |author=Friedrich C |title=Physiology and genetics of sulfur-oxidizing bacteria |journal=Adv Microb Physiol |volume=39 |pages=235–89 |year=1998 |pmid=9328649 |doi=10.1016/S0065-2911(08)60018-1 |series=Advances in Microbial Physiology |isbn=978-0-12-027739-1}}</ref>。生物の[[基礎代謝|'''基礎代謝率''']]は、こうしたすべての化学反応によって消費されるエネルギー量の尺度である。 |
|||
== 定義・位置づけ == |
|||
代謝と言う用語は、主に物質代謝をさして使用される場合が多いが、物質代謝そのものはエネルギーの代謝によって起きている。またエネルギー代謝も物質の交代によって起きているので、相互に共役していると考える<ref name="SeikagakuDic776-9" />。したがって、物質代謝およびエネルギー代謝を包括して指す言葉として本記事の『代謝』の正確な定義となる。 |
|||
さまざまな生物種において、基本的な代謝経路が驚くほど類似していることは、代謝の顕著な特徴である<ref>{{cite journal | vauthors = Pace NR | title = The universal nature of biochemistry | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 98 | issue = 3 | pages = 805–8 | date = January 2001 | pmid = 11158550 | pmc = 33372 | doi = 10.1073/pnas.98.3.805 | bibcode = 2001PNAS...98..805P | doi-access = free }}</ref>。たとえば、[[クエン酸回路]]の中間体としてよく知られている一連の[[カルボン酸]]は、知られているすべての生物に存在し、[[単細胞生物|単細胞]]の[[大腸菌]](''Escherichia coli'')から[[ゾウ]]のような巨大な[[多細胞生物]]にいたるまで見い出されている<ref name="SmithE">{{cite journal | vauthors = Smith E, Morowitz HJ | title = Universality in intermediary metabolism | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 101 | issue = 36 | pages = 13168–73 | date = September 2004 | pmid = 15340153 | pmc = 516543 | doi = 10.1073/pnas.0404922101 | bibcode = 2004PNAS..10113168S | doi-access = free }}</ref>。このような代謝経路の類似性は、{{Ill2|生命の歴史|en|History of life}}の中で早くから出現し、その有効性によって持続しているためと考えられる<ref name="Ebenhoh">{{cite journal | vauthors = Ebenhöh O, Heinrich R | title = Evolutionary optimization of metabolic pathways. Theoretical reconstruction of the stoichiometry of ATP and NADH producing systems | journal = Bulletin of Mathematical Biology | volume = 63 | issue = 1 | pages = 21–55 | date = January 2001 | pmid = 11146883 | doi = 10.1006/bulm.2000.0197 | s2cid = 44260374 }}</ref><ref name="Cascante">{{cite journal | vauthors = Meléndez-Hevia E, Waddell TG, Cascante M | title = The puzzle of the Krebs citric acid cycle: assembling the pieces of chemically feasible reactions, and opportunism in the design of metabolic pathways during evolution | journal = Journal of Molecular Evolution | volume = 43 | issue = 3 | pages = 293–303 | date = September 1996 | pmid = 8703096 | doi = 10.1007/BF02338838 | s2cid = 19107073 | bibcode = 1996JMolE..43..293M }}</ref>。[[2型糖尿病|II型糖尿病]]、[[メタボリックシンドローム]]、[[がん]]などの特定の疾患では、正常な代謝が乱されている<ref name="Smith2018">{{cite journal | vauthors = Smith RL, Soeters MR, Wüst RC, Houtkooper RH | title = Metabolic Flexibility as an Adaptation to Energy Resources and Requirements in Health and Disease | journal = Endocrine Reviews | volume = 39 | issue = 4 | pages = 489–517 | date = August 2018 | pmid = 29697773 | pmc = 6093334 | doi = 10.1210/er.2017-00211 }}</ref>。がん細胞の代謝も正常細胞の代謝とは異なっており、この違いを利用して、がんに対する治療介入の[[生物学的標的|標的]]を特定できる可能性がある<ref name="Vander_Heiden_2017">{{cite journal | vauthors = Vander Heiden MG, DeBerardinis RJ | title = Understanding the Intersections between Metabolism and Cancer Biology | journal = Cell | volume = 168 | issue = 4 | pages = 657–669 | date = February 2017 | pmid = 28187287 | pmc = 5329766 | doi = 10.1016/j.cell.2016.12.039 }}</ref>。 |
|||
物質およびエネルギー代謝などの簡単な定義および位置づけは以下の通りである。 |
|||
*物質代謝:物質の変換 |
|||
**異化:外部基質の分解反応 |
|||
**同化:[[生体高分子]]の合成反応 |
|||
*エネルギー代謝:生体活動に関わるエネルギーの出入りや変換および利用<ref name="SeikagakuDic192-6">[[#生化学辞典(2版)|生化学辞典第2版、p.192-193 【エネルギー代謝】]]</ref> |
|||
**化学エネルギー:化学エネルギーが基本となり以下のエネルギー、あるいは物質代謝に利用される |
|||
***[[力学]]エネルギー:[[筋肉]]、[[鞭毛]]、[[繊毛]]、[[細胞分裂]]など |
|||
***電気エネルギー:[[発電器官]]、[[神経]]伝達 |
|||
***光エネルギー:[[発光]] |
|||
なお、代謝反応のほとんど全ては各々の反応を担当する[[酵素]]あるいは[[タンパク質]]による。[[代謝マップ]]にてその基質および生産物のみが描かれているが、その反応自体は酵素が担当している。代謝系において特定の物質ないしエネルギーの偏りが出来ないように基質、酵素化学、発現レベルにおける調節が見られ、その調節機構は非常に多様で厳密である。 |
|||
__TOC__ |
|||
== 物質代謝 == |
|||
'''物質代謝'''とは、細胞内における物質の変換を意味する。別名、物質交代など。上記にもあるようにエネルギー代謝との関連により両者を分けて考えるのは困難だが、物質の変換に注目してみた場合の『代謝』が物質代謝である。物質代謝は異化および同化に分けられる。 |
|||
== 主な生化学物質 == |
|||
異化と同化反応は関連している。例えば異化反応である[[解糖系]]の逆行は[[糖新生]]経路(糖の合成)であり、[[クエン酸回路|酸化的クエン酸回路]](異化)の逆行である還元的クエン酸回路では[[炭酸固定]](同化)が行われる。また、[[カルビン - ベンソン回路]](同化)は解糖系の一種であるペントースリン酸経路(異化)が還元的に働いたものである。 |
|||
{{further|生体物質|細胞|生化学}} |
|||
[[File:Trimyristin-3D-vdW.png|right|thumb|upright=1.15|脂質である[[トリアシルグリセロール]]分子の構造を示す。トリグリセリドとも呼ばれ、グリセロール分子と3つの脂肪酸分子が結合した構造をしている。]] |
|||
しかしながら、この両者は反応の方向性と[[アデノシン三リン酸|ATP]]あるいは還元型ピリジンヌクレオチド ([[NADH]] or [[NADPH]]) が生成されるか否かに注目すると容易に区別がつく(ATPおよび還元型ピリジンヌクレオチドの生成を行うのが異化、異化により生成したエネルギーを用いて生体高分子の合成を行うのが同化)。 |
|||
[[File:Human Metabolism - Pathways.jpg|thumb|人体におけるさまざまな代謝経路を包括的に表現した[[代謝ネットワーク]]図。[[ヒト]]の代謝を維持するために起こるさまざまな化学反応の相互関係と相互作用を描いている。]] |
|||
動物、植物、微生物の構成要素は、主に[[アミノ酸]]、[[炭水化物]]、[[核酸]]、[[脂質]](しばしば[[脂肪]]と呼ばれる)という4種類の基本的な[[分子]]から作られている。これらの分子は生命維持に不可欠であるため、代謝反応は、細胞や組織を形成するためにそれらを合成するか、消化によって分解してエネルギーとして利用することに集中している。また、これらの生化学物質が結合して、[[デオキシリボ核酸]](DNA)や[[タンパク質]]など、生命維持に不可欠な[[高分子]]を形成する<ref>{{cite journal| vauthors = Cooper GM |date=2000|title=The Molecular Composition of Cells|url=https://www.ncbi.nlm.nih.gov/books/NBK9879/|journal=The Cell: A Molecular Approach | edition = 2nd |language=en|access-date=25 June 2020|archive-date=27 August 2020|archive-url=https://web.archive.org/web/20200827120320/https://www.ncbi.nlm.nih.gov/books/NBK9879/|url-status=live}}</ref>。 |
|||
=== 異化 === |
|||
{| class="wikitable" style="margin-left: auto; margin-right: auto;" |
|||
[[ファイル:Catabolism schematic.svg|thumb|タンパク質(Proteins)、炭水化物(polysaccharides)、脂質(fats)の異化の概略。]] |
|||
!分子の種類 |
|||
異化(異化作用)とは外部から取り入れた高分子量の[[有機物]]あるいは[[無機物]]を水やアンモニアなどの単純な低分子まで分解し、その過程でエネルギーを得てATPを合成する代謝である<ref name="SeikagakuDic115-6">[[#生化学辞典(2版)|生化学辞典第2版、p.115 【異化作用】]]</ref>。現生する生物は地球上に存在するほとんどの有機化合物を代謝できると言われているが、異化代謝系が各々に存在しているわけではなく、代表的なATP生成機構に最終的には集約されていく。それらの機構とは[[発酵]]、[[呼吸]]、[[光合成]]の3つである。光合成はカルビン - ベンソン回路が含まれる場合は同化反応となりうるが、[[光化学反応]]においては、NADPHおよびATPが生産されるために異化反応に分類される。またATP合成を主たる目的とした[[光化学反応|循環的光リン酸化]]はより異化反応的側面が強い。 |
|||
![[モノマー]]型の名称 |
|||
![[ポリマー]]型の名称 |
|||
!ポリマー型の例 |
|||
|- style="text-align:center;" |
|||
||[[アミノ酸]] |
|||
||アミノ酸 |
|||
||[[タンパク質]](ポリペプチドでできている) |
|||
||[[繊維状タンパク質]]、[[球状タンパク質]] |
|||
|- style="text-align:center;" |
|||
||[[炭水化物]] |
|||
||[[単糖]] |
|||
||[[多糖]] |
|||
||[[デンプン]]、[[グリコーゲン]]、[[セルロース]] |
|||
|- style="text-align:center;" |
|||
||[[核酸]] |
|||
||[[ヌクレオチド]] |
|||
||[[ポリヌクレオチド]] |
|||
||[[デオキシリボ核酸|デオキシリボ核酸(DNA)]]、[[リボ核酸|リボ核酸(RNA)]] |
|||
|} |
|||
=== アミノ酸とタンパク質 === |
|||
==== 発酵 ==== |
|||
{{Main|タンパク質}} |
|||
発酵は、基質レベルのリン酸化によるATP生成を行うが、電子伝達系を通らずエネルギー効率としてはきわめて低い。しかしながら機構の単純さや酸素が要らないなどの理由から多くの微生物にてよく見られる。なお無酸素運動における筋肉でも解糖系が乳酸発酵へと転じている([[筋肉痛]])。 |
|||
タンパク質は、[[アミノ酸]]が直鎖状に配列し、[[ペプチド結合]]で結合したものである。多くのタンパク質は、代謝における化学反応の[[触媒]]となる[[酵素]]である。また、細胞の形状を維持する足場となる[[細胞骨格]]を形成するなど、構造的あるいは機械的な機能を持つタンパク質もある<ref>{{cite journal | vauthors = Michie KA, Löwe J | title = Dynamic filaments of the bacterial cytoskeleton | journal = [[:en:Annual Review of Biochemistry|Annual Review of Biochemistry]] | volume = 75 | pages = 467–92 | year = 2006 | pmid = 16756499 | doi = 10.1146/annurev.biochem.75.103004.142452 | s2cid = 4550126 }}</ref>。タンパク質は、[[細胞シグナル伝達]]、[[免疫応答]]、[[細胞接着]]、膜を介した[[能動輸送]]、および[[細胞周期]]の調節など、さまざまな重要な役割を担っている<ref name="Nelson">{{cite book | vauthors = Nelson DL, Cox MM | title = Lehninger Principles of Biochemistry | publisher = W. H. Freeman and company | year = 2005 | location = New York | page = [https://archive.org/details/lehningerprincip00lehn_0/page/841 841] | isbn = 978-0-7167-4339-2 | url-access = registration | url = https://archive.org/details/lehningerprincip00lehn_0/page/841 }}</ref>。また、アミノ酸は、細胞のエネルギー代謝にも寄与しており、特にグルコースなどの主要なエネルギー源が不足したときや、細胞が代謝ストレスを受けたときに<ref>{{cite journal | vauthors = Hothersall JS, Ahmed A | title = Metabolic fate of the increased yeast amino Acid uptake subsequent to catabolite derepression | journal = Journal of Amino Acids | volume = 2013 | pages = 461901 | year = 2013 | pmid = 23431419 | pmc = 3575661 | doi = 10.1155/2013/461901 | doi-access = free }}</ref>、[[クエン酸回路|クエン酸回路(トリカルボン酸回路)]]<ref>{{cite journal | vauthors = Kelleher JK, Bryan BM, Mallet RT, Holleran AL, Murphy AN, Fiskum G | title = Analysis of tricarboxylic acid-cycle metabolism of hepatoma cells by comparison of 14CO2 ratios | journal = The Biochemical Journal | volume = 246 | issue = 3 | pages = 633–9 | date = September 1987 | pmid = 3120698 | pmc = 1148327 | doi = 10.1042/bj2460633 }}</ref>に炭素源を供給する役割もある。 |
|||
電子供与体および電子受容体はともに有機物であり、電子供与体となる還元物質には通常、[[糖]]が使用される。しかしながら微生物はある種の有機酸([[酢酸]]、[[乳酸]]など)、[[アミノ酸]]、[[ヌクレオチド]]などを基質に発酵する能力を有する。 |
|||
=== 脂質 === |
|||
基質レベルのリン酸化によるATP生成の式は以下の通りである。 |
|||
{{Main|脂質}} |
|||
*[[グルコース]] + [[アデノシン二リン酸|ADP]] + [[リン酸|P<sub>i</sub>]] + [[ニコチンアミドアデニンジヌクレオチド|NAD<sup>+</sup>]] → [[ピルビン酸]] + [[アデノシン三リン酸|ATP]] + NADH |
|||
しかしながら、生じた還元型ピリジンヌクレオチド (NADH) は生物にとっては有害なピルビン酸の異化反応に使用される(以下乳酸発酵の例)。 |
|||
*ピルビン酸 + NADH → [[乳酸]] + NAD<sup>+</sup> |
|||
微生物の行う発酵の電子受容体(産物)としては、乳酸、エタノールをはじめ[[ブタノール]]、[[酪酸]]、[[プロパノール|イソプロパノール]]、酢酸、[[プロピオン酸]]、[[ギ酸]]、[[アセトン]]などがある。 |
|||
脂質は、生化学物質の中でもっとも多様な一群である。その主な用途は、[[細胞膜]]のような内外の[[生体膜]]の一部として構造を作りだすほか、その[[化学エネルギー]]を利用することもできる<ref name="Nelson" />。多くの場合、非極性の長い炭化水素鎖と、小さな酸素を含む極性領域を持つ脂肪酸の重合体である{{要出典|date=2022年12月}}。一般的に脂質は、[[疎水性]]または[[両親媒性分子|両親媒性]]の生体分子と定義され、[[エタノール]]、[[ベンゼン]]、[[クロロホルム]]などの[[有機溶媒]]に可溶である<ref>{{cite journal | vauthors = Fahy E, Subramaniam S, Brown HA, Glass CK, Merrill AH, Murphy RC, Raetz CR, Russell DW, Seyama Y, Shaw W, Shimizu T, Spener F, van Meer G, VanNieuwenhze MS, White SH, Witztum JL, Dennis EA | display-authors = 6 | title = A comprehensive classification system for lipids | journal = Journal of Lipid Research | volume = 46 | issue = 5 | pages = 839–61 | date = May 2005 | pmid = 15722563 | doi = 10.1194/jlr.E400004-JLR200 | doi-access = free }}</ref>。脂質は、[[脂肪酸]]と[[グリセロール]]を含む大きな化合物群で、グリセロール分子が3つの脂肪酸に[[エステル結合]]したものは[[トリアシルグリセロール|トリアシルグリセリド]]と呼ばれる<ref>{{cite web|title=Lipid nomenclature Lip-1 & Lip-2|url=https://www.qmul.ac.uk/sbcs/iupac/lipid/lip1n2.html#p11|access-date=2020-06-06|website=www.qmul.ac.uk|archive-date=6 June 2020|archive-url=https://web.archive.org/web/20200606140055/https://www.qmul.ac.uk/sbcs/iupac/lipid/lip1n2.html#p11|url-status=live}}</ref>。この基本構造にはいくつかの変種があり、[[スフィンゴミエリン]]は[[スフィンゴシン]]などの骨格鎖が、[[リン脂質]]にはリン酸などの[[親水性|親水性基]]が存在する。また、[[ステロール]]などの[[ステロイド|ステロイド類]]も脂質の主要な分類の一つである<ref>{{cite book|edition=8|title=Biochemistry|location=New York|isbn=978-1-4641-2610-9|oclc=913469736 | vauthors = Berg JM, Tymoczko JL, Gatto Jr GJ, Stryer L |date=8 April 2015|publisher=W. H. Freeman|pages=362}}</ref>。 |
|||
詳しくは[[発酵]]を参照。 |
|||
=== 炭水化物 === |
|||
[[File:Glucose Fisher to Haworth.gif|thumb|upright=1.15|right|alt=The straight chain form consists of four C H O H groups linked in a row, capped at the ends by an aldehyde group C O H and a methanol group C H 2 O H. To form the ring, the aldehyde group combines with the O H group of the next-to-last carbon at the other end, just before the methanol group.|単糖である[[グルコース]]は、直鎖状と環状という2種類の形態で存在することができる。どちらの形態のグルコースも代謝において重要な役割を担っている。]] |
|||
呼吸は基質レベルのリン酸化過程(解糖系、クエン酸回路)および[[電子伝達系]]を通り、ATPの生成を行う。上記の代謝系は電子供与体として有機物を用いる多くの従属栄養生物に見られるATP合成系であるが、最終電子受容体に使用できるのはほとんどが数種の無機物である。また、無機物を電子供与体とする化学合成独立栄養生物の行う呼吸も含まれる。そのような無機物には[[水素]]、[[一酸化炭素]]、[[アンモニア]]、[[亜硝酸塩]]、[[一価鉄]]、[[硫化水素]]などがある。 |
|||
{{Main|炭水化物}} |
|||
炭水化物(糖類とも呼ぶ)は、複数の[[ヒドロキシ基|ヒドロキシ基(水酸基)]]が結合した[[アルデヒド]]または[[ケトン]]からなる生体分子で、直鎖状または環状の形態を取ることがある。炭水化物はもっとも豊富に存在する生体分子であり、[[エネルギー]]の貯蔵や輸送や([[デンプン]]や[[グリコーゲン]])、構造部品としてなど(植物の[[セルロース]]や動物の[[キチン]])、さまざまな役割を担っている<ref name="Nelson" />。炭水化物の基本的な構成単位は[[単糖]]と呼ばれ、[[ガラクトース]]、[[フルクトース]]、そしてもっとも重要な[[グルコース]]などがある。単糖は互いに結合して[[多糖]]と呼ばれるより大きな炭水化物分子を形成することができ、その結合様式はほぼ無限に存在する<ref>{{cite journal | vauthors = Raman R, Raguram S, Venkataraman G, Paulson JC, Sasisekharan R | title = Glycomics: an integrated systems approach to structure-function relationships of glycans | journal = Nature Methods | volume = 2 | issue = 11 | pages = 817–24 | date = November 2005 | pmid = 16278650 | doi = 10.1038/nmeth807 | s2cid = 4644919 }}</ref>。 |
|||
[[最終電子受容体]]として[[酸素]]を用いる呼吸を『好気呼吸』それ以外の無機物を用いるものを『嫌気呼吸』という。化学合成独立栄養の場合は、多くは酸素を最終電子受容体として用いるが、嫌気呼吸の電子伝達系を併せ持つものも存在する。なお、嫌気呼吸の電子受容体には[[硝酸塩]]、[[硫酸塩]]、[[亜硝酸塩]]、[[二価鉄]]等の無機物や、[[トリメチルアミンオキサイド]] (TMAO) や[[ジメチルスルホキシド]] (DMSO) といった有機物を用いるものもある。 |
|||
=== ヌクレオチド === |
|||
基質レベルのリン酸化は解糖系および[[クエン酸]]回路で発生する。またそのとき生じた還元型ピリジンヌクレオチドは電子伝達系を通って、ATP生成に使用される。基質レベルのリン酸化ではわずかグルコース1分子辺り4分子のATPしか生成し得ないが、電子伝達系においては平均して34分子のATPが生産可能である(ただし計算によっては34分子以上生産されているかもしれない)。 |
|||
{{Main|ヌクレオチド}} |
|||
デオキシリボ核酸(DNA)とリボ核酸([[リボ核酸|RNA]])は共に核酸の一種で、いずれも[[ヌクレオチド]]の重合体である。各ヌクレオチドは、糖基([[リボース]]または[[デオキシリボース]])に[[窒素塩基]]とリン酸基が結合したものである。核酸は、[[遺伝情報]]の保存や利用、および[[転写 (生物学)|転写]]や[[タンパク質生合成|タンパク質の生合成]]などの過程を通した解釈に大きな役割を果たしている<ref name="Nelson" />。これらの情報は、[[DNA修復]]機構によって保護され、[[DNA複製]]によって受け継がれる。[[ヒト免疫不全ウイルス|HIV]]などの多くの[[ウイルス]]が[[RNAウイルス|RNAゲノム]]を持ち、[[逆転写酵素|逆転写]]を通じてそのRNAゲノムからDNA鋳型を生成している<ref>{{cite journal | vauthors = Sierra S, Kupfer B, Kaiser R | title = Basics of the virology of HIV-1 and its replication | journal = Journal of Clinical Virology | volume = 34 | issue = 4 | pages = 233–44 | date = December 2005 | pmid = 16198625 | doi = 10.1016/j.jcv.2005.09.004 }}</ref>。[[スプライセオソーム]]や[[リボソーム]]などの[[リボザイム]]中のRNAは酵素としても働き、化学反応を触媒することができる。個々の[[ヌクレオシド]]は、[[リボース]]糖に核酸塩基が結合して形成され、これらの塩基は[[プリン]]または[[ピリミジン]]に分類される含窒素[[複素環式化合物|複素環]]である。また、ヌクレオチドは代謝基転移反応<!-- metabolic-group-transfer reactions -->において補酵素としても働く<ref name="Wimmer">{{cite journal | vauthors = Wimmer MJ, Rose IA | title = Mechanisms of enzyme-catalyzed group transfer reactions | journal = [[:en:Annual Review of Biochemistry|Annual Review of Biochemistry]] | volume = 47 | pages = 1031–78 | year = 1978 | pmid = 354490 | doi = 10.1146/annurev.bi.47.070178.005123 }}</ref>。 |
|||
最終産物は酸素を用いた場合は[[水]]、硝酸塩は[[窒素]]など(あるいは[[一酸化窒素]]、[[一酸化二窒素]]など)、硫酸塩の場合は[[硫化水素]]などである。 |
|||
=== 補酵素 === |
|||
詳しくは[[呼吸]]、[[解糖系]]、[[クエン酸回路]]、[[電子伝達系]]、[[嫌気呼吸]]を参照。 |
|||
[[File:Acetyl-CoA-2D.svg|thumb|right|upright=1.35|[[補酵素]][[アセチルCoA]]の分子構造を示す。左端の硫黄原子(S)に転移性の[[アセチル基]]が結合している。]] |
|||
{{main|補酵素}} |
|||
代謝は膨大な数の化学反応から構成されているが、そのほとんどは、分子内の[[基|官能基]]や原子間の結合の移動させるという、いくつかの基本的な種類の反応に分類される<ref>{{cite journal | vauthors = Mitchell P | title = The Ninth Sir Hans Krebs Lecture. Compartmentation and communication in living systems. Ligand conduction: a general catalytic principle in chemical, osmotic and chemiosmotic reaction systems | journal = European Journal of Biochemistry | volume = 95 | issue = 1 | pages = 1–20 | date = March 1979 | pmid = 378655 | doi = 10.1111/j.1432-1033.1979.tb12934.x | doi-access = free }}</ref>。この共通の化学的反応により、細胞は少数の代謝中間体の集まりを使って、異なる反応間で化学基を移動させることができる<ref name="Wimmer" />。これらの基転移中間体は[[補酵素]]と呼ばれる。基転移反応はそれぞれの種類ごとに特定の補酵素によって行われ、補酵素は、それを生成する一連の酵素の[[基質 (化学)|基質]]となるとともに、それを消費する一連の酵素の基質となる。このように、補酵素は絶えず生産、消費、そして再利用されている<ref name="Dimroth">{{cite journal | vauthors = Dimroth P, von Ballmoos C, Meier T | title = Catalytic and mechanical cycles in F-ATP synthases. Fourth in the Cycles Review Series | journal = EMBO Reports | volume = 7 | issue = 3 | pages = 276–82 | date = March 2006 | pmid = 16607397 | pmc = 1456893 | doi = 10.1038/sj.embor.7400646 }}</ref>。 |
|||
==== 光化学反応 ==== |
|||
[[ファイル:Plagiomnium affine laminazellen.jpeg|thumb|right|200px|代表的な光化学反応である光合成で最も一般的なものは、[[植物細胞]]に含まれる[[葉緑体]]によって行われるものである]] |
|||
[[光化学反応]]は光エネルギーによる電子の励起およびそれに伴う電子伝達によってATP生成が行われる。光合成反応は植物および一部の細菌([[光合成細菌]];[[シアノバクテリア]]、紅色硫黄細菌など)のみが有している。電子供与体には酸素発生型光合成の場合H<sub>2</sub>Oが使用される。また酸素非発生型光合成の場合は、硫化水素、水素をはじめ幾つかの有機化合物(プロパノールなど)を電子供与体として利用する。 |
|||
[[アデノシン三リン酸]](ATP)は中心的な補酵素で、細胞の普遍的なエネルギー通貨として機能する。このヌクレオチドは、異なる化学反応間で化学エネルギーを伝達するために使用される。細胞内に存在するATPは微量であるが、常に再生されているため、人体は1日に自分の体重と同程度のATPを使うことができる<ref name="Dimroth" />。ATPは[[異化 (生物学)|異化作用]]と[[同化 (生物学)|同化作用]]の橋渡しをする。異化作用は分子を分解し、同化作用は分子を再構築する。異化反応でATPが生産され、同化反応ではATPが消費される。さらに、ATPは[[リン酸化]]反応におけるリン酸基の担体としても機能する<ref>{{cite journal | vauthors = Bonora M, Patergnani S, Rimessi A, De Marchi E, Suski JM, Bononi A, Giorgi C, Marchi S, Missiroli S, Poletti F, Wieckowski MR, Pinton P | display-authors = 6 | title = ATP synthesis and storage | journal = Purinergic Signalling | volume = 8 | issue = 3 | pages = 343–57 | date = September 2012 | pmid = 22528680 | pmc = 3360099 | doi = 10.1007/s11302-012-9305-8 }}</ref>。 |
|||
酸素発生型光合成の場合、水2分子あたり4分子のATPおよび2分子のNADPHが生産される。うち3分子のATPおよび2分子のNADPHを用いて[[炭酸同化]]を行う。また電子がピリジンヌクレオチド(あるいは[[フェレドキシン]])に伝達された後に再び電子伝達系に戻る光化学反応を循環的光リン酸化というが、こちらは電子が光合成電子伝達系を回転するために、光励起を受ける限りATP生成が行われる。明条件かつ有機物の少ない環境ではこのような異化反応が見られる。循環的光リン酸化の収支は以下の通りである。 |
|||
*光化学系I → 光励起P700(光化学反応中心) |
|||
*光励起P700(光化学反応中心) → 初発電子受容体A<sub>0</sub> |
|||
*初発電子受容体A<sub>0</sub> → フェレドキシン |
|||
*フェレドキシン → プラストキノン |
|||
*プラストキノン → シトクロムb<sub>6</sub>/f複合体 |
|||
*シトクロムb<sub>6</sub>/f複合体 → 光化学系I(上に戻る) |
|||
なお、光合成反応は好気的な反応と思われがちだが、必ずしもそうではない。酸素を発生するために好気条件のように見えるが、酸素非発生型光合成を行う光合成細菌のほとんどが極度の嫌気性である(シアノバクテリアは除く)。酸素発生型光合成の起源は光合成細菌の光化学系を起源とするので、光化学反応は『明条件かつ嫌気的な』代謝系である。 |
|||
[[ビタミン]]は、微量で必須とされる有機化合物で、細胞内では作ることができない。{{Ill2|人間栄養学|en|Human nutrition|label=ヒトの栄養}}では、ほとんどのビタミンは修飾された後、補酵素として作用する。たとえば、水溶性ビタミンはすべて、細胞内で使用される際にリン酸化されるかヌクレオチドに結合する<ref>{{cite journal| vauthors = Berg JM, Tymoczko JL, Stryer L |date=2002|title=Vitamins Are Often Precursors to Coenzymes|url=https://www.ncbi.nlm.nih.gov/books/NBK22549/|journal=Biochemistry. 5th Edition|language=en|access-date=9 June 2020|archive-date=15 December 2020|archive-url=https://web.archive.org/web/20201215232601/https://www.ncbi.nlm.nih.gov/books/NBK22549/|url-status=live}}</ref>。ビタミンB<sub>3</sub>([[ナイアシン]])の誘導体である[[ニコチンアミドアデニンジヌクレオチド]](NAD<sup>+</sup>)は、水素受容体として機能する重要な補酵素である。数百種類の[[デヒドロゲナーゼ|デヒドロゲナーゼ(脱水素酵素)]]が基質から電子を奪い、NAD<sup>+</sup>をNADHに[[還元]]する。この還元型補酵素は、水素原子を基質へ移動する必要のある細胞内の[[還元酵素]]の基質となる<ref>{{cite journal | vauthors = Pollak N, Dölle C, Ziegler M | title = The power to reduce: pyridine nucleotides--small molecules with a multitude of functions | journal = The Biochemical Journal | volume = 402 | issue = 2 | pages = 205–18 | date = March 2007 | pmid = 17295611 | pmc = 1798440 | doi = 10.1042/BJ20061638 }}</ref>。ニコチンアミドアデニンジヌクレオチドは、細胞内でNADHとNADPHという2つの関連した形態で存在し、NAD<sup>+</sup>/NADHは異化反応でより重要であり、NADP<sup>+</sup>/NADPHは同化反応で使用される<ref>{{cite book| vauthors = Fatih Y |title=Advances in food biochemistry|publisher=CRC Press|year=2009|isbn=978-1-4200-0769-5|location=Boca Raton|pages=228|oclc=607553259}}</ref>。[[File:1GZX Haemoglobin.png|thumb|upright=1.35|right|赤血球に含まれるタンパク質である鉄含有[[ヘモグロビン]]の構造を示す図で、サブユニットは赤と青で色分けされ、鉄を含むヘム基は緑で示されている。{{PDB|1GZX}}]] |
|||
詳しくは光合成、[[光化学反応]]を参照。 |
|||
=== |
=== ミネラルと補因子 === |
||
{{further|生物無機化学}} |
|||
同化(同化作用)とは、外部から取り込んだ物質を生合成する事を指す。ATPや還元型ピリジンヌクレオチドなどの異化反応によって得られたエネルギーを用い、酵素反応を利用し、単純な前駆体を経て[[核酸]]、[[タンパク質]]、[[多糖]]、[[脂質]]など複雑な生体高分子さらには増殖を行う過程である<ref name="SeikagakuDic904-8">[[#生化学辞典(2版)|生化学辞典第2版、p.115 【同化作用】]]</ref>。 |
|||
代謝はさまざまな無機元素に大きく依存しており、[[ナトリウム]]や[[カリウム]]のように豊富に含まれるものもあれば、少量で機能するものもある。ヒトの体重の約99%は、[[炭素]]、[[窒素]]、[[カルシウム]]、[[ナトリウム]]、[[塩素]]、カリウム、[[水素]]、[[リン]]、[[酸素]]、[[硫黄]]などの元素で構成されている。これらの元素のうち、炭素と窒素の大部分は[[有機化合物]](タンパク質、脂質、炭水化物)に含まれており、酸素と水素の大部分は水として存在する<ref name="Heymsfield">{{cite journal | vauthors = Heymsfield SB, Waki M, Kehayias J, Lichtman S, Dilmanian FA, Kamen Y, Wang J, Pierson RN | display-authors = 6 | title = Chemical and elemental analysis of humans in vivo using improved body composition models | journal = The American Journal of Physiology | volume = 261 | issue = 2 Pt 1 | pages = E190-8 | date = August 1991 | pmid = 1872381 | doi = 10.1152/ajpendo.1991.261.2.E190 }}</ref>。 |
|||
同化反応は異化のように代謝系に注目するよりも、低分子無機物の取り込み、無機物から低分子有機物の構築、ならびに生体高分子の構築という順に、生体分子の構築過程に注目すると理解しやすい。 |
|||
豊富な無機元素は[[電解質]]として[[イオン]]となり、さまざまな身体機能を維持するために機能している。もっとも重要なイオンには、[[ナトリウム]]、[[カリウム]]、[[カルシウム]]、[[マグネシウム]]、[[塩化物]]、[[リン酸塩]]、および有機イオンである[[重炭酸塩]]が含まれる。[[細胞膜]]を隔てた[[電気化学的勾配|イオン勾配]]を正確に維持することにより、[[浸透圧]]と[[水素イオン指数|pH]]が保たれる<ref>{{cite book | chapter = Electrolyte Balance | chapter-url = https://opentextbc.ca/anatomyandphysiology/chapter/26-3-electrolyte-balance/ | title = Anatomy and Physiology | publisher = OpenStax | access-date = 23 June 2020 | archive-date = 2 June 2020 | archive-url = https://web.archive.org/web/20200602222138/https://opentextbc.ca/anatomyandphysiology/chapter/26-3-electrolyte-balance/ | url-status = dead }}</ref>。[[神経]]や[[筋肉]]の[[活動電位]]は、[[細胞外液]]と[[細胞質基質|細胞内液]]の電解質交換によって生じるため、イオンはこれらの組織の機能にも重要である<ref>{{cite book | vauthors = Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J |date=2000 |chapter=The Action Potential and Conduction of Electric Impulses |chapter-url=https://www.ncbi.nlm.nih.gov/books/NBK21668/ |title=Molecular Cell Biology |edition=4th |language=en |via=NCBI |access-date=23 June 2020 |archive-date=30 May 2020 |archive-url=https://web.archive.org/web/20200530112637/https://www.ncbi.nlm.nih.gov/books/NBK21668/ |url-status=live }}</ref>。電解質は、細胞膜に存在する[[イオンチャネル]]というタンパク質を通じて細胞に出入りする。たとえば、[[筋収縮|筋肉の収縮]]は、細胞膜や[[T管|横行小管(T細管)]]にあるイオンチャネルを介したカルシウム、ナトリウム、カリウムの移動に依存している<ref>{{cite journal | vauthors = Dulhunty AF | title = Excitation-contraction coupling from the 1950s into the new millennium | journal = Clinical and Experimental Pharmacology & Physiology | volume = 33 | issue = 9 | pages = 763–72 | date = September 2006 | pmid = 16922804 | doi = 10.1111/j.1440-1681.2006.04441.x | s2cid = 37462321 }}</ref>。 |
|||
なお、無機態の[[炭素]]、[[窒素]]、[[硫黄]]の取り込みを可能にするのは独立栄養生物のみであり、従属栄養生物は生体高分子(有機物)の異化から生合成系へ流れていく。したがって、この点でも異化と同化は関連していることがわかる。 |
|||
[[遷移金属]]は通常、生体内に[[微量元素]]として存在し、[[亜鉛]]と[[鉄]]がもっとも多く含まれている<ref>{{cite book| vauthors = Torres-Romero JC, Alvarez-Sánchez ME, Fernández-Martín K, Alvarez-Sánchez LC, Arana-Argáez V, Ramírez-Camacho M, Lara-Riegos J | chapter=Zinc Efflux in Trichomonas vaginalis: In Silico Identification and Expression Analysis of CDF-Like Genes|date=2018| title =Quantitative Models for Microscopic to Macroscopic Biological Macromolecules and Tissues|pages=149–168| veditors = Olivares-Quiroz L, Resendis-Antonio O |place=Cham|publisher=Springer International Publishing|language=en|doi=10.1007/978-3-319-73975-5_8|isbn=978-3-319-73975-5 }}</ref>。これらの金属は、タンパク質上の特定の部位に強固に結合し、金属補因子<!-- metal cofactors -->として機能する。酵素補因子は、酵素の触媒作用の役割を果たし、触媒作用中に一時的に変化することはあっても、その後は必ず元の状態に戻る。生物は、特定の[[膜輸送体|輸送担体]](トランスポーター)を通じて金属微量栄養素を生体内に取り込む。これらの栄養素は、使用しないときには[[フェリチン]]や[[メタロチオネイン]]などの貯蔵タンパク質に結合している<ref>{{cite journal | vauthors = Cousins RJ, Liuzzi JP, Lichten LA | title = Mammalian zinc transport, trafficking, and signals | journal = The Journal of Biological Chemistry | volume = 281 | issue = 34 | pages = 24085–9 | date = August 2006 | pmid = 16793761 | doi = 10.1074/jbc.R600011200 | url = https://www.jbc.org/content/281/34/24085 | doi-access = free | access-date = 24 June 2020 | archive-date = 25 June 2020 | archive-url = https://web.archive.org/web/20200625055940/https://www.jbc.org/content/281/34/24085 | url-status = live }}</ref><ref>{{cite journal | vauthors = Dunn LL, Suryo Rahmanto Y, Richardson DR | title = Iron uptake and metabolism in the new millennium | journal = Trends in Cell Biology | volume = 17 | issue = 2 | pages = 93–100 | date = February 2007 | pmid = 17194590 | doi = 10.1016/j.tcb.2006.12.003 }}</ref>。 |
|||
==== 無機態炭素、窒素、硫黄の取り込み ==== |
|||
無機態の炭素は主に[[二酸化炭素]]として固定される。炭酸固定経路は光合成の[[カルビン - ベンソン回路]]や[[クエン酸回路|還元的クエン酸回路]]、[[メタン生成経路]]などによる。カルビン回路は光化学反応によって生じたATPおよびNADPH、還元的クエン酸回路はピルビン酸:フェレドキシン酸化還元酵素による、通常のクエン酸回路の逆行、メタン生成経路はATP合成と炭酸固定が同時に行われる。炭酸固定によって生じた生産物は通常は糖としてあるいは異化の中間代謝物として、高次の生合成に組み込まれる。詳しくは当該記事へ。 |
|||
== 異化 == |
|||
水圏以外にも豊富に存在する窒素源としては大気中の窒素ガスが挙げられる。窒素ガスは[[窒素固定]]という代謝系のみで[[アンモニア]]まで還元される。窒素固定は[[根粒菌]]などでは呼吸による、[[シアノバクテリア]]では光化学系Iの循環的光リン酸化によるATP生成にて窒素固定が行われる。窒素固定反応は以下の通りである。 |
|||
{{Main|異化 (生物学)}} |
|||
*[[窒素|N<sub>2</sub>]] + 6[[フェレドキシン|Fd<sup>red</sup>]] + 12ATP + 6[[水素イオン|H<sup>+</sup>]] → 2[[アンモニア|NH<sub>3</sub>]] + 12[[アデノシン二リン酸|ADP]] + 12P<sub>i</sub> |
|||
*2H<sup>+</sup> + 2Fd<sup>red</sup> + 4ATP → H<sub>2</sub> + 4ADP + 4P<sub>i</sub> |
|||
硝酸塩は有機物窒素と比べて酸化的であり、同化的硝酸還元と言う過程にてアンモニアまで還元される。 |
|||
*[[硝酸|NO<sub>3</sub><sup>-</sup>]] + [[ニコチンアミドアデニンジヌクレオチド|NAD(P)H]] + H<sup>+</sup> → [[亜硝酸|NO<sub>2</sub><sup>-</sup>]] + NAD(P)<sup>+</sup> + H<sub>2</sub>O |
|||
*NO<sub>2</sub><sup>-</sup> + 6Fd<sup>red</sup> → NH<sub>3</sub> + 2H<sub>2</sub>O |
|||
最終産物のアンモニアは下記の系により[[アミノ酸]]に取り込まれる。 |
|||
また、アンモニアに含まれる窒素の酸化レベルは有機物窒素と同一であり、還元型ピリジンヌクレオチドなどは必要としない。アンモニア同化反応は以下の3つがある。 |
|||
*[[ケトグルタル酸]](クエン酸回路中間体) + NH<sub>3</sub> → [[グルタミン酸]] |
|||
*グルタミン酸 + NH<sub>3</sub> → [[グルタミン]] |
|||
*[[アスパラギン酸]] + NH<sub>3</sub> → [[アスパラギン]] |
|||
異化作用は、大きな分子を分解する一連の代謝過程である。これらの過程には、食物分子の分解と酸化が含まれる。異化反応の主な目的は、分子を構築する同化反応に必要なエネルギーと成分を供給することである<ref name="Alberts 2002">{{cite book| vauthors = Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P |date=2002|chapter=How Cells Obtain Energy from Food |url= https://www.ncbi.nlm.nih.gov/books/NBK26882/ |title=Molecular Biology of the Cell|edition=4th|language=en|via=NCBI|access-date=25 June 2020|archive-date=5 July 2021|archive-url=https://web.archive.org/web/20210705091156/https://www.ncbi.nlm.nih.gov/books/NBK26882/|url-status=live}}</ref>。具体的な異化反応は生物によって異なり、生物はそのエネルギー、水素、および炭素([[主要栄養素|主要栄養群]])の供給源によって下表のように分類することができる。{{Ill2|有機栄養生物|en|Organotroph}}は、水素原子や電子の供給源として有機分子を利用し、{{Ill2|無機栄養生物|en|Lithotroph}}は無機基質を利用する。[[光栄養生物]]は太陽光を[[化学エネルギー]]に変換し<ref>{{cite journal| vauthors = Raven J |date=2009-09-03|title=Contributions of anoxygenic and oxygenic phototrophy and chemolithotrophy to carbon and oxygen fluxes in aquatic environments|url=http://www.int-res.com/abstracts/ame/v56/n2-3/p177-192/|journal=Aquatic Microbial Ecology|language=en|volume=56|pages=177–192|doi=10.3354/ame01315|issn=0948-3055|doi-access=free|access-date=25 June 2020|archive-date=25 June 2020|archive-url=https://web.archive.org/web/20200625091103/http://www.int-res.com/abstracts/ame/v56/n2-3/p177-192/|url-status=live}}</ref>、[[化学栄養生物]]は[[有機分子]]、[[水素]]、[[硫化水素]]、{{Ill2|鉄イオン|en|Ferrous}}{{Enlink|Ferrous|英語版|en}}などの還元型供与体分子から[[酸素]]、[[硝酸塩]]、[[硫酸塩]]に電子を移動させる[[酸化還元反応]]に依存する。動物では、この反応によって複雑な[[有機分子]]が分解され、[[二酸化炭素]]や水などの単純な分子になる。植物や[[シアノバクテリア]]などの[[光合成]]生物も、同様の電子移動反応によって、太陽光から吸収したエネルギーを蓄積している<ref name="Nelson2004">{{cite journal | vauthors = Nelson N, Ben-Shem A | title = The complex architecture of oxygenic photosynthesis | journal = Nature Reviews. Molecular Cell Biology | volume = 5 | issue = 12 | pages = 971–82 | date = December 2004 | pmid = 15573135 | doi = 10.1038/nrm1525 | s2cid = 5686066 }}</ref>。 |
|||
硫黄は同化的硫酸還元によってタンパク質に[[チオール]]あるいは[[スルホ基]]として取り込まれる。硫酸塩はタンパク質中の硫黄と比べて還元的であり、[[アデノシン]]と結合することにより活性型の硫黄(ホスホアデノシンホスホ硫酸;PAPS)の状態でタンパク質と硫黄が結合する。 |
|||
{| class="wikitable float-right" style="text-align:center;" |
|||
*[[硫酸|SO<sub>4</sub><sup>-</sup>]] + ATP → APS + [[ピロリン酸|PP<sub>i</sub>]] |
|||
|+代謝による生物の分類 <ref name=":1">{{cite book| vauthors = Madigan MT, Martinko JM |title=Brock Mikrobiologie|date=2006|publisher=Pearson Studium|isbn=3-8273-7187-2|edition=11., überarb. Aufl|location=München|pages=604, 621|oclc=162303067}}</ref> |
|||
*APS + ATP → PAPS + ADP |
|||
|- |
|||
*PAPS + Protein[[チオール|-SH基]] → Protein-S[[亜硫酸|-SO<sub>3</sub><sup>-</sup>]](このProteinの末端は含硫黄アミノ酸である[[システイン]]) |
|||
| rowspan="2" style="background:#ff0;" |エネルギー源 || style="background:#ff0;" | 太陽光 || style="background:#ff0;" | 光- || colspan="2" rowspan="2" | || rowspan="6" style="background:#7fc31c;" | -栄養生物 |
|||
*Protein-S-SO<sub>3</sub><sup>-</sup> + 6Fd<sup>red</sup> → S<sub>2</sub><sup>-</sup>(有機物として利用され得る硫黄) + S-S結合を有するタンパク質 |
|||
|- style="background:#ff0;" |
|||
*Protein S-S bond + NADPH → Protein-SH + NADP<sup>+</sup> |
|||
|| 分子 || style="background:#ff0;" | 化学- |
|||
S<sub>2</sub><sup>-</sup>はその後、システイン、ホモシステインを経て[[メチオニン]]に取り込まれる。ただし、硫黄代謝は更に多様であると考えられており、異化型硫酸還元や硫黄酸化などでは、更に複雑な中間体が生じている可能性が示唆されている。 |
|||
|- |
|||
| rowspan="2" style="background:#ffb300;" | 水素または電子供与体 || style="background:#ffb300;" | 有機化合物 || rowspan="2" | || style="background:#ffb300;" | 有機- || rowspan="2" | |
|||
|- style="background:#ffb300;" |
|||
|| 有機化合物 || style="background:#ffb300;" | 無機- |
|||
|- |
|||
| rowspan="2" style="background:#fb805f;" | 炭素源 || style="background:#fb805f;" | 有機化合物 || colspan="2" rowspan="2" | || style="background:#fb805f;" | 従属- |
|||
|- style="background:#fb805f;" |
|||
|| 無機化合物 || style="background:#fb805f;" | 独立- |
|||
|} |
|||
動物でもっとも多く見られる一連の異化反応は、大きく3つの段階に分けることができる。第一段階では、[[タンパク質]]、[[多糖]]、[[脂質]]などの大きな有機分子を細胞外で消化し、より小さな成分に分解する。次に、これらの小分子は細胞に取り込まれ、さらに小さな分子、典型的には[[アセチル補酵素A]](アセチルCoA)に変換され、若干のエネルギーを放出する。最終段階では、アセチルCoA上のアセチル基が[[クエン酸回路]]と[[電子伝達系]]で水と二酸化炭素に酸化され、補酵素の[[ニコチンアミドアデニンジヌクレオチド]](NAD<sup>+</sup>)をNADHに還元しながら、より多くのエネルギーを放出する<ref name="Alberts 2002" />。 |
|||
==== ヌクレオチド、アミノ酸、炭水化物および脂肪酸の生合成 ==== |
|||
上記の反応により細胞内取り込まれた炭素、窒素、硫黄は豊富に存在している水と化合し、生体高分子の単量体である[[ヌクレオチド]]、アミノ酸、[[糖]]などの有機物を生合成する。これらの生体高分子のモノマーには前駆体として中央代謝系(解糖系、クエン酸回路)の中間代謝物が用いられることが多い。 |
|||
=== 消化 === |
|||
核酸 (DNA、RNA) のモノマーであるヌクレオチドは[[プリン (化学)|プリン]]、[[ピリミジン]]塩基に五炭糖であるリボースあるいはデオキシリボースの5'位にリン酸が結合している構造をとっている。プリン(アデニン、グアニン)ピリミジン(ウラシル、シトシン)ヌクレオチドはそれぞれ異なる経路にて合成される。まずピリミジンヌクレオチドの合成系は以下のとおりである。 |
|||
{{further|消化|消化管}} |
|||
#[[カルバモイルリン酸]] + [[アスパラギン酸]] → [[オロチン酸]] |
|||
#リボース5リン酸 + ATP → ホスホリボシル1ピロリン酸 |
|||
#オロチン酸 + ホスホリボシル1ピロリン酸 → オロチジン5'リン酸 (OMP) |
|||
#オロチジン5'リン酸 → ウリジン5'リン酸 (UMP) + CO<sub>2</sub> |
|||
#ウリジン5'リン酸(UMP) + ATP → [[ウリジン三リン酸]] (UTP) |
|||
#ウリジン三リン酸 + [[グルタミン]] → [[シチジン三リン酸]] (CTP) |
|||
リボース5リン酸は[[ペントースリン酸経路]]より生じている。またアスパラギン酸は後述するアミノ酸合成系より生じている。カルバモイルリン酸はアミノ酸とリン酸を基質としてカルバモイルリン酸合成酵素により合成される。プリン合成系については以下のとおりである。 |
|||
#リボース5リン酸 + ATP → ホスホリボシル1ピロリン酸 |
|||
#ホスホリボシル1ピロリン酸 + アスパラギンあるいはグルタミン酸由来の[[アミノ基]] → ホスホリボシルアミン |
|||
#ホスホリボシルアミン + [[グリシン]] + ATP → グリシナマイドヌクレオチド |
|||
#グリシナマイドヌクレオチド + グルタミン由来アミノ基 + ATP + [[葉酸|ホルミルTHFA]]由来の[[アルデヒド基]] → 5アミノイミダゾールリボヌクレオチド |
|||
#5アミノイミダゾールリボヌクレオチド + ATP + CO<sub>2</sub> + アスパラギン酸由来のアミノ基 → 5アミノイミダゾール4サクシノカルボキサミドリボヌクレオチド |
|||
#5アミノイミダゾール4サクシノカルボキサミドリボヌクレオチド + ホルミルTHFA由来のアルデヒド基 → イノシン5'リン酸 (IMP) |
|||
#イノシン5'リン酸 + アスパラギン酸 + ATP → [[アデノシン三リン酸]] (ATP) |
|||
#イノシン5'リン酸 + グルタミン + ATP → [[グアノシン三リン酸]] (GTP) |
|||
上記の過程で合成されたリボヌクレオチド (RNA) はリボース部位が還元を受けることによってデオキシリボースとなり、デオキシリボヌクレオチド (DNA) が合成される。また、DNAにおいてアデニンと相補的塩基対を構成するチミンはピリミジン塩基でありながらはウラシル、シトシンとは異なる経路にて合成される。チミン合成系には[[葉酸]]およびコバミド([[ビタミンB12]]の補酵素形)を要求することがわかっている。また、上記の新生経路(de novo経路)のみならず、使用済みの核酸を再利用するサルベージ経路も存在する。 |
|||
細胞は高分子を直接処理することができないため、タンパク質や多糖などの高分子は、細胞の代謝に利用される前に、より小さな単位に分解されなければならない。高分子の消化には、さまざまな種類の酵素が使用される。これらの[[消化酵素]]には、タンパク質をアミノ酸に分解する[[プロテアーゼ]]や、多糖を[[単糖]]に分解する[[グリコシドヒドロラーゼ|グリコシドヒドラーゼ]](糖質加水分解酵素)がある<ref>{{cite book| vauthors = Demirel Y |title=Energy : production, conversion, storage, conservation, and coupling|publisher=Springer|year=2016|isbn=978-3-319-29650-0|edition=Second|location=Lincoln|pages=431|oclc=945435943}}</ref>。 |
|||
タンパク質を構成する20種のアミノ酸については各アミノ酸の炭素骨格から生合成経路が決定される。アミノ酸は炭素骨格によって以下の『族』に分類することが可能である。 |
|||
*'''グルタミン酸族''':[[グルタミン酸]]、[[グルタミン]]、[[アルギニン]]、[[プロリン]] |
|||
*'''アスパラギン酸族''':[[アスパラギン酸]]、[[アスパラギン]]、[[リシン]]、[[メチオニン]]、[[スレオニン]]、[[イソロイシン]] |
|||
*'''芳香族''':[[トリプトファン]]、[[フェニルアラニン]]、[[チロシン]] |
|||
*'''セリン族''':[[セリン]]、[[グリシン]]、[[システイン]] |
|||
*'''ピルビン酸族''':[[アラニン]]、[[バリン]]、[[ロイシン]] |
|||
なお、それぞれの族の前駆体および由来する代謝系は以下のとおりである。 |
|||
*'''グルタミン酸族''':[[ケトグルタル酸]](クエン酸回路) |
|||
*'''アスパラギン酸族''':[[オキサロ酢酸]](クエン酸回路) |
|||
*'''芳香族''':[[ホスホエノールピルビン酸]](解糖系:EM経路、ED経路) + エリトロース4リン酸(ペントースリン酸経路) |
|||
*'''セリン族''':3ホスホグリセリン酸(解糖系:EM経路、ED経路) |
|||
*'''ピルビン酸族''':[[ピルビン酸]](解糖系:EM経路、ED経路) |
|||
なお、上記の例は中央代謝系を基準にしたものであり、中央代謝系以外に回路を所持している、例えば植物などでは芳香族は[[シキミ酸経路]]、セリン族は[[カルビン - ベンソン回路]]由来のグリセリン酸リン酸より生合成を行う。なお、[[ヒスチジン]]のみが上記の族に属さずペントースリン酸経路由来のリボース5リン酸より合成される。 |
|||
微生物は単純に消化酵素を周囲に分泌するのに対し<ref>{{cite journal | vauthors = Häse CC, Finkelstein RA | title = Bacterial extracellular zinc-containing metalloproteases | journal = Microbiological Reviews | volume = 57 | issue = 4 | pages = 823–37 | date = December 1993 | pmid = 8302217 | pmc = 372940 | doi = 10.1128/MMBR.57.4.823-837.1993 }}</ref><ref>{{cite journal | vauthors = Gupta R, Gupta N, Rathi P | title = Bacterial lipases: an overview of production, purification and biochemical properties | journal = Applied Microbiology and Biotechnology | volume = 64 | issue = 6 | pages = 763–81 | date = June 2004 | pmid = 14966663 | doi = 10.1007/s00253-004-1568-8 | s2cid = 206934353 }}</ref>、動物は[[胃]]や[[膵臓]]などの消化管や[[唾液腺]]にある特殊な細胞から消化酵素を分泌する<ref>{{cite journal | vauthors = Hoyle T | title = The digestive system: linking theory and practice | journal = British Journal of Nursing | volume = 6 | issue = 22 | pages = 1285–91 | year = 1997 | pmid = 9470654 | doi = 10.12968/bjon.1997.6.22.1285 }}</ref>。これらの細胞外酵素は、タンパク質をアミノ酸に、多糖を単糖に分解し、[[能動輸送]]タンパク質によって細胞内に輸送される<ref>{{cite journal | vauthors = Souba WW, Pacitti AJ | title = How amino acids get into cells: mechanisms, models, menus, and mediators | journal = Journal of Parenteral and Enteral Nutrition | volume = 16 | issue = 6 | pages = 569–78 | year = 1992 | pmid = 1494216 | doi = 10.1177/0148607192016006569 }}</ref><ref>{{cite journal | vauthors = Barrett MP, Walmsley AR, Gould GW | title = Structure and function of facilitative sugar transporters | journal = Current Opinion in Cell Biology | volume = 11 | issue = 4 | pages = 496–502 | date = August 1999 | pmid = 10449337 | doi = 10.1016/S0955-0674(99)80072-6 }}</ref>。[[File:Catabolism schematic.svg|thumb|left|upright=1.35|異化作用として知られる、[[タンパク質]]、[[炭水化物]]、[[脂肪]]の分解過程を簡略化した図。これらの大栄養素が、体内でエネルギーやその他の目的に利用できるより小さな分子に分解される主要な段階を示している。]] |
|||
すべての前駆体は中央代謝系に由来するものであり、理論上、糖さえ摂取すればすべてのアミノ酸を合成できるはずだが、マウス、ヒトにおいては[[必須アミノ酸]]といわれる一群のアミノ酸を経口摂取する必要がある。それらは芳香族、アスパラギン酸族およびピルビン酸族のアミノ酸である。 |
|||
=== 有機化合物からのエネルギー === |
|||
糖については、解糖系の逆行である[[糖新生系]]にて合成される。また、[[ペントースリン酸経路]]においては多種多様な糖が合成される。また還元的ペントースリン酸経路と呼称されるカルビン - ベンソン回路においても同様である。 |
|||
{{further|細胞呼吸|発酵|炭水化物異化|{{ill2|脂肪酸代謝|en|Fatty acid metabolism}}|{{ill2|タンパク質代謝|en|Protein catabolism}}}} |
|||
炭水化物は、炭水化物異化作用と呼ばれる過程を経て、より小さな単位に分解される。炭水化物は通常、[[単糖]]に消化された後、細胞内に取り込まれる<ref>{{cite journal | vauthors = Bell GI, Burant CF, Takeda J, Gould GW | title = Structure and function of mammalian facilitative sugar transporters | journal = The Journal of Biological Chemistry | volume = 268 | issue = 26 | pages = 19161–4 | date = September 1993 | doi = 10.1016/S0021-9258(19)36489-0 | pmid = 8366068 | doi-access = free }}</ref>。細胞内では、主に[[解糖系|'''解糖''']]という分解経路で分解され、[[グルコース]]や[[フルクトース]]などの糖類が[[ピルビン酸]]に変換され、若干のATPが生産される<ref name="Bouche">{{cite journal | vauthors = Bouché C, Serdy S, Kahn CR, Goldfine AB | title = The cellular fate of glucose and its relevance in type 2 diabetes | journal = Endocrine Reviews | volume = 25 | issue = 5 | pages = 807–30 | date = October 2004 | pmid = 15466941 | doi = 10.1210/er.2003-0026 | df = dmy-all | doi-access = free }}</ref>。ピルビン酸はその後、いくつかの代謝経路で中間体として利用されるが、もっとも一般的には[[細胞呼吸|好気性]](酸素を伴う)解糖によって[[アセチルCoA]]に変換され、[[クエン酸回路]]に入る。クエン酸回路でも若干のATPが作られるが、主な生成物はアセチルCoAが酸化されるときにNAD<sup>+</sup>から作られる[[ニコチンアミドアデニンジヌクレオチド|NADH]]で、老廃物として二酸化炭素が放出される。[[嫌気性生物|嫌気性]]条件下では、代わりに解糖によって[[乳酸]]が生成し、[[乳酸デヒドロゲナーゼ|乳酸デヒドロゲナーゼ(乳酸脱水素酵素)]]がNADHをNAD<sup>+</sup>に再酸化し、解糖で再利用される<ref>{{cite journal | vauthors = Alfarouk KO, Verduzco D, Rauch C, Muddathir AK, Adil HH, Elhassan GO, Ibrahim ME, David Polo Orozco J, Cardone RA, Reshkin SJ, Harguindey S | display-authors = 6 | title = Glycolysis, tumor metabolism, cancer growth and dissemination. A new pH-based etiopathogenic perspective and therapeutic approach to an old cancer question | journal = Oncoscience | volume = 1 | issue = 12 | pages = 777–802 | date = 18 December 2014 | pmid = 25621294 | pmc = 4303887 | doi = 10.18632/oncoscience.109 | doi-access = free }}</ref>。グルコース分解のもう一つの代替経路は[[ペントースリン酸経路]]で、補酵素[[NADPH]]を還元して、[[核酸]]の糖成分である[[リボース]]などの[[ペントース|ペントース糖]]を生成する{{要出典|date=2022年12月}}。 |
|||
[[脂肪酸]]は[[アセチルCoA]]を基質として脂肪酸合成経路にて合成される。アセチルCoAは解糖系に由来するものであるが必要な還元力には[[ニコチンアミドアデニンジヌクレオチドリン酸|NADPH]]が使用される。NADPHはペントースリン酸経路より供給され、後述するが異化経路と同化経路の密接なかかわりをここにも見ることができる。 |
|||
脂肪は、[[加水分解]]により遊離脂肪酸とグリセロールに異化される。グリセロールは解糖に入り、脂肪酸は[[β酸化]]によって分解されてアセチルCoAを生成し、クエン酸回路に送られる。脂肪酸は炭水化物よりも酸化されたときに多くのエネルギーを放出する。一部の[[細菌]]では、β酸化と同様の過程でステロイドを分解し、この分解過程でアセチルCoA、プロピオニルCoA、およびピルビン酸が大量に放出され、これらはすべて細胞内でエネルギーとして利用できる。[[結核菌]](''Mycobacterium tuberculosis'')は、脂質である[[コレステロール]]を唯一の炭素源として増殖することができ、コレステロールの利用経路に関わる遺伝子は、結核菌の感染ライフサイクルのさまざまな段階において重要であることが分かっている<ref>{{cite journal | vauthors = Wipperman MF, Sampson NS, Thomas ST | title = Pathogen roid rage: cholesterol utilization by Mycobacterium tuberculosis | journal = Critical Reviews in Biochemistry and Molecular Biology | volume = 49 | issue = 4 | pages = 269–93 | date = 2014 | pmid = 24611808 | pmc = 4255906 | doi = 10.3109/10409238.2014.895700 }}</ref>。 |
|||
==== 生体高分子の生合成 ==== |
|||
上記の過程にて合成された核酸、タンパク質、多糖の各モノマーはポリマーとなって生体高分子となる。各単量体の名称および結合の名称は以下のとおりである。 |
|||
*'''核酸''':ヌクレオチドのホスホジエステル結合ポリマー |
|||
*'''タンパク質''':アミノ酸のペプチド結合ポリマー |
|||
*'''多糖''':単糖のグリコシド結合ポリマー |
|||
ただし、各モノマーが重合するよりもポリマーが加水分解を受ける方が[[ギブス自由エネルギー|自由エネルギー]]的に低く、したがって各モノマーは活性化されなければならない。各モノマーの活性化された形状とは以下のとおりである。 |
|||
*'''ヌクレオチド''':ヌクレオシド三リン酸 |
|||
*'''アミノ酸''':アミノアシルtRNA |
|||
*'''糖''':糖-ヌクレオシド二リン酸 |
|||
核酸には[[ゲノム|ゲノムDNA]]、[[プラスミド]]、ミトコンドリアDNA、葉緑体DNAあるいは[[rRNA]]、[[tRNA]]、[[mRNA]]といったいくつかの種類が存在している。遺伝情報を保存したDNAが合成される際は[[DNA複製|複製]]という過程にて、生合成が行われる。また、遺伝情報を発現する際に用いられるRNAはすべてが[[転写 (生物学)|転写]]によって生合成される。転写された各RNAの共同的な働きにより遺伝情報は[[翻訳 (生物学)|翻訳]]され、タンパク質の生合成が行われる。各過程の詳細な説明は、該当記事参照。 |
|||
[[アミノ酸]]は、タンパク質やその他の生体分子の合成に使われたり、エネルギーを作り出すために酸化されて[[尿素]]と二酸化炭素になる<ref>{{cite journal | vauthors = Sakami W, Harrington H | title = Amino Acid Metabolism | journal = [[:en:Annual Review of Biochemistry|Annual Review of Biochemistry]] | volume = 32 | pages = 355–98 | year = 1963 | pmid = 14144484 | doi = 10.1146/annurev.bi.32.070163.002035 }}</ref>。酸化経路では、まず[[アミノ基転移酵素]](トランスアミナーゼ)によりアミノ基が除去される。その後、アミノ基は[[尿素回路]]に送られ、脱アミノ化された炭素骨格が[[ケト酸]]の形で残される。これらのケト酸の中には、[[グルタミン酸]]の脱アミノ化によって生成する[[α-ケトグルタル酸]]のように、クエン酸回路の中間体となるものもある<ref>{{cite journal | vauthors = Brosnan JT | title = Glutamate, at the interface between amino acid and carbohydrate metabolism | journal = The Journal of Nutrition | volume = 130 | issue = 4S Suppl | pages = 988S–90S | date = April 2000 | pmid = 10736367 | doi = 10.1093/jn/130.4.988S | doi-access = free }}</ref>。さらに、[[糖原性アミノ酸]]は、[[糖新生]]によってグルコースに変換されることもある(後述)<ref>{{cite journal | vauthors = Young VR, Ajami AM | title = Glutamine: the emperor or his clothes? | journal = The Journal of Nutrition | volume = 131 | issue = 9 Suppl | pages = 2449S–59S; discussion 2486S–7S | date = September 2001 | pmid = 11533293 | doi = 10.1093/jn/131.9.2449S | doi-access = free }}</ref>。 |
|||
多糖の合成については不明な部分が多いが、糖新生系あるいはカルビン - ベンソン回路にてデンプンが合成される。またもっとも現存量の多い有機物である[[セルロース]]はドリコールというアルコールおよびタンパク質が多糖キャリアーとなって生合成が行われる。 |
|||
== エネルギー転換 == |
|||
=== 異化と同化の関連、代謝経路のつながり === |
|||
異化と同化による物質代謝は関連している。それらの関連については、異化によって得られたエネルギーを同化に使用すると言う点のほかに、何らかの有機物が不足した際に代謝系の連結によって不足した物質をある程度補えるという点がある。 |
|||
=== 酸化的リン酸化 === |
|||
生物を構成する物質を大まかに分類すると糖(核酸など)、アミノ酸(タンパク質)、脂肪酸(生体膜)となる。いずれの物質も生物にとって必要欠くべからざるものであり、一部の例外(寄生を行う生物など)を除いてはこれらの物質に関する代謝系(異化、同化のいずれも)を有している。それぞれの物質に対応する代謝系は以下の通りである。 |
|||
{{further|酸化的リン酸化|化学浸透|ミトコンドリア}} |
|||
*'''糖'''・・・同化:糖新生系(解糖系の逆行)、異化:解糖系。 |
|||
*'''アミノ酸'''・・・同化:解糖系とクエン酸回路を中心としたアミノ酸合成系、異化:解糖系とクエン酸回路を中心とした分解経路。詳細は[[アミノ酸の代謝分解]] |
|||
*'''脂肪酸'''・・・同化:脂肪酸生合成系、異化:β酸化経路。 |
|||
酸化的リン酸化は、クエン酸回路に見られるように、有機分子から奪った電子を酸素に移動し、放出されたエネルギーでATPを作る。[[真核生物]]では、ミトコンドリアの膜にある[[電子伝達系]]と呼ばれる一連のタンパク質がこれを行っている。一方、[[原核生物]]では、これらのタンパク質は細胞の[[内膜]]に存在する<ref>{{cite journal | vauthors = Hosler JP, Ferguson-Miller S, Mills DA | title = Energy transduction: proton transfer through the respiratory complexes | journal = [[:en:Annual Review of Biochemistry|Annual Review of Biochemistry]] | volume = 75 | pages = 165–87 | year = 2006 | pmid = 16756489 | pmc = 2659341 | doi = 10.1146/annurev.biochem.75.062003.101730 }}</ref>。これらのタンパク質は、[[ニコチンアミドアデニンジヌクレオチド|NADH]]などの[[還元剤|還元]]分子からのエネルギーを使って、膜を超えて[[陽子|プロトン(陽子)]]を送り出す<ref>{{cite journal | vauthors = Schultz BE, Chan SI | title = Structures and proton-pumping strategies of mitochondrial respiratory enzymes | journal = [[:en:Annual Review of Biophysics and Biomolecular Structure|Annual Review of Biophysics and Biomolecular Structure]] | volume = 30 | pages = 23–65 | year = 2001 | pmid = 11340051 | doi = 10.1146/annurev.biophys.30.1.23 | url = https://authors.library.caltech.edu/1623/1/SCHarbbs01.pdf | access-date = 11 November 2019 | archive-date = 22 January 2020 | archive-url = https://web.archive.org/web/20200122235247/https://authors.library.caltech.edu/1623/1/SCHarbbs01.pdf | url-status = live }}</ref>。 |
|||
これらのうち、解糖系はほとんどの生物が持っている基本的なエネルギー獲得経路であり<ref name="SeikagakuDic246-5">[[#生化学辞典(2版)|生化学辞典第2版、p.246-247 【解糖系】]]</ref>、クエン酸回路も[[真核生物]]ではミトコンドリア、[[原生生物]]では膜系で行われる<ref name="SeikagakuDic365-4">[[#生化学辞典(2版)|生化学辞典第2版、p.365-366 【クエン酸回路】]]</ref>。脂肪酸生合成系の出発物質およびβ酸化の最終産物は解糖系の最終産物である[[アセチルCoA]]である。また、各アミノ酸の分解における中間代謝物質は、以下の通りである。 |
|||
[[File:ATPsyn.gif|thumb|right|[[ATP合成酵素]]がATPを生成する機構を描いた図。赤が[[アデノシン三リン酸|ATP]]、ピンクが[[アデノシン二リン酸|ADP]]と[[リン酸]]、黒が回転する軸サブユニットを示している。]] |
|||
*中間代謝物を解糖系に含むもの |
|||
プロトンを送り出すことによって、ミトコンドリア膜を隔てたプロトン[[拡散|濃度差]]が生じ、[[電気化学的勾配|電気化学的な勾配]]が生じる<ref>{{cite journal | vauthors = Capaldi RA, Aggeler R | title = Mechanism of the F(1)F(0)-type ATP synthase, a biological rotary motor | journal = Trends in Biochemical Sciences | volume = 27 | issue = 3 | pages = 154–60 | date = March 2002 | pmid = 11893513 | doi = 10.1016/S0968-0004(01)02051-5 }}</ref>。この勾配が動力となって、プロトンは[[ATP合成酵素]]と呼ばれる酵素の基部を経由してミトコンドリア内に戻される。プロトンの流入によってATP合成酵素の軸サブユニットが回転し、酵素ドメイン[[活性部位]]の形が変化し、これによって[[アデノシン二リン酸]]がリン酸化され、ATPへ変換される<ref name="Dimroth" />。 |
|||
**ピルビン酸:アラニン、システイン、グリシン、セリン、スレオニン |
|||
**アセチルCoA:ロイシン、イソロイシン、トリプトファン |
|||
**アセトアセチルCoA:フェニルアラニン、チロシン、リシン、ロイシン、トリプトファン |
|||
*中間代謝物をクエン酸回路に含むもの |
|||
**[[オキサロ酢酸]]:アスパラギン酸、アスパラギン |
|||
**[[フマル酸]]:チロシン、フェニルアラニン |
|||
**スクシニルCoA:イソロイシン、バリン、メチオニン |
|||
**2-オキソグルタル酸(正確にはグルタミン酸):アルギニン、ヒスチジン、グルタミン、プロリン |
|||
なお、上述したアミノ酸生合成経路と若干異なる点については、代謝の調節に関わっている(後述)。 |
|||
=== 無機化合物からのエネルギー === |
|||
中央代謝系を中心としたそれぞれの物質の異化と同化が行われる点について、例えば糖が不足した際にはアミノ酸および脂肪酸を摂取していれば生合成が可能である。脂肪酸の場合も同様で糖、アミノ酸から生合成できる。唯一アミノ酸は窒素および生体成分における硫黄の供給源となるので、ある程度摂取しなければならないが無機態の窒素および硫黄を利用可能な代謝系が存在することは上述の通りである。 |
|||
{{further|{{ill2|微生物代謝|en|Microbial metabolism}}|窒素循環}} |
|||
{{Ill2|化学合成無機栄養生物|en|Chemolithotroph|label=化学無機栄養}}とは、[[原核生物]]に見られる代謝の一種で、[[無機化合物]]の酸化によってエネルギーを得るものである。これらの生物は、[[水素]]<ref>{{cite journal | vauthors = Friedrich B, Schwartz E | title = Molecular biology of hydrogen utilization in aerobic chemolithotrophs | journal = [[:en:Annual Review of Microbiology|Annual Review of Microbiology]] | volume = 47 | pages = 351–83 | year = 1993 | pmid = 8257102 | doi = 10.1146/annurev.mi.47.100193.002031 }}</ref>、還元硫黄化合物([[硫化物]]、[[硫化水素]]、[[チオ硫酸]]など)<ref name="Physiology1" />、[[酸化鉄(II)|二価鉄イオン]](Fe(II))<ref>{{cite journal | vauthors = Weber KA, Achenbach LA, Coates JD | title = Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction | journal = Nature Reviews. Microbiology | volume = 4 | issue = 10 | pages = 752–64 | date = October 2006 | pmid = 16980937 | doi = 10.1038/nrmicro1490 | url = https://digitalcommons.unl.edu/cgi/viewcontent.cgi?article=1203&context=bioscifacpub | s2cid = 8528196 | access-date = 6 October 2019 | archive-date = 2 May 2019 | archive-url = https://web.archive.org/web/20190502051428/https://digitalcommons.unl.edu/cgi/viewcontent.cgi?article=1203&context=bioscifacpub | url-status = live }}</ref>、または[[アンモニア]]<ref>{{cite journal | vauthors = Jetten MS, Strous M, van de Pas-Schoonen KT, Schalk J, van Dongen UG, van de Graaf AA, Logemann S, Muyzer G, van Loosdrecht MC, Kuenen JG | display-authors = 6 | title = The anaerobic oxidation of ammonium | journal = FEMS Microbiology Reviews | volume = 22 | issue = 5 | pages = 421–37 | date = December 1998 | pmid = 9990725 | doi = 10.1111/j.1574-6976.1998.tb00379.x | doi-access = free }}</ref>を還元力源として利用し、これらの化合物を酸化することでエネルギーを得ている<ref>{{cite journal | vauthors = Simon J | title = Enzymology and bioenergetics of respiratory nitrite ammonification | journal = FEMS Microbiology Reviews | volume = 26 | issue = 3 | pages = 285–309 | date = August 2002 | pmid = 12165429 | doi = 10.1111/j.1574-6976.2002.tb00616.x | doi-access = free }}</ref>。これらの微生物過程は、{{Ill2|酢酸生成|en|Acetogenesis}}、[[硝化作用|硝化]]、[[脱窒]]などの地球規模での[[生物地球化学的循環]]において重要な役割を担い、[[土壌肥沃度|土壌の肥沃度]]を維持するのに不可欠である<ref>{{cite journal | vauthors = Conrad R | title = Soil microorganisms as controllers of atmospheric trace gases (H2, CO, CH4, OCS, N2O, and NO) | journal = Microbiological Reviews | volume = 60 | issue = 4 | pages = 609–40 | date = December 1996 | pmid = 8987358 | pmc = 239458 | doi = 10.1128/MMBR.60.4.609-640.1996 }}</ref><ref>{{cite journal | vauthors = Barea JM, Pozo MJ, Azcón R, Azcón-Aguilar C | title = Microbial co-operation in the rhizosphere | journal = Journal of Experimental Botany | volume = 56 | issue = 417 | pages = 1761–78 | date = July 2005 | pmid = 15911555 | doi = 10.1093/jxb/eri197 | doi-access = free }}</ref>。 |
|||
== 化学反応からの代謝の分類 == |
|||
代謝反応は何千何百の多種多様な代謝反応も化学的に分類すれば僅か6種類に分類することができる<ref>{{Cite book|title=ストライヤー生化学(第8版)|date=2018年8月28日|publisher=東京化学同人|ページ=p407〜p409}}</ref>。 |
|||
=== 光からのエネルギー === |
|||
=== 酸化還元反応(oxidation-reduction reaction) === |
|||
{{further|光栄養生物|光リン酸化|葉緑体}} |
|||
電子の授受による反応で多くの代謝経路において重要な要素となっている。以下が主な化学反応式である。 |
|||
[[植物]]、[[シアノバクテリア]]、[[紅色細菌]]、[[緑色硫黄細菌]]、および一部の[[原生生物]]では、太陽光からエネルギーを取り込むことができる。この過程は、後述する光合成の一部として、二酸化炭素を有機化合物に変換することにしばしば関連する。しかし、原核生物では、エネルギー捕捉系と[[炭素固定]]系を別々に働かせることもある。紅色細菌や緑色硫黄細菌は、太陽光をエネルギー源として利用するのと同時に、炭素固定と有機化合物の発酵を交互に行うことができる<ref>{{cite journal | vauthors = van der Meer MT, Schouten S, Bateson MM, Nübel U, Wieland A, Kühl M, de Leeuw JW, Sinninghe Damsté JS, Ward DM | display-authors = 6 | title = Diel variations in carbon metabolism by green nonsulfur-like bacteria in alkaline siliceous hot spring microbial mats from Yellowstone National Park | journal = Applied and Environmental Microbiology | volume = 71 | issue = 7 | pages = 3978–86 | date = July 2005 | pmid = 16000812 | pmc = 1168979 | doi = 10.1128/AEM.71.7.3978-3986.2005 | bibcode = 2005ApEnM..71.3978V }}</ref><ref>{{cite journal | vauthors = Tichi MA, Tabita FR | title = Interactive control of Rhodobacter capsulatus redox-balancing systems during phototrophic metabolism | journal = Journal of Bacteriology | volume = 183 | issue = 21 | pages = 6344–54 | date = November 2001 | pmid = 11591679 | pmc = 100130 | doi = 10.1128/JB.183.21.6344-6354.2001 }}</ref>。 |
|||
[[コハク酸]]+FAD⇆[[フマル酸]]+FADH2 |
|||
さまざまな生物において、太陽エネルギーの捕獲は、プロトン濃度勾配という形でエネルギーを蓄積するという点で、上述の酸化的リン酸化と類似している。このプロトン起電力がATP合成の動力源となる<ref>{{cite book | vauthors = Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P |date=2002|chapter=Energy Conversion: Mitochondria and Chloroplasts|url=https://www.ncbi.nlm.nih.gov/books/NBK21063/|title=Molecular Biology of the Cell | edition = 4th |language=en|access-date=3 July 2020|archive-date=15 December 2020|archive-url=https://web.archive.org/web/20201215131416/https://www.ncbi.nlm.nih.gov/books/NBK21063/|url-status=live}}</ref>。この[[電子伝達系]]を駆動するのに必要な電子は、{{Ill2|光合成反応中心|en|Photosynthetic reaction centre}}{{Enlink|Photosynthetic reaction centre|英語版|en}}と呼ばれる光捕集タンパク質から供給される。この反応中心は、{{Ill2|光合成色素|en|Photosynthetic pigment}}{{Enlink|Photosynthetic pigment|英語版|en}}の性質によって2種類に分類され、光合成細菌の多くは1種類しか持たないが、植物やシアノバクテリアは2種類とも持っている<ref>{{cite journal | vauthors = Allen JP, Williams JC | title = Photosynthetic reaction centers | journal = FEBS Letters | volume = 438 | issue = 1–2 | pages = 5–9 | date = October 1998 | pmid = 9821949 | doi = 10.1016/S0014-5793(98)01245-9 | s2cid = 21596537 }}</ref>。 |
|||
[[リンゴ酸]]+NAD+⇆[[オキサロ酢酸]]+NADH+H+ |
|||
植物、藻類、シアノバクテリアなどの光合成生物では、[[光化学系II]]{{Enlink|Photosystem|英語版|en}}が光エネルギーを利用して水から電子を奪って、老廃物として酸素を放出する。この電子は{{Ill2|シトクロムb6f複合体|en|Cytochrome b6f complex}}に渡され、そのエネルギーを使って[[葉緑体]]内の[[チラコイド膜]]を超えてプロトンを送り出す<ref name="Nelson2004" />。このプロトンが、再び膜を通過して戻ってくることで、先と同様にATP合成酵素を駆動する。電子は[[光化学系I]]を通り、補酵素NADP<sup>+</sup>を還元するために使われる<ref>{{cite journal | vauthors = Munekage Y, Hashimoto M, Miyake C, Tomizawa K, Endo T, Tasaka M, Shikanai T | title = Cyclic electron flow around photosystem I is essential for photosynthesis | journal = Nature | volume = 429 | issue = 6991 | pages = 579–82 | date = June 2004 | pmid = 15175756 | doi = 10.1038/nature02598 | bibcode = 2004Natur.429..579M | s2cid = 4421776 }}</ref>。この補酵素は、後述する[[カルビン回路]]に入るか、さらなるATP生成のために再利用される{{要出典|date=2022年12月}}。 |
|||
=== 連結反応(ligation reaction,ライゲーション反応) === |
|||
[[ATP開裂]]で得られたエネルギーを利用して炭素ー炭素間の[[共有結合]]の形成をする。 |
|||
== 同化 == |
|||
[[ピルビン酸]]+[[二酸化炭素]]+[[アデノシン三リン酸|ATP]]+[[水]]⇆[[オキサロ酢酸]]+[[アデノシン二リン酸|ADP]]+[[リン酸|P<sub>i</sub>]] |
|||
{{further|同化 (生物学)}} |
|||
同化作用とは、異化作用によって放出されたエネルギーを使って、複雑な分子を合成する一連の建設的な代謝過程のことである。一般に、細胞構造を構成する複雑な分子は、より小さくて単純な前駆体が組み合わさって、段階的に構築される。同化作用は3つの基本的な段階からなる。第一に、[[アミノ酸]]、[[単糖]]、[[イソプレノイド]]、[[ヌクレオチド]]などの前駆体の生成、第二に、これらの前駆体をATPからのエネルギーを使って反応型に活性化、第三に、これらの前駆体を[[タンパク質]]、[[多糖]]、[[脂質]]、[[核酸]]などの複合分子へ組み立てることである<ref name=":0">{{cite web| vauthors = Mandal A |date=2009-11-26|title=What is Anabolism?|url=https://www.news-medical.net/life-sciences/What-is-Anabolism.aspx|access-date=2020-07-04|website=News-Medical.net|language=en|archive-date=5 July 2020|archive-url=https://web.archive.org/web/20200705173136/https://www.news-medical.net/life-sciences/What-is-Anabolism.aspx|url-status=live}}</ref>。 |
|||
なお[[オキサロ酢酸]]は[[クエン酸回路]]で使用されるほか[[アスパラギン酸]]のような[[アミノ酸]]に変換される。 |
|||
生物の同化作用は、細胞内で作られる分子の供給源によって分類される。植物のような[[独立栄養生物]]は、[[二酸化炭素]]や水という単純な分子から多糖やタンパク質など、複雑な有機分子を細胞内で作ることができる。一方、[[従属栄養生物]]は、これらの複雑な分子を作るために、単糖やアミノ酸など、より複雑な化合物の供給源を必要とする。さらに、生物は最終的なエネルギー源によって分類される。光独立栄養生物と光従属栄養生物は光からエネルギーを得ており、化学独立栄養生物と化学従属栄養生物は酸化反応からエネルギーを得ている<ref name=":0" />。 |
|||
=== 異性化反応(isomerization reaction) === |
|||
[[異性体]]生成のために原子を[[転位]]させる。主に引き続き起こる反応の分子を調製するために行われることが多い。 |
|||
=== 炭素固定 === |
|||
[[クエン酸]]⇆[[イソクエン酸]] |
|||
{{further|光合成|炭素固定|化学合成 (生命科学)}} |
|||
[[File:Plagiomnium affine laminazellen.jpeg|thumb|光合成を行う[[葉緑体]] (緑色) で満たされた[[植物細胞]] (紫色の壁で囲まれた部分) の顕微鏡像。]] |
|||
光合成は、太陽光と[[二酸化炭素]](CO<sub>2</sub>)から炭水化物を合成することである。植物、シアノバクテリア、藻類などでは、酸素光合成によって水を分解し、老廃物として酸素を放出する。このとき、前述の[[光合成反応中心]]で作られたATPとNADPHのエネルギーを利用して、CO<sub>2</sub>を[[3-ホスホグリセリン酸]]に変換し、さらにグルコースに変換することができる。この炭素固定反応は、[[カルビン-ベンソン回路]]の一部として、[[Rubisco|RuBisCO]]という酵素によって行われる<ref>{{cite journal | vauthors = Miziorko HM, Lorimer GH | title = Ribulose-1,5-bisphosphate carboxylase-oxygenase | journal = [[:en:Annual Review of Biochemistry|Annual Review of Biochemistry]] | volume = 52 | pages = 507–35 | year = 1983 | pmid = 6351728 | doi = 10.1146/annurev.bi.52.070183.002451 }}</ref>。植物では3種類で光合成が行われており、[[C3型光合成]]、[[C4型光合成]]、[[CAM型光合成]]である。これらは、CO<sub>2</sub>がカルビン回路に送られる経路が異なり、C3型はCO<sub>2</sub>を直接固定するのに対し、C4型とCAM型光合成はまずCO<sub>2</sub>を他の化合物に取り込むことで、強い日射しや乾燥した環境に適応する<ref>{{cite journal | vauthors = Dodd AN, Borland AM, Haslam RP, Griffiths H, Maxwell K | title = Crassulacean acid metabolism: plastic, fantastic | journal = Journal of Experimental Botany | volume = 53 | issue = 369 | pages = 569–80 | date = April 2002 | pmid = 11886877 | doi = 10.1093/jexbot/53.369.569 | doi-access = free }}</ref>。 |
|||
上記の反応は[[クエン酸]]の[[ヒドロキシ基]]を[[転位]]することで[[三級アルコール]]を[[二級アルコール]]にしている。 |
|||
光合成原核生物では、より多様な炭素固定化の機構を持っている。これらの生物は、カルビン-ベンソン回路、[[逆クエン酸回路]]<ref>{{cite journal | vauthors = Hügler M, Wirsen CO, Fuchs G, Taylor CD, Sievert SM | title = Evidence for autotrophic CO2 fixation via the reductive tricarboxylic acid cycle by members of the epsilon subdivision of proteobacteria | journal = Journal of Bacteriology | volume = 187 | issue = 9 | pages = 3020–7 | date = May 2005 | pmid = 15838028 | pmc = 1082812 | doi = 10.1128/JB.187.9.3020-3027.2005 }}</ref>、またはアセチルCoAのカルボキシル化により炭素を固定できる<ref>{{cite journal | vauthors = Strauss G, Fuchs G | title = Enzymes of a novel autotrophic CO2 fixation pathway in the phototrophic bacterium Chloroflexus aurantiacus, the 3-hydroxypropionate cycle | journal = European Journal of Biochemistry | volume = 215 | issue = 3 | pages = 633–43 | date = August 1993 | pmid = 8354269 | doi = 10.1111/j.1432-1033.1993.tb18074.x }}</ref><ref>{{cite journal | vauthors = Wood HG | title = Life with CO or CO2 and H2 as a source of carbon and energy | journal = FASEB Journal | volume = 5 | issue = 2 | pages = 156–63 | date = February 1991 | pmid = 1900793 | doi = 10.1096/fasebj.5.2.1900793 | s2cid = 45967404 }}</ref>。また、原核生物の[[化学合成生物|化学合成独立栄養生物]]では、カルビン-ベンソン回路によってCO<sub>2</sub>を固定しつつ、無機化合物からのエネルギーで反応を駆動するものもある<ref>{{cite journal | vauthors = Shively JM, van Keulen G, Meijer WG | title = Something from almost nothing: carbon dioxide fixation in chemoautotrophs | journal = [[:en:Annual Review of Microbiology|Annual Review of Microbiology]] | volume = 52 | pages = 191–230 | year = 1998 | pmid = 9891798 | doi = 10.1146/annurev.micro.52.1.191 }}</ref>。 |
|||
=== 官能基転移反応(group-transfer reaction) === |
|||
一つの分子から別の分子への[[基|官能基]]の転移を行う反応。 |
|||
=== |
=== 炭水化物と糖鎖 === |
||
{{further|糖新生|グリオキシル酸回路|グリコーゲン合成|グリコシル化}} |
|||
水の付加によって原子間の結合を切断する。 |
|||
炭水化物の同化作用では、単純な[[有機酸]]を[[グルコース]]などの[[単糖]]分子に変換し、さらに[[デンプン]]などの[[多糖]]を作る場合がある。[[ピルビン酸]]、[[乳酸]]、[[グリセロール]]、[[3-ホスホグリセリン酸]]、[[アミノ酸]]などの化合物から[[グルコース]]を生成することを'''[[糖新生]]'''という。糖新生は、ピルビン酸が一連の中間体を経て[[グルコース-6-リン酸]]に変換するが、その多くは解糖と共通である<ref name="Bouche" />。しかし、この経路は単に解糖を逆にしたものではなく、いくつかの段階は非解糖系の酵素によって触媒されるという点に注意を要する。このことは、グルコースの生成と分解を別々に調節することができ、両方の経路が同時に進行する[[無益回路]]を防ぐことができる<ref>{{cite journal | vauthors = Boiteux A, Hess B | title = Design of glycolysis | journal = Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences | volume = 293 | issue = 1063 | pages = 5–22 | date = June 1981 | pmid = 6115423 | doi = 10.1098/rstb.1981.0056 | doi-access = free | bibcode = 1981RSPTB.293....5B }}</ref><ref>{{cite journal | vauthors = Pilkis SJ, el-Maghrabi MR, Claus TH | title = Fructose-2,6-bisphosphate in control of hepatic gluconeogenesis. From metabolites to molecular genetics | journal = Diabetes Care | volume = 13 | issue = 6 | pages = 582–99 | date = June 1990 | pmid = 2162755 | doi = 10.2337/diacare.13.6.582 | s2cid = 44741368 }}</ref>。 |
|||
=== 加水分解または酸化反応以外による炭素原子間の結合の開裂(cleavage of carbon bonds by means other than hydrolysis or oxidation) === |
|||
二つの[[基質 (化学)|基質]]から一つの生成物またはその逆反応、[[水]]または[[二酸化炭素]]が生成物の時には[[二重結合]]が形成される。このような反応を[[触媒]]する[[酵素]]は[[リアーゼ]]と呼ばれる。 |
|||
脂肪は一般的なエネルギー貯蔵形態であるが、ヒトなどの[[脊椎動物]]はアセチルCoAを[[ピルビン酸]]に変換する酵素機構<!-- enzymatic machinery -->を持たないため、貯蔵された[[脂肪酸]]を[[糖新生]]によってグルコースに変換することができない(植物には必要な酵素機構があるが、動物にはない)<ref name="Ensign">{{cite journal | vauthors = Ensign SA | title = Revisiting the glyoxylate cycle: alternate pathways for microbial acetate assimilation | journal = Molecular Microbiology | volume = 61 | issue = 2 | pages = 274–6 | date = July 2006 | pmid = 16856935 | doi = 10.1111/j.1365-2958.2006.05247.x | s2cid = 39986630 | doi-access = free }}</ref>。そのため、脊椎動物は長期間の飢餓状態に陥ると、脂肪酸をエネルギー源として代謝できない脳などの組織で、グルコースの代わりに脂肪酸から[[ケトン体]]を生成してエネルギーを供給しなければならない<ref>{{cite journal | vauthors = Finn PF, Dice JF | title = Proteolytic and lipolytic responses to starvation | journal = Nutrition | volume = 22 | issue = 7–8 | pages = 830–44 | year = 2006 | pmid = 16815497 | doi = 10.1016/j.nut.2006.04.008 }}</ref>。一方、植物や細菌など他の生物では、[[グリオキシル酸回路]]という代謝経路を持ち、クエン酸回路の[[脱炭酸]]段階を迂回してアセチルCoAを[[オキサロ酢酸]]に変換し、そこからグルコースを生成することで解決している<ref name="Ensign" /><ref name="Kornberg">{{cite journal | vauthors = Kornberg HL, Krebs HA | title = Synthesis of cell constituents from C2-units by a modified tricarboxylic acid cycle | journal = Nature | volume = 179 | issue = 4568 | pages = 988–91 | date = May 1957 | pmid = 13430766 | doi = 10.1038/179988a0 | s2cid = 40858130 | bibcode = 1957Natur.179..988K }}</ref>。グルコースは、脂肪と異なり、通常は血液中のグルコース濃度を維持していた糖新生を通じて組織内で利用可能なエネルギー源として、ほとんどの組織に貯蔵される<ref>{{cite journal| vauthors = Evans RD, Heather LC |date=June 2016|title=Metabolic pathways and abnormalities|journal=Surgery (Oxford)|volume=34|issue=6|pages=266–272|doi=10.1016/j.mpsur.2016.03.010|s2cid=87884121 |issn=0263-9319|url=https://ora.ox.ac.uk/objects/uuid:84c0a8e7-38e9-4de2-ba19-9f129a07987a|access-date=28 August 2020|archive-date=31 October 2020|archive-url=https://web.archive.org/web/20201031143458/https://ora.ox.ac.uk/objects/uuid:84c0a8e7-38e9-4de2-ba19-9f129a07987a|url-status=live}}</ref>。 |
|||
== エネルギー代謝 == |
|||
'''エネルギー代謝'''とは物質代謝に対して生命現象をエネルギーという観点から見た、より熱力学的要素の強い代謝の視点である。具体的には、エネルギー獲得系は光・食物・ある種の細菌では無機物などを元に、ミトコンドリア内膜や葉緑体などの生体膜で H<sup>+</sup> 輸送反応を介して生体のエネルギー通貨である ATP を合成する反応(ATP 合成系)である。エネルギー利用系は、[[筋肉]]を動かす[[ミオシン]]等の収縮性タンパク質やイオン輸送を行う[[ATPアーゼ]]は ATP を加水分解する。分子合成は酵素[[リガーゼ]]が ATP を消費して行う<ref name="SeikagakuDic192-6" />。 |
|||
多糖や[[糖鎖]](グリカンともいう)は、[[グリコシルトランスフェラーゼ]](糖転移酵素)という酵素によって、[[ウリジン二リン酸グルコース]](UDP-Glc)のような反応性の糖-リン酸供与体から単糖が逐次、成長する多糖上の糖受容体性の[[ヒドロキシ基]]に付加されることによって形成される。基質の環上のヒドロキシ基はいずれも糖受容体となりうるため、生成する多糖は直鎖でも分岐した構造でもよい<ref>{{cite book | vauthors = Freeze HH, Hart GW, Schnaar RL | chapter=Glycosylation Precursors |date=2015 |url=http://www.ncbi.nlm.nih.gov/books/NBK453043/ |title=Essentials of Glycobiology| veditors = Varki A, Cummings RD, Esko JD, Stanley P |edition=3rd |place=Cold Spring Harbor (NY) |publisher=Cold Spring Harbor Laboratory Press |pmid=28876856 |access-date=2020-07-08 |doi=10.1101/glycobiology.3e.005|doi-broken-date=31 December 2022 |archive-date=24 February 2022|archive-url=https://web.archive.org/web/20220224114901/https://www.ncbi.nlm.nih.gov/books/NBK453043/|url-status=live}}</ref>。生成した多糖は、それ自体が構造的あるいは代謝的な機能を果たすこともあれば、{{Ill2|オリゴサッカリルトランスフェラーゼ|en|Oligosaccharyltransferase}}(オリゴ糖転移酵素)と呼ばれる酵素によって、脂質やタンパク質に転位されることもある<ref>{{cite journal | vauthors = Opdenakker G, Rudd PM, Ponting CP, Dwek RA | title = Concepts and principles of glycobiology | journal = FASEB Journal | volume = 7 | issue = 14 | pages = 1330–7 | date = November 1993 | pmid = 8224606 | doi = 10.1096/fasebj.7.14.8224606 | s2cid = 10388991 }}</ref><ref>{{cite journal | vauthors = McConville MJ, Menon AK | title = Recent developments in the cell biology and biochemistry of glycosylphosphatidylinositol lipids (review) | journal = Molecular Membrane Biology | volume = 17 | issue = 1 | pages = 1–16 | year = 2000 | pmid = 10824734 | doi = 10.1080/096876800294443 | doi-access = free }}</ref>。 |
|||
また、この ATP の化学エネルギーをさかのぼると異化によって生じることから独立栄養生物による有機物生産が大元であり、それらの生産は太陽光<ref name="SeikagakuDic193-3">[[#生化学辞典(2版)|生化学辞典第2版、p.193 【エネルギーの流れ】]]</ref>の還元力(特殊な環境においては地球科学的起源の水素、硫化水素と置き換えても良い)が出発点であることがわかる。太陽光の(あるいは地球に残存した)還元力は生体的な代謝のエネルギーのみならず、[[石油]]や[[天然ガス]]といった人間活動に使用しているエネルギーをも供給している。 |
|||
=== 脂肪酸, イソプレノイド, ステロール === |
|||
== 代謝の調節 == |
|||
{{further|脂肪酸の合成|{{ill2|ステロイド代謝|en|Steroid metabolism}}}} |
|||
生命の恒常性に際しては異化と同化両方の代謝系の調和が成立しなければならない。代謝系のほとんど全ての反応は酵素によるものであるが、したがって個々の反応の調節がなされなければならない。全ての酵素反応を調節するには、非常に複雑で膨大なシステムの存在をイメージするが、生物はその過程をシンプルかつ最小のエネルギーで行えるよう優れたシステムを構築している。 |
|||
[[File:Sterol synthesis.svg|thumb|right|upright=1.6|簡略化した[[ステロイド合成]]経路。主要中間体の[[イソペンテニルピロリン酸]] (IPP)、[[ジメチルアリルピロリン酸]] (DMAPP)、[[ゲラニルピロリン酸]] (GPP)、および[[スクアレン]]を示している。わかりやすくするために一部の中間段階は略された。]] |
|||
主たる酵素反応の調節には、以下の 4 つがあげられる。 |
|||
脂肪酸は、[[脂肪酸合成酵素]]によるアセチルCoA単位の重合と、その後に還元することで作られる。脂肪酸のアシル鎖は、アシル基の付加、アルコールへの還元、[[アルケン]]基への脱水、さらにアルカン基への再還元という一連の反応によって伸長される。脂肪酸生合成の酵素は大きく2種類に分けられ、動物や菌類では、これらの脂肪酸合成酵素の反応のすべてを単一の多機能なI型タンパク質が担っているのに対し<ref>{{cite journal | vauthors = Chirala SS, Wakil SJ | title = Structure and function of animal fatty acid synthase | journal = Lipids | volume = 39 | issue = 11 | pages = 1045–53 | date = November 2004 | pmid = 15726818 | doi = 10.1007/s11745-004-1329-9 | s2cid = 4043407 }}</ref>、植物の[[プラスチド|プラスチド(色素体)]]や細菌では、経路の各段階を別々のII型酵素が担っている<ref>{{cite journal | vauthors = White SW, Zheng J, Zhang YM | title = The structural biology of type II fatty acid biosynthesis | journal = [[:en:Annual Review of Biochemistry|Annual Review of Biochemistry]] | volume = 74 | pages = 791–831 | year = 2005 | pmid = 15952903 | doi = 10.1146/annurev.biochem.74.082803.133524 }}</ref><ref>{{cite journal | vauthors = Ohlrogge JB, Jaworski JG | title = Regulation of Fatty Acid Synthesis | journal = [[:en:Annual Review of Plant Physiology and Plant Molecular Biology|Annual Review of Plant Physiology and Plant Molecular Biology]] | volume = 48 | pages = 109–136 | date = June 1997 | pmid = 15012259 | doi = 10.1146/annurev.arplant.48.1.109 | s2cid = 46348092 }}</ref>。 |
|||
#'''[[形質膜]]を用いた酵素の局所化''' |
|||
#'''生体成分の異化および同化を異なる経路で行うこと''' |
|||
#'''熱力学的な反応の調節(基質の濃度差やpHの変化)''' |
|||
#'''酵素活性および酵素の発現量による調節''' |
|||
1. の酵素の局所化については、原核生物の場合は形質膜構造は原則として1つであり、細胞内、細胞外のほか膜内といった区別しかなされない。したがって、原核生物の代謝調節における 1. の依存度は真核生物ほどではない。一方真核生物は、[[ミトコンドリア]]、[[小胞体]]、[[リソソーム]]といった多くの形質膜構造からなる[[オルガネラ]]を有しており、個々の器官において特有の代謝系を有している。例えばミトコンドリアはクエン酸回路および電子伝達系のほかβ酸化系を有している。 |
|||
[[テルペン]]や[[イソプレノイド]]は、[[カロテノイド]]を含む脂質の大きな一群であり、植物由来の[[天然物化学|天然物]]の中で最大の分類を形成している<ref>{{cite journal | vauthors = Dubey VS, Bhalla R, Luthra R | title = An overview of the non-mevalonate pathway for terpenoid biosynthesis in plants | journal = Journal of Biosciences | volume = 28 | issue = 5 | pages = 637–46 | date = September 2003 | pmid = 14517367 | doi = 10.1007/BF02703339 | url = http://www.ias.ac.in/jbiosci/sep2003/637.pdf | url-status = dead | s2cid = 27523830 | archive-url = https://web.archive.org/web/20070415213325/http://www.ias.ac.in/jbiosci/sep2003/637.pdf | archive-date = 15 April 2007 }}</ref>。これらの化合物は、反応性前駆体である[[イソペンテニルピロリン酸]]や[[ジメチルアリルピロリン酸]]から供与されたイソプレン単位の結合と修飾によって作られる<ref name="Kuzuyama">{{cite journal | vauthors = Kuzuyama T, Seto H | title = Diversity of the biosynthesis of the isoprene units | journal = Natural Product Reports | volume = 20 | issue = 2 | pages = 171–83 | date = April 2003 | pmid = 12735695 | doi = 10.1039/b109860h }}</ref>。これらの前駆体は、さまざまな方法で作られる。動物や古細菌では、アセチルCoAから[[メバロン酸経路]]で作られ<ref>{{cite journal | vauthors = Grochowski LL, Xu H, White RH | title = Methanocaldococcus jannaschii uses a modified mevalonate pathway for biosynthesis of isopentenyl diphosphate | journal = Journal of Bacteriology | volume = 188 | issue = 9 | pages = 3192–8 | date = May 2006 | pmid = 16621811 | pmc = 1447442 | doi = 10.1128/JB.188.9.3192-3198.2006 }}</ref>、植物や細菌では、ピルビン酸と[[グリセルアルデヒド-3-リン酸|グリセルアルデヒド3-リン酸]]を基質とする[[非メバロン酸経路]]で作られる<ref name="Kuzuyama" /><ref>{{cite journal | vauthors = Lichtenthaler HK | title = The 1-Deoxy-D-Xylulose-5-Phosphate Pathway of Isoprenoid Biosynthesis in Plants | journal = [[:en:Annual Review of Plant Physiology and Plant Molecular Biology|Annual Review of Plant Physiology and Plant Molecular Biology]] | volume = 50 | pages = 47–65 | date = June 1999 | pmid = 15012203 | doi = 10.1146/annurev.arplant.50.1.47 }}</ref>。これらの活性化イソプレン供与体を用いる重要な反応のひとつに{{Ill2|ステロール生合成|en|Steroid biosynthesis}}がある。ここでは、イソプレン単位が結合して[[スクアレン]]となり、さらに折り畳まれて一連の環を形成して[[ラノステロール]]となる(図を参照)<ref name="Schroepfer">{{cite journal | vauthors = Schroepfer GJ | title = Sterol biosynthesis | journal = [[:en:Annual Review of Biochemistry|Annual Review of Biochemistry]] | volume = 50 | pages = 585–621 | year = 1981 | pmid = 7023367 | doi = 10.1146/annurev.bi.50.070181.003101 }}</ref>。ラノステロールはその後、[[コレステロール]]や[[エルゴステロール]]など、他のステロールに変換される<ref name="Schroepfer" /><ref>{{cite journal | vauthors = Lees ND, Skaggs B, Kirsch DR, Bard M | title = Cloning of the late genes in the ergosterol biosynthetic pathway of Saccharomyces cerevisiae--a review | journal = Lipids | volume = 30 | issue = 3 | pages = 221–6 | date = March 1995 | pmid = 7791529 | doi = 10.1007/BF02537824 | s2cid = 4019443 }}</ref>。 |
|||
2. の異化と同化を別経路に分ける点については上述の異化と代謝のつながりにも筆記している。例えば解糖系と糖新生系は多くの酵素に関しては同一であるが、一部不可逆反応を交えることにより、結果として別経路となっている。また、そのような不可逆反応を行う酵素は酵素活性そのものの調節を受けるアロステリック酵素である場合が多い(後述)。 |
|||
=== タンパク質 === |
|||
3. の熱力学的な反応の調節については、基質の濃度差の変化に伴うケースが多い。例えば A→B→C という反応が存在し、細胞のフェーズとして C が必要であるとすると A あるいは B を何らかの形で外部から摂取し、細胞内の A あるいは B の濃度を高めることで C の生合成を助ける。その結果、最終的に C が使用されなくなり C の濃度が細胞内で増加したとすると B→C の反応は濃度差の解消により[[化学平衡]]に達する。B と C 間の反応が可逆であり B の濃度が減少すると今度は C から B へと反応が起きる。 |
|||
{{further|タンパク質生合成|アミノ酸合成}} |
|||
生物によって、20種類のアミノ酸を合成する能力において違いがある。ほとんどの細菌や植物では20種類すべてを合成することができるが、哺乳類は11種類の非必須アミノ酸しか合成できないため、残る9種類の[[必須アミノ酸]]は食物から摂取しなければならない<ref name="Nelson" />。細菌の[[肺炎マイコプラズマ]](''[[:en:Mycoplasma pneumoniae|Mycoplasma pneumoniae]]'')のような単純な[[寄生虫|寄生生物]]は、アミノ酸合成ができないため、[[宿主]]から直接アミノ酸を摂取している<ref>{{cite journal | vauthors = Himmelreich R, Hilbert H, Plagens H, Pirkl E, Li BC, Herrmann R | title = Complete sequence analysis of the genome of the bacterium Mycoplasma pneumoniae | journal = Nucleic Acids Research | volume = 24 | issue = 22 | pages = 4420–49 | date = November 1996 | pmid = 8948633 | pmc = 146264 | doi = 10.1093/nar/24.22.4420 }}</ref>。すべてのアミノ酸は、解糖、クエン酸回路、またはペントースリン酸経路の中間体から合成される。窒素は[[グルタミン酸]]と[[グルタミン]]から供給される。非必須アミノ酸の合成は、適切なα-ケト酸の形成に依存しており、そのα-ケト酸が[[アミノ基転移]]によってアミノ酸を形成する<ref>{{cite book | vauthors = Guyton AC, Hall JE |title=Textbook of Medical Physiology |url=https://archive.org/details/textbookmedicalp00acgu |url-access=limited |publisher=Elsevier |year=2006 |location=Philadelphia |pages=[https://archive.org/details/textbookmedicalp00acgu/page/n889 855]–6 |isbn=978-0-7216-0240-0}}</ref>。 |
|||
4. の酵素活性そのものの調節や酵素の発現量による調節は特に後者は原核生物にて、非常によく研究が進んでいる。酵素活性の調節は[[アロステリック効果]]をはじめとした最終産物阻害を中心に、複雑な[[カスケード系]]あるいは酵素そのものの化学修飾(一例として[[プロテインキナーゼ]]を参照)などがある。酵素の発現量による調節はジャコブとモノーの[[オペロン|オペロン説]]を中心に遺伝子発現と生体成分の協同的なモデルがある(一例として[[ラクトースオペロン]]を参照)。 |
|||
タンパク質は、アミノ酸が[[ペプチド結合]]で直鎖状に結合してできている。さまざまなタンパク質は、固有のアミノ酸残基の並びがあり、その[[一次構造]]を決定している。アルファベットを組み合わせて無数の単語ができるのと同様に、アミノ酸をさまざまな配列で組み合わせると、膨大な数のタンパク質ができあがる。タンパク質の合成は、まずアミノ酸を[[エステル結合]]で[[転移RNA]](トランスファーRNA)分子に結合させ、活性化することから始まる。これは、[[アミノアシルtRNA合成酵素]]による[[アデノシン三リン酸|ATP]]依存的な反応によって行われる<ref>{{cite journal | vauthors = Ibba M, Söll D | title = The renaissance of aminoacyl-tRNA synthesis | journal = EMBO Reports | volume = 2 | issue = 5 | pages = 382–7 | date = May 2001 | pmid = 11375928 | pmc = 1083889 | doi = 10.1093/embo-reports/kve095 | url = http://www.molcells.org/home/journal/include/downloadPdf.asp?articleuid={A158E3B4-2423-4806-9A30-4B93CDA76DA0} | url-status = dead | archive-url = https://web.archive.org/web/20110501181419/http://www.molcells.org/home/journal/include/downloadPdf.asp?articleuid=%7BA158E3B4-2423-4806-9A30-4B93CDA76DA0%7D | archive-date = 1 May 2011 }}</ref>。こうしてできた[[アミノアシルtRNA]]は、[[リボソーム]]酵素の基質となり、リボソームは、[[伝令RNA]](メッセンジャーRNA)の配列情報を利用して、伸長するタンパク質鎖にアミノ酸を順次結合する<ref>{{cite journal | vauthors = Lengyel P, Söll D | title = Mechanism of protein biosynthesis | journal = Bacteriological Reviews | volume = 33 | issue = 2 | pages = 264–301 | date = June 1969 | pmid = 4896351 | pmc = 378322 | doi = 10.1128/MMBR.33.2.264-301.1969 }}</ref>。 |
|||
==二次代謝== |
|||
{{Main|二次代謝産物}} |
|||
上述の糖、アミノ酸、脂肪酸に関連した異化同化の両反応およびそれらに関するエネルギー代謝を'''中央代謝'''あるいは'''一次代謝'''という。対して、それらの中央代謝系から外れた生命維持における役割の不明な物質を生産する特定の生物に限定的な代謝のことを'''[[二次代謝]]'''という。 |
|||
=== ヌクレオチドの合成とサルベージ === |
|||
[[二次代謝産物]]としては、以下のような物質があげられる。 |
|||
{{further|サルベージ経路|{{ill2|ピリミジン代謝|en|Pyrimidine biosynthesis}}|[[プリン_(化学)|プリン代謝]]}} |
|||
;[[アルカロイド]] |
|||
:植物が主として生産する窒素を含有する塩基性物質の総称。少量で顕著な生理活性を示し、種類も非常に多い。 |
|||
;[[テルペノイド]] |
|||
:[[メバロン酸経路]]から生産される[[イソプレン]]の重合した物質。有名なテルペンとしては[[コレステロール]]などがある。 |
|||
;[[フェノール類]] |
|||
:植物の木質成分の大半を占める[[リグニン]]などはフェノール類の重合体である。えてして反応性に乏しく、資化されにくい。 |
|||
;[[配糖体]] |
|||
:主として植物の生産する糖のヒドロキシ基が何らかの化合物で置換された物質の総称。[[アントシアニン]]などの色素のほか強心配糖体といった薬理作用を示すものも存在する。 |
|||
;[[抗生物質]] |
|||
:[[アオカビ]]など[[真菌]]や[[放線菌]]の生産する原核生物特異的に作用する生理活性物質。 |
|||
;[[アミノ酸|特殊アミノ酸]] |
|||
:植物が主として生産する、タンパク質に含まれない特殊なアミノ酸。植物自体への生理活性は現在のところ不明であるが、植物の生育とともに生産量や種類などが変化する。別名非タンパク質性アミノ酸。 |
|||
ヌクレオチドは、アミノ酸、二酸化炭素、そして[[ギ酸]]から合成されるが、その合成経路は大量の代謝エネルギーを必要とする<ref name="Rudolph">{{cite journal | vauthors = Rudolph FB | title = The biochemistry and physiology of nucleotides | journal = The Journal of Nutrition | volume = 124 | issue = 1 Suppl | pages = 124S–127S | date = January 1994 | pmid = 8283301 | doi = 10.1093/jn/124.suppl_1.124S }} {{cite journal | vauthors = Zrenner R, Stitt M, Sonnewald U, Boldt R | title = Pyrimidine and purine biosynthesis and degradation in plants | journal = [[:en:Annual Review of Plant Biology|Annual Review of Plant Biology]] | volume = 57 | pages = 805–36 | year = 2006 | pmid = 16669783 | doi = 10.1146/annurev.arplant.57.032905.105421 }}</ref>。そのため、ほとんどの生物は、合成前のヌクレオチドを回収する効率的なシステムを備えている<ref name="Rudolph" /><ref>{{cite journal | vauthors = Stasolla C, Katahira R, Thorpe TA, Ashihara H | title = Purine and pyrimidine nucleotide metabolism in higher plants | journal = Journal of Plant Physiology | volume = 160 | issue = 11 | pages = 1271–95 | date = November 2003 | pmid = 14658380 | doi = 10.1078/0176-1617-01169 }}</ref>。[[プリン塩基]]は、リボースに塩基が結合した[[ヌクレオシド]]として[[プリン代謝|合成]]される<ref name="pmid 22531138">{{cite journal | vauthors = Davies O, Mendes P, Smallbone K, Malys N | title = Characterisation of multiple substrate-specific (d)ITP/(d)XTPase and modelling of deaminated purine nucleotide metabolism | journal = BMB Reports | volume = 45 | issue = 4 | pages = 259–64 | date = April 2012 | pmid = 22531138 | doi = 10.5483/BMBRep.2012.45.4.259 | url = http://wrap.warwick.ac.uk/49510/1/WRAP_Malys_%5B45-4%5D1204261917_%28259-264%29BMB_11-169.pdf | doi-access = free | access-date = 18 September 2019 | archive-date = 24 October 2020 | archive-url = https://web.archive.org/web/20201024132423/http://wrap.warwick.ac.uk/49510/1/WRAP_Malys_%5B45-4%5D1204261917_%28259-264%29BMB_11-169.pdf | url-status = live }}</ref>。[[アデニン]]と[[グアニン]]はともに、アミノ酸の[[グリシン]]、[[グルタミン]]、[[アスパラギン酸]]の原子と、[[補酵素]]の[[テトラヒドロ葉酸]]から転移した[[ギ酸塩|ギ酸]]を用いて合成される前駆体ヌクレオシドの[[イノシン酸|イノシン一リン酸]]から作られる。一方、[[ピリミジン]]塩基は、グルタミンとアスパラギン酸から作られる[[オロト酸]]から合成される<ref>{{cite journal | vauthors = Smith JL | title = Enzymes of nucleotide synthesis | journal = Current Opinion in Structural Biology | volume = 5 | issue = 6 | pages = 752–7 | date = December 1995 | pmid = 8749362 | doi = 10.1016/0959-440X(95)80007-7 }}</ref>。 |
|||
これらにあげたのは一部であり、生物界には未分類の微量生体成分が非常に多数存在すると言われている。二次代謝産物の多くは顕著な生理活性を示すものが多く、毒物や薬物として分類されるものも多い。 |
|||
== |
== 生体異物と酸化還元代謝 == |
||
{{further|{{ill2|異物代謝|en|Xenobiotic metabolism}}|薬物代謝|{{ill2|エタノール代謝|en|Alcohol metabolism}}|抗酸化物質}} |
|||
{{Main|薬物代謝}} |
|||
生物は薬、毒物などの[[生体外物質]](ゼノバイオティクス (Xenobiotics)、[[異物]]ともいう)にさらされており、これらを分解あるいは排出するための代謝も行う。 |
|||
すべての生物は、食物として利用できない化合物や、代謝機能を持たないために細胞内に蓄積されると有害となる化合物に常にさらされている。これらの有害となりうる化合物は、[[生体異物]](ゼノバイオティクス)と呼ばれる<ref>{{cite journal | vauthors = Testa B, Krämer SD | title = The biochemistry of drug metabolism--an introduction: part 1. Principles and overview | journal = Chemistry & Biodiversity | volume = 3 | issue = 10 | pages = 1053–101 | date = October 2006 | pmid = 17193224 | doi = 10.1002/cbdv.200690111 | s2cid = 28872968 }}</ref>。[[薬物|合成薬]]、[[毒|自然毒]]、[[抗生物質]]などの生体異物は、一連の生体異物代謝酵素によって解毒される。ヒトでは、[[シトクロムP450|シトクロムP450オキシダーゼ]](酸化酵素)<ref>{{cite journal | vauthors = Danielson PB | title = The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans | journal = Current Drug Metabolism | volume = 3 | issue = 6 | pages = 561–97 | date = December 2002 | pmid = 12369887 | doi = 10.2174/1389200023337054 }}</ref>、[[UDP-グルクロン酸転移酵素]]<ref>{{cite journal | vauthors = King CD, Rios GR, Green MD, Tephly TR | title = UDP-glucuronosyltransferases | journal = Current Drug Metabolism | volume = 1 | issue = 2 | pages = 143–61 | date = September 2000 | pmid = 11465080 | doi = 10.2174/1389200003339171 }}</ref>、[[グルタチオン-S-トランスフェラーゼ]](転移酵素)<ref>{{cite journal | vauthors = Sheehan D, Meade G, Foley VM, Dowd CA | title = Structure, function and evolution of glutathione transferases: implications for classification of non-mammalian members of an ancient enzyme superfamily | journal = The Biochemical Journal | volume = 360 | issue = Pt 1 | pages = 1–16 | date = November 2001 | pmid = 11695986 | pmc = 1222196 | doi = 10.1042/0264-6021:3600001 }}</ref>がこれに該当する。この酵素のシステムは3段階で作用し、まず生体異物を酸化し(第1段階)、次に分子上に水溶性基を結合させる(第2段階)。最後に、水溶性に変化した生体異物は細胞外に排出され、多細胞生物ではさらに代謝されてから排出されることもある(第3段階)。[[生態系]]では、これらの反応は、汚染物質の微生物による[[生分解]]や、汚染土壌や流出油の[[バイオレメディエーション]](生物学的環境修復)において特に重要である<ref>{{cite journal | vauthors = Galvão TC, Mohn WW, de Lorenzo V | title = Exploring the microbial biodegradation and biotransformation gene pool | journal = Trends in Biotechnology | volume = 23 | issue = 10 | pages = 497–506 | date = October 2005 | pmid = 16125262 | doi = 10.1016/j.tibtech.2005.08.002 }}</ref>。これらの微生物反応の多くは多細胞生物と共通であるが、微生物の種類は驚くほど多様であるため、多細胞生物よりもはるかに幅広い種類の生体異物に対処し、[[有機塩素化合物]]などの[[残留性有機汚染物質]]も分解することが可能である<ref>{{cite journal | vauthors = Janssen DB, Dinkla IJ, Poelarends GJ, Terpstra P | title = Bacterial degradation of xenobiotic compounds: evolution and distribution of novel enzyme activities | journal = Environmental Microbiology | volume = 7 | issue = 12 | pages = 1868–82 | date = December 2005 | pmid = 16309386 | doi = 10.1111/j.1462-2920.2005.00966.x | url = https://pure.rug.nl/ws/files/3623678/2005EnvironMicrobiolJanssen.pdf | doi-access = free | access-date = 11 November 2019 | archive-date = 11 November 2019 | archive-url = https://web.archive.org/web/20191111195543/https://pure.rug.nl/ws/files/3623678/2005EnvironMicrobiolJanssen.pdf | url-status = live }}</ref>。 |
|||
[[好気性生物]]に密接に関連する問題として、[[酸化ストレス]]が知られている<ref name="Davies">{{cite journal | vauthors = Davies KJ | title = Oxidative stress: the paradox of aerobic life | journal = Biochemical Society Symposium | volume = 61 | pages = 1–31 | year = 1995 | pmid = 8660387 | doi = 10.1042/bss0610001 }}</ref>。これは、[[酸化的リン酸化]]や[[タンパク質フォールディング]]時の[[ジスルフィド結合]]形成などの過程で、[[過酸化水素]]などの[[活性酸素|活性酸素種]]が作られることで起こる<ref>{{cite journal | vauthors = Tu BP, Weissman JS | title = Oxidative protein folding in eukaryotes: mechanisms and consequences | journal = The Journal of Cell Biology | volume = 164 | issue = 3 | pages = 341–6 | date = February 2004 | pmid = 14757749 | pmc = 2172237 | doi = 10.1083/jcb.200311055 }}</ref>。これらの有害な酸化物質は、[[グルタチオン]]などの[[抗酸化物質|抗酸化]]代謝物や、[[カタラーゼ]]、[[ペルオキシダーゼ]]などの酵素によって除去される<ref name="Sies">{{cite journal | vauthors = Sies H | title = Oxidative stress: oxidants and antioxidants | journal = Experimental Physiology | volume = 82 | issue = 2 | pages = 291–5 | date = March 1997 | pmid = 9129943 | doi = 10.1113/expphysiol.1997.sp004024 | s2cid = 20240552 | doi-access = free }}</ref><ref name="Vertuani">{{cite journal | vauthors = Vertuani S, Angusti A, Manfredini S | title = The antioxidants and pro-antioxidants network: an overview | journal = Current Pharmaceutical Design | volume = 10 | issue = 14 | pages = 1677–94 | year = 2004 | pmid = 15134565 | doi = 10.2174/1381612043384655 | s2cid = 43713549 }}</ref>。 |
|||
== 生命系の熱力学 == |
|||
{{further|{{ill2|生物学的熱力学|en|Biological thermodynamics}}}} |
|||
[[熱力学の法則]]{{Enlink|Laws of thermodynamics|英語版|en}}は生物にも適用され、熱と仕事の移動に関する原則に従わなければならない。[[熱力学第二法則|熱力学の第二法則]]は、{{Ill2|孤立系|en|Isolated system|label=孤立した系}}{{Enlink|Isolated system|英語版|en}}では[[エントロピー]](無秩序)が減少することはない、というものである。生物は驚くほど複雑なので、この法則と矛盾しているように思えるが、すべての生物は周囲と物質やエネルギーを交換する[[オープンシステム (システム理論)|開放系]]であり、それゆえ生存が可能である。生命系は[[熱力学的平衡|平衡状態]]にあるのではなく、むしろ環境のエントロピーを増大させることによって高い複雑性を維持する[[散逸構造|散逸系]]である<ref>{{cite journal | vauthors = von Stockar U, Liu J | title = Does microbial life always feed on negative entropy? Thermodynamic analysis of microbial growth | journal = Biochimica et Biophysica Acta (BBA) - Bioenergetics | volume = 1412 | issue = 3 | pages = 191–211 | date = August 1999 | pmid = 10482783 | doi = 10.1016/S0005-2728(99)00065-1 | doi-access = free }}</ref>。細胞の代謝では、{{Ill2|自然過程<!-- or 自発過程 -->|en|Spontaneous process|label=自然発生的}}な異化作用と非自然発生的な同化作用の結合によって、これを実現している。[[非平衡熱力学|熱力学]]{{Enlink|Non-equilibrium thermodynamics|英語版|en}}の用語で言えば、代謝は無秩序を作り出すことによって秩序を維持しているのである<ref>{{cite journal | vauthors = Demirel Y, Sandler SI | title = Thermodynamics and bioenergetics | journal = Biophysical Chemistry | volume = 97 | issue = 2–3 | pages = 87–111 | date = June 2002 | pmid = 12050002 | doi = 10.1016/S0301-4622(02)00069-8 | s2cid = 3754065 | url = https://digitalcommons.unl.edu/cgi/viewcontent.cgi?article=1006&context=chemengthermalmech | access-date = 22 September 2019 | archive-date = 4 August 2020 | archive-url = https://web.archive.org/web/20200804002615/https://digitalcommons.unl.edu/cgi/viewcontent.cgi?article=1006&context=chemengthermalmech | url-status = live }}</ref>。 |
|||
== 調節と制御 == |
|||
{{further|代謝経路|{{ill2|代謝調節分析|en|Metabolic control analysis}}|ホルモン|{{ill2|調節酵素|en|Regulatory enzymes}}|{{ill2|細胞シグナリング|en|Cell signaling}}}} |
|||
ほとんどの生物の環境は常に変化しているため、代謝反応を細かく[[制御理論|制御]]して、細胞内を一定の状態に維持する必要がある。この状態を[[恒常性|恒常性(ホメオスタシス)]]という<ref>{{cite journal | vauthors = Albert R | title = Scale-free networks in cell biology | journal = Journal of Cell Science | volume = 118 | issue = Pt 21 | pages = 4947–57 | date = November 2005 | pmid = 16254242 | doi = 10.1242/jcs.02714 | arxiv = q-bio/0510054 | s2cid = 3001195 | bibcode = 2005q.bio....10054A }}</ref><ref>{{cite journal | vauthors = Brand MD | title = Regulation analysis of energy metabolism | journal = The Journal of Experimental Biology | volume = 200 | issue = Pt 2 | pages = 193–202 | date = January 1997 | doi = 10.1242/jeb.200.2.193 | pmid = 9050227 | url = http://jeb.biologists.org/cgi/reprint/200/2/193 | access-date = 12 March 2007 | archive-date = 29 March 2007 | archive-url = https://web.archive.org/web/20070329202116/http://jeb.biologists.org/cgi/reprint/200/2/193 | url-status = live }}</ref>。また、代謝調節によって、生物が[[細胞シグナル伝達|シグナル]]に応答し、環境と積極的に相互作用することを可能にする<ref>{{cite journal | vauthors = Soyer OS, Salathé M, Bonhoeffer S | title = Signal transduction networks: topology, response and biochemical processes | journal = Journal of Theoretical Biology | volume = 238 | issue = 2 | pages = 416–25 | date = January 2006 | pmid = 16045939 | doi = 10.1016/j.jtbi.2005.05.030 | bibcode = 2006JThBi.238..416S }}</ref>。代謝経路がどのように制御されているかを理解するためには、密接に関連する2つの概念が重要である。第一に、経路内における酵素の''調節''(''regulation'')とは、シグナルに応じて酵素の活性をいかに増減させるかということである。第二に、酵素による''制御''(''control'')とは、こうした酵素活性の変化が経路全体の速度(経路を通る[[流束|流束(フラックス)]])に及ぼす影響のことである<ref name="Salter">{{cite journal | vauthors = Salter M, Knowles RG, Pogson CI | title = Metabolic control | journal = Essays in Biochemistry | volume = 28 | pages = 1–12 | year = 1994 | pmid = 7925313 }}</ref>。たとえば、ある酵素が大きな活性変化を示しても(すなわち、高度に調節されている)、その活性の変化が代謝経路のフラックスにほとんど影響を及ぼさないのであれば、この酵素は経路の制御には関与していないことになる<ref>{{cite journal | vauthors = Westerhoff HV, Groen AK, Wanders RJ | title = Modern theories of metabolic control and their applications (review) | journal = Bioscience Reports | volume = 4 | issue = 1 | pages = 1–22 | date = January 1984 | pmid = 6365197 | doi = 10.1007/BF01120819 | s2cid = 27791605 }}</ref>。 |
|||
[[File:Insulin glucose metabolism ZP.svg|thumb|right|upright=1.35|'''インスリンがグルコースの取り込みと代謝に与える影響の概略図。'''インスリンは細胞表面の受容体に結合し(1)、一連のタンパク質活性化カスケードを開始する(2)。これらのカスケードによって、Glut-4トランスポーターの[[細胞膜]]への移動とグルコースの流入(3)、[[グリコーゲン]]合成(4)、[[解糖系|解糖]](5)、[[脂肪酸]]合成(6)が引き起こされる。]] |
|||
代謝調節は複数のレベルで行われる。[[内因性 (生物学)|内因性]]調節では、代謝経路は基質や生成物の量の変化に応じて自己調節する。たとえば、ある生成物の量が減少すると、それを補うために経路を通るフラックスを増加させることがある<ref name="Salter" />。この種の調節には、経路内の複数の酵素の活性を調節する[[アロステリック調節]]がよく行われる<ref>{{cite journal | vauthors = Fell DA, Thomas S | title = Physiological control of metabolic flux: the requirement for multisite modulation | journal = The Biochemical Journal | volume = 311 | issue = Pt 1 | pages = 35–9 | date = October 1995 | pmid = 7575476 | pmc = 1136115 | doi = 10.1042/bj3110035 }}</ref>。一方、[[外因性 (生物学)|外因性]]調節は、多細胞生物において、ある細胞が別の細胞からのシグナルに応じて代謝を変化させるときに起こる。これらのシグナルは通常、[[ホルモン]]や[[成長因子]]などの水溶性メッセンジャーの形で、細胞表面にある特定の[[受容体]]によって検出される<ref>{{cite journal | vauthors = Hendrickson WA | title = Transduction of biochemical signals across cell membranes | journal = Quarterly Reviews of Biophysics | volume = 38 | issue = 4 | pages = 321–30 | date = November 2005 | pmid = 16600054 | doi = 10.1017/S0033583506004136 | s2cid = 39154236 }}</ref>。これらのシグナルは、しばしばタンパク質の[[リン酸化]]が関与する[[セカンドメッセンジャー]]系によって細胞内に伝達される<ref>{{cite journal | vauthors = Cohen P | title = The regulation of protein function by multisite phosphorylation--a 25 year update | journal = Trends in Biochemical Sciences | volume = 25 | issue = 12 | pages = 596–601 | date = December 2000 | pmid = 11116185 | doi = 10.1016/S0968-0004(00)01712-6 }}</ref>。 |
|||
外因性制御の例として、[[インスリン]]というホルモンによるグルコース代謝の調節がよく知られている<ref>{{cite journal | vauthors = Lienhard GE, Slot JW, James DE, Mueckler MM | title = How cells absorb glucose | journal = Scientific American | volume = 266 | issue = 1 | pages = 86–91 | date = January 1992 | pmid = 1734513 | doi = 10.1038/scientificamerican0192-86 | bibcode = 1992SciAm.266a..86L }}</ref>。インスリンは、[[血糖値]]の上昇に反応して分泌される。インスリンが細胞上の[[インスリン受容体]]に結合すると、[[プロテインキナーゼ]]のカスケードが活性化され、細胞にグルコースを吸収させ、脂肪酸や[[グリコーゲン]]といった貯蔵分子に変換させる<ref>{{cite journal | vauthors = Roach PJ | title = Glycogen and its metabolism | journal = Current Molecular Medicine | volume = 2 | issue = 2 | pages = 101–20 | date = March 2002 | pmid = 11949930 | doi = 10.2174/1566524024605761 }}</ref>。グリコーゲンの代謝は、グリコーゲンを分解する酵素である[[グリコーゲンホスホリラーゼ]]と、グリコーゲンを合成する酵素である[[グリコーゲンシンターゼ]]の活性によって制御されている。これらの酵素は相互に調節され、リン酸化によってシンターゼは抑制されるが、ホスホリラーゼは活性化される。インスリンは、[[プロテインホスファターゼ]](タンパク質脱リン酸化酵素)を活性化し、これらの酵素のリン酸化を低下させることにより、グリコーゲン合成を促進する<ref>{{cite journal | vauthors = Newgard CB, Brady MJ, O'Doherty RM, Saltiel AR | title = Organizing glucose disposal: emerging roles of the glycogen targeting subunits of protein phosphatase-1 | journal = Diabetes | volume = 49 | issue = 12 | pages = 1967–77 | date = December 2000 | pmid = 11117996 | doi = 10.2337/diabetes.49.12.1967 | url = http://diabetes.diabetesjournals.org/cgi/reprint/49/12/1967.pdf | doi-access = free | access-date = 25 March 2007 | archive-date = 19 June 2007 | archive-url = https://web.archive.org/web/20070619211503/http://diabetes.diabetesjournals.org/cgi/reprint/49/12/1967.pdf | url-status = live }}</ref>。 |
|||
== 進化 == |
|||
{{further|分子進化|分子進化 {{enlink|Molecular evolution|英語版}}|系統学}} |
|||
[[File:Tree of life int.svg|thumb|right|upright=1.8|生物の3つの[[ドメイン (分類学)|ドメイン]]の共通祖先を示す進化系統樹。[[細菌]](青)、[[真核生物]](赤)、[[古細菌]](緑)で色分けされている。また、この樹に含まれるいくつかの[[門 (分類学)|門]]の相対的な位置も示している。すべての生物が共通祖先を通じて互いに関連し、時間の経過とともに進化して、現在の多様な生物になったことを表している。]] |
|||
解糖やクエン酸回路といった、上述の代謝の中心的経路は、生物の{{Ill2|3ドメイン説|en|Three-domain system|label=3つのドメイン}}{{Enlink|Three-domain system|英語版|en}}すべてに存在し、{{Ill2|最終普遍的共通祖先|en|Last universal common ancestor|label=最後の普遍的共通祖先}}にも存在した<ref name="SmithE" /><ref>{{cite journal | vauthors = Romano AH, Conway T | title = Evolution of carbohydrate metabolic pathways | journal = Research in Microbiology | volume = 147 | issue = 6–7 | pages = 448–55 | year = 1996 | pmid = 9084754 | doi = 10.1016/0923-2508(96)83998-2 }}</ref>。この普遍的共通祖先は[[原核生物]]であり、おそらくアミノ酸、ヌクレオチド、炭水化物、および脂質の多様な代謝を行う[[メタン菌|メタン生成菌]]であったと考えられる<ref>{{cite book |author=Koch A |title=How did bacteria come to be? |journal=Adv Microb Physiol |volume=40 |pages=353–99 |year=1998 |pmid=9889982 |doi=10.1016/S0065-2911(08)60135-6 |series=Advances in Microbial Physiology |isbn=978-0-12-027740-7}}</ref><ref>{{cite journal | vauthors = Ouzounis C, Kyrpides N | title = The emergence of major cellular processes in evolution | journal = FEBS Letters | volume = 390 | issue = 2 | pages = 119–23 | date = July 1996 | pmid = 8706840 | doi = 10.1016/0014-5793(96)00631-X | s2cid = 39128865 }}</ref>。このような古代の経路がその後の進化においても保持されたのは、解糖系やクエン酸回路などの経路が、最小限の段階で効率よく最終生成物を生成し、これらの反応が特定の代謝問題に対する最適解であった結果であると考えられる<ref name="Ebenhoh" /><ref name="Cascante" />。酵素に基づく代謝の最初の経路は[[プリン代謝|プリンヌクレオチド代謝]]の一部であり、それ以前の代謝経路は古代の[[RNAワールド]]とつながっていた可能性がある<ref>{{cite journal | vauthors = Caetano-Anollés G, Kim HS, Mittenthal JE | title = The origin of modern metabolic networks inferred from phylogenomic analysis of protein architecture | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 104 | issue = 22 | pages = 9358–63 | date = May 2007 | pmid = 17517598 | pmc = 1890499 | doi = 10.1073/pnas.0701214104 | bibcode = 2007PNAS..104.9358C | doi-access = free }}</ref>。 |
|||
新しい代謝経路が進化する機構を説明するために、さまざまなモデルが提案されている。たとえば、小規模な祖先経路に新しい酵素が順次追加される方法、経路全体が複製しその後分岐する方法、そして既存の酵素が新しい反応経路に組み込まれる方法である<ref>{{cite journal | vauthors = Schmidt S, Sunyaev S, Bork P, Dandekar T | title = Metabolites: a helping hand for pathway evolution? | journal = Trends in Biochemical Sciences | volume = 28 | issue = 6 | pages = 336–41 | date = June 2003 | pmid = 12826406 | doi = 10.1016/S0968-0004(03)00114-2 }}</ref>。これらの機構の相対的な重要性は不明であるが、ゲノム研究の結果、経路に含まれる酵素は共通の祖先を持つ可能性が高く、多くの経路が経路中の既存の段階から新たな機能を作り出し、段階的に進化してきたことが示唆されている<ref>{{cite journal | vauthors = Light S, Kraulis P | title = Network analysis of metabolic enzyme evolution in Escherichia coli | journal = BMC Bioinformatics | volume = 5 | pages = 15 | date = February 2004 | pmid = 15113413 | pmc = 394313 | doi = 10.1186/1471-2105-5-15 }} {{cite journal | vauthors = Alves R, Chaleil RA, Sternberg MJ | title = Evolution of enzymes in metabolism: a network perspective | journal = Journal of Molecular Biology | volume = 320 | issue = 4 | pages = 751–70 | date = July 2002 | pmid = 12095253 | doi = 10.1016/S0022-2836(02)00546-6 }}</ref>。第二のモデルとしては、代謝ネットワークにおけるタンパク質構造の進化を追跡する研究に基づくもので、酵素は広範囲に動員され、さまざまな代謝経路において同様の機能を果たすために酵素が借用されたことが示唆されている({{Ill2|MANETデータベース|en|MANET database}}で明らか)<ref>{{cite journal | vauthors = Kim HS, Mittenthal JE, Caetano-Anollés G | title = MANET: tracing evolution of protein architecture in metabolic networks | journal = BMC Bioinformatics | volume = 7 | pages = 351 | date = July 2006 | pmid = 16854231 | pmc = 1559654 | doi = 10.1186/1471-2105-7-351 }}</ref>。このような動員過程は、進化的な酵素の集成<!-- evolutionary enzymatic mosaic -->を形成する<ref>{{cite journal | vauthors = Teichmann SA, Rison SC, Thornton JM, Riley M, Gough J, Chothia C | title = Small-molecule metabolism: an enzyme mosaic | journal = Trends in Biotechnology | volume = 19 | issue = 12 | pages = 482–6 | date = December 2001 | pmid = 11711174 | doi = 10.1016/S0167-7799(01)01813-3 }}</ref>。第三の可能性は、代謝の一部が「基本単位(モジュール)」として存在し、異なる経路で再利用され、さまざまな分子に対して同様の機能を果たすというものである<ref>{{cite journal | vauthors = Spirin V, Gelfand MS, Mironov AA, Mirny LA | title = A metabolic network in the evolutionary context: multiscale structure and modularity | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 103 | issue = 23 | pages = 8774–9 | date = June 2006 | pmid = 16731630 | pmc = 1482654 | doi = 10.1073/pnas.0510258103 | bibcode = 2006PNAS..103.8774S | doi-access = free }}</ref>。 |
|||
新しい代謝経路の進化だけでなく、進化によって特定の代謝機能が失われることもある。たとえば、ある種の寄生生物では、生存に必須でない代謝過程が失われ、代わりに[[宿主]]からアミノ酸、ヌクレオチド、炭水化物などを搾取することがある<ref>{{cite journal | vauthors = Lawrence JG | title = Common themes in the genome strategies of pathogens | journal = Current Opinion in Genetics & Development | volume = 15 | issue = 6 | pages = 584–8 | date = December 2005 | pmid = 16188434 | doi = 10.1016/j.gde.2005.09.007 }} {{cite journal | vauthors = Wernegreen JJ | title = For better or worse: genomic consequences of intracellular mutualism and parasitism | journal = Current Opinion in Genetics & Development | volume = 15 | issue = 6 | pages = 572–83 | date = December 2005 | pmid = 16230003 | doi = 10.1016/j.gde.2005.09.013 }}</ref>。同様の代謝機能の低下は、[[内部共生体|内部共生]]生物にも見られる<ref>{{cite journal | vauthors = Pál C, Papp B, Lercher MJ, Csermely P, Oliver SG, Hurst LD | title = Chance and necessity in the evolution of minimal metabolic networks | journal = Nature | volume = 440 | issue = 7084 | pages = 667–70 | date = March 2006 | pmid = 16572170 | doi = 10.1038/nature04568 | s2cid = 4424895 | bibcode = 2006Natur.440..667P }}</ref>。 |
|||
== 研究と操作 == |
|||
{{further|{{ill2|タンパク質法|en|Protein methods}}|プロテオーム解析|メタボロミクス|{{ill2|代謝ネットワークモデリング|en|Metabolic network modelling}}}} |
|||
[[File:A thaliana metabolic network.png|thumb|upright=1.35|right|植物[[シロイヌナズナ]](''Arabidopsis thaliana'')の[[クエン酸回路]]の{{Ill2|代謝ネットワーク|en|Metabolic network}}。回路に関与する[[酵素]]と[[代謝物質|代謝物]]を赤い四角で、それらの間の相互作用を黒い線で描いている。図には合計43の酵素と40の代謝産物がある。]] |
|||
古典的に、代謝は、単一の代謝経路に焦点を当てた[[還元主義|還元主義的]]なアプローチで研究される。とくに重要な方法は、生体全体、組織、細胞単体などさまざまなレベルでの[[放射性トレーサー]]の利用であり、放射性標識された中間体や生成物を同定することで、前駆体から最終産物までの経路を明確にする<ref>{{cite journal | vauthors = Rennie MJ | title = An introduction to the use of tracers in nutrition and metabolism | journal = The Proceedings of the Nutrition Society | volume = 58 | issue = 4 | pages = 935–44 | date = November 1999 | pmid = 10817161 | doi = 10.1017/S002966519900124X | doi-access = free }}</ref>。そして、これらの化学反応を触媒する酵素を{{Ill2|タンパク質精製|en|Protein purification|label=精製}}し、その[[酵素反応速度論|動態]]や[[酵素阻害剤|阻害剤]]に対する反応を研究することができる。もう一つの方法は、細胞や組織に含まれる小分子を同定することで、これらの分子の完全な集合を[[メタボローム]]と呼ぶ。これらの方法では、単純な代謝経路の構造と機能についての洞察を与えてくれるが、細胞全体の代謝のような、より複雑な系を研究するには十分ではない<ref>{{cite journal | vauthors = Phair RD | title = Development of kinetic models in the nonlinear world of molecular cell biology | journal = Metabolism | volume = 46 | issue = 12 | pages = 1489–95 | date = December 1997 | pmid = 9439549 | doi = 10.1016/S0026-0495(97)90154-2 }}</ref>。 |
|||
細胞内の{{Ill2|代謝ネットワーク|en|Metabolic network}}は複雑で、数千種類の酵素が存在することもある。右上の図は、わずか43種類のタンパク質と40種類の代謝産物の相互関係を示したものである(ゲノム配列に基づき、最大26,500個の遺伝子を含む一覧が得られる)<ref>{{cite journal | vauthors = Sterck L, Rombauts S, Vandepoele K, Rouzé P, Van de Peer Y | title = How many genes are there in plants (... and why are they there)? | journal = Current Opinion in Plant Biology | volume = 10 | issue = 2 | pages = 199–203 | date = April 2007 | pmid = 17289424 | doi = 10.1016/j.pbi.2007.01.004 }}</ref>。しかし、現在ではゲノムデータを用いて生化学反応の完全なネットワークを再構築し、その挙動を説明し予測できる、より[[全体論|包括的]]な数理モデルを開発することができるようになった<ref>{{cite journal | vauthors = Borodina I, Nielsen J | title = From genomes to in silico cells via metabolic networks | journal = Current Opinion in Biotechnology | volume = 16 | issue = 3 | pages = 350–5 | date = June 2005 | pmid = 15961036 | doi = 10.1016/j.copbio.2005.04.008 }}</ref>。これらのモデルは、経路や代謝産物データなどの古典的な手法によるデータと、[[プロテオミクス]]や[[DNAマイクロアレイ]]研究による[[遺伝子発現]]データを組み合わせた場合に、特に有効である<ref>{{cite journal | vauthors = Gianchandani EP, Brautigan DL, Papin JA | title = Systems analyses characterize integrated functions of biochemical networks | journal = Trends in Biochemical Sciences | volume = 31 | issue = 5 | pages = 284–91 | date = May 2006 | pmid = 16616498 | doi = 10.1016/j.tibs.2006.03.007 }}</ref>。これらの技術により、ヒトの代謝モデルが作成され、今後の創薬や生化学研究の指針になると期待される<ref>{{cite journal | vauthors = Duarte NC, Becker SA, Jamshidi N, Thiele I, Mo ML, Vo TD, Srivas R, Palsson BØ | display-authors = 6 | title = Global reconstruction of the human metabolic network based on genomic and bibliomic data | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 104 | issue = 6 | pages = 1777–82 | date = February 2007 | pmid = 17267599 | pmc = 1794290 | doi = 10.1073/pnas.0610772104 | bibcode = 2007PNAS..104.1777D | doi-access = free }}</ref>。さらに、これらのモデルは、ヒトの病気を共通のタンパク質や代謝産物を持つグループに分類するための[[ネットワーク理論|ネットワーク解析]]に利用されている<ref>{{cite journal | vauthors = Goh KI, Cusick ME, Valle D, Childs B, Vidal M, Barabási AL | title = The human disease network | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 104 | issue = 21 | pages = 8685–90 | date = May 2007 | pmid = 17502601 | pmc = 1885563 | doi = 10.1073/pnas.0701361104 | bibcode = 2007PNAS..104.8685G | doi-access = free }}</ref><ref>{{cite journal | vauthors = Lee DS, Park J, Kay KA, Christakis NA, Oltvai ZN, Barabási AL | title = The implications of human metabolic network topology for disease comorbidity | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 105 | issue = 29 | pages = 9880–5 | date = July 2008 | pmid = 18599447 | pmc = 2481357 | doi = 10.1073/pnas.0802208105 | bibcode = 2008PNAS..105.9880L | doi-access = free }}</ref>。 |
|||
細菌の代謝ネットワークは、{{Ill2|蝶ネクタイ (生物学)|en|Bow tie (biology)|label=蝶ネクタイ型の組織構造}}の顕著な例を示し<ref name="pmid15331224">{{cite journal | vauthors = Csete M, Doyle J | title = Bow ties, metabolism and disease | journal = Trends in Biotechnology | volume = 22 | issue = 9 | pages = 446–50 | date = September 2004 | pmid = 15331224 | doi = 10.1016/j.tibtech.2004.07.007 }}</ref><ref name="PMID12874056">{{cite journal | vauthors = Ma HW, Zeng AP | title = The connectivity structure, giant strong component and centrality of metabolic networks | journal = Bioinformatics | volume = 19 | issue = 11 | pages = 1423–30 | date = July 2003 | pmid = 12874056 | doi = 10.1093/bioinformatics/btg177 | citeseerx = 10.1.1.605.8964 }}</ref><ref name="PMID16916470">{{cite journal | vauthors = Zhao J, Yu H, Luo JH, Cao ZW, Li YX | title = Hierarchical modularity of nested bow-ties in metabolic networks | journal = BMC Bioinformatics | volume = 7 | pages = 386 | date = August 2006 | pmid = 16916470 | pmc = 1560398 | doi = 10.1186/1471-2105-7-386 | arxiv = q-bio/0605003 | bibcode = 2006q.bio.....5003Z }}</ref>、幅広い種類の栄養素を取り込み、少数の中間的な共通通貨分子を用いて、多様な生成物や複雑な高分子を作り出すことができる構造となっている。 |
|||
代謝ネットワークに関する知識は、{{Ill2|代謝工学|en|Metabolic engineering}}の分野にも応用されている。この分野では、[[酵母]]、植物、[[細菌]]などの生物を、[[遺伝子工学]]的に改変して、[[バイオテクノロジー]]における有用性を高め、抗生物質などの[[薬物|医薬品]]や[[1,3-プロパンジオール]]、[[シキミ酸]]などの工業化学物質の生産を支援する<ref>{{cite journal | vauthors = Thykaer J, Nielsen J | title = Metabolic engineering of beta-lactam production | journal = Metabolic Engineering | volume = 5 | issue = 1 | pages = 56–69 | date = January 2003 | pmid = 12749845 | doi = 10.1016/S1096-7176(03)00003-X }}</ref><ref>{{cite journal | vauthors = González-Pajuelo M, Meynial-Salles I, Mendes F, Andrade JC, Vasconcelos I, Soucaille P | title = Metabolic engineering of Clostridium acetobutylicum for the industrial production of 1,3-propanediol from glycerol | journal = Metabolic Engineering | volume = 7 | issue = 5–6 | pages = 329–36 | year = 2005 | pmid = 16095939 | doi = 10.1016/j.ymben.2005.06.001 | hdl-access = free | hdl = 10400.14/3388 }}</ref><ref>{{cite journal | vauthors = Krämer M, Bongaerts J, Bovenberg R, Kremer S, Müller U, Orf S, Wubbolts M, Raeven L | display-authors = 6 | title = Metabolic engineering for microbial production of shikimic acid | journal = Metabolic Engineering | volume = 5 | issue = 4 | pages = 277–83 | date = October 2003 | pmid = 14642355 | doi = 10.1016/j.ymben.2003.09.001 }}</ref>。これらの遺伝子組み換えは、通常、生産エネルギー消費の削減、製品収率の向上、廃棄物の発生を押さえることを目的として行われる<ref>{{cite journal | vauthors = Koffas M, Roberge C, Lee K, Stephanopoulos G | title = Metabolic engineering | journal = [[:en:Annual Review of Biomedical Engineering|Annual Review of Biomedical Engineering]] | volume = 1 | pages = 535–57 | year = 1999 | pmid = 11701499 | doi = 10.1146/annurev.bioeng.1.1.535 | s2cid = 11814282 }}</ref>。 |
|||
== 歴史 == |
|||
{{further|生化学の歴史|分子生物学の歴史}} |
|||
「metabolism(代謝)」という言葉は、[[フランス語]]の「métabolisme」または[[古代ギリシア語|古代ギリシャ語]]の「μεταβολή」(metabolē)に由来し、「変化」を意味している。これは、「μεταβάλή」(metaballein)から派生したもので、「変化する」という意味である<ref>{{Cite web|title=metabolism {{!}} Origin and meaning of metabolism by Online Etymology Dictionary|url=https://www.etymonline.com/word/metabolism|access-date=2020-07-23|website=www.etymonline.com|language=en|archive-date=21 September 2017|archive-url=https://web.archive.org/web/20170921001422/http://www.etymonline.com/index.php?term=metabolism|url-status=live}}</ref>。[[File:Aristotle's metabolism.png|thumb|right|upright=1.4|{{Ill2|アリストテレスの生物学|en|Aristotle's biology|label=アリストテレスの代謝}}をオープンフロー系として描いた概念図。]] |
|||
=== ギリシャ哲学 === |
|||
[[アリストテレス]]の『[[動物部分論]](''The Parts of Animals'')』には、オープンフローモデルを構築するのに十分なほど、{{Ill2|アリストテレスの生物学|en|Aristotle's biology|label=彼の代謝に関する考え方}}の詳細が書かれている。アリストテレスは、代謝の過程で食物からの物質が各段階に変換し、熱が[[四元素|古典的な火の要素]]として放出され、残留物が尿、胆汁、糞便として排泄されると考えた<ref>{{cite book|author=Leroi, Armand Marie|url=https://archive.org/stream/lagoonhowaristot0000lero?ref=ol#page/402/mode/2up|title=The Lagoon: How Aristotle Invented Science|date=2014|publisher=Bloomsbury|isbn=978-1-4088-3622-4|pages=400–401|author-link=Armand Marie Leroi}}</ref>。 |
|||
{{Ill2|イブン・アン=ナフィース|en|Ibn al-Nafis}}は、西暦1260年の著作『[[:en:Theologus_Autodidactus|''Theologus Autodidactus'']]』(預言者の伝記に関するカミルの論考)で、代謝について、『身体とその部分は共に、分解と栄養の絶えない状態にあり、それらは常に永久に変化している 』と述べている<ref>{{cite conference | vauthors = Al-Roubi AS | date = 1982 | title = Ibn Al-Nafis as a philosopher | conference = Symposium on Ibn al-Nafis, Second International Conference on Islamic Medicine | publisher = Islamic Medical Organization | location = Kuwait }}</ref>。 |
|||
=== 科学的手法の応用と現代代謝理論 === |
|||
代謝の科学的研究には長い歴史があり、初期の動物全体を調べる研究から、現代の生化学における個々の代謝反応の研究へと、数世紀にもわたって発展してきた。ヒトの代謝に関する最初の[[対照実験]]は、1614年に[[サントーリオ・サントーリオ]]が著書『''Ars de statica medicina''』の中で発表したものである<ref>{{cite journal | vauthors = Eknoyan G | title = Santorio Sanctorius (1561-1636) - founding father of metabolic balance studies | journal = American Journal of Nephrology | volume = 19 | issue = 2 | pages = 226–33 | year = 1999 | pmid = 10213823 | doi = 10.1159/000013455 | s2cid = 32900603 }}</ref>。彼は、食事、[[睡眠]]、仕事、セックス、絶食、飲酒、排泄の前後の体重を記録した。彼は、摂取した食物の大部分が、「{{Ill2|不感水分喪失|en|Insensible perspiration}}」<!-- insensible perspiration -->と名付けた過程で失われることを発見した。 |
|||
[[File:SantoriosMeal.jpg|thumb|right|upright=0.7|竿秤(さおばかり)に乗って食事をする[[サントーリオ・サントーリオ]]の描写。1614年の彼の著作『''Ars de statica medicina''』より。]] |
|||
こうした初期の研究では、代謝過程の機構は解明されておらず、生体組織を活性化しているのは[[生気論|生命力]]という特別な力によると考えられていた<ref>{{cite book|url=https://archive.org/details/historyofscience04willuoft/page/n7/mode/2up|title=Modern Development of the Chemical and Biological Sciences|vauthors=Williams HA|date=1904|publisher=Harper and Brothers|series=A History of Science: in Five Volumes|volume=IV|location=New York|pages=184–185|access-date=26 March 2007}}</ref>。しかし、19世紀、[[ルイ・パスツール]]は、[[酵母]]による糖の[[エタノール]][[発酵]]の研究から、この過程は酵母細胞内の物質が触媒になっていることを突き止め、「発酵体(ferments)」と名付けた。彼は、『アルコール発酵は、細胞の死や腐敗ではなく、酵母細胞の生命や組織化の結果として起こる作用である。』と記した<ref>{{cite journal | vauthors = Manchester KL | title = Louis Pasteur (1822-1895)--chance and the prepared mind | journal = Trends in Biotechnology | volume = 13 | issue = 12 | pages = 511–5 | date = December 1995 | pmid = 8595136 | doi = 10.1016/S0167-7799(00)89014-9 }}</ref>。この発見は、1828年に[[フリードリヒ・ヴェーラー]]が発表した[[尿素]]を化学的に合成に関する論文とともに<ref>{{cite journal | vauthors = Kinne-Saffran E, Kinne RK | title = Vitalism and synthesis of urea. From Friedrich Wöhler to Hans A. Krebs | journal = American Journal of Nephrology | volume = 19 | issue = 2 | pages = 290–4 | year = 1999 | pmid = 10213830 | doi = 10.1159/000013463 | s2cid = 71727190 }}</ref>、完全に無機的な前駆体から作られた最初の有機化合物として特筆に値する。これによって、細胞内の有機化合物や化学反応が、他の化学分野のものと原理的に変わりないことが証明された。 |
|||
20世紀初頭、[[エドゥアルト・ブフナー]]による[[酵素]]の発見により、代謝の化学反応の研究は、細胞の生物学的研究から切り離され、[[生化学]]の分野が確立された<ref>Eduard Buchner's 1907 [http://nobelprize.org/nobel_prizes/chemistry/laureates/1907/buchner-lecture.html Nobel lecture] {{Webarchive|url=https://web.archive.org/web/20170708144420/http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1907/buchner-lecture.html |date=8 July 2017 }} at http://nobelprize.org {{Webarchive|url=https://web.archive.org/web/20060405023917/http://nobelprize.org/ |date=5 April 2006 }} Accessed 20 March 2007</ref>。その後、[[ハンス・クレブス]]が尿素回路を発見し<ref>{{cite journal | vauthors = Kornberg H | title = Krebs and his trinity of cycles | journal = Nature Reviews. Molecular Cell Biology | volume = 1 | issue = 3 | pages = 225–8 | date = December 2000 | pmid = 11252898 | doi = 10.1038/35043073 | s2cid = 28092593 }}</ref>、[[ハンス・コーンバーグ]]と共同でクエン酸回路とグリオキシル酸回路を発見するなど<ref>{{cite journal |vauthors=Krebs HA, Henseleit K |title=Untersuchungen über die Harnstoffbildung im tierkorper |journal=Z. Physiol. Chem. |volume=210 |issue=1–2 |pages=33–66 |year=1932 |doi=10.1515/bchm2.1932.210.1-2.33}}</ref><ref>{{cite journal | vauthors = Krebs HA, Johnson WA | title = Metabolism of ketonic acids in animal tissues | journal = The Biochemical Journal | volume = 31 | issue = 4 | pages = 645–60 | date = April 1937 | pmid = 16746382 | pmc = 1266984 | doi = 10.1042/bj0310645 }}</ref><ref name="Kornberg" />、近代的な生化学者の貢献によって、生化学の知識は急速に拡大した。現代の生化学研究は、[[クロマトグラフィー]]、[[X線回折]]、[[NMR分光法]]、[[放射性トレーサー|放射性同位体標識]]、[[電子顕微鏡]]、[[分子動力学法|分子動力学]]シミュレーションなどの新しい技術の利用により、細胞内の多数の分子や代謝経路の同定と詳細な解析が可能になった{{要出典|date=2022年12月}}。 |
|||
== 参考項目 == |
|||
* {{Ill2|人為的な代謝|en|Anthropogenic metabolism}} - 人間社会の物質とエネルギーの回転を表す産業における用語 |
|||
* [[代謝拮抗剤]] - 代謝物の利用を阻害する化学物質 |
|||
* {{ill2|熱量測定法|en|Calorimetry}} - 化学および熱力学において物体の状態変数の変化を測定すること |
|||
* {{ill2|等温マイクロカロリメトリー|en|Isothermal microcalorimetry}} - 化学、物理、生物学的プロセスのリアルタイム監視と動的分析のための実験室的手法 |
|||
* [[先天性代謝異常]] - 先天的に酵素活性に異常をきたす遺伝病の一種 |
|||
* {{ill2|鉄-硫黄ワールド仮説|en|Iron–sulfur world hypothesis}} - 生命の起源に関する「代謝優先」説 |
|||
* [[代謝異常]] - タンパク質、脂肪、炭水化物などの主要栄養素の体内での下項および配分を有害に変化させる疾患 |
|||
* {{ill2|マイクロ生理学|en|Microphysiometry}} - 生命や生体物質の機能や活動、および非常に小規模な物理的および化学的現象のinvitro測定 |
|||
* {{ill2|一次栄養群|en|Primary nutritional groups}} - 生命維持、成長、生殖に必要なエネルギーと炭素の供給源に応じた栄養様式に関連して分類された生物のグループ |
|||
* {{ill2|呼吸測定|en|Respirometry}} - 生物の代謝率を推定するための熱産生の間接的な測定手法(熱量測定法) |
|||
* {{ill2|河川代謝|en|Stream metabolism}} - 水生生態系内でエネルギーがどのように作成され、使用されるかを定量化する概念 |
|||
* {{ill2|硫黄代謝|en|Sulfur metabolism}} - 生物による硫黄の還元、酸化の経路 |
|||
* {{Ill2|特異動的作用|en|Specific dynamic action|label=食品の温熱効果}} - 食品を使用および保管するための処理コストによる基礎代謝率を超えるエネルギー消費 |
|||
* {{ill2|都市代謝|en|Urban metabolism}} - 都市内の物質とエネルギーの流れの記述と分析のためのモデル |
|||
* {{ill2|体液バランス|en|Fluid balance|label=水代謝}} - 浸透圧調節と行動によって生体内の水分量を制御する必要がある生体の恒常性の側面 |
|||
* {{ill2|オーバーフロー代謝|en|Overflow metabolism}} - 細胞が呼吸経路を使わずにグルコースなど成長基質を不完全に酸化すること |
|||
* {{ill2|腫瘍代謝|en|Oncometabolism}} -発癌および腫瘍状態への進行を伴う細胞で発生する代謝変化に着目した研究分野 |
|||
* {{ill2|Reactome|en|Reactome}} - 生物学的経路の無料のオンラインデータベース |
|||
* [[KEGG]] - ゲノム、生物経路、疾患、薬剤、化学物質などを扱うデータベースの集合体 |
|||
== 脚注 == |
== 脚注 == |
||
| 269行目: | 281行目: | ||
{{reflist|2}} |
{{reflist|2}} |
||
== |
== 推薦文献 == |
||
{{Library resources box |
|||
* {{Cite book|和書|author = |title = 生化学辞典第2版|edition = 第2版第6刷|year = 1995|publisher = [[東京化学同人]]|isbn = 4-8079-0340-3|page = |ref = 生化学辞典(2版)}} |
|||
|onlinebooks=yes |
|||
|by=no |
|||
|lcheading=Metabolism |
|||
|label=Metabolism |
|||
}} |
|||
'''入門''' |
|||
{{refbegin}} |
|||
* {{cite book | vauthors = Rose S, Mileusnic R | title = The Chemistry of Life. | publisher = Penguin Press Science | date = 1999 | isbn = 0-14-027273-9 }} |
|||
* {{cite book | vauthors = Schneider EC, Sagan D | title = Into the Cool: Energy Flow, Thermodynamics, and Life. | publisher = University of Chicago Press | date = 2005 | isbn = 0-226-73936-8}} |
|||
* {{cite book | vauthors = Lane N | title = Oxygen: The Molecule that Made the World. | publisher = Oxford University Press | location= USA | date = 2004 | isbn = 0-19-860783-0 }} |
|||
{{refend}} |
|||
'''高度''' |
|||
{{refbegin}} |
|||
*『ストライヤー生化学第8版』[[東京化学同人]]2018年8月28日 |
*『ストライヤー生化学第8版』[[東京化学同人]]2018年8月28日 |
||
* {{cite book | vauthors = Price N, Stevens L | title = Fundamentals of Enzymology: Cell and Molecular Biology of Catalytic Proteins. | publisher = Oxford University Press | date = 1999 | isbn = 0-19-850229-X }} |
|||
* {{cite book | vauthors = Berg J, Tymoczko J, Stryer L | title = Biochemistry | publisher = W. H. Freeman and Company | date = 2002 | isbn = 0-7167-4955-6 }} |
|||
* {{cite book | vauthors = Cox M, Nelson DL | title = Lehninger Principles of Biochemistry. | publisher = Palgrave Macmillan | date = 2004 | isbn = 0-7167-4339-6 }} |
|||
* {{cite book | author-link1 = Thomas D. Brock | vauthors = Brock TD, Madigan MR, Martinko J, Parker J | title = Brock's Biology of Microorganisms. | publisher = Benjamin Cummings | date = 2002 | isbn = 0-13-066271-2 }} |
|||
* {{cite book | vauthors = Da Silva JJ, Williams RJ | title = The Biological Chemistry of the Elements: The Inorganic Chemistry of Life. | publisher = Clarendon Press | date = 1991 | isbn = 0-19-855598-9 }} |
|||
* {{cite book | vauthors = Nicholls DG, Ferguson SJ | title = Bioenergetics | publisher = Academic Press Inc. | date = 2002 | isbn = 0-12-518121-3 }} |
|||
* {{cite journal | vauthors = Wood HG | title = Life with CO or CO2 and H2 as a source of carbon and energy | journal = FASEB Journal | volume = 5 | issue = 2 | pages = 156–63 | date = February 1991 | pmid = 1900793 | doi = 10.1096/fasebj.5.2.1900793 | s2cid = 45967404 }} |
|||
{{refend}} |
|||
== |
== 外部リンク == |
||
{{Wikiversity|Topic:Biochemistry}} |
|||
* [[代謝経路]] |
|||
{{wikibooks}} |
|||
* [[代謝マップ]] |
|||
{{Wiktionary}} |
|||
* [[呼吸]] |
|||
{{Commons category}} |
|||
* [[光合成]] |
|||
'''一般事項''' |
|||
* [[生合成]] |
|||
* [https://web.archive.org/web/20050308172226/http://www.rpi.edu/dept/bcbp/molbiochem/MBWeb/mb1/MB1index.html The Biochemistry of Metabolism] (archived 8 March 2005) |
|||
* [[生体高分子]] |
|||
* [http://www.sparknotes.com/testprep/books/sat2/biology/ Sparknotes SAT biochemistry] Overview of biochemistry. School level. |
|||
* [[恒常性]] |
|||
* [http://www.sciencegateway.org/resources/biologytext/index.html MIT Biology Hypertextbook] Undergraduate-level guide to molecular biology. |
|||
* [[生理的熱量]] |
|||
* [[新陳代謝]] |
|||
* [[薬物代謝]] |
|||
* [[基礎代謝]] |
|||
* [[メタボロミクス]] |
|||
'''ヒト代謝''' |
|||
==外部リンク== |
|||
* [http://library.med.utah.edu/NetBiochem/titles.htm Topics in Medical Biochemistry] Guide to human metabolic pathways. School level. |
|||
* [https://web.archive.org/web/20060218034732/http://www2.ufp.pt/~pedros/bq/integration.htm 代謝マップ Interactive Map of the Major Metabolic Pathways (英語)] |
|||
* [http://themedicalbiochemistrypage.org/ THE Medical Biochemistry Page] Comprehensive resource on human metabolism. |
|||
* {{Kotobank}} |
|||
'''データベース''' |
|||
* [http://www.expasy.org/cgi-bin/show_thumbnails.pl Flow Chart of Metabolic Pathways] at [[:en:ExPASy|ExPASy]] |
|||
* [http://www.iubmb-nicholson.org/pdf/MetabolicPathways_6_17_04_.pdf IUBMB-Nicholson Metabolic Pathways Chart] |
|||
* [http://bioinformatics.charite.de/supercyp/ SuperCYP: Database for Drug-Cytochrome-Metabolism] {{Webarchive|url=https://web.archive.org/web/20111103123642/http://bioinformatics.charite.de/supercyp/ |date=3 November 2011 }} |
|||
'''代謝経路''' |
|||
* [http://www.genome.ad.jp/kegg/pathway/map/map01100.html Metabolism reference Pathway] {{Webarchive|url=https://web.archive.org/web/20090223112439/http://www.genome.ad.jp/kegg/pathway/map/map01100.html |date=23 February 2009 }} |
|||
* {{webarchive |url=https://web.archive.org/web/*/helios.bto.ed.ac.uk/bto/microbes/nitrogen.htm |date=* |title=The Nitrogen cycle and Nitrogen fixation }} |
|||
<!-- 下記 Navboxes テンプレートは、英語版 Metabolism に由来するが、日本語版 Wikipedia ではほとんど役に立たないためコメントアウトした。削除してもよいが、いつか記事が充実するかもしれないので残すことにした。 --> |
|||
<!-- |
|||
{{Navboxes |
|||
|title = Articles related to Metabolism |
|||
|list = |
|||
{{MetabolismMap}} |
|||
{{metabolism}} |
|||
{{Glycolysis enzymes}} |
|||
{{Fructose and galactose metabolism enzymes}} |
|||
{{Glycosaminoglycan metabolism enzymes}} |
|||
{{Glycoprotein metabolism enzymes}} |
|||
{{Glycolipid/sphingolipid metabolism enzymes}} |
|||
{{Eicosanoid metabolism enzymes}} |
|||
{{Lipid metabolism enzymes}} |
|||
{{Urea cycle enzymes}} |
|||
{{Neurotransmitter metabolism enzymes}} |
|||
{{Porphyrin metabolism enzymes}} |
|||
{{Metabolism of vitamins, coenzymes, and cofactors}} |
|||
{{Amino acid metabolism enzymes}} |
|||
{{Nucleotide metabolism enzymes}} |
|||
{{Ketone and cholesterol metabolism enzymes}} |
|||
{{Pentose phosphate pathway enzymes}} |
|||
{{Non-mevalonate pathway enzymes}} |
|||
}} |
|||
--> |
|||
{{代謝}} |
{{代謝}} |
||
{{ |
{{Food science}} |
||
{{normdaten}} |
{{normdaten}} |
||
{{DEFAULTSORT:たいしや}} |
{{DEFAULTSORT:たいしや}} |
||
[[Category:代謝|*]] |
[[Category:代謝|*]] |
||
2023年2月25日 (土) 19:38時点における版
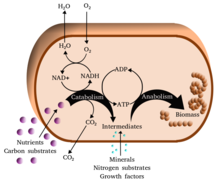

| 生化学 |
|---|
 |
代謝(たいしゃ、英: metabolism)とは、生物の生存と機能に不可欠な一連の化学反応である。代謝の主な機能は大きく3つあり、食物を細胞プロセスを実行するためのエネルギーに変換すること、食物をタンパク質、脂質、核酸および一部の炭水化物の合成に必要な構成成分に変換すること、そして代謝廃棄物を排出することである。酵素が触媒するこれらの反応によって生物は成長し、繁殖し、構造を維持し、環境に対応することができる。また、代謝という言葉は、消化、細胞内外・細胞間の物質輸送など、生体内で起こるすべての化学反応の全体を指すこともある。この文脈において、上記のような細胞内で起こる一連の反応を中間代謝(英: intermediary metabolism)と呼ぶ。
代謝反応は、化合物の分解を伴う異化作用(例:細胞呼吸によるグルコースからピルビン酸への変換)と、化合物(タンパク質、糖質、脂質、核酸など)の合成を伴う同化作用(生合成ともいう)に大別される。一般に、異化作用はエネルギーを放出し、同化作用はエネルギーを消費する。
代謝経路は、ある化学物質が別の化学物質に変換される一連の化学反応で、それぞれの段階は特定の酵素によって促進される。酵素は、エネルギーを必要とし、自然には起こらない望ましい反応を、エネルギーを放出する自発的な反応と結びつけることで、生物が推進することを可能にするため、極めて重要な役割を担っている。酵素は触媒として働き、反応速度を速めるとともに、細胞の環境の変化や他の細胞からのシグナルに応答するなど、代謝反応を調節することができる。
どの物質が栄養になり、どの物質が毒になるかは、その生物に固有の代謝系によって決まる。たとえば、ある種の原核生物は硫化水素を栄養とすることができるが、このガスは動物にとっては有毒なものである[1]。生物の基礎代謝率は、こうしたすべての化学反応によって消費されるエネルギー量の尺度である。
さまざまな生物種において、基本的な代謝経路が驚くほど類似していることは、代謝の顕著な特徴である[2]。たとえば、クエン酸回路の中間体としてよく知られている一連のカルボン酸は、知られているすべての生物に存在し、単細胞の大腸菌(Escherichia coli)からゾウのような巨大な多細胞生物にいたるまで見い出されている[3]。このような代謝経路の類似性は、生命の歴史の中で早くから出現し、その有効性によって持続しているためと考えられる[4][5]。II型糖尿病、メタボリックシンドローム、がんなどの特定の疾患では、正常な代謝が乱されている[6]。がん細胞の代謝も正常細胞の代謝とは異なっており、この違いを利用して、がんに対する治療介入の標的を特定できる可能性がある[7]。
主な生化学物質

動物、植物、微生物の構成要素は、主にアミノ酸、炭水化物、核酸、脂質(しばしば脂肪と呼ばれる)という4種類の基本的な分子から作られている。これらの分子は生命維持に不可欠であるため、代謝反応は、細胞や組織を形成するためにそれらを合成するか、消化によって分解してエネルギーとして利用することに集中している。また、これらの生化学物質が結合して、デオキシリボ核酸(DNA)やタンパク質など、生命維持に不可欠な高分子を形成する[8]。
| 分子の種類 | モノマー型の名称 | ポリマー型の名称 | ポリマー型の例 |
|---|---|---|---|
| アミノ酸 | アミノ酸 | タンパク質(ポリペプチドでできている) | 繊維状タンパク質、球状タンパク質 |
| 炭水化物 | 単糖 | 多糖 | デンプン、グリコーゲン、セルロース |
| 核酸 | ヌクレオチド | ポリヌクレオチド | デオキシリボ核酸(DNA)、リボ核酸(RNA) |
アミノ酸とタンパク質
タンパク質は、アミノ酸が直鎖状に配列し、ペプチド結合で結合したものである。多くのタンパク質は、代謝における化学反応の触媒となる酵素である。また、細胞の形状を維持する足場となる細胞骨格を形成するなど、構造的あるいは機械的な機能を持つタンパク質もある[9]。タンパク質は、細胞シグナル伝達、免疫応答、細胞接着、膜を介した能動輸送、および細胞周期の調節など、さまざまな重要な役割を担っている[10]。また、アミノ酸は、細胞のエネルギー代謝にも寄与しており、特にグルコースなどの主要なエネルギー源が不足したときや、細胞が代謝ストレスを受けたときに[11]、クエン酸回路(トリカルボン酸回路)[12]に炭素源を供給する役割もある。
脂質
脂質は、生化学物質の中でもっとも多様な一群である。その主な用途は、細胞膜のような内外の生体膜の一部として構造を作りだすほか、その化学エネルギーを利用することもできる[10]。多くの場合、非極性の長い炭化水素鎖と、小さな酸素を含む極性領域を持つ脂肪酸の重合体である[要出典]。一般的に脂質は、疎水性または両親媒性の生体分子と定義され、エタノール、ベンゼン、クロロホルムなどの有機溶媒に可溶である[13]。脂質は、脂肪酸とグリセロールを含む大きな化合物群で、グリセロール分子が3つの脂肪酸にエステル結合したものはトリアシルグリセリドと呼ばれる[14]。この基本構造にはいくつかの変種があり、スフィンゴミエリンはスフィンゴシンなどの骨格鎖が、リン脂質にはリン酸などの親水性基が存在する。また、ステロールなどのステロイド類も脂質の主要な分類の一つである[15]。
炭水化物

炭水化物(糖類とも呼ぶ)は、複数のヒドロキシ基(水酸基)が結合したアルデヒドまたはケトンからなる生体分子で、直鎖状または環状の形態を取ることがある。炭水化物はもっとも豊富に存在する生体分子であり、エネルギーの貯蔵や輸送や(デンプンやグリコーゲン)、構造部品としてなど(植物のセルロースや動物のキチン)、さまざまな役割を担っている[10]。炭水化物の基本的な構成単位は単糖と呼ばれ、ガラクトース、フルクトース、そしてもっとも重要なグルコースなどがある。単糖は互いに結合して多糖と呼ばれるより大きな炭水化物分子を形成することができ、その結合様式はほぼ無限に存在する[16]。
ヌクレオチド
デオキシリボ核酸(DNA)とリボ核酸(RNA)は共に核酸の一種で、いずれもヌクレオチドの重合体である。各ヌクレオチドは、糖基(リボースまたはデオキシリボース)に窒素塩基とリン酸基が結合したものである。核酸は、遺伝情報の保存や利用、および転写やタンパク質の生合成などの過程を通した解釈に大きな役割を果たしている[10]。これらの情報は、DNA修復機構によって保護され、DNA複製によって受け継がれる。HIVなどの多くのウイルスがRNAゲノムを持ち、逆転写を通じてそのRNAゲノムからDNA鋳型を生成している[17]。スプライセオソームやリボソームなどのリボザイム中のRNAは酵素としても働き、化学反応を触媒することができる。個々のヌクレオシドは、リボース糖に核酸塩基が結合して形成され、これらの塩基はプリンまたはピリミジンに分類される含窒素複素環である。また、ヌクレオチドは代謝基転移反応において補酵素としても働く[18]。
補酵素

代謝は膨大な数の化学反応から構成されているが、そのほとんどは、分子内の官能基や原子間の結合の移動させるという、いくつかの基本的な種類の反応に分類される[19]。この共通の化学的反応により、細胞は少数の代謝中間体の集まりを使って、異なる反応間で化学基を移動させることができる[18]。これらの基転移中間体は補酵素と呼ばれる。基転移反応はそれぞれの種類ごとに特定の補酵素によって行われ、補酵素は、それを生成する一連の酵素の基質となるとともに、それを消費する一連の酵素の基質となる。このように、補酵素は絶えず生産、消費、そして再利用されている[20]。
アデノシン三リン酸(ATP)は中心的な補酵素で、細胞の普遍的なエネルギー通貨として機能する。このヌクレオチドは、異なる化学反応間で化学エネルギーを伝達するために使用される。細胞内に存在するATPは微量であるが、常に再生されているため、人体は1日に自分の体重と同程度のATPを使うことができる[20]。ATPは異化作用と同化作用の橋渡しをする。異化作用は分子を分解し、同化作用は分子を再構築する。異化反応でATPが生産され、同化反応ではATPが消費される。さらに、ATPはリン酸化反応におけるリン酸基の担体としても機能する[21]。
ビタミンは、微量で必須とされる有機化合物で、細胞内では作ることができない。ヒトの栄養では、ほとんどのビタミンは修飾された後、補酵素として作用する。たとえば、水溶性ビタミンはすべて、細胞内で使用される際にリン酸化されるかヌクレオチドに結合する[22]。ビタミンB3(ナイアシン)の誘導体であるニコチンアミドアデニンジヌクレオチド(NAD+)は、水素受容体として機能する重要な補酵素である。数百種類のデヒドロゲナーゼ(脱水素酵素)が基質から電子を奪い、NAD+をNADHに還元する。この還元型補酵素は、水素原子を基質へ移動する必要のある細胞内の還元酵素の基質となる[23]。ニコチンアミドアデニンジヌクレオチドは、細胞内でNADHとNADPHという2つの関連した形態で存在し、NAD+/NADHは異化反応でより重要であり、NADP+/NADPHは同化反応で使用される[24]。

ミネラルと補因子
代謝はさまざまな無機元素に大きく依存しており、ナトリウムやカリウムのように豊富に含まれるものもあれば、少量で機能するものもある。ヒトの体重の約99%は、炭素、窒素、カルシウム、ナトリウム、塩素、カリウム、水素、リン、酸素、硫黄などの元素で構成されている。これらの元素のうち、炭素と窒素の大部分は有機化合物(タンパク質、脂質、炭水化物)に含まれており、酸素と水素の大部分は水として存在する[25]。
豊富な無機元素は電解質としてイオンとなり、さまざまな身体機能を維持するために機能している。もっとも重要なイオンには、ナトリウム、カリウム、カルシウム、マグネシウム、塩化物、リン酸塩、および有機イオンである重炭酸塩が含まれる。細胞膜を隔てたイオン勾配を正確に維持することにより、浸透圧とpHが保たれる[26]。神経や筋肉の活動電位は、細胞外液と細胞内液の電解質交換によって生じるため、イオンはこれらの組織の機能にも重要である[27]。電解質は、細胞膜に存在するイオンチャネルというタンパク質を通じて細胞に出入りする。たとえば、筋肉の収縮は、細胞膜や横行小管(T細管)にあるイオンチャネルを介したカルシウム、ナトリウム、カリウムの移動に依存している[28]。
遷移金属は通常、生体内に微量元素として存在し、亜鉛と鉄がもっとも多く含まれている[29]。これらの金属は、タンパク質上の特定の部位に強固に結合し、金属補因子として機能する。酵素補因子は、酵素の触媒作用の役割を果たし、触媒作用中に一時的に変化することはあっても、その後は必ず元の状態に戻る。生物は、特定の輸送担体(トランスポーター)を通じて金属微量栄養素を生体内に取り込む。これらの栄養素は、使用しないときにはフェリチンやメタロチオネインなどの貯蔵タンパク質に結合している[30][31]。
異化
異化作用は、大きな分子を分解する一連の代謝過程である。これらの過程には、食物分子の分解と酸化が含まれる。異化反応の主な目的は、分子を構築する同化反応に必要なエネルギーと成分を供給することである[32]。具体的な異化反応は生物によって異なり、生物はそのエネルギー、水素、および炭素(主要栄養群)の供給源によって下表のように分類することができる。有機栄養生物は、水素原子や電子の供給源として有機分子を利用し、無機栄養生物は無機基質を利用する。光栄養生物は太陽光を化学エネルギーに変換し[33]、化学栄養生物は有機分子、水素、硫化水素、鉄イオン (en:英語版) などの還元型供与体分子から酸素、硝酸塩、硫酸塩に電子を移動させる酸化還元反応に依存する。動物では、この反応によって複雑な有機分子が分解され、二酸化炭素や水などの単純な分子になる。植物やシアノバクテリアなどの光合成生物も、同様の電子移動反応によって、太陽光から吸収したエネルギーを蓄積している[34]。
| エネルギー源 | 太陽光 | 光- | -栄養生物 | ||
| 分子 | 化学- | ||||
| 水素または電子供与体 | 有機化合物 | 有機- | |||
| 有機化合物 | 無機- | ||||
| 炭素源 | 有機化合物 | 従属- | |||
| 無機化合物 | 独立- | ||||
動物でもっとも多く見られる一連の異化反応は、大きく3つの段階に分けることができる。第一段階では、タンパク質、多糖、脂質などの大きな有機分子を細胞外で消化し、より小さな成分に分解する。次に、これらの小分子は細胞に取り込まれ、さらに小さな分子、典型的にはアセチル補酵素A(アセチルCoA)に変換され、若干のエネルギーを放出する。最終段階では、アセチルCoA上のアセチル基がクエン酸回路と電子伝達系で水と二酸化炭素に酸化され、補酵素のニコチンアミドアデニンジヌクレオチド(NAD+)をNADHに還元しながら、より多くのエネルギーを放出する[32]。
消化
細胞は高分子を直接処理することができないため、タンパク質や多糖などの高分子は、細胞の代謝に利用される前に、より小さな単位に分解されなければならない。高分子の消化には、さまざまな種類の酵素が使用される。これらの消化酵素には、タンパク質をアミノ酸に分解するプロテアーゼや、多糖を単糖に分解するグリコシドヒドラーゼ(糖質加水分解酵素)がある[36]。
微生物は単純に消化酵素を周囲に分泌するのに対し[37][38]、動物は胃や膵臓などの消化管や唾液腺にある特殊な細胞から消化酵素を分泌する[39]。これらの細胞外酵素は、タンパク質をアミノ酸に、多糖を単糖に分解し、能動輸送タンパク質によって細胞内に輸送される[40][41]。

有機化合物からのエネルギー
炭水化物は、炭水化物異化作用と呼ばれる過程を経て、より小さな単位に分解される。炭水化物は通常、単糖に消化された後、細胞内に取り込まれる[42]。細胞内では、主に解糖という分解経路で分解され、グルコースやフルクトースなどの糖類がピルビン酸に変換され、若干のATPが生産される[43]。ピルビン酸はその後、いくつかの代謝経路で中間体として利用されるが、もっとも一般的には好気性(酸素を伴う)解糖によってアセチルCoAに変換され、クエン酸回路に入る。クエン酸回路でも若干のATPが作られるが、主な生成物はアセチルCoAが酸化されるときにNAD+から作られるNADHで、老廃物として二酸化炭素が放出される。嫌気性条件下では、代わりに解糖によって乳酸が生成し、乳酸デヒドロゲナーゼ(乳酸脱水素酵素)がNADHをNAD+に再酸化し、解糖で再利用される[44]。グルコース分解のもう一つの代替経路はペントースリン酸経路で、補酵素NADPHを還元して、核酸の糖成分であるリボースなどのペントース糖を生成する[要出典]。
脂肪は、加水分解により遊離脂肪酸とグリセロールに異化される。グリセロールは解糖に入り、脂肪酸はβ酸化によって分解されてアセチルCoAを生成し、クエン酸回路に送られる。脂肪酸は炭水化物よりも酸化されたときに多くのエネルギーを放出する。一部の細菌では、β酸化と同様の過程でステロイドを分解し、この分解過程でアセチルCoA、プロピオニルCoA、およびピルビン酸が大量に放出され、これらはすべて細胞内でエネルギーとして利用できる。結核菌(Mycobacterium tuberculosis)は、脂質であるコレステロールを唯一の炭素源として増殖することができ、コレステロールの利用経路に関わる遺伝子は、結核菌の感染ライフサイクルのさまざまな段階において重要であることが分かっている[45]。
アミノ酸は、タンパク質やその他の生体分子の合成に使われたり、エネルギーを作り出すために酸化されて尿素と二酸化炭素になる[46]。酸化経路では、まずアミノ基転移酵素(トランスアミナーゼ)によりアミノ基が除去される。その後、アミノ基は尿素回路に送られ、脱アミノ化された炭素骨格がケト酸の形で残される。これらのケト酸の中には、グルタミン酸の脱アミノ化によって生成するα-ケトグルタル酸のように、クエン酸回路の中間体となるものもある[47]。さらに、糖原性アミノ酸は、糖新生によってグルコースに変換されることもある(後述)[48]。
エネルギー転換
酸化的リン酸化
酸化的リン酸化は、クエン酸回路に見られるように、有機分子から奪った電子を酸素に移動し、放出されたエネルギーでATPを作る。真核生物では、ミトコンドリアの膜にある電子伝達系と呼ばれる一連のタンパク質がこれを行っている。一方、原核生物では、これらのタンパク質は細胞の内膜に存在する[49]。これらのタンパク質は、NADHなどの還元分子からのエネルギーを使って、膜を超えてプロトン(陽子)を送り出す[50]。

プロトンを送り出すことによって、ミトコンドリア膜を隔てたプロトン濃度差が生じ、電気化学的な勾配が生じる[51]。この勾配が動力となって、プロトンはATP合成酵素と呼ばれる酵素の基部を経由してミトコンドリア内に戻される。プロトンの流入によってATP合成酵素の軸サブユニットが回転し、酵素ドメイン活性部位の形が変化し、これによってアデノシン二リン酸がリン酸化され、ATPへ変換される[20]。
無機化合物からのエネルギー
化学無機栄養とは、原核生物に見られる代謝の一種で、無機化合物の酸化によってエネルギーを得るものである。これらの生物は、水素[52]、還元硫黄化合物(硫化物、硫化水素、チオ硫酸など)[1]、二価鉄イオン(Fe(II))[53]、またはアンモニア[54]を還元力源として利用し、これらの化合物を酸化することでエネルギーを得ている[55]。これらの微生物過程は、酢酸生成、硝化、脱窒などの地球規模での生物地球化学的循環において重要な役割を担い、土壌の肥沃度を維持するのに不可欠である[56][57]。
光からのエネルギー
植物、シアノバクテリア、紅色細菌、緑色硫黄細菌、および一部の原生生物では、太陽光からエネルギーを取り込むことができる。この過程は、後述する光合成の一部として、二酸化炭素を有機化合物に変換することにしばしば関連する。しかし、原核生物では、エネルギー捕捉系と炭素固定系を別々に働かせることもある。紅色細菌や緑色硫黄細菌は、太陽光をエネルギー源として利用するのと同時に、炭素固定と有機化合物の発酵を交互に行うことができる[58][59]。
さまざまな生物において、太陽エネルギーの捕獲は、プロトン濃度勾配という形でエネルギーを蓄積するという点で、上述の酸化的リン酸化と類似している。このプロトン起電力がATP合成の動力源となる[60]。この電子伝達系を駆動するのに必要な電子は、光合成反応中心 (en:英語版) と呼ばれる光捕集タンパク質から供給される。この反応中心は、光合成色素 (en:英語版) の性質によって2種類に分類され、光合成細菌の多くは1種類しか持たないが、植物やシアノバクテリアは2種類とも持っている[61]。
植物、藻類、シアノバクテリアなどの光合成生物では、光化学系II (en:英語版) が光エネルギーを利用して水から電子を奪って、老廃物として酸素を放出する。この電子はシトクロムb6f複合体に渡され、そのエネルギーを使って葉緑体内のチラコイド膜を超えてプロトンを送り出す[34]。このプロトンが、再び膜を通過して戻ってくることで、先と同様にATP合成酵素を駆動する。電子は光化学系Iを通り、補酵素NADP+を還元するために使われる[62]。この補酵素は、後述するカルビン回路に入るか、さらなるATP生成のために再利用される[要出典]。
同化
同化作用とは、異化作用によって放出されたエネルギーを使って、複雑な分子を合成する一連の建設的な代謝過程のことである。一般に、細胞構造を構成する複雑な分子は、より小さくて単純な前駆体が組み合わさって、段階的に構築される。同化作用は3つの基本的な段階からなる。第一に、アミノ酸、単糖、イソプレノイド、ヌクレオチドなどの前駆体の生成、第二に、これらの前駆体をATPからのエネルギーを使って反応型に活性化、第三に、これらの前駆体をタンパク質、多糖、脂質、核酸などの複合分子へ組み立てることである[63]。
生物の同化作用は、細胞内で作られる分子の供給源によって分類される。植物のような独立栄養生物は、二酸化炭素や水という単純な分子から多糖やタンパク質など、複雑な有機分子を細胞内で作ることができる。一方、従属栄養生物は、これらの複雑な分子を作るために、単糖やアミノ酸など、より複雑な化合物の供給源を必要とする。さらに、生物は最終的なエネルギー源によって分類される。光独立栄養生物と光従属栄養生物は光からエネルギーを得ており、化学独立栄養生物と化学従属栄養生物は酸化反応からエネルギーを得ている[63]。
炭素固定

光合成は、太陽光と二酸化炭素(CO2)から炭水化物を合成することである。植物、シアノバクテリア、藻類などでは、酸素光合成によって水を分解し、老廃物として酸素を放出する。このとき、前述の光合成反応中心で作られたATPとNADPHのエネルギーを利用して、CO2を3-ホスホグリセリン酸に変換し、さらにグルコースに変換することができる。この炭素固定反応は、カルビン-ベンソン回路の一部として、RuBisCOという酵素によって行われる[64]。植物では3種類で光合成が行われており、C3型光合成、C4型光合成、CAM型光合成である。これらは、CO2がカルビン回路に送られる経路が異なり、C3型はCO2を直接固定するのに対し、C4型とCAM型光合成はまずCO2を他の化合物に取り込むことで、強い日射しや乾燥した環境に適応する[65]。
光合成原核生物では、より多様な炭素固定化の機構を持っている。これらの生物は、カルビン-ベンソン回路、逆クエン酸回路[66]、またはアセチルCoAのカルボキシル化により炭素を固定できる[67][68]。また、原核生物の化学合成独立栄養生物では、カルビン-ベンソン回路によってCO2を固定しつつ、無機化合物からのエネルギーで反応を駆動するものもある[69]。
炭水化物と糖鎖
炭水化物の同化作用では、単純な有機酸をグルコースなどの単糖分子に変換し、さらにデンプンなどの多糖を作る場合がある。ピルビン酸、乳酸、グリセロール、3-ホスホグリセリン酸、アミノ酸などの化合物からグルコースを生成することを糖新生という。糖新生は、ピルビン酸が一連の中間体を経てグルコース-6-リン酸に変換するが、その多くは解糖と共通である[43]。しかし、この経路は単に解糖を逆にしたものではなく、いくつかの段階は非解糖系の酵素によって触媒されるという点に注意を要する。このことは、グルコースの生成と分解を別々に調節することができ、両方の経路が同時に進行する無益回路を防ぐことができる[70][71]。
脂肪は一般的なエネルギー貯蔵形態であるが、ヒトなどの脊椎動物はアセチルCoAをピルビン酸に変換する酵素機構を持たないため、貯蔵された脂肪酸を糖新生によってグルコースに変換することができない(植物には必要な酵素機構があるが、動物にはない)[72]。そのため、脊椎動物は長期間の飢餓状態に陥ると、脂肪酸をエネルギー源として代謝できない脳などの組織で、グルコースの代わりに脂肪酸からケトン体を生成してエネルギーを供給しなければならない[73]。一方、植物や細菌など他の生物では、グリオキシル酸回路という代謝経路を持ち、クエン酸回路の脱炭酸段階を迂回してアセチルCoAをオキサロ酢酸に変換し、そこからグルコースを生成することで解決している[72][74]。グルコースは、脂肪と異なり、通常は血液中のグルコース濃度を維持していた糖新生を通じて組織内で利用可能なエネルギー源として、ほとんどの組織に貯蔵される[75]。
多糖や糖鎖(グリカンともいう)は、グリコシルトランスフェラーゼ(糖転移酵素)という酵素によって、ウリジン二リン酸グルコース(UDP-Glc)のような反応性の糖-リン酸供与体から単糖が逐次、成長する多糖上の糖受容体性のヒドロキシ基に付加されることによって形成される。基質の環上のヒドロキシ基はいずれも糖受容体となりうるため、生成する多糖は直鎖でも分岐した構造でもよい[76]。生成した多糖は、それ自体が構造的あるいは代謝的な機能を果たすこともあれば、オリゴサッカリルトランスフェラーゼ(オリゴ糖転移酵素)と呼ばれる酵素によって、脂質やタンパク質に転位されることもある[77][78]。
脂肪酸, イソプレノイド, ステロール

脂肪酸は、脂肪酸合成酵素によるアセチルCoA単位の重合と、その後に還元することで作られる。脂肪酸のアシル鎖は、アシル基の付加、アルコールへの還元、アルケン基への脱水、さらにアルカン基への再還元という一連の反応によって伸長される。脂肪酸生合成の酵素は大きく2種類に分けられ、動物や菌類では、これらの脂肪酸合成酵素の反応のすべてを単一の多機能なI型タンパク質が担っているのに対し[79]、植物のプラスチド(色素体)や細菌では、経路の各段階を別々のII型酵素が担っている[80][81]。
テルペンやイソプレノイドは、カロテノイドを含む脂質の大きな一群であり、植物由来の天然物の中で最大の分類を形成している[82]。これらの化合物は、反応性前駆体であるイソペンテニルピロリン酸やジメチルアリルピロリン酸から供与されたイソプレン単位の結合と修飾によって作られる[83]。これらの前駆体は、さまざまな方法で作られる。動物や古細菌では、アセチルCoAからメバロン酸経路で作られ[84]、植物や細菌では、ピルビン酸とグリセルアルデヒド3-リン酸を基質とする非メバロン酸経路で作られる[83][85]。これらの活性化イソプレン供与体を用いる重要な反応のひとつにステロール生合成がある。ここでは、イソプレン単位が結合してスクアレンとなり、さらに折り畳まれて一連の環を形成してラノステロールとなる(図を参照)[86]。ラノステロールはその後、コレステロールやエルゴステロールなど、他のステロールに変換される[86][87]。
タンパク質
生物によって、20種類のアミノ酸を合成する能力において違いがある。ほとんどの細菌や植物では20種類すべてを合成することができるが、哺乳類は11種類の非必須アミノ酸しか合成できないため、残る9種類の必須アミノ酸は食物から摂取しなければならない[10]。細菌の肺炎マイコプラズマ(Mycoplasma pneumoniae)のような単純な寄生生物は、アミノ酸合成ができないため、宿主から直接アミノ酸を摂取している[88]。すべてのアミノ酸は、解糖、クエン酸回路、またはペントースリン酸経路の中間体から合成される。窒素はグルタミン酸とグルタミンから供給される。非必須アミノ酸の合成は、適切なα-ケト酸の形成に依存しており、そのα-ケト酸がアミノ基転移によってアミノ酸を形成する[89]。
タンパク質は、アミノ酸がペプチド結合で直鎖状に結合してできている。さまざまなタンパク質は、固有のアミノ酸残基の並びがあり、その一次構造を決定している。アルファベットを組み合わせて無数の単語ができるのと同様に、アミノ酸をさまざまな配列で組み合わせると、膨大な数のタンパク質ができあがる。タンパク質の合成は、まずアミノ酸をエステル結合で転移RNA(トランスファーRNA)分子に結合させ、活性化することから始まる。これは、アミノアシルtRNA合成酵素によるATP依存的な反応によって行われる[90]。こうしてできたアミノアシルtRNAは、リボソーム酵素の基質となり、リボソームは、伝令RNA(メッセンジャーRNA)の配列情報を利用して、伸長するタンパク質鎖にアミノ酸を順次結合する[91]。
ヌクレオチドの合成とサルベージ
ヌクレオチドは、アミノ酸、二酸化炭素、そしてギ酸から合成されるが、その合成経路は大量の代謝エネルギーを必要とする[92]。そのため、ほとんどの生物は、合成前のヌクレオチドを回収する効率的なシステムを備えている[92][93]。プリン塩基は、リボースに塩基が結合したヌクレオシドとして合成される[94]。アデニンとグアニンはともに、アミノ酸のグリシン、グルタミン、アスパラギン酸の原子と、補酵素のテトラヒドロ葉酸から転移したギ酸を用いて合成される前駆体ヌクレオシドのイノシン一リン酸から作られる。一方、ピリミジン塩基は、グルタミンとアスパラギン酸から作られるオロト酸から合成される[95]。
生体異物と酸化還元代謝
すべての生物は、食物として利用できない化合物や、代謝機能を持たないために細胞内に蓄積されると有害となる化合物に常にさらされている。これらの有害となりうる化合物は、生体異物(ゼノバイオティクス)と呼ばれる[96]。合成薬、自然毒、抗生物質などの生体異物は、一連の生体異物代謝酵素によって解毒される。ヒトでは、シトクロムP450オキシダーゼ(酸化酵素)[97]、UDP-グルクロン酸転移酵素[98]、グルタチオン-S-トランスフェラーゼ(転移酵素)[99]がこれに該当する。この酵素のシステムは3段階で作用し、まず生体異物を酸化し(第1段階)、次に分子上に水溶性基を結合させる(第2段階)。最後に、水溶性に変化した生体異物は細胞外に排出され、多細胞生物ではさらに代謝されてから排出されることもある(第3段階)。生態系では、これらの反応は、汚染物質の微生物による生分解や、汚染土壌や流出油のバイオレメディエーション(生物学的環境修復)において特に重要である[100]。これらの微生物反応の多くは多細胞生物と共通であるが、微生物の種類は驚くほど多様であるため、多細胞生物よりもはるかに幅広い種類の生体異物に対処し、有機塩素化合物などの残留性有機汚染物質も分解することが可能である[101]。
好気性生物に密接に関連する問題として、酸化ストレスが知られている[102]。これは、酸化的リン酸化やタンパク質フォールディング時のジスルフィド結合形成などの過程で、過酸化水素などの活性酸素種が作られることで起こる[103]。これらの有害な酸化物質は、グルタチオンなどの抗酸化代謝物や、カタラーゼ、ペルオキシダーゼなどの酵素によって除去される[104][105]。
生命系の熱力学
熱力学の法則 (en:英語版) は生物にも適用され、熱と仕事の移動に関する原則に従わなければならない。熱力学の第二法則は、孤立した系 (en:英語版) ではエントロピー(無秩序)が減少することはない、というものである。生物は驚くほど複雑なので、この法則と矛盾しているように思えるが、すべての生物は周囲と物質やエネルギーを交換する開放系であり、それゆえ生存が可能である。生命系は平衡状態にあるのではなく、むしろ環境のエントロピーを増大させることによって高い複雑性を維持する散逸系である[106]。細胞の代謝では、自然発生的な異化作用と非自然発生的な同化作用の結合によって、これを実現している。熱力学 (en:英語版) の用語で言えば、代謝は無秩序を作り出すことによって秩序を維持しているのである[107]。
調節と制御
ほとんどの生物の環境は常に変化しているため、代謝反応を細かく制御して、細胞内を一定の状態に維持する必要がある。この状態を恒常性(ホメオスタシス)という[108][109]。また、代謝調節によって、生物がシグナルに応答し、環境と積極的に相互作用することを可能にする[110]。代謝経路がどのように制御されているかを理解するためには、密接に関連する2つの概念が重要である。第一に、経路内における酵素の調節(regulation)とは、シグナルに応じて酵素の活性をいかに増減させるかということである。第二に、酵素による制御(control)とは、こうした酵素活性の変化が経路全体の速度(経路を通る流束(フラックス))に及ぼす影響のことである[111]。たとえば、ある酵素が大きな活性変化を示しても(すなわち、高度に調節されている)、その活性の変化が代謝経路のフラックスにほとんど影響を及ぼさないのであれば、この酵素は経路の制御には関与していないことになる[112]。
代謝調節は複数のレベルで行われる。内因性調節では、代謝経路は基質や生成物の量の変化に応じて自己調節する。たとえば、ある生成物の量が減少すると、それを補うために経路を通るフラックスを増加させることがある[111]。この種の調節には、経路内の複数の酵素の活性を調節するアロステリック調節がよく行われる[113]。一方、外因性調節は、多細胞生物において、ある細胞が別の細胞からのシグナルに応じて代謝を変化させるときに起こる。これらのシグナルは通常、ホルモンや成長因子などの水溶性メッセンジャーの形で、細胞表面にある特定の受容体によって検出される[114]。これらのシグナルは、しばしばタンパク質のリン酸化が関与するセカンドメッセンジャー系によって細胞内に伝達される[115]。
外因性制御の例として、インスリンというホルモンによるグルコース代謝の調節がよく知られている[116]。インスリンは、血糖値の上昇に反応して分泌される。インスリンが細胞上のインスリン受容体に結合すると、プロテインキナーゼのカスケードが活性化され、細胞にグルコースを吸収させ、脂肪酸やグリコーゲンといった貯蔵分子に変換させる[117]。グリコーゲンの代謝は、グリコーゲンを分解する酵素であるグリコーゲンホスホリラーゼと、グリコーゲンを合成する酵素であるグリコーゲンシンターゼの活性によって制御されている。これらの酵素は相互に調節され、リン酸化によってシンターゼは抑制されるが、ホスホリラーゼは活性化される。インスリンは、プロテインホスファターゼ(タンパク質脱リン酸化酵素)を活性化し、これらの酵素のリン酸化を低下させることにより、グリコーゲン合成を促進する[118]。
進化

解糖やクエン酸回路といった、上述の代謝の中心的経路は、生物の3つのドメイン (en:英語版) すべてに存在し、最後の普遍的共通祖先にも存在した[3][119]。この普遍的共通祖先は原核生物であり、おそらくアミノ酸、ヌクレオチド、炭水化物、および脂質の多様な代謝を行うメタン生成菌であったと考えられる[120][121]。このような古代の経路がその後の進化においても保持されたのは、解糖系やクエン酸回路などの経路が、最小限の段階で効率よく最終生成物を生成し、これらの反応が特定の代謝問題に対する最適解であった結果であると考えられる[4][5]。酵素に基づく代謝の最初の経路はプリンヌクレオチド代謝の一部であり、それ以前の代謝経路は古代のRNAワールドとつながっていた可能性がある[122]。
新しい代謝経路が進化する機構を説明するために、さまざまなモデルが提案されている。たとえば、小規模な祖先経路に新しい酵素が順次追加される方法、経路全体が複製しその後分岐する方法、そして既存の酵素が新しい反応経路に組み込まれる方法である[123]。これらの機構の相対的な重要性は不明であるが、ゲノム研究の結果、経路に含まれる酵素は共通の祖先を持つ可能性が高く、多くの経路が経路中の既存の段階から新たな機能を作り出し、段階的に進化してきたことが示唆されている[124]。第二のモデルとしては、代謝ネットワークにおけるタンパク質構造の進化を追跡する研究に基づくもので、酵素は広範囲に動員され、さまざまな代謝経路において同様の機能を果たすために酵素が借用されたことが示唆されている(MANETデータベースで明らか)[125]。このような動員過程は、進化的な酵素の集成を形成する[126]。第三の可能性は、代謝の一部が「基本単位(モジュール)」として存在し、異なる経路で再利用され、さまざまな分子に対して同様の機能を果たすというものである[127]。
新しい代謝経路の進化だけでなく、進化によって特定の代謝機能が失われることもある。たとえば、ある種の寄生生物では、生存に必須でない代謝過程が失われ、代わりに宿主からアミノ酸、ヌクレオチド、炭水化物などを搾取することがある[128]。同様の代謝機能の低下は、内部共生生物にも見られる[129]。
研究と操作

古典的に、代謝は、単一の代謝経路に焦点を当てた還元主義的なアプローチで研究される。とくに重要な方法は、生体全体、組織、細胞単体などさまざまなレベルでの放射性トレーサーの利用であり、放射性標識された中間体や生成物を同定することで、前駆体から最終産物までの経路を明確にする[130]。そして、これらの化学反応を触媒する酵素を精製し、その動態や阻害剤に対する反応を研究することができる。もう一つの方法は、細胞や組織に含まれる小分子を同定することで、これらの分子の完全な集合をメタボロームと呼ぶ。これらの方法では、単純な代謝経路の構造と機能についての洞察を与えてくれるが、細胞全体の代謝のような、より複雑な系を研究するには十分ではない[131]。
細胞内の代謝ネットワークは複雑で、数千種類の酵素が存在することもある。右上の図は、わずか43種類のタンパク質と40種類の代謝産物の相互関係を示したものである(ゲノム配列に基づき、最大26,500個の遺伝子を含む一覧が得られる)[132]。しかし、現在ではゲノムデータを用いて生化学反応の完全なネットワークを再構築し、その挙動を説明し予測できる、より包括的な数理モデルを開発することができるようになった[133]。これらのモデルは、経路や代謝産物データなどの古典的な手法によるデータと、プロテオミクスやDNAマイクロアレイ研究による遺伝子発現データを組み合わせた場合に、特に有効である[134]。これらの技術により、ヒトの代謝モデルが作成され、今後の創薬や生化学研究の指針になると期待される[135]。さらに、これらのモデルは、ヒトの病気を共通のタンパク質や代謝産物を持つグループに分類するためのネットワーク解析に利用されている[136][137]。
細菌の代謝ネットワークは、蝶ネクタイ型の組織構造の顕著な例を示し[138][139][140]、幅広い種類の栄養素を取り込み、少数の中間的な共通通貨分子を用いて、多様な生成物や複雑な高分子を作り出すことができる構造となっている。
代謝ネットワークに関する知識は、代謝工学の分野にも応用されている。この分野では、酵母、植物、細菌などの生物を、遺伝子工学的に改変して、バイオテクノロジーにおける有用性を高め、抗生物質などの医薬品や1,3-プロパンジオール、シキミ酸などの工業化学物質の生産を支援する[141][142][143]。これらの遺伝子組み換えは、通常、生産エネルギー消費の削減、製品収率の向上、廃棄物の発生を押さえることを目的として行われる[144]。
歴史
「metabolism(代謝)」という言葉は、フランス語の「métabolisme」または古代ギリシャ語の「μεταβολή」(metabolē)に由来し、「変化」を意味している。これは、「μεταβάλή」(metaballein)から派生したもので、「変化する」という意味である[145]。
ギリシャ哲学
アリストテレスの『動物部分論(The Parts of Animals)』には、オープンフローモデルを構築するのに十分なほど、彼の代謝に関する考え方の詳細が書かれている。アリストテレスは、代謝の過程で食物からの物質が各段階に変換し、熱が古典的な火の要素として放出され、残留物が尿、胆汁、糞便として排泄されると考えた[146]。
イブン・アン=ナフィースは、西暦1260年の著作『Theologus Autodidactus』(預言者の伝記に関するカミルの論考)で、代謝について、『身体とその部分は共に、分解と栄養の絶えない状態にあり、それらは常に永久に変化している 』と述べている[147]。
科学的手法の応用と現代代謝理論
代謝の科学的研究には長い歴史があり、初期の動物全体を調べる研究から、現代の生化学における個々の代謝反応の研究へと、数世紀にもわたって発展してきた。ヒトの代謝に関する最初の対照実験は、1614年にサントーリオ・サントーリオが著書『Ars de statica medicina』の中で発表したものである[148]。彼は、食事、睡眠、仕事、セックス、絶食、飲酒、排泄の前後の体重を記録した。彼は、摂取した食物の大部分が、「不感水分喪失」と名付けた過程で失われることを発見した。

こうした初期の研究では、代謝過程の機構は解明されておらず、生体組織を活性化しているのは生命力という特別な力によると考えられていた[149]。しかし、19世紀、ルイ・パスツールは、酵母による糖のエタノール発酵の研究から、この過程は酵母細胞内の物質が触媒になっていることを突き止め、「発酵体(ferments)」と名付けた。彼は、『アルコール発酵は、細胞の死や腐敗ではなく、酵母細胞の生命や組織化の結果として起こる作用である。』と記した[150]。この発見は、1828年にフリードリヒ・ヴェーラーが発表した尿素を化学的に合成に関する論文とともに[151]、完全に無機的な前駆体から作られた最初の有機化合物として特筆に値する。これによって、細胞内の有機化合物や化学反応が、他の化学分野のものと原理的に変わりないことが証明された。
20世紀初頭、エドゥアルト・ブフナーによる酵素の発見により、代謝の化学反応の研究は、細胞の生物学的研究から切り離され、生化学の分野が確立された[152]。その後、ハンス・クレブスが尿素回路を発見し[153]、ハンス・コーンバーグと共同でクエン酸回路とグリオキシル酸回路を発見するなど[154][155][74]、近代的な生化学者の貢献によって、生化学の知識は急速に拡大した。現代の生化学研究は、クロマトグラフィー、X線回折、NMR分光法、放射性同位体標識、電子顕微鏡、分子動力学シミュレーションなどの新しい技術の利用により、細胞内の多数の分子や代謝経路の同定と詳細な解析が可能になった[要出典]。
参考項目
- 人為的な代謝 - 人間社会の物質とエネルギーの回転を表す産業における用語
- 代謝拮抗剤 - 代謝物の利用を阻害する化学物質
- 熱量測定法 - 化学および熱力学において物体の状態変数の変化を測定すること
- 等温マイクロカロリメトリー - 化学、物理、生物学的プロセスのリアルタイム監視と動的分析のための実験室的手法
- 先天性代謝異常 - 先天的に酵素活性に異常をきたす遺伝病の一種
- 鉄-硫黄ワールド仮説 - 生命の起源に関する「代謝優先」説
- 代謝異常 - タンパク質、脂肪、炭水化物などの主要栄養素の体内での下項および配分を有害に変化させる疾患
- マイクロ生理学 - 生命や生体物質の機能や活動、および非常に小規模な物理的および化学的現象のinvitro測定
- 一次栄養群 - 生命維持、成長、生殖に必要なエネルギーと炭素の供給源に応じた栄養様式に関連して分類された生物のグループ
- 呼吸測定 - 生物の代謝率を推定するための熱産生の間接的な測定手法(熱量測定法)
- 河川代謝 - 水生生態系内でエネルギーがどのように作成され、使用されるかを定量化する概念
- 硫黄代謝 - 生物による硫黄の還元、酸化の経路
- 食品の温熱効果 - 食品を使用および保管するための処理コストによる基礎代謝率を超えるエネルギー消費
- 都市代謝 - 都市内の物質とエネルギーの流れの記述と分析のためのモデル
- 水代謝 - 浸透圧調節と行動によって生体内の水分量を制御する必要がある生体の恒常性の側面
- オーバーフロー代謝 - 細胞が呼吸経路を使わずにグルコースなど成長基質を不完全に酸化すること
- 腫瘍代謝 -発癌および腫瘍状態への進行を伴う細胞で発生する代謝変化に着目した研究分野
- Reactome - 生物学的経路の無料のオンラインデータベース
- KEGG - ゲノム、生物経路、疾患、薬剤、化学物質などを扱うデータベースの集合体
脚注
- ^ a b Friedrich C (1998). Physiology and genetics of sulfur-oxidizing bacteria. Advances in Microbial Physiology. 39. 235–89. doi:10.1016/S0065-2911(08)60018-1. ISBN 978-0-12-027739-1. PMID 9328649
- ^ “The universal nature of biochemistry”. Proceedings of the National Academy of Sciences of the United States of America 98 (3): 805–8. (January 2001). Bibcode: 2001PNAS...98..805P. doi:10.1073/pnas.98.3.805. PMC 33372. PMID 11158550.
- ^ a b “Universality in intermediary metabolism”. Proceedings of the National Academy of Sciences of the United States of America 101 (36): 13168–73. (September 2004). Bibcode: 2004PNAS..10113168S. doi:10.1073/pnas.0404922101. PMC 516543. PMID 15340153.
- ^ a b “Evolutionary optimization of metabolic pathways. Theoretical reconstruction of the stoichiometry of ATP and NADH producing systems”. Bulletin of Mathematical Biology 63 (1): 21–55. (January 2001). doi:10.1006/bulm.2000.0197. PMID 11146883.
- ^ a b “The puzzle of the Krebs citric acid cycle: assembling the pieces of chemically feasible reactions, and opportunism in the design of metabolic pathways during evolution”. Journal of Molecular Evolution 43 (3): 293–303. (September 1996). Bibcode: 1996JMolE..43..293M. doi:10.1007/BF02338838. PMID 8703096.
- ^ “Metabolic Flexibility as an Adaptation to Energy Resources and Requirements in Health and Disease”. Endocrine Reviews 39 (4): 489–517. (August 2018). doi:10.1210/er.2017-00211. PMC 6093334. PMID 29697773.
- ^ “Understanding the Intersections between Metabolism and Cancer Biology”. Cell 168 (4): 657–669. (February 2017). doi:10.1016/j.cell.2016.12.039. PMC 5329766. PMID 28187287.
- ^ “The Molecular Composition of Cells” (英語). The Cell: A Molecular Approach. (2000). オリジナルの27 August 2020時点におけるアーカイブ。 25 June 2020閲覧。.
- ^ “Dynamic filaments of the bacterial cytoskeleton”. Annual Review of Biochemistry 75: 467–92. (2006). doi:10.1146/annurev.biochem.75.103004.142452. PMID 16756499.
- ^ a b c d e Lehninger Principles of Biochemistry. New York: W. H. Freeman and company. (2005). p. 841. ISBN 978-0-7167-4339-2
- ^ “Metabolic fate of the increased yeast amino Acid uptake subsequent to catabolite derepression”. Journal of Amino Acids 2013: 461901. (2013). doi:10.1155/2013/461901. PMC 3575661. PMID 23431419.
- ^ “Analysis of tricarboxylic acid-cycle metabolism of hepatoma cells by comparison of 14CO2 ratios”. The Biochemical Journal 246 (3): 633–9. (September 1987). doi:10.1042/bj2460633. PMC 1148327. PMID 3120698.
- ^ “A comprehensive classification system for lipids”. Journal of Lipid Research 46 (5): 839–61. (May 2005). doi:10.1194/jlr.E400004-JLR200. PMID 15722563.
- ^ “Lipid nomenclature Lip-1 & Lip-2”. www.qmul.ac.uk. 6 June 2020時点のオリジナルよりアーカイブ。2020年6月6日閲覧。
- ^ Biochemistry (8 ed.). New York: W. H. Freeman. (8 April 2015). pp. 362. ISBN 978-1-4641-2610-9. OCLC 913469736
- ^ “Glycomics: an integrated systems approach to structure-function relationships of glycans”. Nature Methods 2 (11): 817–24. (November 2005). doi:10.1038/nmeth807. PMID 16278650.
- ^ “Basics of the virology of HIV-1 and its replication”. Journal of Clinical Virology 34 (4): 233–44. (December 2005). doi:10.1016/j.jcv.2005.09.004. PMID 16198625.
- ^ a b “Mechanisms of enzyme-catalyzed group transfer reactions”. Annual Review of Biochemistry 47: 1031–78. (1978). doi:10.1146/annurev.bi.47.070178.005123. PMID 354490.
- ^ “The Ninth Sir Hans Krebs Lecture. Compartmentation and communication in living systems. Ligand conduction: a general catalytic principle in chemical, osmotic and chemiosmotic reaction systems”. European Journal of Biochemistry 95 (1): 1–20. (March 1979). doi:10.1111/j.1432-1033.1979.tb12934.x. PMID 378655.
- ^ a b c “Catalytic and mechanical cycles in F-ATP synthases. Fourth in the Cycles Review Series”. EMBO Reports 7 (3): 276–82. (March 2006). doi:10.1038/sj.embor.7400646. PMC 1456893. PMID 16607397.
- ^ “ATP synthesis and storage”. Purinergic Signalling 8 (3): 343–57. (September 2012). doi:10.1007/s11302-012-9305-8. PMC 3360099. PMID 22528680.
- ^ “Vitamins Are Often Precursors to Coenzymes” (英語). Biochemistry. 5th Edition. (2002). オリジナルの15 December 2020時点におけるアーカイブ。 9 June 2020閲覧。.
- ^ “The power to reduce: pyridine nucleotides--small molecules with a multitude of functions”. The Biochemical Journal 402 (2): 205–18. (March 2007). doi:10.1042/BJ20061638. PMC 1798440. PMID 17295611.
- ^ Advances in food biochemistry. Boca Raton: CRC Press. (2009). pp. 228. ISBN 978-1-4200-0769-5. OCLC 607553259
- ^ “Chemical and elemental analysis of humans in vivo using improved body composition models”. The American Journal of Physiology 261 (2 Pt 1): E190-8. (August 1991). doi:10.1152/ajpendo.1991.261.2.E190. PMID 1872381.
- ^ “Electrolyte Balance”. Anatomy and Physiology. OpenStax. オリジナルの2 June 2020時点におけるアーカイブ。 23 June 2020閲覧。
- ^ “The Action Potential and Conduction of Electric Impulses” (英語). Molecular Cell Biology (4th ed.). (2000). オリジナルの30 May 2020時点におけるアーカイブ。 23 June 2020閲覧。
- ^ “Excitation-contraction coupling from the 1950s into the new millennium”. Clinical and Experimental Pharmacology & Physiology 33 (9): 763–72. (September 2006). doi:10.1111/j.1440-1681.2006.04441.x. PMID 16922804.
- ^ “Zinc Efflux in Trichomonas vaginalis: In Silico Identification and Expression Analysis of CDF-Like Genes” (英語). Quantitative Models for Microscopic to Macroscopic Biological Macromolecules and Tissues. Cham: Springer International Publishing. (2018). pp. 149–168. doi:10.1007/978-3-319-73975-5_8. ISBN 978-3-319-73975-5
- ^ “Mammalian zinc transport, trafficking, and signals”. The Journal of Biological Chemistry 281 (34): 24085–9. (August 2006). doi:10.1074/jbc.R600011200. PMID 16793761. オリジナルの25 June 2020時点におけるアーカイブ。 24 June 2020閲覧。.
- ^ “Iron uptake and metabolism in the new millennium”. Trends in Cell Biology 17 (2): 93–100. (February 2007). doi:10.1016/j.tcb.2006.12.003. PMID 17194590.
- ^ a b “How Cells Obtain Energy from Food” (英語). Molecular Biology of the Cell (4th ed.). (2002). オリジナルの5 July 2021時点におけるアーカイブ。 25 June 2020閲覧。
- ^ “Contributions of anoxygenic and oxygenic phototrophy and chemolithotrophy to carbon and oxygen fluxes in aquatic environments” (英語). Aquatic Microbial Ecology 56: 177–192. (2009-09-03). doi:10.3354/ame01315. ISSN 0948-3055. オリジナルの25 June 2020時点におけるアーカイブ。 25 June 2020閲覧。.
- ^ a b “The complex architecture of oxygenic photosynthesis”. Nature Reviews. Molecular Cell Biology 5 (12): 971–82. (December 2004). doi:10.1038/nrm1525. PMID 15573135.
- ^ Brock Mikrobiologie (11., überarb. Aufl ed.). München: Pearson Studium. (2006). pp. 604, 621. ISBN 3-8273-7187-2. OCLC 162303067
- ^ Energy : production, conversion, storage, conservation, and coupling (Second ed.). Lincoln: Springer. (2016). pp. 431. ISBN 978-3-319-29650-0. OCLC 945435943
- ^ “Bacterial extracellular zinc-containing metalloproteases”. Microbiological Reviews 57 (4): 823–37. (December 1993). doi:10.1128/MMBR.57.4.823-837.1993. PMC 372940. PMID 8302217.
- ^ “Bacterial lipases: an overview of production, purification and biochemical properties”. Applied Microbiology and Biotechnology 64 (6): 763–81. (June 2004). doi:10.1007/s00253-004-1568-8. PMID 14966663.
- ^ “The digestive system: linking theory and practice”. British Journal of Nursing 6 (22): 1285–91. (1997). doi:10.12968/bjon.1997.6.22.1285. PMID 9470654.
- ^ “How amino acids get into cells: mechanisms, models, menus, and mediators”. Journal of Parenteral and Enteral Nutrition 16 (6): 569–78. (1992). doi:10.1177/0148607192016006569. PMID 1494216.
- ^ “Structure and function of facilitative sugar transporters”. Current Opinion in Cell Biology 11 (4): 496–502. (August 1999). doi:10.1016/S0955-0674(99)80072-6. PMID 10449337.
- ^ “Structure and function of mammalian facilitative sugar transporters”. The Journal of Biological Chemistry 268 (26): 19161–4. (September 1993). doi:10.1016/S0021-9258(19)36489-0. PMID 8366068.
- ^ a b “The cellular fate of glucose and its relevance in type 2 diabetes”. Endocrine Reviews 25 (5): 807–30. (October 2004). doi:10.1210/er.2003-0026. PMID 15466941.
- ^ “Glycolysis, tumor metabolism, cancer growth and dissemination. A new pH-based etiopathogenic perspective and therapeutic approach to an old cancer question”. Oncoscience 1 (12): 777–802. (18 December 2014). doi:10.18632/oncoscience.109. PMC 4303887. PMID 25621294.
- ^ “Pathogen roid rage: cholesterol utilization by Mycobacterium tuberculosis”. Critical Reviews in Biochemistry and Molecular Biology 49 (4): 269–93. (2014). doi:10.3109/10409238.2014.895700. PMC 4255906. PMID 24611808.
- ^ “Amino Acid Metabolism”. Annual Review of Biochemistry 32: 355–98. (1963). doi:10.1146/annurev.bi.32.070163.002035. PMID 14144484.
- ^ “Glutamate, at the interface between amino acid and carbohydrate metabolism”. The Journal of Nutrition 130 (4S Suppl): 988S–90S. (April 2000). doi:10.1093/jn/130.4.988S. PMID 10736367.
- ^ “Glutamine: the emperor or his clothes?”. The Journal of Nutrition 131 (9 Suppl): 2449S–59S; discussion 2486S–7S. (September 2001). doi:10.1093/jn/131.9.2449S. PMID 11533293.
- ^ “Energy transduction: proton transfer through the respiratory complexes”. Annual Review of Biochemistry 75: 165–87. (2006). doi:10.1146/annurev.biochem.75.062003.101730. PMC 2659341. PMID 16756489.
- ^ “Structures and proton-pumping strategies of mitochondrial respiratory enzymes”. Annual Review of Biophysics and Biomolecular Structure 30: 23–65. (2001). doi:10.1146/annurev.biophys.30.1.23. PMID 11340051. オリジナルの22 January 2020時点におけるアーカイブ。 11 November 2019閲覧。.
- ^ “Mechanism of the F(1)F(0)-type ATP synthase, a biological rotary motor”. Trends in Biochemical Sciences 27 (3): 154–60. (March 2002). doi:10.1016/S0968-0004(01)02051-5. PMID 11893513.
- ^ “Molecular biology of hydrogen utilization in aerobic chemolithotrophs”. Annual Review of Microbiology 47: 351–83. (1993). doi:10.1146/annurev.mi.47.100193.002031. PMID 8257102.
- ^ “Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction”. Nature Reviews. Microbiology 4 (10): 752–64. (October 2006). doi:10.1038/nrmicro1490. PMID 16980937. オリジナルの2 May 2019時点におけるアーカイブ。 6 October 2019閲覧。.
- ^ “The anaerobic oxidation of ammonium”. FEMS Microbiology Reviews 22 (5): 421–37. (December 1998). doi:10.1111/j.1574-6976.1998.tb00379.x. PMID 9990725.
- ^ “Enzymology and bioenergetics of respiratory nitrite ammonification”. FEMS Microbiology Reviews 26 (3): 285–309. (August 2002). doi:10.1111/j.1574-6976.2002.tb00616.x. PMID 12165429.
- ^ “Soil microorganisms as controllers of atmospheric trace gases (H2, CO, CH4, OCS, N2O, and NO)”. Microbiological Reviews 60 (4): 609–40. (December 1996). doi:10.1128/MMBR.60.4.609-640.1996. PMC 239458. PMID 8987358.
- ^ “Microbial co-operation in the rhizosphere”. Journal of Experimental Botany 56 (417): 1761–78. (July 2005). doi:10.1093/jxb/eri197. PMID 15911555.
- ^ “Diel variations in carbon metabolism by green nonsulfur-like bacteria in alkaline siliceous hot spring microbial mats from Yellowstone National Park”. Applied and Environmental Microbiology 71 (7): 3978–86. (July 2005). Bibcode: 2005ApEnM..71.3978V. doi:10.1128/AEM.71.7.3978-3986.2005. PMC 1168979. PMID 16000812.
- ^ “Interactive control of Rhodobacter capsulatus redox-balancing systems during phototrophic metabolism”. Journal of Bacteriology 183 (21): 6344–54. (November 2001). doi:10.1128/JB.183.21.6344-6354.2001. PMC 100130. PMID 11591679.
- ^ “Energy Conversion: Mitochondria and Chloroplasts” (英語). Molecular Biology of the Cell (4th ed.). (2002). オリジナルの15 December 2020時点におけるアーカイブ。 3 July 2020閲覧。
- ^ “Photosynthetic reaction centers”. FEBS Letters 438 (1–2): 5–9. (October 1998). doi:10.1016/S0014-5793(98)01245-9. PMID 9821949.
- ^ “Cyclic electron flow around photosystem I is essential for photosynthesis”. Nature 429 (6991): 579–82. (June 2004). Bibcode: 2004Natur.429..579M. doi:10.1038/nature02598. PMID 15175756.
- ^ a b “What is Anabolism?” (英語). News-Medical.net (2009年11月26日). 5 July 2020時点のオリジナルよりアーカイブ。2020年7月4日閲覧。
- ^ “Ribulose-1,5-bisphosphate carboxylase-oxygenase”. Annual Review of Biochemistry 52: 507–35. (1983). doi:10.1146/annurev.bi.52.070183.002451. PMID 6351728.
- ^ “Crassulacean acid metabolism: plastic, fantastic”. Journal of Experimental Botany 53 (369): 569–80. (April 2002). doi:10.1093/jexbot/53.369.569. PMID 11886877.
- ^ “Evidence for autotrophic CO2 fixation via the reductive tricarboxylic acid cycle by members of the epsilon subdivision of proteobacteria”. Journal of Bacteriology 187 (9): 3020–7. (May 2005). doi:10.1128/JB.187.9.3020-3027.2005. PMC 1082812. PMID 15838028.
- ^ “Enzymes of a novel autotrophic CO2 fixation pathway in the phototrophic bacterium Chloroflexus aurantiacus, the 3-hydroxypropionate cycle”. European Journal of Biochemistry 215 (3): 633–43. (August 1993). doi:10.1111/j.1432-1033.1993.tb18074.x. PMID 8354269.
- ^ “Life with CO or CO2 and H2 as a source of carbon and energy”. FASEB Journal 5 (2): 156–63. (February 1991). doi:10.1096/fasebj.5.2.1900793. PMID 1900793.
- ^ “Something from almost nothing: carbon dioxide fixation in chemoautotrophs”. Annual Review of Microbiology 52: 191–230. (1998). doi:10.1146/annurev.micro.52.1.191. PMID 9891798.
- ^ “Design of glycolysis”. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences 293 (1063): 5–22. (June 1981). Bibcode: 1981RSPTB.293....5B. doi:10.1098/rstb.1981.0056. PMID 6115423.
- ^ “Fructose-2,6-bisphosphate in control of hepatic gluconeogenesis. From metabolites to molecular genetics”. Diabetes Care 13 (6): 582–99. (June 1990). doi:10.2337/diacare.13.6.582. PMID 2162755.
- ^ a b “Revisiting the glyoxylate cycle: alternate pathways for microbial acetate assimilation”. Molecular Microbiology 61 (2): 274–6. (July 2006). doi:10.1111/j.1365-2958.2006.05247.x. PMID 16856935.
- ^ “Proteolytic and lipolytic responses to starvation”. Nutrition 22 (7–8): 830–44. (2006). doi:10.1016/j.nut.2006.04.008. PMID 16815497.
- ^ a b “Synthesis of cell constituents from C2-units by a modified tricarboxylic acid cycle”. Nature 179 (4568): 988–91. (May 1957). Bibcode: 1957Natur.179..988K. doi:10.1038/179988a0. PMID 13430766.
- ^ “Metabolic pathways and abnormalities”. Surgery (Oxford) 34 (6): 266–272. (June 2016). doi:10.1016/j.mpsur.2016.03.010. ISSN 0263-9319. オリジナルの31 October 2020時点におけるアーカイブ。 28 August 2020閲覧。.
- ^ “Glycosylation Precursors”. Essentials of Glycobiology (3rd ed.). Cold Spring Harbor (NY): Cold Spring Harbor Laboratory Press. (2015). doi:10.1101/glycobiology.3e.005. PMID 28876856. オリジナルの24 February 2022時点におけるアーカイブ。 2020年7月8日閲覧。
- ^ “Concepts and principles of glycobiology”. FASEB Journal 7 (14): 1330–7. (November 1993). doi:10.1096/fasebj.7.14.8224606. PMID 8224606.
- ^ “Recent developments in the cell biology and biochemistry of glycosylphosphatidylinositol lipids (review)”. Molecular Membrane Biology 17 (1): 1–16. (2000). doi:10.1080/096876800294443. PMID 10824734.
- ^ “Structure and function of animal fatty acid synthase”. Lipids 39 (11): 1045–53. (November 2004). doi:10.1007/s11745-004-1329-9. PMID 15726818.
- ^ “The structural biology of type II fatty acid biosynthesis”. Annual Review of Biochemistry 74: 791–831. (2005). doi:10.1146/annurev.biochem.74.082803.133524. PMID 15952903.
- ^ “Regulation of Fatty Acid Synthesis”. Annual Review of Plant Physiology and Plant Molecular Biology 48: 109–136. (June 1997). doi:10.1146/annurev.arplant.48.1.109. PMID 15012259.
- ^ “An overview of the non-mevalonate pathway for terpenoid biosynthesis in plants”. Journal of Biosciences 28 (5): 637–46. (September 2003). doi:10.1007/BF02703339. PMID 14517367. オリジナルの15 April 2007時点におけるアーカイブ。.
- ^ a b “Diversity of the biosynthesis of the isoprene units”. Natural Product Reports 20 (2): 171–83. (April 2003). doi:10.1039/b109860h. PMID 12735695.
- ^ “Methanocaldococcus jannaschii uses a modified mevalonate pathway for biosynthesis of isopentenyl diphosphate”. Journal of Bacteriology 188 (9): 3192–8. (May 2006). doi:10.1128/JB.188.9.3192-3198.2006. PMC 1447442. PMID 16621811.
- ^ “The 1-Deoxy-D-Xylulose-5-Phosphate Pathway of Isoprenoid Biosynthesis in Plants”. Annual Review of Plant Physiology and Plant Molecular Biology 50: 47–65. (June 1999). doi:10.1146/annurev.arplant.50.1.47. PMID 15012203.
- ^ a b “Sterol biosynthesis”. Annual Review of Biochemistry 50: 585–621. (1981). doi:10.1146/annurev.bi.50.070181.003101. PMID 7023367.
- ^ “Cloning of the late genes in the ergosterol biosynthetic pathway of Saccharomyces cerevisiae--a review”. Lipids 30 (3): 221–6. (March 1995). doi:10.1007/BF02537824. PMID 7791529.
- ^ “Complete sequence analysis of the genome of the bacterium Mycoplasma pneumoniae”. Nucleic Acids Research 24 (22): 4420–49. (November 1996). doi:10.1093/nar/24.22.4420. PMC 146264. PMID 8948633.
- ^ Textbook of Medical Physiology. Philadelphia: Elsevier. (2006). pp. 855–6. ISBN 978-0-7216-0240-0
- ^ “The renaissance of aminoacyl-tRNA synthesis”. EMBO Reports 2 (5): 382–7. (May 2001). doi:10.1093/embo-reports/kve095. PMC 1083889. PMID 11375928. オリジナルの1 May 2011時点におけるアーカイブ。.
- ^ “Mechanism of protein biosynthesis”. Bacteriological Reviews 33 (2): 264–301. (June 1969). doi:10.1128/MMBR.33.2.264-301.1969. PMC 378322. PMID 4896351.
- ^ a b “The biochemistry and physiology of nucleotides”. The Journal of Nutrition 124 (1 Suppl): 124S–127S. (January 1994). doi:10.1093/jn/124.suppl_1.124S. PMID 8283301. “Pyrimidine and purine biosynthesis and degradation in plants”. Annual Review of Plant Biology 57: 805–36. (2006). doi:10.1146/annurev.arplant.57.032905.105421. PMID 16669783.
- ^ “Purine and pyrimidine nucleotide metabolism in higher plants”. Journal of Plant Physiology 160 (11): 1271–95. (November 2003). doi:10.1078/0176-1617-01169. PMID 14658380.
- ^ “Characterisation of multiple substrate-specific (d)ITP/(d)XTPase and modelling of deaminated purine nucleotide metabolism”. BMB Reports 45 (4): 259–64. (April 2012). doi:10.5483/BMBRep.2012.45.4.259. PMID 22531138. オリジナルの24 October 2020時点におけるアーカイブ。 18 September 2019閲覧。.
- ^ “Enzymes of nucleotide synthesis”. Current Opinion in Structural Biology 5 (6): 752–7. (December 1995). doi:10.1016/0959-440X(95)80007-7. PMID 8749362.
- ^ “The biochemistry of drug metabolism--an introduction: part 1. Principles and overview”. Chemistry & Biodiversity 3 (10): 1053–101. (October 2006). doi:10.1002/cbdv.200690111. PMID 17193224.
- ^ “The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans”. Current Drug Metabolism 3 (6): 561–97. (December 2002). doi:10.2174/1389200023337054. PMID 12369887.
- ^ “UDP-glucuronosyltransferases”. Current Drug Metabolism 1 (2): 143–61. (September 2000). doi:10.2174/1389200003339171. PMID 11465080.
- ^ “Structure, function and evolution of glutathione transferases: implications for classification of non-mammalian members of an ancient enzyme superfamily”. The Biochemical Journal 360 (Pt 1): 1–16. (November 2001). doi:10.1042/0264-6021:3600001. PMC 1222196. PMID 11695986.
- ^ “Exploring the microbial biodegradation and biotransformation gene pool”. Trends in Biotechnology 23 (10): 497–506. (October 2005). doi:10.1016/j.tibtech.2005.08.002. PMID 16125262.
- ^ “Bacterial degradation of xenobiotic compounds: evolution and distribution of novel enzyme activities”. Environmental Microbiology 7 (12): 1868–82. (December 2005). doi:10.1111/j.1462-2920.2005.00966.x. PMID 16309386. オリジナルの11 November 2019時点におけるアーカイブ。 11 November 2019閲覧。.
- ^ “Oxidative stress: the paradox of aerobic life”. Biochemical Society Symposium 61: 1–31. (1995). doi:10.1042/bss0610001. PMID 8660387.
- ^ “Oxidative protein folding in eukaryotes: mechanisms and consequences”. The Journal of Cell Biology 164 (3): 341–6. (February 2004). doi:10.1083/jcb.200311055. PMC 2172237. PMID 14757749.
- ^ “Oxidative stress: oxidants and antioxidants”. Experimental Physiology 82 (2): 291–5. (March 1997). doi:10.1113/expphysiol.1997.sp004024. PMID 9129943.
- ^ “The antioxidants and pro-antioxidants network: an overview”. Current Pharmaceutical Design 10 (14): 1677–94. (2004). doi:10.2174/1381612043384655. PMID 15134565.
- ^ “Does microbial life always feed on negative entropy? Thermodynamic analysis of microbial growth”. Biochimica et Biophysica Acta (BBA) - Bioenergetics 1412 (3): 191–211. (August 1999). doi:10.1016/S0005-2728(99)00065-1. PMID 10482783.
- ^ “Thermodynamics and bioenergetics”. Biophysical Chemistry 97 (2–3): 87–111. (June 2002). doi:10.1016/S0301-4622(02)00069-8. PMID 12050002. オリジナルの4 August 2020時点におけるアーカイブ。 22 September 2019閲覧。.
- ^ “Scale-free networks in cell biology”. Journal of Cell Science 118 (Pt 21): 4947–57. (November 2005). arXiv:q-bio/0510054. Bibcode: 2005q.bio....10054A. doi:10.1242/jcs.02714. PMID 16254242.
- ^ “Regulation analysis of energy metabolism”. The Journal of Experimental Biology 200 (Pt 2): 193–202. (January 1997). doi:10.1242/jeb.200.2.193. PMID 9050227. オリジナルの29 March 2007時点におけるアーカイブ。 12 March 2007閲覧。.
- ^ “Signal transduction networks: topology, response and biochemical processes”. Journal of Theoretical Biology 238 (2): 416–25. (January 2006). Bibcode: 2006JThBi.238..416S. doi:10.1016/j.jtbi.2005.05.030. PMID 16045939.
- ^ a b “Metabolic control”. Essays in Biochemistry 28: 1–12. (1994). PMID 7925313.
- ^ “Modern theories of metabolic control and their applications (review)”. Bioscience Reports 4 (1): 1–22. (January 1984). doi:10.1007/BF01120819. PMID 6365197.
- ^ “Physiological control of metabolic flux: the requirement for multisite modulation”. The Biochemical Journal 311 (Pt 1): 35–9. (October 1995). doi:10.1042/bj3110035. PMC 1136115. PMID 7575476.
- ^ “Transduction of biochemical signals across cell membranes”. Quarterly Reviews of Biophysics 38 (4): 321–30. (November 2005). doi:10.1017/S0033583506004136. PMID 16600054.
- ^ “The regulation of protein function by multisite phosphorylation--a 25 year update”. Trends in Biochemical Sciences 25 (12): 596–601. (December 2000). doi:10.1016/S0968-0004(00)01712-6. PMID 11116185.
- ^ “How cells absorb glucose”. Scientific American 266 (1): 86–91. (January 1992). Bibcode: 1992SciAm.266a..86L. doi:10.1038/scientificamerican0192-86. PMID 1734513.
- ^ “Glycogen and its metabolism”. Current Molecular Medicine 2 (2): 101–20. (March 2002). doi:10.2174/1566524024605761. PMID 11949930.
- ^ “Organizing glucose disposal: emerging roles of the glycogen targeting subunits of protein phosphatase-1”. Diabetes 49 (12): 1967–77. (December 2000). doi:10.2337/diabetes.49.12.1967. PMID 11117996. オリジナルの19 June 2007時点におけるアーカイブ。 25 March 2007閲覧。.
- ^ “Evolution of carbohydrate metabolic pathways”. Research in Microbiology 147 (6–7): 448–55. (1996). doi:10.1016/0923-2508(96)83998-2. PMID 9084754.
- ^ Koch A (1998). How did bacteria come to be?. Advances in Microbial Physiology. 40. 353–99. doi:10.1016/S0065-2911(08)60135-6. ISBN 978-0-12-027740-7. PMID 9889982
- ^ “The emergence of major cellular processes in evolution”. FEBS Letters 390 (2): 119–23. (July 1996). doi:10.1016/0014-5793(96)00631-X. PMID 8706840.
- ^ “The origin of modern metabolic networks inferred from phylogenomic analysis of protein architecture”. Proceedings of the National Academy of Sciences of the United States of America 104 (22): 9358–63. (May 2007). Bibcode: 2007PNAS..104.9358C. doi:10.1073/pnas.0701214104. PMC 1890499. PMID 17517598.
- ^ “Metabolites: a helping hand for pathway evolution?”. Trends in Biochemical Sciences 28 (6): 336–41. (June 2003). doi:10.1016/S0968-0004(03)00114-2. PMID 12826406.
- ^ “Network analysis of metabolic enzyme evolution in Escherichia coli”. BMC Bioinformatics 5: 15. (February 2004). doi:10.1186/1471-2105-5-15. PMC 394313. PMID 15113413. “Evolution of enzymes in metabolism: a network perspective”. Journal of Molecular Biology 320 (4): 751–70. (July 2002). doi:10.1016/S0022-2836(02)00546-6. PMID 12095253.
- ^ “MANET: tracing evolution of protein architecture in metabolic networks”. BMC Bioinformatics 7: 351. (July 2006). doi:10.1186/1471-2105-7-351. PMC 1559654. PMID 16854231.
- ^ “Small-molecule metabolism: an enzyme mosaic”. Trends in Biotechnology 19 (12): 482–6. (December 2001). doi:10.1016/S0167-7799(01)01813-3. PMID 11711174.
- ^ “A metabolic network in the evolutionary context: multiscale structure and modularity”. Proceedings of the National Academy of Sciences of the United States of America 103 (23): 8774–9. (June 2006). Bibcode: 2006PNAS..103.8774S. doi:10.1073/pnas.0510258103. PMC 1482654. PMID 16731630.
- ^ “Common themes in the genome strategies of pathogens”. Current Opinion in Genetics & Development 15 (6): 584–8. (December 2005). doi:10.1016/j.gde.2005.09.007. PMID 16188434. “For better or worse: genomic consequences of intracellular mutualism and parasitism”. Current Opinion in Genetics & Development 15 (6): 572–83. (December 2005). doi:10.1016/j.gde.2005.09.013. PMID 16230003.
- ^ “Chance and necessity in the evolution of minimal metabolic networks”. Nature 440 (7084): 667–70. (March 2006). Bibcode: 2006Natur.440..667P. doi:10.1038/nature04568. PMID 16572170.
- ^ “An introduction to the use of tracers in nutrition and metabolism”. The Proceedings of the Nutrition Society 58 (4): 935–44. (November 1999). doi:10.1017/S002966519900124X. PMID 10817161.
- ^ “Development of kinetic models in the nonlinear world of molecular cell biology”. Metabolism 46 (12): 1489–95. (December 1997). doi:10.1016/S0026-0495(97)90154-2. PMID 9439549.
- ^ “How many genes are there in plants (... and why are they there)?”. Current Opinion in Plant Biology 10 (2): 199–203. (April 2007). doi:10.1016/j.pbi.2007.01.004. PMID 17289424.
- ^ “From genomes to in silico cells via metabolic networks”. Current Opinion in Biotechnology 16 (3): 350–5. (June 2005). doi:10.1016/j.copbio.2005.04.008. PMID 15961036.
- ^ “Systems analyses characterize integrated functions of biochemical networks”. Trends in Biochemical Sciences 31 (5): 284–91. (May 2006). doi:10.1016/j.tibs.2006.03.007. PMID 16616498.
- ^ “Global reconstruction of the human metabolic network based on genomic and bibliomic data”. Proceedings of the National Academy of Sciences of the United States of America 104 (6): 1777–82. (February 2007). Bibcode: 2007PNAS..104.1777D. doi:10.1073/pnas.0610772104. PMC 1794290. PMID 17267599.
- ^ “The human disease network”. Proceedings of the National Academy of Sciences of the United States of America 104 (21): 8685–90. (May 2007). Bibcode: 2007PNAS..104.8685G. doi:10.1073/pnas.0701361104. PMC 1885563. PMID 17502601.
- ^ “The implications of human metabolic network topology for disease comorbidity”. Proceedings of the National Academy of Sciences of the United States of America 105 (29): 9880–5. (July 2008). Bibcode: 2008PNAS..105.9880L. doi:10.1073/pnas.0802208105. PMC 2481357. PMID 18599447.
- ^ “Bow ties, metabolism and disease”. Trends in Biotechnology 22 (9): 446–50. (September 2004). doi:10.1016/j.tibtech.2004.07.007. PMID 15331224.
- ^ “The connectivity structure, giant strong component and centrality of metabolic networks”. Bioinformatics 19 (11): 1423–30. (July 2003). doi:10.1093/bioinformatics/btg177. PMID 12874056.
- ^ “Hierarchical modularity of nested bow-ties in metabolic networks”. BMC Bioinformatics 7: 386. (August 2006). arXiv:q-bio/0605003. Bibcode: 2006q.bio.....5003Z. doi:10.1186/1471-2105-7-386. PMC 1560398. PMID 16916470.
- ^ “Metabolic engineering of beta-lactam production”. Metabolic Engineering 5 (1): 56–69. (January 2003). doi:10.1016/S1096-7176(03)00003-X. PMID 12749845.
- ^ “Metabolic engineering of Clostridium acetobutylicum for the industrial production of 1,3-propanediol from glycerol”. Metabolic Engineering 7 (5–6): 329–36. (2005). doi:10.1016/j.ymben.2005.06.001. hdl:10400.14/3388. PMID 16095939.
- ^ “Metabolic engineering for microbial production of shikimic acid”. Metabolic Engineering 5 (4): 277–83. (October 2003). doi:10.1016/j.ymben.2003.09.001. PMID 14642355.
- ^ “Metabolic engineering”. Annual Review of Biomedical Engineering 1: 535–57. (1999). doi:10.1146/annurev.bioeng.1.1.535. PMID 11701499.
- ^ “metabolism | Origin and meaning of metabolism by Online Etymology Dictionary” (英語). www.etymonline.com. 21 September 2017時点のオリジナルよりアーカイブ。2020年7月23日閲覧。
- ^ Leroi, Armand Marie (2014). The Lagoon: How Aristotle Invented Science. Bloomsbury. pp. 400–401. ISBN 978-1-4088-3622-4
- ^ Al-Roubi AS (1982). Ibn Al-Nafis as a philosopher. Symposium on Ibn al-Nafis, Second International Conference on Islamic Medicine. Kuwait: Islamic Medical Organization.
- ^ “Santorio Sanctorius (1561-1636) - founding father of metabolic balance studies”. American Journal of Nephrology 19 (2): 226–33. (1999). doi:10.1159/000013455. PMID 10213823.
- ^ Modern Development of the Chemical and Biological Sciences. A History of Science: in Five Volumes. IV. New York: Harper and Brothers. (1904). pp. 184–185 26 March 2007閲覧。
- ^ “Louis Pasteur (1822-1895)--chance and the prepared mind”. Trends in Biotechnology 13 (12): 511–5. (December 1995). doi:10.1016/S0167-7799(00)89014-9. PMID 8595136.
- ^ “Vitalism and synthesis of urea. From Friedrich Wöhler to Hans A. Krebs”. American Journal of Nephrology 19 (2): 290–4. (1999). doi:10.1159/000013463. PMID 10213830.
- ^ Eduard Buchner's 1907 Nobel lecture Archived 8 July 2017 at the Wayback Machine. at http://nobelprize.org Archived 5 April 2006 at the Wayback Machine. Accessed 20 March 2007
- ^ “Krebs and his trinity of cycles”. Nature Reviews. Molecular Cell Biology 1 (3): 225–8. (December 2000). doi:10.1038/35043073. PMID 11252898.
- ^ “Untersuchungen über die Harnstoffbildung im tierkorper”. Z. Physiol. Chem. 210 (1–2): 33–66. (1932). doi:10.1515/bchm2.1932.210.1-2.33.
- ^ “Metabolism of ketonic acids in animal tissues”. The Biochemical Journal 31 (4): 645–60. (April 1937). doi:10.1042/bj0310645. PMC 1266984. PMID 16746382.
推薦文献
| Metabolismに関する 図書館収蔵著作物 |
入門
- The Chemistry of Life.. Penguin Press Science. (1999). ISBN 0-14-027273-9
- Into the Cool: Energy Flow, Thermodynamics, and Life.. University of Chicago Press. (2005). ISBN 0-226-73936-8
- Oxygen: The Molecule that Made the World.. USA: Oxford University Press. (2004). ISBN 0-19-860783-0
高度
- 『ストライヤー生化学第8版』東京化学同人2018年8月28日
- Fundamentals of Enzymology: Cell and Molecular Biology of Catalytic Proteins.. Oxford University Press. (1999). ISBN 0-19-850229-X
- Biochemistry. W. H. Freeman and Company. (2002). ISBN 0-7167-4955-6
- Lehninger Principles of Biochemistry.. Palgrave Macmillan. (2004). ISBN 0-7167-4339-6
- Brock's Biology of Microorganisms.. Benjamin Cummings. (2002). ISBN 0-13-066271-2
- The Biological Chemistry of the Elements: The Inorganic Chemistry of Life.. Clarendon Press. (1991). ISBN 0-19-855598-9
- Bioenergetics. Academic Press Inc.. (2002). ISBN 0-12-518121-3
- “Life with CO or CO2 and H2 as a source of carbon and energy”. FASEB Journal 5 (2): 156–63. (February 1991). doi:10.1096/fasebj.5.2.1900793. PMID 1900793.
外部リンク
一般事項
- The Biochemistry of Metabolism (archived 8 March 2005)
- Sparknotes SAT biochemistry Overview of biochemistry. School level.
- MIT Biology Hypertextbook Undergraduate-level guide to molecular biology.
ヒト代謝
- Topics in Medical Biochemistry Guide to human metabolic pathways. School level.
- THE Medical Biochemistry Page Comprehensive resource on human metabolism.
データベース
- Flow Chart of Metabolic Pathways at ExPASy
- IUBMB-Nicholson Metabolic Pathways Chart
- SuperCYP: Database for Drug-Cytochrome-Metabolism Archived 3 November 2011 at the Wayback Machine.
代謝経路
- Metabolism reference Pathway Archived 23 February 2009 at the Wayback Machine.
- The Nitrogen cycle and Nitrogen fixation at the Wayback Machine (archive index)
