ケトン

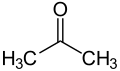
ケトン (独: Keton [keˈtoːn]、英: ketone [ˈkiːtoʊn]) は、分子内に、カルボニル基 を有する化合物(カルボニル化合物)のうち、カルボニル基にアルキル基が結合しているものの総称。一般式は、 ( はアルキル基)である。
身近な物質の中では、除光液として用いられるアセトンなどがその代表例である。
が水素原子であるカルボニル化合物はアルデヒドと呼ばれ、その官能基 をホルミル基という。その中でも特に、 がどちらも水素原子であるアルデヒドを、ホルムアルデヒドという。
がヒドロキシ基であるカルボニル化合物はカルボン酸と呼ばれ、その官能基 をカルボキシ基という。その中でも特に、 が水素原子であるカルボン酸をギ酸、ヒドロキシ基であるカルボン酸を炭酸という(ただし炭酸が有機化合物でないという点には注意。)。
シクロアルケンのパラ位がカルボニル基になっている物質はキノンと呼ばれる。
命名法
[編集]ケトンを命名する場合は、カルボニル基の位置を示す数字とともに、対応するアルカンの語尾に one をつけるか、接頭語 oxo を用いる。
例:  2-ブタノン (2-butanone) / 2-オキソブタン (2-oxobutane)
2-ブタノン (2-butanone) / 2-オキソブタン (2-oxobutane)
合成法
[編集]- 酸化剤
しかしこの反応では、生成したケトンがさらに求核剤と反応することでアルコールへと変換される(反応の項を参照)。
この副反応を防ぐために、ワインレブアミドを中間体として経由するケトン合成法が知られている。
- フリーデル・クラフツ反応によるアシル化で芳香族ケトンを得ることができる。
物性・反応性
[編集]物性
[編集]水素結合性はアルコールほど強くはないが、カルボニル基が持つ極性のため、低分子量のケトンは極性溶媒、非極性溶媒を問わず溶解性は良好である。
反応性
[編集]化学的には比較的安定であるが、グリニャール試薬や有機リチウムなど、求核性の強い有機金属とは反応し、続いて酸で加水分解すると第三級アルコールが得られる。
- (加水分解後)
また、水素化アルミニウムリチウムやボランなどで還元すると第二級アルコールになり、クレメンゼン還元やウォルフ・キッシュナー還元ではメチレン化合物 R-CH2-R' になる。
- など
酸触媒下に2分子のアルコールと脱水縮合させるとアセタールが得られ、これはケトンの保護法のひとつである。
ウィッティヒ反応やマクマリー反応により、アルケンに変えることができる。
ほか、アルドール縮合、バイヤー・ビリガー酸化、シュミット反応、ヴィルゲロット反応など、ケトンを基質とする化学反応は数多い。
検出法
[編集]ケトンとアルデヒドとを区別するには、還元性を持たないケトンは銀鏡反応やフェーリング反応を起こさないことが利用できる。ただし、糖のケトースは、ケトン構造を持つにもかかわらず、還元性を有するため、この方法でアルドースと区別することはできない。メチルケトン構造の検出のためには、ヨードホルム反応が利用できる。
薄層クロマトグラフィーでは 2,4-ジニトロフェニルヒドラジンを呈色試薬として用いることで検出できる。
その他
[編集]最も単純なケトンはアセトン(プロパノン)で、工業的にはクメン法によって作られる。糖尿病の際に排泄されるケトンは主としてアセトンである。これは糖や脂肪を代謝する際に自然に生成するもので、過剰に生成されると血中に排出されて毒性を発揮することになる。これを予防するには代謝を改善することが必要である。
主鎖の炭素がケイ素に置き換わった構造(R-Si(=O)-R')はシラケトン(silaketone)と呼ばれる。

















