ヒドラゾン

ヒドラゾン (hydrazone) とは、有機化合物のうちカルボニル化合物 (R1C(=O)R2)と、ヒドラジンあるいはヒドラジン誘導体 (H2N-NR3R4) とが脱水縮合した構造 R1C(=N-NR3R4)R2 を持つ化合物群のこと。複素環式化合物などへの合成中間体として用いられる。また、反応中間体として現れることもある。
性質
[編集]イミンの部分構造を持つことから、塩基性や配位性を示す。酸や塩基の水溶液で処理すると加水分解を受け、元のケトンとヒドラジンに戻るが、その反応性は置換基の種類や立体障害により異なる。炭素上の立体障害が小さいヒドラゾンほど、加水分解を受けやすい。
合成
[編集]通常は、ケトンとヒドラジンの脱水縮合で合成する。
- R1C(=O)R2 + H2N-NR3R4 → R1C(=N-NR3R4)R2
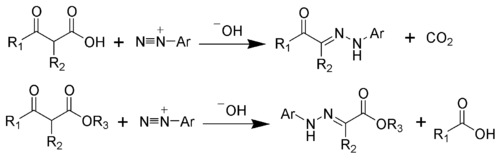
カルバニオンとジアゾニウムイオンが結合してできるアゼン (azene) が互変異性化するとヒドラゾンとなる。
- EE'CH− + +N2Ar → EE'CH-N=N-Ar (アゼン) → EE'C=N-NHAr (E,E' = 電子求引基)
上の例は活性メチレン化合物の反応であるが、活性メチン化合物を基質とした場合は電子求引基が脱離した生成物が得られる場合があり、ヤップ・クリンゲマン反応 (Japp-Klingemann reaction) と呼ばれる。
反応
[編集]イミンやカルボニル化合物と同様に、炭素上が電子不足になっているために求核剤の攻撃を受ける。求核剤が水や水酸化物イオンである場合が加水分解である。
求電子剤は反対側の窒素を攻撃する。例えば、ハロゲン化アルキルでアルキル化することができる。
- R(R')C=N-NH2 + R''-CHO → R(R')C=N-N=CHR'' (アジン)
ヒドラゾンに水素化リチウムアルミニウムを作用させると水素化を受けてヒドラジンとなる。
- R(R')C=N-NH2 + LiAlH4 → R(R')CH-NH-NH2
酸化銀(I) で脱水素させ、ジアゾ化物に変える反応がある。
- (H3C)2C=N-NH2 + Ag2O → (H3C)2C=N2
ウォルフ・キッシュナー還元では、ケトンとヒドラジンから最初にヒドラゾンができ、さらなる強塩基の作用により窒素分子が脱離してメチレン化合物に変わる。
ヒドラゾンはまた、フィッシャーのインドール合成やエッシェンモーザー・タナベ開裂の中間体として知られる。
ヒドラゾン誘導体
[編集]セミカルバジド (H2N-NHC(=O)NH2) とカルボニル化合物から得られるヒドラゾン誘導体は、セミカルバゾンと呼ばれる。
2個のヒドラゾン基が隣接した化合物 (R-C(=N-NH2)-C(=N-NH2)-R) は、特にオサゾンと呼ばれる。
上述のように、ヒドラジンと2分子のカルボニル化合物が縮合した化合物 (RR'C=N-N=CR''R''') をアジンと呼ぶ。特に、アルデヒドから得られるアジンはアルダジン、ケトンから得られるアジンはケタジンと呼ぶ。
参考文献
[編集]- Smith, M. B.; March, J. March's Advanced Organic Chemistry 5th ed., WILEY, 2001.
外部リンク
[編集]- hydrazones - IUPAC Gold Book
