ヨウ化銅(I)
| ヨウ化銅(I) | |
|---|---|

| |
| IUPAC名 | ヨウ化銅(I) |
| 別名 | ヨウ化第一銅 |
| 組成式 | CuI |
| 式量 | 190.45 g/mol |
| 形状 | 白色固体(市販試薬は不純物により薄い褐色となることも) |
| CAS登録番号 | [7681-65-4] |
| 密度と相 | 5.62 g/cm3, 固体 |
| 水への溶解度 | 0.00042 g/100 mL (25 °C) |
| 融点 | 605 °C |
| 沸点 | 1290 °C |
ヨウ化銅(I)(ヨウかどう(I)、Copper(I) iodide)は、化学式 CuI で表される無機化合物である。有機合成試薬や人工降雨剤など幅広い分野で用いられている。ほぼ白色の粉末で水には難溶であるが、ヨウ化物塩の濃い水溶液やアセトニトリルなどには錯体を作りながら溶ける。
天然には、希少鉱物のマーシュ石として産出する。
合成
[編集]実験室レベルで合成するには、ヨウ化ナトリウムまたはヨウ化カリウムの水溶液に、硫酸銅(II)など水溶性の銅イオンを加えるだけでよい。
生成したCuI2はただちにヨウ化銅(I)とヨウ素に分解する。[1]
また、ヨウ化水素酸中でヨウ素と銅を加熱することでも生成する。
ヨウ化銅(I)は極めて水に溶けにくいが、NaIやKI存在下では直線型の[CuI2]−イオンとなって溶解する。この溶液を水で薄めるとヨウ化銅(I)が析出する。この精製方法により、無色で純度の高いヨウ化銅(I)が得られる[2]。
構造
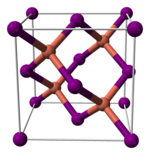
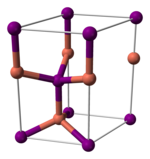
[編集]ヨウ化銅(I)は様々な構造をとる。390℃以下では閃亜鉛鉱型構造(γ-CuI)、390~440℃ではウルツ鉱型構造(β-CuI)、440℃以上では塩化ナトリウム型構造(α-CuI)となる。
利用
[編集]有機合成化学における利用
[編集]ヨウ化銅(I)は触媒、ヨウ素化試薬として有機合成化学で用いられる。薗頭カップリング、ウルマン反応などのクロスカップリング反応において触媒、あるいは助触媒とされる。また、ヨウ化ナトリウムとともに、臭化アリールからヨウ化アリールへの変換に用いられる[3]。ヨウ化アリールは薗頭カップリング、ヘック反応、鈴木・宮浦カップリング、右田・小杉・スティルカップリング、ウルマン反応などの各種カップリング反応において臭化アリールより高い反応性を示すため、この変換は重要である。
東京大学の福山透らは、ヨウ化銅(I)と酢酸セシウムを用いた芳香族アミノ化反応を開発し、全合成に用いている[4]。
チオシアン酸イミダゾリウムを添加し結晶を微細化したヨウ化銅(I)は、固体型色素増感太陽電池への応用が研究されている[5]。
その他の利用
[編集]人工降雨剤として、ヨウ化銀などと同様に用いられる。
脚注
[編集]- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ Kauffman, G. B.; Fang, L. Y. "Purification of Copper(I) Iodide" Inorganic Syntheses, 1983, volume 22, pages 101-103. ISBN 0-471-88887-7.
- ^ Klapars, A.; Buchwald, S. L. J. Am. Chem. Soc. 2002, 124, 14844−14845. DOI: 10.1021/ja028865v
- ^ Okano, K.; Tokuyama, H.; Fukuyama, T. Chem. Asian J. 2007, 3, 296 - 309. DOI: 10.1002/asia.200700282
- ^ 「色素増感太陽電池を全固体にする(昆野昭則)」『光と界面がおりなす新しい化学の世界 -光触媒と光エネルギー変換』(初版)クバプロ、2008年1月30日、173頁。ISBN 978-4-87805-090-9。
| 1 | 18 | |||||||||||||||||||||||||||||||
| 1 | HI | 2 | 13 | 14 | 15 | 16 | 17 | He | ||||||||||||||||||||||||
| 2 | LiI | BeI2 | BI3 | CI4 | NI3 | IxOy | IFx | Ne | ||||||||||||||||||||||||
| 3 | NaI | MgI2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | AlI3 | SiI4 | PI3 | SI2 | IxCly | Ar | ||||||||||||||
| 4 | KI | CaI2 | ScI3 | TiI4 | VI3 | CrIx | MnI2 | FeI2 | CoI2 | NiI2 | CuI | ZnI2 | Ga2I6 | GeIx | AsI3 | SeI2 | IBr | Kr | ||||||||||||||
| 5 | RbI | SrI2 | YI3 | ZrI4 | NbI5 | Mo | Tc | Ru | Rh | Pd | AgI | CdI2 | InI3 | SnIx | SbI3 | TeI4 | I | Xe | ||||||||||||||
| 6 | CsI | BaI2 | La | Ce | Pr | Nd | Pm | SmI2 | Eu | Gd | TbI3 | Dy | Ho | Er | Tm | Yb | Lu | HfI4 | TaI5 | W | Re | Os | Ir | Pt | AuI | HgxIy | TlI | PbI2 | Bi | Po | AtI | Rn |
| 7 | Fr | Ra | Ac | ThI4 | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |