フッ化銅(II)
表示
| フッ化銅(II) | |
|---|---|

| |
| |

| |
| |
Copper difluoride | |
別称 Cupric fluoride; Copper fluoride | |
| 識別情報 | |
| CAS登録番号 | 7789-19-7 13454-88-1 (dihydrate) |
| PubChem | 82236 |
| ChemSpider | 74214 |
| |
| |
| 特性 | |
| 化学式 | CuF2 |
| モル質量 | 101.543 g/mol (無水和物) 137.573 g/mol (二水和物) |
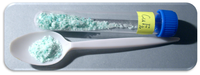
| 外観 | 白色の結晶粉末 水和物:青 |
| 密度 | 4.23 g/cm3 (無水和物) 2.934 g/cm3 (二水和物)[1] |
| 融点 |
836 °C (無水和物) |
| 沸点 |
1676 °C (無水和物) |
| 他の溶媒への溶解度 | 吸湿性 |
| 関連する物質 | |
| その他の陰イオン | 臭化銅(II) 塩化銅(II) |
| その他の陽イオン | フッ化銀(II) フッ化コバルト(II) |
| 関連物質 | フッ化銅(I) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
フッ化銅(II)(フッかどう に)とは、銅とフッ素から成る無機化合物で、組成式は CuF2 のものを指す。
銅と気体フッ素の反応で得られる。無水物は吸湿性が強く、空気中の湿気で青に変色する。熱水で加水分解を受け CuFOH になる[2]。
CuF2+H2O->CuFOH+HF
利用
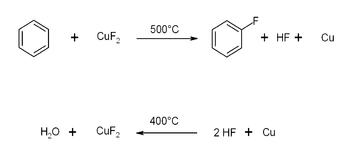
[編集]芳香環の直接フッ素化に用いられた例がある[3]。
その他のフッ化銅
[編集]フッ化銅(I) は気相に発生させて分光学的な測定が行える程度の不安定な化合物であるが、適切な配位子を加えた錯体には安定なものがある(例: CuF•(PPh3)3•2ROH[4])。
フッ化銅(III) は銅と気体フッ素との反応でも生じないとされる[5]。
脚注
[編集]- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ Merck Index 14th ed., 2638.
- ^ Subramanian, M. A.; Manzer, L. E. Science 2002, 297, 1665. DOI: 10.1126/science.107639
- ^ Chaudhuri, M. K.; Dhar, S. S.; Vijayashree, N. Transition Metal Chemistry 2000, 25, 559-561. DOI: 10.1023/A:1007050908874
- ^ Ehlert, T. C.; Wang, J. S. J. Phys. Chem. 1977, 81, 2069-73.
