シクロブタノン
| シクロブタノン | |
|---|---|

| |
| 識別情報 | |
| CAS登録番号 | 1191-95-3 |
| PubChem | 14496 |
| ChemSpider | 13840 |
| UNII | 6PF2SH405U |
| |
| |
| 特性 | |
| 化学式 | C4H6O |
| モル質量 | 70.09 g mol−1 |
| 外観 | 無色~淡黄色液体[1] |
| 匂い | 特異臭[1] |
| 密度 | 0.9547 g/cm3 (0 °C)[2] |
| 融点 |
-50.9 °C, 222 K, -60 °F [2] |
| 沸点 |
99.75 °C, 373 K, 212 °F [2] |
| 水への溶解度 | エタノールやアセトンに混和。水には微溶。[1] |
| log POW | 0.14[1] |
| 屈折率 (nD) | 1.4210[1] |
| 危険性 | |
| GHSピクトグラム |  [1] [1]
|
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
シクロブタノン(英語:Cyclobutanone)とは、化学式C4H6Oで表される有機化合物であり、四員環の環状ケトンである。高い揮発性を持った環状ケトンであり、常温で安定な液体である。
日本では消防法で定める第4類危険物 第1石油類に該当する[1]。
合成法
[編集]1905年にロシアの化学者であるニコライ・キッシュナー(英語版)によって、初めてシクロブタノンの合成法が報告された[3][4]。キッシュナーは、低収率ながらシクロブタンカルボン酸から数段階を経てシクロブタノンを合成した。ただし、この合成法は非効率であり、現在は用いられていない。
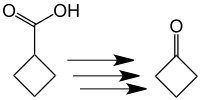
より収率が高く、効率的な合成法が開発されている。一つの手段としては、5つの炭素を持つ化合物の分解反応を用いる手法であり、先述したシクロブタンカルボン酸の酸化的脱炭酸反応において、より効率的な方法が報告されている[5]。ところが、より効率的なシクロブタノンの合成法が、アーヘン工科大学のP. Lipp と R. Kösterによって報告された。それは、ジエチルエーテル溶媒中で、ジアゾメタンとケテンを反応させる手法である[6]。当反応において中間体としてシクロプロパノンが生成し、こちらがさらにジアゾメタンと反応して環拡大反応を起こすことによりシクロブタノンが生成する。反応機構は、14Cでラベルしたジアゾメタンを用いることで解明された[7]。
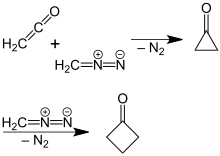
他の合成法としては、リチウムを触媒としたオキサスピロペンタンの転位反応を用いた方法が挙げられる。オキサスピロペンタンはメチレンシクロプロパン(英語版)のエポキシ化により容易に合成できる。[8][9]
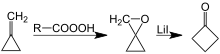
また、1,3-ジチアンを1-クロロ-3-ブロモプロパンでジアルキル化して、塩化水銀(II)(HgCl2)と炭酸カドミウム(CdCO3)を用いて脱保護を行った際にも生成する[10]。
反応
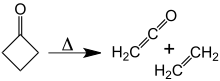
[編集]350℃で加熱すると、ケテンとエチレンに分解する[11]。[2+2]逆環化に必要な活性化エネルギーは52kcal/molであるが、ケテンとエチレンの環化反応は未だに観測されていない。
関連項目
[編集]脚注
[編集]- ^ a b c d e f g 安全データシート - 和光純薬工業株式会社
- ^ a b c CRC Handbook of Chemistry and Physics. 90. Boca Raton, FL: CRC Press
- ^ N. Kishner (1905). “'Über die Einwirkung von Brom auf die Amide α-bromsubstituierter Säuren”. Journal der Russischen Physikalisch-Chemischen Gesellschaft 37: 103–105.
- ^ N. Kishner (1905). “Über das Cyklobutanon”. Journal der Russischen Physikalisch-Chemischen Gesellschaft 37: 106–109.
- ^ Dieter Seebach (1971). “Isocyclische Vierringverbindungen”. In Houben; Weyl; Müller. Methoden der Organischen Chemie. IV/4. Stuttgart: Georg Thieme Verlag
- ^ P. Lipp und R. Köster (1931). “Ein neuer Weg zum Cyclobutanon”. Berichte der Deutschen Chemischen Gesellschaft 64: 2823–2825. doi:10.1002/cber.19310641112.
- ^ Semenow, Dorothy A.; Cox, Eugene F.; Roberts, John D. (1956). “Small-Ring Compounds. XIV. Radioactive Cyclobutanone from Ketene and Diazomethane-14C1”. Journal of the American Chemical Society 78 (13): 3221–3223. doi:10.1021/ja01594a069.
- ^ Salaün, J. R.; Conia, J. M. (1971). “Oxaspiropentane. A rapid route to cyclobutanone”. Journal of the Chemical Society D: Chemical Communications (23): 1579b. doi:10.1039/C2971001579B.
- ^ J. R. Salaün, J. Champion, J. M. Conia (1977). "Cyclobutanone from Methylenecyclopropane via Oxaspiropentane". Organic Syntheses (英語). 57: 36. doi:10.15227/orgsyn.057.0036。; Collective Volume, vol. 6, p. 320
- ^ D. Seebach, A. K. Beck (1971). "Cyclic Ketones from 1,3-Dithiane: Cyclobutanone". Organic Syntheses (英語). 51: 76. doi:10.15227/orgsyn.051.0076。; Collective Volume, vol. 6, p. 316
- ^ Das, M. N.; Kern, F.; Coyle, T. D.; Walters, W. D. (1954). “The Thermal Decomposition of Cyclobutanone1”. Journal of the American Chemical Society 76 (24): 6271–6274. doi:10.1021/ja01653a013.
