シクロプロパノン
| シクロプロパノン | |
|---|---|
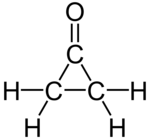
| |
cyclopropanone | |
| 識別情報 | |
| CAS登録番号 | 5009-27-8 |
| PubChem | 138404 |
| ChemSpider | 122027 |
| J-GLOBAL ID | 200907007550955614 |
| |
| |
| 特性 | |
| 化学式 | C3H4O |
| モル質量 | 56.06326 |
| 密度 | 0.867 g/mL at 25 °C |
| 融点 |
−90 °C, 183 K, -130 °F |
| 沸点 |
50 - 53 °C, 270 K, -13 °F (at 22 mmHg) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
シクロプロパノン(Cyclopropanone)は、化学式C3H4Oで表される有機化合物であり、シクロプロパン骨格にカルボニル基が導入された構造を持つ環状ケトンである。融点が−90 °Cで、大きく歪んでいるため不安定な化合物であり、−145 °Cでケテンとジアゾメタンを反応させることにより生成する[1][2]。シクロプロパノン骨格の構築は、有機化学の分野における関心事の一つである[3]。
有機合成においてシクロプロパノンは、シクロプロパノンエチルヘミアセタール[4]やシクロプロパノンエチルトリメチルシリルアセタール[5] のようなシントンとして利用される。
誘導体
[編集]シクロプロパノンは、環状ケトンが環縮小を伴いカルボン酸となる「ファヴォルスキー転位」における中間体である。
シクロプロパノンの興味深い特徴は、1,3-双極子として働き、フランのような環状ジエンと環化付加反応を起こすことである[6][7]。C2-C3結合開裂により生じる原子価互変異性によるオキシアリル中間体は、活性中間体であり、またビラジカル構造を持っていると考えられている。ただし、実験的に確証は得られていない。
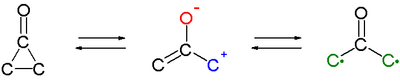
この中間体を経て進行する反応例は他にもある。例えば、純粋なエナンチオマーである、(+)-trans-2,3-ジ-tert-ブチルシクロプロパノンは、80 °Cでラセミ化する[8]。
オキシアリル中間体の生成は光により促進され、3,5-ジヒドロ-4H-ピラゾール-4-オンに紫外線を照射すると、窒素が脱離してインダンを得る[9]。
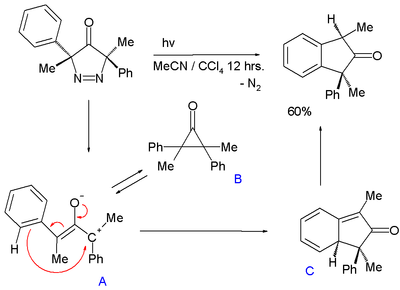
シクロプロパノンBと化学平衡の状態にあるオキシアリル中間体Aは、カルボカチオンが芳香環による求核攻撃を受け、1,3-シクロヘキサジエンの構造となり(上図のC)、続いて芳香族化が起こりDとなる。AとBのエネルギー差は、5 - 7 kcal/molである。
脚注
[編集]- ^ N. J. Turro and W. B. Hammond (1968). “Preparation and characterization of cyclopropanone, methylcyclopropanone, 2,2-dimethylcyclopropanone and tetramethylcyclopropanone”. Tetrahedron 24 (18): 6017-6028. doi:10.1016/S0040-4020(01)90985-8.
- ^ E. F. Rothgery, R. J. Holt, H. A. McGee,, Jr. (1975). “Cryochemical synthesis and molecular energetics of cyclopropanone and some related compounds”. J. Am. Chem. Soc. 97 (17): 4971-4973. doi:10.1021/ja00850a034.
- ^ Turro, N. J. (1969). “Cyclopropanones”. Acc. Chem. Res. 2 (1): 25-32. doi:10.1021/ar50013a004.
- ^ Salaün, J.; Marguerite, J. (1985). "Cyclopropanone ethyl hemiacetal from ethyl 3-chloropropanoate". Organic Syntheses (英語). 63: 147.; Collective Volume, vol. 7, p. 131
- ^ “Product Specification: (1-Ethoxycyclopropoxy)trimethylsilane”. Sigma-Aldrich. 2017年4月28日閲覧。
- ^ Turro, N. J.; Edelson, S. S.; Williams, J. R.; Darling, T. R.; Hammond, W. B. (1969). “Cyclopropanones. XII. Cycloaddition reactions of cyclopropanones'”. J. Am. Chem. Soc. 91 (9): 2283-2292. doi:10.1021/ja01037a018.
- ^ Edelson, S. S.; Turro, N. J. (1970). “Cyclopropanones. XVII. Kinetics of the cycloaddition reaction of cyclopropanones with 1,3-dienes”. J. Am. Chem. Soc. 92 (9): 2770-2773. doi:10.1021/ja00712a030.
- ^ Greene, F. D.; Sclove, D. B.; Pazos, J. F.; Camp, R. L. (1970). “Thermal reactions of a cyclopropanone. Racemization and decarbonylation of trans-2,3-di-tert-butylcyclopropanone”. J. Am. Chem. Soc. 92 (25): 7488-7488. doi:10.1021/ja00728a051.
- ^ Moiseev, A. G.; Abe, M.; Danilov, E. O; Neckers, D. C. (2007). “First Direct Detection of 2,3-Dimethyl-2,3-diphenylcyclopropanone”. J. Org. Chem. 72 (8): 2777 - 2784. doi:10.1021/jo062259r.
