Wntシグナル経路
Wntシグナル経路(ウィント-シグナルけいろ、英: Wnt signaling pathway)は、細胞表面受容体を介して細胞内へシグナルを伝達するタンパク質によって開始されるシグナル伝達経路の1つである。Wntという名称は、winglessとint-1という2つの遺伝子の名称に由来する「かばん語」である[1]。Wntシグナル経路は、近接する細胞間のコミュニケーション(傍分泌)または細胞自身に対するコミュニケーション(自己分泌)のいずれかを利用する。この経路は動物で進化的に高度に保存されており、ショウジョウバエからヒトまで類似した経路が存在する[2][3]。
古典的(標準的、cannonical)Wnt経路に加えて、非古典的(非標準的、non-cannonical)経路である平面内細胞極性(PCP)経路、Wnt/カルシウム経路の3種類のWntシグナル経路の特性解析がなされている。これら3つの経路は全て、WntリガンドがFrizzledファミリーの受容体に結合することで活性化され、細胞内のDishevelledタンパク質へ生物学的シグナルが伝達される。古典的Wnt経路は遺伝子の転写調節をもたらすが、その一部はSPATS1による負の調節を受ける[4]。平面内細胞極性経路は細胞骨格を調節し、細胞の形状形成を担う。Wnt/カルシウム経路は細胞内のカルシウムを調節する。
Wntシグナル伝達は発がんにおける役割がまず特定され、その後に胚発生における機能が同定された。Wntシグナルによって制御される胚過程には、体軸パターンの決定、細胞運命の決定、細胞増殖、細胞遊走などがある。これらの過程は、骨、心臓、筋肉などの重要な組織が正しく形成されるために必要である。胚発生における役割は、ショウジョウバエのWnt経路のタンパク質の遺伝子変異が異常な胚の形成をもたらすことから発見された。その後の研究によって、こうした異常の原因となる遺伝子はマウスの肺がんの発生にも影響を与えていることが発見された。Wntシグナルは成体の骨髄、皮膚、腸での組織再生も制御している[5]。
この経路の臨床的重要性は、経路を構成するタンパク質の変異が乳がんや前立腺がん、膠芽腫、2型糖尿病などさまざまな疾患の原因となることから明らかである[6][7]。マウスの疾患モデルでは、Wnt経路の阻害剤の有効性が報告されている[8]。
歴史と語源
[編集]Wntシグナル経路は、発がん性レトロウイルスに関する研究の影響を受けて発見された。1982年、Roel Nusseとハロルド・ヴァーマスはマウスにマウス乳癌ウイルスを感染させ、どの遺伝子の変異が乳癌を引き起こしているのかを観察しようとした。その結果、彼らはマウスの新たながん原遺伝子を発見し、int1(integration 1)と命名した[3][9]。
Int1は、ヒトやショウジョウバエを含む複数の生物種で高度に保存されている。キイロショウジョウバエDrosophila melanogasterに存在するint1遺伝子は、実際にはショウジョウバエでwingless(wg)として特性解析がなされていた遺伝子と同じものであることが発見された[10]。クリスティアーネ・ニュスライン=フォルハルトとエリック・ヴィーシャウス(共に1995年にノーベル生理学・医学賞を受賞した)による研究によって、wgが胚発生時の体軸の形成に関与するセグメントポラリティー遺伝子として機能することはすでに確立されており、哺乳類のint1も胚発生に関与することが明らかにされた[11]。
その後の研究によってint1関連遺伝子が他にも発見されたが、これらの遺伝子はint1と同様の命名はなされず、int遺伝子群の命名は不適切な状態となっていた。そのため、int/winglessファミリーはWntファミリーと命名し直され、int1はWnt1と改名された。Wntという前はintとwgのかばん語であり、"wingless-related integration site"としての意味も持つ[1]。
タンパク質
[編集]
Wntは脂質修飾されたシグナル伝達糖タンパク質からなる多様なファミリーを構成し、タンパク質の長さは350–400アミノ酸である[12]。すべてのWntに対して脂質修飾がなされており、完全に保存された1か所のセリン残基がパルミトレオイル化される[13]。パルミトレオイル化は、分泌のためにキャリアタンパク質であるWntless(WLS)へ結合し、細胞膜へ輸送される過程で必要であり[14]、また受容体であるFrizzledへの結合も可能にする[15][16]。Wntにはグリコシル化も行われ、適切な分泌を保証するために糖鎖が付加される[17]。Wntシグナル経路ではWntタンパク質はリガンドとして機能し、傍分泌や自己分泌によってさまざまなWnt経路を活性化する[2][7]。
Wntタンパク質は生物種間で高度に保存されており[3]、マウス、ヒト、ツメガエル、ゼブラフィッシュ、ショウジョウバエやその他の生物に存在する[18]。
| 生物種 | Wntタンパク質 |
|---|---|
| ヒトHomo sapiens | WNT1, WNT2, WNT2B, WNT3, WNT3A, WNT4, WNT5A, WNT5B, WNT6, WNT7A, WNT7B, WNT8A, WNT8B, WNT9A, WNT9B, WNT10A, WNT10B, WNT11, WNT16 |
| マウスMus musculus (ヒトと同一) | Wnt1, Wnt2, Wnt2B, Wnt3, Wnt3A, Wnt4, Wnt5A, Wnt5B, Wnt6, Wnt7A, Wnt7B, Wnt8A, Wnt8B, Wnt9A, Wnt9B, Wnt10A, Wnt10B, Wnt11, Wnt16 |
| ツメガエルXenopus | Wnt1, Wnt2, Wnt2B, Wnt3, Wnt3A, Wnt4, Wnt5A, Wnt5B, Wnt7A, Wnt7B, Wnt8A, Wnt8B, Wnt10A, Wnt10B, Wnt11, Wnt11R |
| ゼブラフィッシュDanio rerio | Wnt1, Wnt2, Wnt2B, Wnt3, Wnt3A, Wnt4, Wnt5A, Wnt5B, Wnt6, Wnt7A, Wnt7B, Wnt8A, Wnt8B, Wnt10A, Wnt10B, Wnt11, Wnt16 |
| ショウジョウバエDrosophila | Wg, DWnt2, DWnt3/5, DWnt 4, DWnt6, WntD/DWnt8, DWnt10 |
| ヒドラHydra | hywnt1, hywnt5a, hywnt8, hywnt7, hywnt9/10a, hywnt9/10b, hywnt9/10c, hywnt11, hywnt16 |
| C. elegans | mom-2, lin-44, egl-20, cwn-1, cwn-2[19] |
機構
[編集]

基礎
[編集]Wntシグナル伝達は、Wntタンパク質がFrizzled(Fz)ファミリー受容体の細胞外N末端システインリッチドメインに結合することで開始される[20]。これらの受容体は7回膜貫通型受容体であり、Gタンパク質共役受容体(GPCR)のファミリーを構成する[21]。Wntシグナルの促進には、Wntタンパク質とFz受容体との相互作用に加えて補助受容体(共受容体)が必要である可能性がある。補助受容体の例としては、LRP5/6やROR2などが挙げられる[7]。受容体の活性化に伴って、細胞質に位置するリン酸化タンパク質Dishevelled(Dsh)へ直接的な相互作用によってシグナルが送られる。Dshタンパク質は全て、N末端のDIXドメイン、中央部のPDZドメイン、C末端のDEPドメインという高度に保存されたドメインを共通して持つ。WntシグナルはDshの後で複数の経路に枝分かれし、各経路ではこれら3つのドメインの異なる組み合わせで相互作用が行われる[22]。
古典的経路と非古典的経路
[編集]最もよく特性解析がなされているWntシグナル経路は、古典的Wnt経路、非古典的経路である平面内細胞極性経路とWnt/カルシウム経路の3つである。古典的経路にはβ-カテニンが関与するのに対し、非古典的経路はβ-カテニンとは無関係に作用する[20]。

古典系経路
[編集]古典的Wnt経路(Wnt/β-カテニン経路)では、細胞質にβ-カテニンが蓄積する。最終的にはβ-カテニンは核に移行し、TCF/LEFファミリーに属する転写因子のコアクチベーターとして機能する。Wntが存在しない場合には、β-カテニンは分解複合体(destruction complex)によって分解されるため、細胞質に蓄積することはない。この分解複合体は、Axin、APC、PP2A、GSK3、CK1αなどから構成される[23][24]。この複合体はβ-カテニンをユビキチン化の標的とすることで分解を誘導し、その後β-カテニンはプロテアソームへ送られて分解される[20][25]。WntがFzとLPR5/6に結合すると、分解複合体の細胞膜移行が引き起こされ、分解複合体の機能は停止する。その結果、β-カテニンは蓄積して核に局在し、TCF/LEF転写因子とともに遺伝子転写を介した細胞応答を誘導する[25][26]。β-カテニンは、BCL9、Pygopus[27]、Parafibromin/Hyrax[28]など他の転写コアクチベーターもリクルートする。こうしたβ-カテニンによって組み立てられる転写複合体の複雑性は、ハイスループットなプロテオミクス研究によって理解されるようになったばかりである[29]。一方で、β-カテニンがどのように標的遺伝子の発現を駆動するのかに関する統一的理論はいまだ存在せず、β-カテニンによる標的遺伝子の決定は組織特異的な因子によって補助されている可能性がある[30]。また、β-カテニンの核移行にはWnt非依存的な機構も存在し、細胞接触部位に局在しているβ-カテニンはAktによってSer552が直接リン酸化されることで膜近傍から解離して細胞質基質に蓄積し、その後14-3-3ζがβ-カテニンと相互作用することで核移行が促進される[31]。また、BCL9とPygopusもβ-カテニン非依存的(すなわちWnt非依存的)な機能をいくつか持つことも報告されている[32][33][34]。
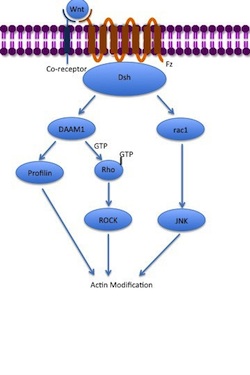
非古典的経路
[編集]非古典的平面内細胞極性(PCP)経路にはβ-カテニンは関与しない。この経路では補助受容体としてLRP5/6は利用されず、NRH1(p75NTR)、RYK、PTK7もしくはROR2が利用されると考えられている。PCP経路はWntがFzと補助受容体に結合することで活性化される。受容体はDshをリクルートし、DshはPDZドメインとDIXドメインを介してDAAM1と複合体を形成する。DAAM1はグアニンヌクレオチド交換因子を介して低分子量GTPアーゼRhoを活性化し、RhoはRhoキナーゼ(ROCK)を活性化する。Rhoキナーゼは細胞骨格の主要な調節因子の1つである。DshはRAC1とも複合体を形成し、プロフィリンのアクチンへの結合を媒介する。RAC1はJNKを活性化し、アクチン重合も引き起こす。プロフィリンのアクチンへの結合は細胞骨格の再構築や原腸形成を引き起こす[7][35]。

非古典的Wnt/カルシウム経路にもβ-カテニンは関与しない。この経路の役割は、小胞体からのカルシウム放出の調節による、細胞内のカルシウム濃度の制御である。他のWnt経路と同様、リガンドの結合に伴って活性化されたFz受容体はDshと直接相互作用し、Dshの特定のドメインを活性化する。Wnt/カルシウム経路に関与するドメインは、PDZドメインとDEPドメインである[7]。しかしながら、他のWnt経路とは異なり、Fz受容体は三量体型Gタンパク質とも直接的に接している。このDshとGタンパク質との共刺激によって、PLCまたはcGMP特異的PDEのいずれかが活性化される。PLCが活性化された場合、細胞膜の構成要素であるPIP2がDAGとIP3へ切断される。IP3が小胞体上の受容体に結合すると、カルシウムが放出される。カルシウムとDAG濃度の増加は、PKCを介してCDC42を活性化する。CDC42は腹側のパターン形成の重要な調節因子である。カルシウムの増加はカルシニューリンやCaMKIIの活性化も引き起こす。CaMKIIは転写因子NFATの活性化を誘導し、NFATは細胞接着、遊走、組織の分離を調節する[7]。カルシニューリンはTAK1やNLKといったキナーゼを活性化し、古典的Wnt経路のTCF/β-カテニンシグナルに干渉する[36]。一方、PDEが活性化された場合には、小胞体からのカルシウムの放出は阻害される。PDEはPKGを阻害することで、その後のカルシウム放出の阻害を引き起こす[7]。
統合的Wnt経路
[編集]古典的・非古典的Wntシグナル経路という二分法について詳細な検討がなされ、統合的(integrarted)または収束的(convergent)Wnt経路という概念が提唱されている[37]。Wnt5Aに関しては、β-カテニン経路の誘導と抑制の双方が引き起こされうることが示されている[38]。また、複数のWntリガンドに対して、Wnt/カルシウム経路とWnt/β-カテニン経路が統合的に活性化されることが哺乳類細胞株で記載されている[39]。
その他の経路
[編集]Wntシグナルは、まだ大規模な解析が行われていない他の多数のシグナル伝達経路も調節している。その一例として、WntとGSK3の相互作用が挙げられる。細胞成長時には、Wntはβ-カテニン非依存的にGSK3を阻害してmTORを活性化する[40]。筋形成時には、WntはPKAとCREBを利用してMyoDとMyf5の遺伝子を活性化する[41]。WntはRykやSrcと共に作用して軸索誘導時の神経の反発を調節する。Wntは原腸形成時にCK1を介してRap1を調節し、細胞骨格を調節する。原腸形成のさらなる調節はWntがROR2を利用した際にも行われ、CDC42とJNK経路とともに、PAPCの発現の調節が行われる。DshはaPKC、Par3、Par6、LGIと相互作用して細胞極性と微小管骨格の発生を制御する。こうした経路の構成要素はPCP経路やWnt/カルシウム経路の構成要素と重複しているが、異なる応答を生み出すため異なる経路であると考えられている[7]。
調節
[編集]適切な機能を保証するため、Wntシグナルはその伝達経路のいくつかのポイントで常に調節されている[42]。その一例として、Wntタンパク質のパルミトレオイル化がある。この過程はporcupineと呼ばれるタンパク質によって媒介され、Wntリガンドが完全に形成される時期を決定することで分泌の時期の調節を補助している。分泌はGPR177(wntless)などのタンパク質やレトロマー複合体などによっても制御されている[7][25]。
分泌に際して、Wntは拡散を防ぐDallyやグリピカン3(GPC3)などの安定化タンパク質へ結合することで、受容体への到達が防がれている。がん細胞では、GPC3のヘパラン硫酸鎖部分[43][44]とコアタンパク質部分[45][46]の双方が、細胞増殖のためのWntの結合と活性化の調節に関与している[47][48]。WntはGPC3のIdoA2SとGlcNS6Sを持つヘパラン硫酸構造を認識し、3-O-硫酸化によるGlcNS6S3Sの形成はWntの結合をさらに高める[49]。GPC3のNローブのシステインリッチドメインはWntが結合する疎水的な溝を形成することが示されており、その中のF41がWntと相互作用する[46][50]。HN3と呼ばれるナノボディでWnt結合ドメインを遮断することでWntの活性化を阻害することができる[46]。
Fz受容体では、Wnt以外のタンパク質の結合がシグナル伝達に拮抗する。特異的アンタゴニストとしては、Dickkopf(Dkk)やWIF1[51][52]などがある。
Wntシグナル伝達経路間の相互作用もWntシグナルを調節する。上述したように、Wnt/カルシウム経路はTCF/β-カテニンを阻害し、古典的Wnt経路のシグナル伝達を妨げる[7][25]。プロスタグランジンE2(PGE2)は古典的Wnt経路に必要不可欠な活性化因子である。PGE2とEP2/EP4受容体との相互作用は、cAMP/PKAを介したリン酸化によってβ-カテニンを安定化する。ゼブラフィッシュやマウスにおいて、PGE2の合成は組織の再生や幹細胞集団の制御などのWntシグナルを介した過程に必要であることが示されている[5]。また、いくつかのタンパク質の巨大な天然変性領域がWntシグナルの調節に重要な役割を果たしている[53]。
誘導される細胞応答
[編集]胚発生
[編集]Wntシグナルは胚発生に重要な役割を果たしており、ヒト、カエル、ゼブラフィッシュ、線虫、ショウジョウバエなど、脊椎動物と無脊椎動物の双方で作用している。Wntシグナルはショウジョウバエのセグメントポラリティーの決定における役割がまず発見され、前部と後部の極性の決定を補助している。他の発生過程への関与も示唆されており、ショウジョウバエにおける機能が示唆するところによると、体軸形成、特に前後軸と背腹軸の形成に重要な役割を果たしている。また、肺や卵巣など重要な器官の形成を促進する細胞分化の誘導にも関与している。Wntは細胞増殖や遊走を適切に調節することで、これらの組織の発生を保証する。Wntシグナル伝達の機能は、体軸パターン形成、細胞運命の決定、細胞増殖、遊走へと分類することができる[54]。
体軸パターン形成
[編集]初期胚発生において、体軸の形成は個体の全体的なボディープランの決定の重要な段階である。体軸には前後軸、背腹軸、左右軸があり、Wntシグナルは前後軸と背腹軸の形成への関与が示唆されている。前後軸形成におけるWntシグナルの活性は、哺乳類、魚類やカエルで観察される。哺乳類では、原始線条(原条)やその他の周囲の組織は原腸形成の後期にWnt、BMP、FGF、Nodal、レチノイン酸など形態形成を誘導する分子を産生して後部を決定する。これらの分子は濃度勾配を形成し、最も高濃度の領域が後部、最も低濃度の領域が前部として決定される。魚類やカエルでは、古典的Wntシグナルによって産生されるβ-カテニンがorganizing centerの形成を引き起こし、BMPとともに後部の形成を引き起こす。背腹軸の形成へのWntの関与はオーガナイザーの形成時に観察され、背側を決定に関与する。古典的Wnt経路によるβ-カテニンの産生はtwinやsiamoisといった遺伝子の活性を介してオーガナイザーの形成を誘導する[37][54]。同様に、鳥類の原腸形成時には、コラーの鎌の細胞がさまざまな中胚葉マーカー遺伝子を発現し、原条形成時のさまざまな細胞の移動を可能にする。FGFによって活性化されるWntシグナルがこの移動を担っている[55][56]。
また、Wntシグナルは発生のより後期の段階においても体の特定の部分や器官系の軸形成に関与している。脊椎動物では、Sonic hedgehog(Shh)とWntによる形態形成シグナルの勾配は、神経管の軸パターンの形成の際に中枢神経系の背腹軸を決定している。強いWntシグナルは背側を決定する一方、強いShhシグナルは腹側を決定する[57]。Wntは軸索誘導に関与することで、中枢神経系の背腹軸の形成に関与する。Wntタンパク質は脊髄の軸索を前後軸方向に誘導する[58]。Wntは四肢の背腹軸の形成にも関与している。具体的には、Wnt7aは発生中の肢の背側パターンの形成を助ける[37][54]。
発生の分化の波モデルでは、Wntは分化の準備が整った細胞中でシグナル伝達複合体の一部として重要な役割を果たす。Wntは細胞骨格の活動に応答し、収縮や膨張の波の通過によって生み出された初期変化を安定化するとともに、さまざまなシグナル伝達経路を用いて個々の細胞がどの波に関与したかを核に伝達する。こうして、Wnt活性は発生時の機械的なシグナル伝達を増幅する[59][60]。
細胞運命の決定
[編集]細胞運命の決定(細胞分化)は、未分化細胞がより専門的な細胞種になる過程である。Wntシグナルは多能性幹細胞から中胚葉や内胚葉の前駆細胞への分化を誘導する[61]。こうした前駆細胞は、さらに内皮細胞、心筋細胞、血管平滑筋細胞系統などの細胞種へ分化する[62]。Wntシグナルは幹細胞から血液の形成を誘導する。具体的には、Wnt3は造血能を持った中胚葉細胞を誘導する[63]。Wnt1は神経分化に対抗する役割を果たし、神経幹細胞の自己複製の主要な因子である。Wnt1は神経系細胞の再生を可能にし、このことは神経幹細胞の増殖を促進する役割の証拠となっている[61]。Wntシグナルは、生殖細胞の決定、腸組織の決定、毛包の発生、肺組織の発生、体幹部神経堤細胞の分化、ネフロンの発生、卵巣の発生、性決定にも関与している[54]。Wntシグナルは心臓形成に対抗し、Wntの阻害が発生時の心臓組織の重要な誘導因子となることが示されている[64][65][66]。低分子Wnt阻害剤は多能性幹細胞から心筋細胞を作製する際に広く用いられている[67][68]。
細胞増殖
[編集]特定の組織の形成に必要な大量の細胞の分化が起こるためには、胚性幹細胞の増殖と成長が必要である。この過程は古典的Wntシグナル伝達によって媒介され、核と細胞質のβ-カテニンの増加が引き起こされる。増加したβ-カテニンはサイクリンD1やc-mycなどの転写活性化を開始し、これらは細胞周期のG1期からS期への移行を制御する。S期への移行はDNA複製を、そして最終的には有糸分裂を引き起こすことで、細胞増殖を担う[69]。幹細胞は増殖することで分化も引き起こされるため、この増殖の増加は細胞分化を直接的に伴うものである。その結果、胚発生時の全体的な成長と特定の組織系の発生が可能となる。このことは循環系などで明らかされており、Wnt3aが赤血球の形成に必要な造血幹細胞の増殖と増幅をもたらす[70]。
がん幹細胞の生化学は、他の腫瘍細胞とはわずかに異なる。いわゆるWnt中毒(Wnt-addicted)状態の細胞はWnt経路を乗っ取って常に刺激し、無制御な成長と生存、遊走を促進している。がんではWntシグナルは通常の刺激に依存しなくなっており、下流のがん遺伝子やがん抑制遺伝子の変異によって正常な受容体がシグナルを受けていない場合であっても常に活性化された状態となっている。β-カテニンはTCF4などの転写因子と結合し、共に特定の遺伝子を活性化する。LF3と呼ばれる化合物はin vitroや細胞株でこの結合を強力に阻害し、またマウスモデルでは腫瘍の成長を低下させることが報告されている。LF3は健康な細胞に影響を与えることなく、複製を防ぎ、遊走能を低下させる。LF3による治療後にはがん幹細胞は残存しない。LF3はAlphaScreenとELISAテクノロジーによるラショナルドラッグデザインによって得られた化合物である[71]。
細胞遊走
[編集]胚発生時の細胞遊走は、体軸の決定、組織形成、肢の誘導やその他のいくつかの過程を可能にする。特に、Wntシグナルは収斂伸長運動を媒介する。原腸形成時の適切な収斂伸長運動には、非古典的PCP経路と古典的経路の双方からのシグナルが必要である。収斂伸長運動はWnt/カルシウム経路によってもさらに調節されており、この系をの活性化時には収斂伸長運動は遮断される。また、Wntシグナルは発生のより後期の段階の細胞遊走も誘導し、神経芽細胞、神経堤細胞、筋細胞、気管の細胞の遊走挙動を制御する[72]。
Wntシグナルは上皮間葉転換(EMT)と呼ばれる重要な遊走過程にも関与している。この過程は上皮細胞から間葉系細胞への形質転換を可能にし、細胞はラミニンによる適切な位置への保持が行われなくなる。この過程にはカドヘリンのダウンレギュレーションが関与しており、そのため細胞はラミニンから解離して遊走を行うことができるようになる。WntはEMTの誘導因子であり、特に乳房の発生において重要である[73]。
インスリン感受性
[編集]
インスリンはグルコースの恒常性に関与するペプチドホルモンである。具体的には、インスリンは細胞膜のグルコーストランスポーターのアップレギュレーションをもたらし、血流からのグルコースの取り込みを増加させる。この過程の一部はWnt/β-カテニンシグナル伝達の活性化によって媒介されており、このシグナルは細胞のインスリン感受性を高める。特に、Wnt10bは骨格筋細胞においてこの感受性を高める役割を果たす[74]。
臨床との関係
[編集]がん
[編集]Wntシグナルは、その発見時からがんと関連付けられている。Wnt1が発見された際には、乳がんのマウスモデルのがん原遺伝子として同定された。Wnt1がWgのホモログであることは胚発生へ関与していることを示しており、胚発生の過程では迅速な細胞分裂と遊走が要求される。こうした過程の調節異常は、過剰な細胞増殖によって腫瘍の形成を引き起こす場合がある[3]。
古典的Wnt経路の活性は、良性や悪性の乳房腫瘍の発生に関与している。腫瘍の化学耐性におけるWnt経路の役割はよく記載されており、またがん幹細胞集団の維持における役割も知られている[75]。古典的Wnt経路の異常は核や細胞質のβ-カテニンレベルの上昇によって明らかにすることができ、免疫染色やウエスタンブロッティングによって検出することができる。β-カテニンの発現の増加は、乳がん患者の予後の悪さと相関している。β-カテニンの蓄積はβ-カテニンの変異やβ-カテニン分解複合体の欠乏などによって引き起こされる可能性があるが、APCの天然変性領域の変異、Wntリガンドの過剰発現、阻害因子の喪失や調節経路(Wnt/カルシウム経路など)の活性の低下が高頻度でみられる[53][76][77]。WntはEMTに関与しているため、乳がんは転移する場合がある。Basal-like型乳がんの肺への転移に関する研究からは、Wnt/β-カテニンシグナルの抑制によってEMTを防ぎ、転移を阻害できることが示されている[78]。
Wntシグナルは他のがんの発生にも関与していることが示唆されている。β-カテニンをコードする遺伝子CTNNB1の発現の変化は、乳がん、大腸がん、メラノーマ、前立腺がん、肺がんやその他のがんで観察されている。Wnt1、Wnt2、Wnt7AなどのWntリガンドの発現の増加は、それぞれ膠芽腫、食道がん、卵巣がんの発生時に観察されている。適切に機能しない場合に複数のがんの原因となるその他のタンパク質には、ROR1、ROR2、SFRP4、Wnt5A、WIF1や、TCF/LEFファミリーのタンパク質などがある[79]。さらに、Wntシグナルは乳がんや前立腺がんの骨転移の病因であることが研究から示唆されており、明確なオン・オフ状態があることが示唆されている。休眠(dormancy)段階ではWntがDKK1の自己分泌によってダウンレギュレーションされることでがんは免疫系の監視から逃れており[80]、播種(dissemination)段階でもWntは細胞内のDACT1によって抑制されている[81]。一方、初期成長(outgrowth)段階ではE-セレクチンによって活性化される[82]。
PGE2とWntの関係は、慢性炎症と関連したPGE2の増加がさまざまな組織でWntの活性化をもたらし、発がんを引き起こしている可能性を示唆している[5]。
2型糖尿病
[編集]2型糖尿病は、インスリン分泌の減少と末梢のインスリン抵抗性の増大が引き起こされる、広くみられる疾患である。この疾患は血糖値の上昇(高血糖)を引き起こし、未治療の場合死に至る場合がある。Wntシグナルはインスリン感受性に関与しているため、この経路の機能不全は糖尿病と関係している可能性がある。肥満と2型糖尿病は高い併存率を示すため、アディポジェネシスに関与しているWnt5bの過剰発現は疾患の易罹患性を高める可能性がある[83]。Wntシグナルはミトコンドリア生合成の強力な活性化因子でもある。その結果、DNAや細胞の損傷を引き起こすことが知られている活性酸素種(ROS)の産生が増大する[84]。こうしたROSによる損傷は、肝臓における急性インスリン抵抗性(損傷後のインスリン抵抗性 [injury-induced insulin resistance])を引き起こす場合があるため重要である[85]。TCF7L2など、Wntシグナルと関係した転写因子の変異も易罹患性の増加と関連付けられている[86]。
出典
[編集]- ^ a b “A new nomenclature for int-1 and related genes: the Wnt gene family”. Cell 64 (2): 231. (January 1991). doi:10.1016/0092-8674(91)90633-a. PMID 1846319.
- ^ a b “Wnt genes”. Cell 69 (7): 1073–87. (June 1992). doi:10.1016/0092-8674(92)90630-U. PMID 1617723.
- ^ a b c d “Wnt signaling in disease and in development”. Cell Research 15 (1): 28–32. (January 2005). doi:10.1038/sj.cr.7290260. PMID 15686623.
- ^ “Dishevelled-DEP domain interacting protein (DDIP) inhibits Wnt signaling by promoting TCF4 degradation and disrupting the TCF4/beta-catenin complex”. Cellular Signalling 22 (11): 1753–60. (November 2010). doi:10.1016/j.cellsig.2010.06.016. PMID 20603214.
- ^ a b c “Genetic interaction of PGE2 and Wnt signaling regulates developmental specification of stem cells and regeneration”. Cell 136 (6): 1136–47. (March 2009). doi:10.1016/j.cell.2009.01.015. PMC 2692708. PMID 19303855.
- ^ “The Wnt signaling pathway in development and disease”. Annual Review of Cell and Developmental Biology 20: 781–810. (2004). doi:10.1146/annurev.cellbio.20.010403.113126. PMID 15473860.
- ^ a b c d e f g h i j “Wnt signal transduction pathways”. Organogenesis 4 (2): 68–75. (April 2008). doi:10.4161/org.4.2.5851. PMC 2634250. PMID 19279717.
- ^ “Pharmacological interventions in the Wnt pathway: inhibition of Wnt secretion versus disrupting the protein-protein interfaces of nuclear factors”. British Journal of Pharmacology 174 (24): 4600–4610. (December 2017). doi:10.1111/bph.13864. PMC 5727313. PMID 28521071.
- ^ “Mode of proviral activation of a putative mammary oncogene (int-1) on mouse chromosome 15”. Nature 307 (5947): 131–6. (1984). Bibcode: 1984Natur.307..131N. doi:10.1038/307131a0. PMID 6318122.
- ^ van Amerongen, Renée (2020-04-30). “Celebrating Discoveries in Wnt Signaling: How One Man Gave Wings to an Entire Field”. Cell 181 (3): 487–491. doi:10.1016/j.cell.2020.03.033. ISSN 1097-4172. PMID 32234518.
- ^ “Wnt signalling and its impact on development and cancer”. Nature Reviews. Cancer 8 (5): 387–98. (May 2008). doi:10.1038/nrc2389. PMID 18432252.
- ^ “Wnt signaling: a common theme in animal development”. Genes & Development 11 (24): 3286–305. (December 1997). doi:10.1101/gad.11.24.3286. PMID 9407023.
- ^ “Synthetic protein lipidation”. Current Opinion in Chemical Biology 28: 39–46. (October 2015). doi:10.1016/j.cbpa.2015.05.025. PMID 26080277.
- ^ “WLS retrograde transport to the endoplasmic reticulum during Wnt secretion”. Developmental Cell 29 (3): 277–91. (May 2014). doi:10.1016/j.devcel.2014.03.016. PMID 24768165.
- ^ “Structural basis of Wnt recognition by Frizzled”. Science 337 (6090): 59–64. (July 2012). Bibcode: 2012Sci...337...59J. doi:10.1126/science.1222879. PMC 3577348. PMID 22653731.
- ^ “Wnt lipidation: Roles in trafficking, modulation, and function”. Journal of Cellular Physiology 234 (6): 8040–8054. (June 2019). doi:10.1002/jcp.27570. PMID 30341908.
- ^ “Post-translational palmitoylation and glycosylation of Wnt-5a are necessary for its signalling”. The Biochemical Journal 402 (3): 515–23. (March 2007). doi:10.1042/BJ20061476. PMC 1863570. PMID 17117926.
- ^ Nusse, Roel. “The Wnt Homepage”. 15 April 2013閲覧。
- ^ Sawa, Hitoshi; Korswagen, Hendrik C. (March 2013). “WNT signaling in C. Elegans”. WormBook: 1–30. doi:10.1895/wormbook.1.7.2. PMC 5402212. PMID 25263666.
- ^ a b c “An updated overview on Wnt signaling pathways: a prelude for more”. Circulation Research 106 (12): 1798–806. (June 2010). doi:10.1161/CIRCRESAHA.110.219840. PMID 20576942.
- ^ “The Frizzled family of unconventional G-protein-coupled receptors”. Trends in Pharmacological Sciences 28 (10): 518–25. (October 2007). doi:10.1016/j.tips.2007.09.001. PMID 17884187.
- ^ “Dishevelled and Wnt signaling: is the nucleus the final frontier?”. Journal of Biology 4 (1): 2. (February 2005). doi:10.1186/jbiol22. PMC 551522. PMID 15720723.
- ^ “Messing up disorder: how do missense mutations in the tumor suppressor protein APC lead to cancer?”. Molecular Cancer 10: 101. (August 2011). doi:10.1186/1476-4598-10-101. PMC 3170638. PMID 21859464.
- ^ Buckle, Ashley M, ed (2013). “Large extent of disorder in Adenomatous Polyposis Coli offers a strategy to guard Wnt signalling against point mutations”. PLOS ONE 8 (10): e77257. Bibcode: 2013PLoSO...877257M. doi:10.1371/journal.pone.0077257. PMC 3793970. PMID 24130866.
- ^ a b c d “Wnt/beta-catenin signaling: components, mechanisms, and diseases”. Developmental Cell 17 (1): 9–26. (July 2009). doi:10.1016/j.devcel.2009.06.016. PMC 2861485. PMID 19619488.
- ^ “Tcf/Lef transcription factors during T-cell development: unique and overlapping functions”. The Hematology Journal 1 (1): 3–6. (February 2000). doi:10.1038/sj.thj.6200001. PMID 11920163.
- ^ “Wnt/wingless signaling requires BCL9/legless-mediated recruitment of pygopus to the nuclear beta-catenin-TCF complex”. Cell 109 (1): 47–60. (April 2002). doi:10.1016/s0092-8674(02)00679-7. PMID 11955446.
- ^ “Parafibromin/Hyrax activates Wnt/Wg target gene transcription by direct association with beta-catenin/Armadillo”. Cell 125 (2): 327–41. (April 2006). doi:10.1016/j.cell.2006.01.053. PMID 16630820.
- ^ “Constitutive scaffolding of multiple Wnt enhanceosome components by Legless/BCL9”. eLife 6: e20882. (March 2017). doi:10.7554/elife.20882. PMC 5352222. PMID 28296634.
- ^ Söderholm, Simon; Cantù, Claudio (21 October 2020). “The WNT/β‐catenin dependent transcription: A tissue‐specific business”. WIREs Systems Biology and Medicine 13 (3): e1511. doi:10.1002/wsbm.1511. PMID 33085215.
- ^ “Phosphorylation of beta-catenin by AKT promotes beta-catenin transcriptional activity”. Journal of Biological Chemistry 282 (15): 11221–9. (April 2007). doi:10.1074/jbc.M611871200. PMC 1850976. PMID 17287208.
- ^ “The Pygo2-H3K4me2/3 interaction is dispensable for mouse development and Wnt signaling-dependent transcription”. Development 140 (11): 2377–86. (June 2013). doi:10.1242/dev.093591. PMID 23637336.
- ^ “Pax6-dependent, but β-catenin-independent, function of Bcl9 proteins in mouse lens development”. Genes & Development 28 (17): 1879–84. (September 2014). doi:10.1101/gad.246140.114. PMC 4197948. PMID 25184676.
- ^ “A cytoplasmic role of Wnt/β-catenin transcriptional cofactors Bcl9, Bcl9l, and Pygopus in tooth enamel formation”. Science Signaling 10 (465): eaah4598. (February 2017). doi:10.1126/scisignal.aah4598. PMID 28174279.
- ^ “Wnt signaling: multiple pathways, multiple receptors, and multiple transcription factors”. The Journal of Biological Chemistry 281 (32): 22429–33. (August 2006). doi:10.1074/jbc.R600015200. PMID 16793760.
- ^ “Noncanonical Wnt signaling in vertebrate development, stem cells, and diseases”. Birth Defects Research. Part C, Embryo Today 90 (4): 243–56. (December 2010). doi:10.1002/bdrc.20195. PMID 21181886.
- ^ a b c “Towards an integrated view of Wnt signaling in development”. Development 136 (19): 3205–14. (October 2009). doi:10.1242/dev.033910. PMID 19736321.
- ^ “Wnt5a can both activate and repress Wnt/β-catenin signaling during mouse embryonic development”. Developmental Biology 369 (1): 101–14. (September 2012). doi:10.1016/j.ydbio.2012.06.020. PMC 3435145. PMID 22771246.
- ^ “Activation of intracellular calcium by multiple Wnt ligands and translocation of β-catenin into the nucleus: a convergent model of Wnt/Ca2+ and Wnt/β-catenin pathways”. The Journal of Biological Chemistry 288 (50): 35651–9. (December 2013). doi:10.1074/jbc.M112.437913. PMC 3861617. PMID 24158438.
- ^ “TSC2 integrates Wnt and energy signals via a coordinated phosphorylation by AMPK and GSK3 to regulate cell growth”. Cell 126 (5): 955–68. (September 2006). doi:10.1016/j.cell.2006.06.055. PMID 16959574.
- ^ “Canonical Wnt signaling induces BMP-4 to specify slow myofibrogenesis of fetal myoblasts”. Skeletal Muscle 3 (1): 5. (March 2013). doi:10.1186/2044-5040-3-5. PMC 3602004. PMID 23497616.
- ^ “Extracellular modulators of Wnt signalling”. Current Opinion in Structural Biology 29: 77–84. (December 2014). doi:10.1016/j.sbi.2014.10.003. PMID 25460271.
- ^ “Inactivation of Wnt signaling by a human antibody that recognizes the heparan sulfate chains of glypican-3 for liver cancer therapy”. Hepatology 60 (2): 576–87. (August 2014). doi:10.1002/hep.26996. PMC 4083010. PMID 24492943.
- ^ “Epitope mapping by a Wnt-blocking antibody: evidence of the Wnt binding domain in heparan sulfate”. Scientific Reports 6: 26245. (May 2016). Bibcode: 2016NatSR...626245G. doi:10.1038/srep26245. PMC 4869111. PMID 27185050.
- ^ “Immunotoxin targeting glypican-3 regresses liver cancer via dual inhibition of Wnt signalling and protein synthesis”. Nature Communications 6: 6536. (March 2015). Bibcode: 2015NatCo...6.6536G. doi:10.1038/ncomms7536. PMC 4357278. PMID 25758784.
- ^ a b c “A Frizzled-Like Cysteine-Rich Domain in Glypican-3 Mediates Wnt Binding and Regulates Hepatocellular Carcinoma Tumor Growth in Mice”. Hepatology 70 (4): 1231–1245. (April 2019). doi:10.1002/hep.30646. PMC 6783318. PMID 30963603.
- ^ “Glypican-3: a new target for cancer immunotherapy”. European Journal of Cancer 47 (3): 333–8. (February 2011). doi:10.1016/j.ejca.2010.10.024. PMC 3031711. PMID 21112773.
- ^ “Glypicans as Cancer Therapeutic Targets”. Trends in Cancer 4 (11): 741–754. (November 2018). doi:10.1016/j.trecan.2018.09.004. PMC 6209326. PMID 30352677.
- ^ Gao, Wei; Xu, Yongmei; Liu, Jian; Ho, Mitchell (May 17, 2016). “Epitope mapping by a Wnt-blocking antibody: evidence of the Wnt binding domain in heparan sulfate”. Scientific Reports 6: 26245. Bibcode: 2016NatSR...626245G. doi:10.1038/srep26245. ISSN 2045-2322. PMC 4869111. PMID 27185050.
- ^ “The Role of Glypican-3 in Regulating Wnt, YAP, and Hedgehog in Liver Cancer”. Frontiers in Oncology 9: 708. (2019-08-02). doi:10.3389/fonc.2019.00708. PMC 6688162. PMID 31428581.
- ^ “Modular mechanism of Wnt signaling inhibition by Wnt inhibitory factor 1”. Nature Structural & Molecular Biology 18 (8): 886–93. (July 2011). doi:10.1038/nsmb.2081. PMC 3430870. PMID 21743455.
- ^ “Docking of fatty acids into the WIF domain of the human Wnt inhibitory factor-1”. Lipids 43 (3): 227–30. (March 2008). doi:10.1007/s11745-007-3144-3. PMID 18256869.
- ^ a b “Large extent of disorder in Adenomatous Polyposis Coli offers a strategy to guard Wnt signalling against point mutations”. PLOS ONE 8 (10): e77257. (2013). Bibcode: 2013PLoSO...877257M. doi:10.1371/journal.pone.0077257. PMC 3793970. PMID 24130866.
- ^ a b c d Gilbert, Scott F. (2010). Developmental biology (9th ed.). Sunderland, Mass.: Sinauer Associates. ISBN 9780878933846
- ^ “Modeling gastrulation in the chick embryo: formation of the primitive streak”. PLOS ONE 5 (5): e10571. (May 2010). Bibcode: 2010PLoSO...510571V. doi:10.1371/journal.pone.0010571. PMC 2868022. PMID 20485500.
- ^ “Early Development in Birds”. Developmental Biology (10th ed.). Sunderland (MA): Sinauer Associates. (2014)
- ^ “Wnt won the war: antagonistic role of Wnt over Shh controls dorso-ventral patterning of the vertebrate neural tube”. Developmental Dynamics 239 (1): 69–76. (January 2010). doi:10.1002/dvdy.22058. PMID 19681160.
- ^ “Wnt signaling in axon guidance”. Trends in Neurosciences 27 (9): 528–32. (September 2004). doi:10.1016/j.tins.2004.06.015. PMID 15331234.
- ^ “The organelle of differentiation in embryos: the cell state splitter”. Theoretical Biology & Medical Modelling 13: 11. (March 2016). doi:10.1186/s12976-016-0037-2. PMC 4785624. PMID 26965444.
- ^ Embryogenesis Explained. Singapore: World Scientific Publishing. (2016). pp. 580–591. doi:10.1142/8152. ISBN 978-981-4740-69-2
- ^ a b “Wnt signaling and stem cell control”. Cell Research 18 (5): 523–7. (May 2008). doi:10.1038/cr.2008.47. PMID 18392048.
- ^ “Generation of multipotential mesendodermal progenitors from mouse embryonic stem cells via sustained Wnt pathway activation”. The Journal of Biological Chemistry 282 (43): 31703–12. (October 2007). doi:10.1074/jbc.M704287200. PMID 17711862.
- ^ “Wnt signaling promotes hematoendothelial cell development from human embryonic stem cells”. Blood 111 (1): 122–31. (January 2008). doi:10.1182/blood-2007-04-084186. PMC 2200802. PMID 17875805.
- ^ “Wnt antagonism initiates cardiogenesis in Xenopus laevis”. Genes & Development 15 (3): 304–15. (February 2001). doi:10.1101/gad.855601. PMC 312618. PMID 11159911.
- ^ “Inhibition of Wnt activity induces heart formation from posterior mesoderm”. Genes & Development 15 (3): 316–27. (February 2001). doi:10.1101/gad.855501. PMC 312622. PMID 11159912.
- ^ “Biphasic role for Wnt/beta-catenin signaling in cardiac specification in zebrafish and embryonic stem cells”. Proceedings of the National Academy of Sciences of the United States of America 104 (23): 9685–90. (June 2007). Bibcode: 2007PNAS..104.9685U. doi:10.1073/pnas.0702859104. PMC 1876428. PMID 17522258.
- ^ “Small-molecule inhibitors of the Wnt pathway potently promote cardiomyocytes from human embryonic stem cell-derived mesoderm”. Circulation Research 109 (4): 360–4. (August 2011). doi:10.1161/CIRCRESAHA.111.249540. PMC 3327303. PMID 21737789.
- ^ “Chemically defined generation of human cardiomyocytes”. Nature Methods 11 (8): 855–60. (August 2014). doi:10.1038/nmeth.2999. PMC 4169698. PMID 24930130.
- ^ “Wnt signaling in mitosis”. Developmental Cell 17 (6): 749–50. (December 2009). doi:10.1016/j.devcel.2009.12.001. PMID 20059944.
- ^ “Wnt signaling: is the party in the nucleus?”. Genes & Development 20 (11): 1394–404. (June 2006). doi:10.1101/gad.1424006. PMID 16751178.
- ^ Hodge, Russ (2016年1月25日). “Hacking the programs of cancer stem cells”. medicalxpress.com. Medical Express. 2016年2月12日閲覧。
- ^ Schambony, A; Wedlich, D. (2013). Wnt Signaling and Cell Migration. Landes Bioscience 7 May 2013閲覧。
- ^ “Epithelial-mesenchymal transition in cancer: parallels between normal development and tumor progression”. Journal of Mammary Gland Biology and Neoplasia 15 (2): 117–34. (June 2010). doi:10.1007/s10911-010-9178-9. PMC 2886089. PMID 20490631.
- ^ “Activation of Wnt/beta-catenin signaling increases insulin sensitivity through a reciprocal regulation of Wnt10b and SREBP-1c in skeletal muscle cells”. PLOS ONE 4 (12): e8509. (December 2009). Bibcode: 2009PLoSO...4.8509A. doi:10.1371/journal.pone.0008509. PMC 2794543. PMID 20041157.
- ^ Milosevic, Vladan; Kopecka, Joanna; Salaroglio, Iris C.; Libener, Roberta; Napoli, Francesca; Izzo, Stefania; Orecchia, Sara; Ananthanarayanan, Preeta et al. (2020-01-01). “Wnt/IL-1β/IL-8 autocrine circuitries control chemoresistance in mesothelioma initiating cells by inducing ABCB5”. International Journal of Cancer 146 (1): 192–207. doi:10.1002/ijc.32419. ISSN 1097-0215. PMID 31107974.
- ^ “Wnt signaling and breast cancer”. Cancer Biology & Therapy 3 (1): 36–41. (January 2004). doi:10.4161/cbt.3.1.561. PMID 14739782.
- ^ “Shutting down Wnt signal-activated cancer”. Nature Genetics 36 (4): 320–2. (April 2004). doi:10.1038/ng0404-320. PMID 15054482.
- ^ “A novel lung metastasis signature links Wnt signaling with cancer cell self-renewal and epithelial-mesenchymal transition in basal-like breast cancer”. Cancer Research 69 (13): 5364–73. (July 2009). doi:10.1158/0008-5472.CAN-08-4135. PMC 2782448. PMID 19549913.
- ^ “WNT signalling pathways as therapeutic targets in cancer”. Nature Reviews. Cancer 13 (1): 11–26. (January 2013). doi:10.1038/nrc3419. PMID 23258168.
- ^ Malladi, Srinivas; Macalinao, Danilo G.; Jin, Xin; He, Lan; Basnet, Harihar; Zou, Yilong; de Stanchina, Elisa; Massagué, Joan (2016-03-24). “Metastatic Latency and Immune Evasion through Autocrine Inhibition of WNT”. Cell 165 (1): 45–60. doi:10.1016/j.cell.2016.02.025. ISSN 1097-4172. PMC 4808520. PMID 27015306.
- ^ Esposito, Mark; Fang, Cao; Cook, Katelyn C.; Park, Nana; Wei, Yong; Spadazzi, Chiara; Bracha, Dan; Gunaratna, Ramesh T. et al. (March 2021). “TGF-β-induced DACT1 biomolecular condensates repress Wnt signalling to promote bone metastasis” (英語). Nature Cell Biology 23 (3): 257–267. doi:10.1038/s41556-021-00641-w. ISSN 1476-4679. PMC 7970447.
- ^ Esposito, Mark; Mondal, Nandini; Greco, Todd M.; Wei, Yong; Spadazzi, Chiara; Lin, Song-Chang; Zheng, Hanqiu; Cheung, Corey et al. (May 2019). “Bone vascular niche E-selectin induces mesenchymal–epithelial transition and Wnt activation in cancer cells to promote bone metastasis” (英語). Nature Cell Biology 21 (5): 627–639. doi:10.1038/s41556-019-0309-2. ISSN 1476-4679. PMC 6556210.
- ^ “Wnt signaling: relevance to beta-cell biology and diabetes”. Trends in Endocrinology and Metabolism 19 (10): 349–55. (December 2008). doi:10.1016/j.tem.2008.08.004. PMID 18926717.
- ^ “Wnt signaling regulates mitochondrial physiology and insulin sensitivity”. Genes & Development 24 (14): 1507–18. (July 2010). doi:10.1101/gad.1924910. PMC 2904941. PMID 20634317.
- ^ “Role of reactive oxygen species in injury-induced insulin resistance”. Molecular Endocrinology 25 (3): 492–502. (March 2011). doi:10.1210/me.2010-0224. PMC 3045736. PMID 21239612.
- ^ “Variant of transcription factor 7-like 2 (TCF7L2) gene confers risk of type 2 diabetes”. Nature Genetics 38 (3): 320–3. (March 2006). doi:10.1038/ng1732. PMID 16415884.
関連文献
[編集]- “Wnt/IL-1β/IL-8 autocrine circuitries control chemoresistance in mesothelioma initiating cells by inducing ABCB5”. Int. J. Cancer 146 (1): 192–207. (January 2020). doi:10.1002/ijc.32419. PMID 31107974.
- “Signaling gateway molecule pages--a data model perspective”. Bioinformatics 27 (12): 1736–8. (June 2011). doi:10.1093/bioinformatics/btr190. PMC 3106186. PMID 21505029.
外部リンク
[編集]- Wnt Proteins - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス
- Wnt gene homepage
- Online 'Mendelian Inheritance in Man' (OMIM) 604663
- βカテニンに新たな機能独立行政法人 理化学研究所
- Wnt シグナルパスウェイ
- Wnt - 脳科学辞典
- カテニン - 脳科学辞典
