イソキノリン
| イソキノリン | |
|---|---|

| |
| 一般情報 | |
| IUPAC名 | イソキノリン |
| 別名 | 2-アザナフタレン 2-ベンズアジン ベンゾ[c]ピリジン |
| 分子式 | C9H7N |
| 分子量 | 129.16 |
| 形状 | 無色油状、板状結晶 |
| CAS登録番号 | [119-65-3] |
| SMILES | C1(C=NC=C2)=C2C=CC=C1 |
| 性質 | |
| 密度と相 | 1.099 g/cm3, |
| 融点 | 26-28 °C |
| 沸点 | 242 °C |
| pKb | 8.60 |
| 粘度 | 3.2528 (30℃) |
| 屈折率 | 1.62078 (30℃) |
イソキノリン (isoquinoline) は、ベンゼン環とピリジン環が縮合した構造を持つ複素環式芳香族化合物の一種である。キノリンの構造異性体にあたり、その構造を、2-アザナフタレン、2-ベンズアジン と表すこともできる。ピリジン環の 3,4位の結合部位にベンゼン環が縮合していることから ベンゾ[c]ピリジン とも表される。無色で吸湿性の油状物質で、強い臭いを呈する。広義では、イソキノリン骨格を持つ各種誘導体の化合物群を示す。イソキノリンは天然に存在するパパベリンやモルヒネなどのアルカロイドに含まれる。生体内で、それらのイソキノリン環はチロシンから誘導されている。
化学的性質
[編集]常温のイソキノリンは無色で吸湿性の油状物質で、突き刺すような悪臭を持つ。他の含窒素複素環式化合物によくあるように、純度の低いサンプルは褐色を呈する。低温では板状結晶となり、水への溶解度は低いが、エタノール、アセトン、ジエチルエーテル、二硫化炭素、ほか通常の有機溶媒に容易に溶ける。希酸にも、プロトン化されたイソキノリニウムの形で溶ける。
ピリジン環を有するため、イソキノリンは弱塩基性を示し、pKb の値は 8.6 である。塩化水素のような強酸で処理するとプロトン化され、イソキノリニウム塩(isoquinolinium salt)となる。BF3 のようなルイス酸とは付加体を作る。
産出、合成
[編集]イソキノリンは Hoogewerf と van Dorp により 1885年に、コールタール中から部分結晶法で硫酸塩の形として単離された。Weissgerber は 1914年にイソキノリンがキノリンよりも塩基性が強いことを利用して、コールタールからのより迅速な選択的抽出法を開発した。
イソキノリンの誘導体を化学合成する手法はいくつか知られているが、無置換のイソキノリンを直接得る方法は比較的少ない。Pomeranz-Fritsch 反応はイソキノリンを得る有効な方法である。
- Pomeranz-Fritsch 反応:ベンズアルデヒドとアミノアセトアルデヒドジエチルアセタールを酸溶媒中で作用させてイソキノリンを与える。代わりにベンジルアミンと、グリオキサールのアセタールを用いても、同様の結果となる。
イソキノリンのさまざまな誘導体の合成法を以下に示す。
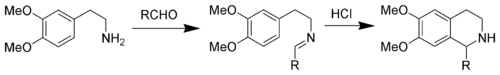
- ビシュラー・ナピエラルスキー反応:β-フェニルエチルアミンをアシル化し、オキシ塩化リンや五酸化二リンなどの酸により脱水環化させる。生じる 1-置換-3,4-ジヒドロイソキノリンはパラジウム触媒により脱水素できる。パパベリンの合成に用いられる。
- Pictet-Gams反応、Pictet-Spengler 反応:どちらも、Bischler-Napieralski 反応から派生した。違いは:
- Pictet-Gams反応では、Bischler-Napieralski 反応の最後にあった脱水素反応を省くために、側鎖にヒドロキシル基を持つβ-フェニルエチルアミンを用いる。この反応は 1-アルキルイソキノリンを与える。
- Pictet-Spengler反応では、β-フェニルエチルアミンを酸溶媒中でアルデヒドと縮合させてイミンとし、マンニッヒ反応の形式で環化させる。この反応は 1,2,3,4-テトラヒドロイソキノリンを与える。
- 分子内アザウィティッヒ反応によってもイソキノリンが得られる。
誘導体の用途
[編集]イソキノリン誘導体にはさまざまな用途がある。例を挙げると:
- 麻酔薬:dimethisoquin
- 降圧剤:キナプリル、quinapirilat、debrisoquine (いずれも 1,2,3,4-テトラヒドロイソキノリン誘導体)。
- 抗菌剤:2,2'-ヘキサデカメチレンジイソキノリニウムジクロリド
- 消毒剤:N-ラウリルイソキノリニウムブロミド
- 血管拡張作用:パパベリン
- イソキノリン誘導体は染料、顔料、殺虫剤、防腐剤としても用いられる。また、樹脂からテルペンを抽出するための溶媒としても用いられる。
-
キナプリル
-
N-ラウリルイソキノリニウムブロミド
-
パパベリン
参考文献
[編集]- Gilchrist, T. L. Heterocyclic Chemistry (3rd ed.). Essex, UK: Addison Wesley Longman, 1997.
- Harris, J.; Pope, W. J. J. Chem. Soc. 1922, 121, 1029-1033.
- Katritsky, A. R.; Pozharskii, A. F. Handbook of Heterocyclic Chemistry (2nd ed.). Oxford, UK: Elsevier, 2000.
- Katritsky, A.R.; Rees, C.W.; Scriven, E.F. (Eds.). Comprehensive Heterocyclic Chemistry II: A Review of the Literature 1982-1995 (Vol. 5). Tarrytown, NY: Elsevier, 1996.
- Nagatsu, T. Neuroscience Research 1997, 29, 99-111.
- O'Neil, Maryadele J. (Ed.). The Merck Index (13th ed.). Whitehouse Station, NJ: Merck, 2001.