アレン (化学)
この項目「アレン (化学)」は翻訳されたばかりのものです。不自然あるいは曖昧な表現などが含まれる可能性があり、このままでは読みづらいかもしれません。(原文:en: Allenes) 修正、加筆に協力し、現在の表現をより自然な表現にして下さる方を求めています。ノートページや履歴も参照してください。(2023年3月) |

有機化学においてアレン(英: Allene)とは、隣接する2つの炭素原子の両方と二重結合する炭素原子を含む、すなわち、RをHもしくはなんらかの置換基として、化学式R
2C=C=CR
2で表わされるような有機化合物をいう。集積ジエン(英: cumulated diene)とも呼ばれる。アレンの親化合物は、プロパジエン(H
2C=C=CH
2)である。プロパジエンのことを指してアレンということもある。RをHもしくはなんらかのアルキル基として、R
2C=C=CR–のような置換基はアレニル基(英: allenyl group)と呼ばれる。
歴史
[編集]長年にわたり、アレンは好奇心の対象とされることはあっても、合成上の用途は無く調製も保管も難しいと考えられていた[1]。伝えられるところによれば[2]、アレンとして初めて合成されたグルチン酸は、アレンが存在しないことを示そうとして合成されたという[3][4]。1950年代から状況は変化しはじめ、2012年にはその年だけでも300報を超えるアレンに関する論文が発表された。アレンは中間体として興味深いだけではなく、それ自体が価値のある合成対象となっている。150種を超えるアレンもしくはクムレン部分構造を含む天然化合物が今までに知られている[2]。
構造と物性
[編集]幾何構造
[編集]
アレンの中心炭素原子は2つのσ結合と2つのπ結合を持つ。2つの末端炭素原子はsp2混成軌道を持つ。3つの炭素原子の結合角は180度であり、直線構造を成す。2つの末端炭素原子は平面構造をなし、それぞれの平面は90度ねじれた配置となる。この構造はメタンのような四面体形分子構造を「引き伸ばした」構造に似ているとみなすことができ、誘導体の立体化学分析はこのアナロジーを用いて行われる。
対称性
[編集]
アレンの分子対称性と異性体は長年の間有機化学者たちを魅了してきた[5]。4つの同一置換基を持つアレンには、中心炭素原子を通り、2つの末端CH
2平面それぞれから45度傾いた2本の2回回転対称軸C2がある。したがって、この分子は2枚羽のプロペラになぞらえて考えることができる。また、C=C=C結合軸に沿った3つめの2回回転対称軸も持ち、2つのCH
2平面は両方とも鏡映対称面となっている。したがって、この分子の対称性は点群D2dに属する。この対称性のため、無置換アレンは総双極子モーメントを持たず、非極性分子である。
2つの炭素原子のそれぞれに異なる2つの置換基が結合した誘導体は、鏡映対称面がなくなるためキラリティーを持つ。この種のキラリティーは1875年にファント・ホッフにより予言されたが、実験的に実証されたのは1935年になってからである[6]。軸不斉配置を考える際には、カーン・インゴールド・プレローグ順位則に加えて、手前側原子に結合する置換基が奥側原子に結合する置換基よりも優先されるという規則が追加される。奥側の原子に結合する置換基は、優先順位の高い1つのみを考慮すれば十分である。
キラリティーをもつアレンは、珍しいキラル光学特性をもつ有機材料の合成におけるビルディングブロックとして使われるようになっている[7]。また、アレン系を部分構造としてもつ薬分子もいくつか知られている[8]。抗結核性抗生物質の1つ、マイコマイシン(Mycomycin)[9]が典型的な例として挙げられる[10]。この薬はアレンに由来する軸不斉を持つ。
教科書的には、アレンの結合は準局所的ヒュッケル法を用いて直交するπ軌道対として説明されるが、分子軌道全体を用いてさらに詳細に説明される。アレンのsymmetry-correct[訳語疑問点](D2d点群に適合する)2重に縮退したHOMOは、直交する2つの分子軌道としても、直交する2つの分子軌道をねじれた螺旋型に線形結合をとったものとしても表わすことができる。系の対称性と軌道の縮退度から、これら2つの表現は(ベンゼンの2重に縮退したHOMOおよびLUMOの表現は無限に存在しどれも正しいのと同様に)どちらも正しいが、置換により縮退が解けた、たとえばC2対称な1,3ジメチルアレンの場合、HOMOおよびHOMO-1の記述としては螺旋型軌道が唯一のsymmetry-correctな描像となる[11][12]。この定性的な分子軌道描像は奇数炭素クムレン(例:1,2,3,4-ペンタテトラエン)に一般化することができる。
化学的性質および分光物性
[編集]アレンの化学的性質は、他のアルケンとは大きく異なる。孤立ジエンや共役ジエンと比べ、アレンは非常に不安定である。ペンタジエンの生成エンタルピーの異性体による差を比較すると、アレンの1,2-ペンタジエンが33.6 kcal/mol、共役ジエンの(E)-1,3-ペンタジエンが18.1 kcal/mol、孤立ジエンの1,4-ペンタジエンでは25.4 kcal/molとなる[13]。
アレンのC–H結合は典型的なビニル基におけるC-H結合に比べて弱く、より酸性が強く、アレンにおける結合解離エネルギーは87.7 kcal/mol(エチレンでは111 kcal/mol)である。プロトン親和力は381 kcal/mol(エチレンでは409 kcal/mol[14])でありプロパルギル基のC-H結合(382 kcal/mol)よりもわずかに酸性度が高い。
アレンの13C NMRスペクトルはsp混成炭素原子に由来する、200–220 ppmに位置するピークにより特徴づけられる。対照的に、sp2混成炭素原子に由来する信号は、典型的なアルキンやニトリル炭素原子の信号と重なる80 ppm近辺にピークを持つ。アレンの末端CH2基のプロトンに由来するピークは4.5 ppmと、典型的ビニル基のプロトンに比べて若干上に位置する[15]。
アレンはさまざまな環化付加反応を起こす。[4+2]環化付加反応と[2+2]環化付加反応のどちらも起こし得るし[16][17]、遷移金属触媒下で形式的環化付加反応を起こすことも知られる[18][19]。また、遷移金属触媒下で水素化官能化反応の基質としても働く[20][21][22]。
合成
[編集]アレンの合成には特殊な合成手法が必要となることが多いが、アレンの親化合物として、プロパジエンはメチルアセチレンとの平衡混合物から産業的に大規模生産されている。
この混合物はマップガスの名称で市販されている。298 Kにおけるこの反応のΔG°は−1.9 kcal/molであり、Keq = 24.7に相当する[23]。
初めて合成されたアレンはグルチン酸(ペンタ-2,3-ジエン二酸)であり、1887年にBurtonおよびPechmannにより合成された。しかし、この構造が正しく同定されたのは1954年になってからである[24]。
研究室スケールでアレンを合成する手法としては以下のようなものが挙げられる。
- ジェミナルジハロゲン化シクロプロパンと有機リチウム化合物(または金属ナトリウムおよびマグネシウム)から、シクロプロピリデンカルベンおよびカルベノイドを経由した、Skattebøl 転位(デーリング–ラフラム・アレン合成)
- 特定の末端アルキンをホルムアルデヒド、臭化銅(I)および塩基下で反応させる(クラベ–マー・アレン合成)[25][26]
- ハロゲン化プロパルギルと有機クプラートのSN2′置換反応[27]
- 特定のジハロゲン化物の脱ハロゲン化水素反応[28]
- トリフェニルホスフィニルエステルと酸ハロゲン化物との、脱ハロゲン化水素反応を伴うウィッティヒ反応[29][30]
- プロパルギルアルコールを出発物質とする、立体特異的なマイヤーズ・アレン合成
- アレンもしくは置換アレンにn-ブチルリチウムをメタレーションさせたのち、求電子剤(RX, R3SiX, D2O, etc.)と反応させる[31]
アレンの化学については様々な書籍[32][33][34]や雑誌論文[1][35][36][37][38][39][40][41][42]が書かれている。アレンの合成にむけたキーアプローチのうちいくつかをまとめた図を以下に示す[43][44][45][46]。
このなかでも古いものの1つがSkattebøl転位[43][47][48](デーリング–ムーア–Skattebøl転位もしくはデーリング–ラフラム転位とも[49][50])であり、ジェミナルジハロゲン化シクロプロパン3を有機リチウム化合物(もしくは溶解しつつある金属)で処理して生じるといわれる中間体が転位反応をおこし、カルベン様化学種を経て直接アレンに転位する。この手法によれば、ゆがんだアレンをも得ることができる[51]。性質の異なる脱離基のかかわる変種も知られる[43]。おそらく現代では、プロパルギル基質からのシグマトロピー転位がもっとも簡便なアレン合成であろう[44][45][46]。ケテンアセタール4のジョンソン–クライゼン転位[46]およびアイルランド–クライゼン転位[52]はアレンエステルおよび酸を調製するためにしばしば用いられる。Saucy–Marbet転位反応により、ビニルエステル5からはアレンアルデヒドを得ることができ[53]スルフェン酸プロパルギル6からはアレンスルホキシドが得られる[54][55]。9および10(求核剤Nu−はたとえばハロゲン化物イオン)からの求核置換反応や、8からの1,2-脱離反応、7からのプロトン転移などによってもアレンを調製することができ、他にもあまり一般的でない手法はさまざまある[44][45]。
用途および分布
[編集]用途
[編集]アレンは反応性に富み、さまざまな発見への扉を開いた[56][57][58][59]。2つのπ結合は互いに90°ねじれて位置するので、反応試薬は若干異なる方向から近付く必要がある。ファントホッフが1875年に予測したとおり、アレンは適切な置換パターンのもとで軸性キラリティーを示す。このような化合物は広く調べられている[59]。アレンのプロトン化により得られるカチオン11はさらなる変換を受ける[60]。軟らかい求電子剤(e.g. Br+)との反応により、正に帯電したオニウムイオン13が生じる[61]。遷移金属触媒下で、アレル性の中間体15を経る反応は、近年大きな注目を集めている[62][63]。12を与える[4+2]-環化付加反応、14を与える(2+1)-環化付加反応、16を与える[2+2]-環化付加反応など、様々な環化付加反応が知られている[56][64][65][66]。
分布
[編集]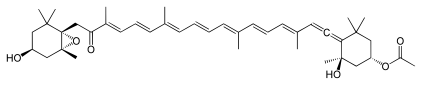
数多くの自然物質にアレン官能基が含まれている。その中でも、フコキサンチンとペリジニンの2つの色素は特筆に値する。その生合成過程はあまりわかっていないが、アルキン前駆体から生成されるという仮説がある[67]。
アレンは有機金属化学における配位子としてもはたらく。典型的な錯体としてPt(η2-アレン)(PPh3)2が挙げられる。Ni(0)試薬はアレンの環化重合反応を触媒する[68]。適切な触媒(例:ウィルキンソン触媒)を使うことにより、アレンの2重結合のうち1つだけを還元することも可能である[69]。
δ慣習法
[編集]多くの環状化合物は、集積的でない結合の最大数を前提とした半系統的命名法で名付けられている。集積的な結合を含む(したがって骨格から予想されるより水素が少ない)誘導体を曖昧さなく特定するために、ある原子がもつ集積2重結合の数を上付き数字として添えた小文字のδを使い、例えば8δ2-ベンゾシクロノネンのように命名することがある。λ慣習法と組み合わせて、例えば2λ4δ2,5λ4δ2-チエノ[3,4-c]チオフェンのように非標準的な価数状態をもつ化合物を表わすこともできる[70]。
関連項目
[編集]- ジエン - 集積しているかどうかを問わず2重結合を2本もつ化合物
- ケテン - R
2C=C=Oの一般式で表わされる、集積2重結合をもつ化合物 - クムレン - 3本以上の2重結合が集積した構造を持つ化合物
- アリル化合物(allyl compound) - -CH2CH=CH2の構造をもつ化合物。語源は同一だが同一構造ではない。
出典
[編集]This article incorporates text by Oleksandr Zhurakovskyi available under the CC BY 2.5 license.
- ^ a b Taylor, David R. (1967-06-01). “The Chemistry of Allenes” (英語). Chemical Reviews 67 (3): 317–359. doi:10.1021/cr60247a004. ISSN 0009-2665.
- ^ a b Hoffmann-Röder, Anja; Krause, Norbert (2004-02-27). “Synthesis and Properties of Allenic Natural Products and Pharmaceuticals” (英語). Angewandte Chemie International Edition 43 (10): 1196–1216. doi:10.1002/anie.200300628. ISSN 1433-7851. PMID 14991780.
- ^ Burton, B. S.; von Pechmann, H. (January 1887). “Ueber die Einwirkung von Chlorphosphor auf Acetondicarbonsäureäther” (ドイツ語). Berichte der Deutschen Chemischen Gesellschaft 20 (1): 145–149. doi:10.1002/cber.18870200136.
- ^ Jones, E. R. H.; Mansfield, G. H.; Whiting, M. C. (1954). “Researches on acetylenic compounds. Part XLVII. The prototropic rearrangements of some acetylenic dicarboxylic acids” (英語). Journal of the Chemical Society (Resumed): 3208–3212. doi:10.1039/jr9540003208. ISSN 0368-1769.
- ^ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, ISBN 0-471-72091-7
- ^ Maitland, Peter; Mills, W. H. (1935). “Experimental Demonstration of the Allene Asymmetry”. Nature 135 (3424): 994. Bibcode: 1935Natur.135Q.994M. doi:10.1038/135994a0.
- ^ Rivera Fuentes, Pablo; Diederich, François (2012). “Allenes in Molecular Materials”. Angew. Chem. Int. Ed. Engl. 51 (12): 2818–2828. doi:10.1002/anie.201108001. PMID 22308109.
- ^ Celmer, Walter D.; Solomons, I. A. (1952). “The Structure of the Antibiotic Mycomycin”. Journal of the American Chemical Society 74 (7): 1870–1871. doi:10.1021/ja01127a529. ISSN 0002-7863.
- ^ Mycomycin, PubChem
- ^ JENKINS, D E (1950). “Mycomycin: a new antibiotic with tuberculostatic properties.”. J Lab Clin Med 36 (5): 841–2. PMID 14784717.
- ^ H. Hendon, Christopher; Tiana, Davide; T. Murray, Alexander; R. Carbery, David; Walsh, Aron (2013). “Helical frontier orbitals of conjugated linear molecules” (英語). Chemical Science 4 (11): 4278–4284. doi:10.1039/C3SC52061G.
- ^ Garner, Marc H.; Hoffmann, Roald; Rettrup, Sten; Solomon, Gemma C. (2018-06-27). “Coarctate and Möbius: The Helical Orbitals of Allene and Other Cumulenes”. ACS Central Science 4 (6): 688–700. doi:10.1021/acscentsci.8b00086. ISSN 2374-7943. PMC 6026781. PMID 29974064.
- ^ Informatics, NIST Office of Data and (1997) (英語). Welcome to the NIST WebBook. doi:10.18434/T4D303 2020年10月17日閲覧。.
- ^ Alabugin, Igor V. (2016-09-19) (英語). Stereoelectronic Effects: A Bridge Between Structure and Reactivity. Chichester, UK: John Wiley & Sons, Ltd. doi:10.1002/9781118906378. ISBN 978-1-118-90637-8
- ^ Pretsch, Ernö, 1942- (2009). Structure determination of organic compounds : tables of spectral data. Bühlmann, P. (Philippe), 1964-, Badertscher, M. (Fourth, Revised and Enlarged ed.). Berlin: Springer. ISBN 978-3-540-93810-1. OCLC 405547697
- ^ Alcaide, Benito; Almendros, Pedro; Aragoncillo, Cristina (2010-01-28). “Exploiting [2+2 cycloaddition chemistry: achievements with allenes”] (英語). Chemical Society Reviews 39 (2): 783–816. doi:10.1039/B913749A. ISSN 1460-4744. PMID 20111793.
- ^ Pasto, Daniel J. (January 1984). “Recent developments in allene chemistry” (英語). Tetrahedron 40 (15): 2805–2827. doi:10.1016/S0040-4020(01)91289-X.
- ^ Alcaide, Benito; Almendros, Pedro (August 2004). “The Allenic Pauson−Khand Reaction in Synthesis” (英語). European Journal of Organic Chemistry 2004 (16): 3377–3383. doi:10.1002/ejoc.200400023. ISSN 1434-193X.
- ^ Mascareñas, José L.; Varela, Iván; López, Fernando (2019-02-19). “Allenes and Derivatives in Gold(I)- and Platinum(II)-Catalyzed Formal Cycloadditions” (英語). Accounts of Chemical Research 52 (2): 465–479. doi:10.1021/acs.accounts.8b00567. ISSN 0001-4842. PMC 6497370. PMID 30640446.
- ^ Zi, Weiwei; Toste, F. Dean (2016-08-08). “Recent advances in enantioselective gold catalysis” (英語). Chemical Society Reviews 45 (16): 4567–4589. doi:10.1039/C5CS00929D. ISSN 1460-4744. PMID 26890605.
- ^ Lee, Mitchell; Nguyen, Mary; Brandt, Chance; Kaminsky, Werner; Lalic, Gojko (2017-12-04). “Catalytic Hydroalkylation of Allenes” (英語). Angewandte Chemie International Edition 56 (49): 15703–15707. doi:10.1002/anie.201709144. PMID 29052303.
- ^ Kim, Seung Wook; Meyer, Cole C.; Mai, Binh Khanh; Liu, Peng; Krische, Michael J. (2019-10-04). “Inversion of Enantioselectivity in Allene Gas versus Allyl Acetate Reductive Aldehyde Allylation Guided by Metal-Centered Stereogenicity: An Experimental and Computational Study”. ACS Catalysis 9 (10): 9158–9163. doi:10.1021/acscatal.9b03695. PMC 6921087. PMID 31857913.
- ^ Robinson, Marin S.; Polak, Mark L.; Bierbaum, Veronica M.; DePuy, Charles H.; Lineberger, W. C. (1995-06-01). “Experimental Studies of Allene, Methylacetylene, and the Propargyl Radical: Bond Dissociation Energies, Gas-Phase Acidities, and Ion-Molecule Chemistry”. Journal of the American Chemical Society 117 (25): 6766–6778. doi:10.1021/ja00130a017. ISSN 0002-7863.
- ^ Jones, E. R. H.; Mansfield, G. H.; Whiting, M. C. (1954-01-01). “Researches on acetylenic compounds. Part XLVII. The prototropic rearrangements of some acetylenic dicarboxylic acids” (英語). Journal of the Chemical Society (Resumed): 3208–3212. doi:10.1039/JR9540003208. ISSN 0368-1769.
- ^ Crabbé, Pierre; Nassim, Bahman; Robert-Lopes, Maria-Teresa. "One-Step Homologation of Acetylenes to Allenes: 4-Hydroxynona-1,2-diene [1,2-Nonadien-4-ol]". Organic Syntheses (英語). 63. doi:10.15227/orgsyn.063.0203。
- ^ Luo, Hongwen; Ma, Dengke; Ma, Shengming. "Buta-2,3-dien-1-ol". Organic Syntheses (英語). doi:10.15227/orgsyn.094.0153。
- ^ Yoshikai, Naohiko; Nakamura, Eiichi (2012-04-11). “Mechanisms of Nucleophilic Organocopper(I) Reactions” (英語). Chemical Reviews 112 (4): 2339–2372. doi:10.1021/cr200241f. ISSN 0009-2665. PMID 22111574.
- ^ Cripps, H. N.; Kiefer, E. F. "Allene". Organic Syntheses (英語). 42. doi:10.15227/orgsyn.042.0012。
- ^ Lang, Robert W.; Hansen, Hans-Jürgen (1980). “Eine einfache Allencarbonsäureester-Synthese mittels der Wittig-Reaktion”. Helv. Chim. Acta 63 (2): 438–455. doi:10.1002/hlca.19800630215.
- ^ Lang, Robert W.; Hansen, Hans-Jürgen. "α-Allenic Esters from α-Phosphoranylidene Esters and Acid Chlorides: Ethyl 2,3-Pentadienoate [2,3-Pentadienoic acid, ethyl ester]". Organic Syntheses (英語). 62. doi:10.15227/orgsyn.062.0202。
- ^ Michelot, Didier; Clinet, Jean-Claude; Linstrumelle, Gérard (1982-01-01). “Allenyllithium Reagents (VI)1. A Highly Regioselective Metalation of Allenic Hydrocarbons2. A Route to Mono, DI, TRI or Tetrasubstituted Allenes”. Synthetic Communications 12 (10): 739–747. doi:10.1080/00397918208061912. ISSN 0039-7911.
- ^ The chemistry of ketenes, allenes and related compounds. Part 1. Saul Patai. Chichester: Wiley. (1980). ISBN 978-0-470-77160-0. OCLC 501315951
- ^ The chemistry of ketenes, allenes and related compounds. Part 2. Saul Patai. Chichester: Wiley. (1980). ISBN 978-0-470-77161-7. OCLC 520990503
- ^ Brandsma, L. (2004). Synthesis of acetylenes, allenes and cumulenes : methods and techniques. H. D. Verkruijsse (1st ed.). Amsterdam: Elsevier. ISBN 978-0-12-125751-4. OCLC 162570992
- ^ Pasto, Daniel J. (January 1984). “Recent developments in allene chemistry” (英語). Tetrahedron 40 (15): 2805–2827. doi:10.1016/S0040-4020(01)91289-X.
- ^ Zimmer, Reinhold; Dinesh, Chimmanamada U.; Nandanan, Erathodiyil; Khan, Faiz Ahmed (2000-08-01). “Palladium-Catalyzed Reactions of Allenes” (英語). Chemical Reviews 100 (8): 3067–3126. doi:10.1021/cr9902796. ISSN 0009-2665. PMID 11749314.
- ^ Ma, Shengming (2009-10-20). “Electrophilic Addition and Cyclization Reactions of Allenes” (英語). Accounts of Chemical Research 42 (10): 1679–1688. doi:10.1021/ar900153r. ISSN 0001-4842. PMID 19603781.
- ^ Alcaide, Benito; Almendros, Pedro; Aragoncillo, Cristina (2010). “Exploiting [2+2 cycloaddition chemistry: achievements with allenes”] (英語). Chem. Soc. Rev. 39 (2): 783–816. doi:10.1039/B913749A. ISSN 0306-0012. PMID 20111793.
- ^ Pinho e Melo, Teresa M. V. D. (July 2011). “Allenes as building blocks in heterocyclic chemistry” (英語). Monatshefte für Chemie - Chemical Monthly 142 (7): 681–697. doi:10.1007/s00706-011-0505-7. ISSN 0026-9247.
- ^ López, Fernando; Mascareñas, José Luis (2011-01-10). “Allenes as Three‐Carbon Units in Catalytic Cycloadditions: New Opportunities with Transition‐Metal Catalysts” (英語). Chemistry – A European Journal 17 (2): 418–428. doi:10.1002/chem.201002366. ISSN 0947-6539. PMID 21207554.
- ^ Aubert, Corinne; Fensterbank, Louis; Garcia, Pierre; Malacria, Max; Simonneau, Antoine (2011-03-09). “Transition Metal Catalyzed Cycloisomerizations of 1, n -Allenynes and -Allenenes” (英語). Chemical Reviews 111 (3): 1954–1993. doi:10.1021/cr100376w. ISSN 0009-2665. PMID 21391568.
- ^ Krause, Norbert; Winter, Christian (2011-03-09). “Gold-Catalyzed Nucleophilic Cyclization of Functionalized Allenes: A Powerful Access to Carbo- and Heterocycles” (英語). Chemical Reviews 111 (3): 1994–2009. doi:10.1021/cr1004088. ISSN 0009-2665. PMID 21314182.
- ^ a b c Sydnes, Leiv K. (2003-04-01). “Allenes from Cyclopropanes and Their Use in Organic SynthesisRecent Developments” (英語). Chemical Reviews 103 (4): 1133–1150. doi:10.1021/cr010025w. ISSN 0009-2665. PMID 12683779.
- ^ a b c Brummond, Kay; DeForrest, Jolie (March 2007). “Synthesizing Allenes Today (1982-2006)” (英語). Synthesis 2007 (6): 795–818. doi:10.1055/s-2007-965963. ISSN 0039-7881.
- ^ a b c Yu, Shichao; Ma, Shengming (2011). “How easy are the syntheses of allenes?” (英語). Chemical Communications 47 (19): 5384–5418. doi:10.1039/C0CC05640E. ISSN 1359-7345. PMID 21409186.
- ^ a b c Tejedor, David; Méndez-Abt, Gabriela; Cotos, Leandro; García-Tellado, Fernando (2013). “Propargyl Claisen rearrangement: allene synthesis and beyond” (英語). Chem. Soc. Rev. 42 (2): 458–471. doi:10.1039/C2CS35311C. ISSN 0306-0012. PMID 23034723.
- ^ Skattebøl, Lars; Nilsson, Martin; Lindberg, Bengt; McKay, James; Munch-Petersen, Jon (1963). “The Synthesis of Allenes from 1,1-Dihalocyclopropane Derivatives and Alkyllithium.” (英語). Acta Chemica Scandinavica 17: 1683–1693. doi:10.3891/acta.chem.scand.17-1683. ISSN 0904-213X.
- ^ Moore, William R.; Ward, Harold R. (December 1962). “The Formation of Allenes from gem-Dihalocyclopropanes by Reaction with Alkyllithium Reagents 1,2” (英語). The Journal of Organic Chemistry 27 (12): 4179–4181. doi:10.1021/jo01059a013. ISSN 0022-3263.
- ^ Fedoryński, Michał (2003-04-01). “Syntheses of gem -Dihalocyclopropanes and Their Use in Organic Synthesis” (英語). Chemical Reviews 103 (4): 1099–1132. doi:10.1021/cr0100087. ISSN 0009-2665. PMID 12683778.
- ^ Kurti, Laszlo (2005). Strategic Applications of Named Reactions in Organic Synthesis : Background and Detailed Mechanisms.. Barbara Czako. Burlington: Elsevier Science. pp. 758. ISBN 978-0-08-057541-4. OCLC 850164343
- ^ Shi, Min; Shao, Li-Xiong; Lu, Jian-Mei; Wei, Yin; Mizuno, Kazuhiko; Maeda, Hajime (2010-10-13). “Chemistry of Vinylidenecyclopropanes” (英語). Chemical Reviews 110 (10): 5883–5913. doi:10.1021/cr900381k. ISSN 0009-2665. PMID 20518460.
- ^ Ireland, Robert E.; Mueller, Richard H.; Willard, Alvin K. (May 1976). “The ester enolate Claisen rearrangement. Stereochemical control through stereoselective enolate formation” (英語). Journal of the American Chemical Society 98 (10): 2868–2877. doi:10.1021/ja00426a033. ISSN 0002-7863.
- ^ Kurtz, Kimberly C.M.; Frederick, Michael O.; Lambeth, Robert H.; Mulder, Jason A.; Tracey, Michael R.; Hsung, Richard P. (April 2006). “Synthesis of chiral allenes from ynamides through a highly stereoselective Saucy–Marbet rearrangement” (英語). Tetrahedron 62 (16): 3928–3938. doi:10.1016/j.tet.2005.11.087.
- ^ Mukai, Chisato; Kobayashi, Minoru; Kubota, Shoko; Takahashi, Yukie; Kitagaki, Shinji (March 2004). “Construction of Azacycles Based on Endo-Mode Cyclization of Allenes” (英語). The Journal of Organic Chemistry 69 (6): 2128–2136. doi:10.1021/jo035729f. ISSN 0022-3263. PMID 15058962.
- ^ Mukai, Chisato; Ohta, Masaru; Yamashita, Haruhisa; Kitagaki, Shinji (October 2004). “Base-Catalyzed Endo-Mode Cyclization of Allenes: Easy Preparation of Five- to Nine-Membered Oxacycles” (英語). The Journal of Organic Chemistry 69 (20): 6867–6873. doi:10.1021/jo0488614. ISSN 0022-3263. PMID 15387613.
- ^ a b Pasto, Daniel J. (January 1984). “Recent developments in allene chemistry” (英語). Tetrahedron 40 (15): 2805–2827. doi:10.1016/S0040-4020(01)91289-X.
- ^ Ma, Shengming (2009-10-20). “Electrophilic Addition and Cyclization Reactions of Allenes” (英語). Accounts of Chemical Research 42 (10): 1679–1688. doi:10.1021/ar900153r. ISSN 0001-4842. PMID 19603781.
- ^ Yu, Shichao; Ma, Shengming (2012-03-26). “Allenes in Catalytic Asymmetric Synthesis and Natural Product Syntheses” (英語). Angewandte Chemie International Edition 51 (13): 3074–3112. doi:10.1002/anie.201101460. PMID 22271630.
- ^ a b Ma, Shengming (2005-07-01). “Some Typical Advances in the Synthetic Applications of Allenes” (英語). Chemical Reviews 105 (7): 2829–2872. doi:10.1021/cr020024j. ISSN 0009-2665. PMID 16011326.
- ^ Fleming, Ian (2010). Molecular orbitals and organic chemical reactions (Reference ed.). Hoboken, N.J.: Wiley. pp. 526. ISBN 978-0-470-68949-3. OCLC 607520014
- ^ Brandsma, L. (2004). Synthesis of acetylenes, allenes and cumulenes : methods and techniques. H. D. Verkruijsse (1st ed.). Amsterdam: Elsevier. ISBN 978-0-12-125751-4. OCLC 162570992
- ^ Ma, Shengming (2006-01-01). “Transition-metal-catalyzed reactions of allenes”. Pure and Applied Chemistry 78 (2): 197–208. doi:10.1351/pac200678020197. ISSN 1365-3075.
- ^ Bates, Roderick W.; Satcharoen, Vachiraporn (2002-03-06). “Nucleophilic transition metal based cyclization of allenes”. Chemical Society Reviews 31 (1): 12–21. doi:10.1039/b103904k. PMID 12108979.
- ^ Cherney, Emily C.; Green, Jason C.; Baran, Phil S. (2013-08-19). “Synthesis of ent -Kaurane and Beyerane Diterpenoids by Controlled Fragmentations of Overbred Intermediates” (英語). Angewandte Chemie International Edition 52 (34): 9019–9022. doi:10.1002/anie.201304609. PMC 3814173. PMID 23861294.
- ^ Wiesner, K. (August 1975). “On the stereochemistry of photoaddition between α,β-unsaturated ketones and olefins” (英語). Tetrahedron 31 (15): 1655–1658. doi:10.1016/0040-4020(75)85082-4.
- ^ Rahman, W.; Kuivila, Henry G. (March 1966). “Synthesis of Some Alkylidenecyclopropanes from Allenes 1” (英語). The Journal of Organic Chemistry 31 (3): 772–776. doi:10.1021/jo01341a029. ISSN 0022-3263.
- ^ Krause, Norbert; Hoffmann‐Röder, Anja (2004). “18. Allenic Natural Products and Pharmaceuticals”. In Krause, Norbert; Hashmi, A. Stephen K.. Modern Allene Chemistry. pp. 997–1040. doi:10.1002/9783527619573.ch18. ISBN 9783527619573
- ^ Otsuka, Sei; Nakamura, Akira "Acetylene and allene complexes: their implication in homogeneous catalysis" Advances in Organometallic Chemistry 1976, volume 14, pp. 245-83. doi:10.1016/S0065-3055(08)60654-1.
- ^ Bhagwat, M. M.; Devaprabhakara, D. (1972). “Selective hydrogenation of allenes with chlorotris-(triphenylphosphine) rhodium catalyst”. Tetrahedron Letters 13 (15): 1391–1392. doi:10.1016/S0040-4039(01)84636-0.
- ^ “Nomenclature for cyclic organic compounds with contiguous formal double bonds (the δ-convention)”. Pure Appl. Chem. 60: 1395-1401. (1988). doi:10.1351/pac198860091395.
関連書籍
[編集]- Brummond, Kay M. (editor). Allene chemistry (special thematic issue). Beilstein Journal of Organic Chemistry 7: 394–943.





