臭化タングステン(VI)
表示
| 臭化タングステン(VI) | |
|---|---|
| |
別称
| |
| 識別情報 | |
| CAS登録番号 | 13701-86-5 |
| PubChem | 14440251 |
| ChemSpider | 103871330 |
| |
| |
| 特性 | |
| 化学式 | WBr6 |
| モル質量 | 663.264 g/mol |
| 外観 | 暗灰色固体 |
| 密度 | 5.32 g/cm3 |
| 融点 |
232 °C, 505 K, 450 °F (分解) |
| 水への溶解度 | 加水分解 |
| 溶解度 | エタノール、ジエチルエーテル、二硫化炭素、アンモニアに可溶[1] |
| 構造 | |
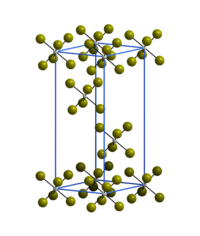
| 結晶構造 | 六方晶系 |
| 空間群 | R3 |
| 格子定数 (a, b, c) | a = 6.39 Å Å |
| 関連する物質 | |
| その他の陰イオン | フッ化タングステン(VI) 塩化タングステン(VI) |
| 関連物質 | 臭化タングステン(V) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
臭化タングステン(VI)(Tungsten hexabromide)は、タングステンと臭素からなる化合物で、化学式はWBr6である。air-sensitiveな濃い灰色の粉末で、200℃以上で臭化タングステン(V)(WBr5)と臭素に分解する[1][2]。
合成と反応
[編集]
主に、金属タングステンと臭素を窒素大気中100℃以上に加熱して反応させることで合成する[1][3]。
- W + 3 Br2 → WBr6
他には、ヘキサカルボニルタングステンと臭素を室温で反応させ、一酸化炭素を遊離させる方法がある[4]。三臭化ホウ素と塩化タングステン(VI)のメタセシス反応でも得られる[5]。
臭化タングステン(VI)は、上昇温度中、アンチモン元素による還元により、順次、WBr6、WBr4、W4Br10、W5Br12が生成し、最終的に350℃でWBr2ができる。この反応で、副産物として三臭化アンチモンが生成する[4][6]。これらの臭化物は、160℃での臭素による酸化で、六臭化物に戻る[7]。
臭化タングステン(VI)は、水中で加水分解し、臭素を遊離して酸化タングステン(V)を生成する[1]。
WOBr4は、臭化タングステン(VI)と酸化タングステン(VI)の反応で生成する[7]。
- 2 WBr6 + WO3 → 3 WOBr4
臭化タングステン(VI)の三方晶結晶構造は、孤立したWBr6八面体からなり、α-WCl6と同じ構造である[3]。
出典
[編集]- ^ a b c d Herbert A. Schaffer; Edgar F. Smith (1896). “Tungsten Hexabromide” (英語). Journal of the American Chemical Society 18 (12): 1098–1100. doi:10.1021/ja02098a015.
- ^ O. Kaposi; A. Popović; J. Marsel (1977). “Mass spectrometric studies of tungsten bromides and oxybromides” (英語). Journal of Inorganic and Nuclear Chemistry 39 (10): 1809–1815. doi:10.1016/0022-1902(77)80206-6.
- ^ a b W. Willing; U. Müller (1987). “Wolframhexabromid” (ドイツ語). Acta Crystallogr. C 43 (7): 1425–1426. Bibcode: 1987AcCrC..43.1425W. doi:10.1107/S0108270187091625.
- ^ a b M. Ströbele; H. -J. Meyer (2012). “Low-temperature preparation of tungsten halide clusters: Crystal structure of the adduct W5Br12 · SbBr3” (英語). Russian Journal of Coordination Chemistry 38 (3): 178–182. doi:10.1134/S1070328412020078.
- ^ P. M. Druce; M. F. Lappert (1971). “Boron halides as reagents in inorganic syntheses. Part II. A further general method for the preparation of anhydrous bromides and iodides: halogen exchange reactions” (英語). Journal of the Chemical Society A: Inorganic, Physical, Theoretical: 3595–3599. doi:10.1039/J19710003595.
- ^ Markus Ströbele; H.-Jürgen Meyer (2012). “W4Br10 Cluster Intermediates in the Solid State Nucleation of W6Br12” (英語). Zeitschrift für anorganische und allgemeine Chemie 638 (6): 945–949. doi:10.1002/zaac.201200010.
- ^ a b P.C. Crouch; G.W.A. Fowles; R.A. Walton (1970). “The high yield synthesis of the tungsten (VI) oxyhalides WOCl4, WOBr4 and WO2Cl2 and some observations on tungsten(VI) bromide and tungsten(V) chloride” (英語). Journal of Inorganic and Nuclear Chemistry 32 (1): 329–333. doi:10.1016/0022-1902(70)80475-4.
