「翻訳 (生物学)」の版間の差分
→関連項目: 関連する複数のウィキリンクを追加, +tmp: {{遺伝子発現}} {{Portal bar|生物学}} +cat: Category:細胞プロセス |
m 解消済み仮リンクアミノアシルtRNAを内部リンクに置き換えます (本次bot作業已進行53.5%) |
||
| (2人の利用者による、間の3版が非表示) | |||
| 1行目: | 1行目: | ||
[[File:Translation - Initiation & Elongation.svg|thumb|翻訳の開始と伸長段階を簡単に解説する。RNA塩基、リボソーム、tRNA、アミノ酸を拡大している。<br />(上) 開始段階: メチオニンとそのアンチコドンを輸送するイニシエーターtRNAが、リボソームのP部位でmRNAの開始コドンAUGと遭遇する。<br />(下) 伸長段階: リボソームが5'から3'方向に移動する。そのとき、ペプチド結合でP部位のtRNAに結合したアミノ酸がA部位のtRNAに結合し、mRNA上のコドンに基づいて長いアミノ酸鎖を合成する。リボソームが移動する際、tRNAはEサイトを通ってリボソームから離れ、新しいtRNAがA部位に入って、アミノ酸鎖の伸長を継続する。]] |
|||
{{出典の明記|date=2011-10}} |
|||
[[File:Protein translation.gif|thumb|250px|翻訳 (生物学)]] |
|||
[[File:Translation drawing- Carina Huerta.svg|thumb|翻訳の3つの段階を示す。<br />①開始 (Initiation): ポリメラーゼがDNA鎖に結合してから、リボソーム小サブユニットがDNAに結合するまで。<br />②伸長 (Elongation): 大サブユニットが結合すると伸長が開始する。<br />③終止 (Termination): 伸長の過程が終了する。]] |
|||
[[分子生物学]]などにおいては、'''翻訳'''(ほんやく、Translation)とは、[[伝令RNA|mRNA]]の情報に基づいて、[[タンパク質生合成|タンパク質を合成する反応]]を指す。本来は細胞内での反応を指すが、細胞によらずに同様の反応を引き起こす系([[無細胞タンパク質合成系|無細胞翻訳系]])も開発されている。 |
|||
[[分子生物学]]や[[遺伝学]]において、'''翻訳'''(ほんやく、{{Lang-en-short|translation}})とは、[[細胞質]]または[[小胞体]]で[[リボソーム]]がタンパク質を合成する過程であり、これは細胞の[[細胞核|核]]で[[DNA]]を元に[[RNA]]が合成される[[転写 (生物学)|転写]]に続くものである。この一連の過程は、[[遺伝子発現]]と呼ばれる。 |
|||
== 概説 == |
== 概説 == |
||
翻訳では、[[伝令RNA|メッセンジャーRNA(mRNA)]]が核の外にあるリボソームで解読され、特定の[[アミノ酸]]鎖([[ポリペプチド]]ともよぶ)が作られる。その後、ポリペプチドは[[活性化エネルギー|活性]][[タンパク質]]に[[タンパク質フォールディング|折り畳まれ]]、[[細胞]]内でその役割を果たす。[[リボソーム]]は、mRNA[[コドン]]に[[相補性 (分子生物学)|相補的]]なtRNA[[アンチコドン]]配列の結合を導くことによって解読を進める。[[転移RNA|転移RNA(tRNA)]]は特定のアミノ酸を輸送し、mRNAがリボソームを通過して「読み取られる」ときにそのアミノ酸がポリペプチドに連結される。 |
|||
翻訳は細胞が最も多くエネルギーを使うことの一つである{{要出典|date=2011-10}}。盛んに増殖する細胞内では、細胞内の全エネルギーの80%と、乾燥重量で50%にのぼる物質がタンパク質合成に関与している{{要出典|date=2011-10}}。1タンパク質合成のためには、100を超えるタンパク質とmRNAが調和して働くことが必要である{{要出典|date=2011-10}}。 |
|||
翻訳は次の3つの段階で進行する。 |
|||
# '''開始''': [[生物学的標的|標的]]<nowiki/>mRNAの周囲にリボソームが集結する。最初のtRNAがmRNAの[[開始コドン]]に結合する。 |
|||
生物の[[遺伝子]]がもっている情報は、[[デオキシリボ核酸|DNA]]の[[塩基配列]]の形で[[細胞]]内に保持されているが、その[[情報]]の一部は生体内で合成されるべき[[タンパク質]]の[[アミノ酸]]配列を規定したものである。DNAのもつ情報は[[転写 (生物学)|転写]]と呼ばれる過程によってまず[[伝令RNA|mRNA]]の形に変換される。そして、mRNAのもつ[[塩基配列]][[情報]]に則して、[[リボソーム]]内で[[アミノ酸]]が重合しポリペプチド鎖が生合成される。{{要出典範囲|このポリペプチド(タンパク質)の合成過程が翻訳と呼ばれる|date=2011-10}}。 |
|||
# '''伸長''': {{Ill2|真核生物のリボソーム小サブユニット (40S)|en|Eukaryotic small ribosomal subunit (40S)|label=リボソーム小サブユニット}}によって確認された(''収容''<!-- accommodation -->)tRNAは、運んだアミノ酸を{{Ill2|真核生物のリボソーム大サブユニット (60S)|en|Eukaryotic large ribosomal subunit (60S)|label=リボソーム大サブユニット}}に移し、その前に収容されたアミノ酸に結合する(''ペプチド転移''<!-- transpeptidation -->)。その後、リボソームは次のmRNAコドンに移動してプロセスを継続し(''転座''<!-- translocation -->)、アミノ酸の鎖を形成する。 |
|||
# '''終結''': [[終止コドン]]に到達すると、リボソームはポリペプチドを放出する。リボソーム複合体はそのまま残り、次に翻訳されるmRNAへ移動する。 |
|||
[[原核生物]]([[細菌]]および[[古細菌]])の場合、翻訳は[[細胞質基質]]で行われ、[[リボソーム]]の大サブユニットと小サブユニットがmRNAに結合する。[[真核生物]]の場合、翻訳は[[細胞質]]内または[[小胞体]]の膜を越えて{{Ill2|タンパク質局在化|en|Protein targeting|label=共翻訳転座}}と呼ばれる過程で行われる。共翻訳転座では、リボソームとmRNAの複合体全体が[[粗面小胞体]](ER)の外膜に結合し、新しいタンパク質が合成されてER内に放出される。新しく作られたポリペプチドは、将来の[[小胞]]輸送や細胞外への[[分泌]]のためにER内に貯蔵されるか、または直ちに分泌される。 |
|||
転移RNA(tRNA)、リボソームRNA(rRNA)、核内低分子RNA(snRNA)など、多くの種類の転写RNAはタンパク質に翻訳されない。 |
|||
==翻訳に重要な構成要素== |
|||
{{出典の明記|section=1|date=2011-10}} |
|||
#mRNA:<!--先にも述べたとおり、-->これにはDNAから転写した翻訳に必要な情報があり、3ヌクレオチド単位(コドンと呼ぶ)で一つのアミノ酸を指定する。 |
|||
#[[運搬RNA|tRNA]]:mRNAのコドンと、ポリペプチドに付加されるアミノ酸とをつなぐアダプターとなる分子。アミノアシルtRNAはtRNAの3'末端にアミノ酸が結合したもの。 |
|||
#[[アミノアシルtRNAシンセテース|アミノアシルtRNA合成酵素]]:アミノ酸と、各アミノ酸に対応する特異的tRNAを結合させる。 |
|||
#リボソーム:タンパク質の合成はリボソームで行われる。mRNAのコドンに対応するtRNAを引きよせ、アミノ酸を伸長中のポリペプチド鎖に結合させる。リボソームは2つのサブユニットからなる。内部には |
|||
#*'''A部位''':アミノアシルtRNAの結合 |
|||
#*'''P部位''':ペプチド結合の形成とtRNAの離脱 |
|||
#*'''E部位''':ポリペプチド鎖から解放されたtRNAの結合 |
|||
という3つのtRNA結合部位が存在し、'''リボソームがmRNA上を5'→3'方向に動いて'''アミノアシルtRNAがA部位→P部位と入れ替わる反応の際に、ポリペプチド鎖が伸長されていく。 |
|||
多くの[[抗生物質]]は、翻訳を阻害することで働く。たとえば、{{Ill2|アニソマイシン|en|Anisomycin}}、[[シクロヘキシミド]]、[[クロラムフェニコール]]、[[テトラサイクリン]]、[[ストレプトマイシン]]、[[エリスロマイシン]]、および[[ピューロマイシン]]がある。細菌などの原核生物のリボソームは真核生物のリボソームと構造が異なるため、抗生物質は真核生物の[[宿主]]細胞に害を与えることなく、[[感染]]した細菌を特異的に標的にすることができる。 |
|||
==細菌の翻訳== |
|||
{{See also|細菌の翻訳}} |
|||
翻訳に関する機構も[[転写 (生物学)|転写]]と同様、[[大腸菌]]が基本的なフォーマットになっている。[[真核生物]]や[[古細菌]]における翻訳も基本は同じだが細部が異なる。翻訳には以下の3ステップが存在する。 |
|||
#開始:リボソームにmRNAが捕まる。mRNA上の開始コドン(一般的にはAUG)に対応する[[運搬RNA|tRNA]]がリボソーム上でmRNAと水素結合で対応する。 |
|||
#伸長:mRNAのコドンに対応するアミノ酸が次々とペプチド結合で結合される。 |
|||
#終結:mRNAのストップコドンに至ると、開放因子と呼ばれるタンパク質がやってきて転写は終了し、ポリペプチド鎖がリボソームから開放される。合成されたポリペプチド鎖は、[[シャペロン]]分子などの助けを借りて折り畳まれた構造をとることや、切断・付加などの[[翻訳後修飾]]を受けることがタンパク質の正常な機能には必要となる。 |
|||
個々のステップの詳細については以下に述べる。 |
|||
==基本的な機構== |
|||
===翻訳開始=== |
|||
{{further|細菌の翻訳|{{ill2|古細菌の翻訳|en|Archaeal translation}}|真核生物の翻訳}} |
|||
大腸菌の翻訳開始はリボソームがサブユニットに解離して、mRNAにリボソーム小サブユニット (30S) (Sはスベドベリ (Svedberg) の略で、遠心器にかけたときの沈降速度を表す単位である。Sの値が大きいほど沈降速度は速い)が結合することから始まる。mRNAのリボソーム結合部位は『'''[[シャイン・ダルガノ配列|Shine-Dalgarno配列]]'''』としてよく知られており、その配列は以下の通りである。 |
|||
[[Image:Protein translation.gif|thumb|300px|リボソームがタンパク質を翻訳して[[小胞体]]に分泌する活動を示すアニメーション。アミノ酸を輸送するtRNAは濃い青色で表されている。]] |
|||
*5'-AGGAGGU-3' |
|||
[[Image:TRNA-Phe yeast 1ehz.png|thumb|[[転移RNA|tRNA]]の三次構造。<span style="color:#E4D00A;">''CCA尾部''</span>は黄色、<span style="color:purple;">''アクセプターステム''</span>は紫、<span style="color:orange;">''可変ループ''</span>はオレンジ、<span style="color:red;">''Dアーム''</span>は赤、<span style="color:blue;">''アンチコドンアームは青''</span>、アンチコドンは黒、<span style="color:green;">''Tアーム''</span>は緑で表示。|246x246px]] |
|||
この配列と16S rRNAが塩基対を形成して、リボソーム小サブユニットが結合できるようになると考えられている。Shine-Dalgarno配列は絶対的なものではなく、'''比較的似た配列でも認識される'''。 |
|||
タンパク質を生成する基本的な過程は、タンパク質の末端にアミノ酸を1つずつ付加することである。この働きは、[[リボソーム]]によって行われる<ref name="PTC">{{cite journal | vauthors = Tirumalai MR, Rivas M, Tran Q, Fox GE | title = The Peptidyl Transferase Center: a Window to the Past | journal = Microbiol Mol Biol Rev | volume = 85 | issue = 4 | pages = e0010421 | date = November 2021 | pmid = 34756086 | pmc = 8579967 | doi = 10.1128/MMBR.00104-21}}</ref>。リボソームは、小サブユニットと大サブユニットの2つのサブユニットから構成されている。これらのサブユニットは、mRNAがタンパク質に翻訳される前に一体となり、翻訳が行われてポリペプチドが生成される場所を提供する。ポリペプチドに付加するアミノ酸の種類と配列は[[mRNA]]分子によって決定される<ref>{{cite book | vauthors = Brooker RJ, Widmaier EP, Graham LE, Stiling PD |title=Biology | publisher=McGraw Hill Education|year=2014 | edition = Third international student |isbn=978-981-4581-85-1 |location= New York, NY |pages=249 }}</ref>。付加された各アミノ酸は、mRNA上の3連ヌクレオチド配列(トリプレットまたは三連符という)と符合する。このようなトリプレットの組み合わせ可能なそれぞれについて、対応するアミノ酸が認められる。鎖に追加された連続したアミノ酸は、mRNAの連続したヌクレオチド・トリプレットに符合する。このようにして、mRNA鎖のヌクレオチド配列が鋳型となり、生成されるアミノ酸鎖のアミノ酸の配列を決定する<ref>{{cite book | last = Neill | first = Campbell | name-list-style = vanc | title = Biology | edition = Fourth | publisher = The Benjamin/Cummings Publishing Company | year = 1996 | isbn = 0-8053-1940-9 | pages = 309–310 }}</ref>。アミノ酸の付加はペプチドの[[C末端]]で起こるので、翻訳は[[アミン]]から[[カルボキシル]]へ向かうと呼ばれる<ref>{{cite book | last = Stryer | first = Lubert | name-list-style = vanc | title = Biochemistry | edition = Fifth | publisher = [[:en:W. H. Freeman and Company|W. H. Freeman and Company]] | year = 2002 | isbn = 0-7167-4684-0 | page = 826 }}</ref>。 |
|||
[[リボヌクレオチド]]の配列としてコード化された[[遺伝暗号|遺伝情報]]は、mRNAによって[[染色体]]からリボソームへ送られる。リボヌクレオチドは、コドンと呼ばれる[[ヌクレオチド]]・トリプレットの配列として翻訳機構によって読み取られる。これらのトリプレットはそれぞれ特定の[[アミノ酸]]をコードしている。 |
|||
Shine-Dalgarno配列に結合したリボソーム小サブユニットは遺伝子の開始コドン(AUG:[[メチオニン]]に該当)までmRNA上を移動し、メチオニン-tRNAが開始コドンに結合する。大腸菌の開始コドンに使用されるメチオニンは、水素原子の部分がホルミル化(-COH基が結合)して'''''N''-ホルミルメチオニン''' (''N''-formylmethionine) となる。このアミノ酸がついた開始tRNAを'''fMet-tRNA<sub>i</sub><sup>fMet</sup>'''で表す。 |
|||
[[リボソーム]]分子は、このコードを特定のアミノ酸の配列へ翻訳する。リボソームは、[[リボソームRNA|rRNA]]とタンパク質からなる多サブユニット構造体であり、アミノ酸をタンパク質に組み立てる「工場」の役割を担っている。tRNAは、アミノ酸をリボソームへ輸送する小さな[[ノンコーディングRNA|ノンコーディングRNA鎖]](74-93ヌクレオチド)であり、アミノ酸が結合する部位と、アンチコドンと呼ばれる部位を持っている。アンチコドンはRNAのトリプレットで、積荷の[[アミノ酸]]をコードするmRNAトリプレットに相補的になっている。 |
|||
mRNA、リボソーム小サブユニット、fMet-tRNA<sub>i</sub><sup>fMet</sup>の結合した複合体を'''開始複合体'''と呼ぶ。なお、これらの反応は、'''翻訳開始因子''' (translation initiation factor) (IF1,2,3) というタンパク質によって触媒される。翻訳開始の最終段階、つまりポリペプチド鎖が形成される直前にリボソーム大サブユニット (50S) が開始複合体に結合する(その際、[[グアノシン三リン酸]]のリン酸が外れて、エネルギーを供給する)。この時に、翻訳の反応が可能になる70Sリボソームとなる。 |
|||
[[酵素]]である[[アミノアシルtRNA合成酵素]]は、特定の[[転移RNA|tRNA]]と、そのアンチコドン配列に対応する[[アミノ酸]]との結合を[[触媒]]する。この反応の産物は[[アミノアシルtRNA]]である。[[細菌]]の場合、このアミノアシルtRNAは転写因子[[EF-Tu]]によってリボソームへ輸送され、そこでmRNAコドンと特定のtRNAアンチコドンが相補的[[塩基対]]を形成することで符合する。アミノアシルtRNA合成酵素が誤ったアミノ酸とtRNAとの対合を形成すると、誤った結合<!-- mischarged -->のアミノアシルtRNAが生成し、その結果、タンパク質の対応する位置に不適切なアミノ酸が生じる可能性がある。このような遺伝暗号の「誤訳」は、ほとんどの生物で低いレベルで自然に起こるが<ref>{{cite journal | vauthors = Moghal A, Mohler K, Ibba M | title = Mistranslation of the genetic code | journal = FEBS Letters | volume = 588 | issue = 23 | pages = 4305–10 | date = November 2014 | pmid = 25220850 | pmc = 4254111 | doi = 10.1016/j.febslet.2014.08.035 }}</ref>、ある種の細胞環境では、mRNA解読の許容範囲が増して細胞の利益につながる場合もある。 |
|||
大サブユニットが会合した際、Shine-Dalgarno配列と開始コドンの絶妙な距離により、先に述べたリボソームのP部位に開始コドン(およびそこに結合したホルミルメチオニン-tRNA)が来るようになる。なお、開始コドンが理想的な距離からずれた場合、翻訳速度が遅くなってしまう。 |
|||
リボソームには、tRNAと結合する部位が2つある。それぞれ、アミノアシル部位(Aと略す)、ペプチジル部位/出口部位(P/Eと略す)である。リボソームはmRNAの3'末端に向かって移動するため、mRNAに対して3つの部位は5'から3'へE-P-Aの順で方向付いている(最初の図を参照)。{{Ill2|A部位|en|A-site}}では、入ってくるtRNAをmRNA上の相補的なコドンと結合する。{{Ill2|P部位|en|P-site|label=P/E部位}}では、そのtRNAと成長中のポリペプチド鎖を保持する。アミノアシルtRNAがmRNA上の対応するコドンと最初に結合するのはA部位で行われる。次に、A部位にあるtRNAのアミノ酸と、P/E部位にある充填tRNA(''charged tRNA'')のアミノ酸との間に[[ペプチド結合]]が形成される。成長するポリペプチド鎖はA部位のtRNAに転移する。P/E部位のアミノ酸を持たないtRNAが移動して転座<!-- translocation -->が起こる。A部位にあったtRNAは、ポリペプチド鎖と結合した状態でP/E部位に移動し、そのtRNAは離れて別のアミノアシルtRNAがA部位に入り、この過程が繰り返される<ref>{{cite book|last=Griffiths|first=Anthony | name-list-style = vanc |title=Introduction to Genetic Analysis|year=2008|publisher=W.H. Freeman and Company|location=New York|isbn=978-0-7167-6887-6|pages=335–339|edition=9th|chapter=9}}</ref>。 |
|||
====細菌の翻訳開始因子==== |
|||
リボソーム小サブユニットから始まる、細菌の翻訳に関する反応は、先に述べたとおりIF1、IF2、IF3という3つの翻訳開始因子が触媒する。 |
|||
*'''IF1''':小サブユニットのA部位にtRNAが結合しないようにする。小サブユニットのゆくゆくA部位の一部になる部位に直接結合する。 |
|||
*'''IF2''':[[GTPアーゼ]](グアノシン三リン酸 (GTP) に結合し加水分解する酵素)の一種。小サブユニット、IF1、fMet-tRNA<sub>i</sub><sup>fMet</sup>と相互作用して、次のステップであるfMet-tRNA<sub>i</sub><sup>fMet</sup>と小サブユニットの結合を手助けし、ほかのアミノアシルtRNAが結合するのを防ぐ。IF1に結合する。fMet-tRNA<sub>i</sub><sup>fMet</sup>と接触できるようにA部位からP部位まで伸びる。大サブユニット結合時にGTPを加水分解し、IF1とともに遊離する。 |
|||
*'''IF3''':小サブユニットと大サブユニットの会合や、小サブユニットとアミノアシルtRNAの結合を防ぐ。また翻訳サイクルの終わりに大小サブユニットが解離するのを助ける。小サブユニットの将来E部位になる部分を占有する。 |
|||
新しいアミノ酸が鎖に付加され、tRNAがリボソームから細胞質へ遊離した後、{{Ill2|トランスロカーゼ|en|Translocase|label=トランスロカーゼ(転移酵素)}}である[[EF-G]]([[細菌]]の場合)または{{Ill2|EEF2|en|EEF2|label=a/eEF-2}}([[真核生物]]および[[古細菌]]の場合)に結合した[[グアノシン三リン酸|グアノシン三リン酸(GTP)]]の加水分解で供給されるエネルギーによって、リボソームは{{Ill2|3'末端|en|3' end}}の方向へ1コドン移動する。タンパク質の翻訳に必要なエネルギーはかなり多い。''n''個のアミノ酸を含むタンパク質の場合、翻訳に必要な[[高エネルギーリン酸結合]]の数は4''n''-1個である<ref>{{Cite web|title=Computational Analysis of Genomic Sequences utilizing Machine Learning|url=https://scholar.googleusercontent.com/scholar?q=cache:B6iUmrNgupYJ:scholar.google.com/+For+a+protein+containing+n+amino+acids,+the+number+of+high-energy+phosphate+bonds+required+to+translate+it+is+4n-1&hl=en&as_sdt=0,5|access-date=2022-01-12|website=scholar.googleusercontent.com}}</ref>。翻訳速度はさまざまで、原核細胞は(1秒間に17-21個のアミノ酸残基)真核細胞(1秒間に6-9個のアミノ酸残基)よりもかなり速い<ref>{{cite journal | vauthors = Ross JF, Orlowski M | title = Growth-rate-dependent adjustment of ribosome function in chemostat-grown cells of the fungus Mucor racemosus | journal = Journal of Bacteriology | volume = 149 | issue = 2 | pages = 650–3 | date = February 1982 | pmid = 6799491 | pmc = 216554 | doi = 10.1128/JB.149.2.650-653.1982 }}</ref>。 |
|||
3つの開始因子が結合した小サブユニットは、mRNA、開始tRNAとに結合できる。順序はどちらが先でもよい。 |
|||
一般に、リボソームは正確でプロセッシブ(mRNAに沿って連続してアミノ酸鎖を合成すること)な機械と考えられているが、翻訳プロセスは誤りを前提としていて、tRNAが誤ったコドンに結合したり誤ったアミノ酸に結合するために、誤ったタンパク質の合成や翻訳の早期断念につながる可能性がある<ref>{{cite journal | vauthors = Ou X, Cao J, Cheng A, Peppelenbosch MP, Pan Q | title = Errors in translational decoding: tRNA wobbling or misincorporation? | journal = PLOS Genetics | volume = 15 | issue = 3 | pages = 2979–2986 | date = March 2019 | pmid = 21930591 | pmc = 3158919 | doi = 10.1371/journal.pgen.1008017 | doi-access = free }}</ref>。タンパク質の合成における誤り率は、実験条件にもよるが、1/10<sup>5</sup><!-- 1/10**5 -->から1/10<sup>3</sup><!-- 1/10**3 -->の間でアミノ酸が誤って取り込まれると推定されている<ref>{{cite journal | vauthors = Wohlgemuth I, Pohl C, Mittelstaet J, Konevega AL, Rodnina MV | title = Evolutionary optimization of speed and accuracy of decoding on the ribosome | journal = Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences | volume = 366 | issue = 1580 | pages = 2979–86 | date = October 2011 | pmid = 30921315 | pmc = 6438450 | doi = 10.1098/rstb.2011.0138 }}</ref>。一方、翻訳を早期に断念する割合は、翻訳されたコドンあたり10<sup>−4</sup><!-- 10**-4 -->イベントのオーダーであると推定されている<ref>{{cite journal | vauthors = Sin C, Chiarugi D, Valleriani A | title = Quantitative assessment of ribosome drop-off in E. coli | journal = Nucleic Acids Research | volume = 44 | issue = 6 | pages = 2528–37 | date = April 2016 | pmid = 26935582 | pmc = 4824120 | doi = 10.1093/nar/gkw137 }}</ref>。{{Ill2|アミノアシルトランスフェラーゼ|en|Aminoacyltransferase}}によって、正しいアミノ酸と正しい[[転移RNA|転移RNA(tRNA)]]が[[共有結合結晶|共有結合]]する。アミノ酸はカルボキシル基によってtRNAの3'OHに[[エステル結合]]する。アミノ酸が結合したtRNAは「チャージしている(''charged'')」と呼ばれる。タンパク質合成の開始過程では、{{Ill2|開始因子|en|Initiation factor}}(IF)の助けを借りて、リボソーム小サブユニットがmRNAの5'末端に結合する。細菌および少数種の古細菌の場合、開始には、[[シャイン・ダルガノ配列]]と呼ばれるmRNA上のプリンに富む開始配列の認識を伴う。シャイン・ダルガノ配列は、30Sリボソームサブユニットの16S rRNA部分の3'末端にある相補的なピリミジンに富む配列と結合する。これらの相補的な配列が結合することによって、30SリボソームサブユニットがmRNAと結合し、開始コドンがP部位の30S部分に配置されるように確実に整列する。mRNAと30Sサブユニットが適切に結合すると、開始因子がイニシエーターtRNA・アミノ酸複合体の[[N-ホルミルメチオニン|fMet]]-tRNAを30SのP部位に輸送する。50Sサブユニットが30Sサブユニットに結合し、活性型70Sリボソームが形成されると開始段階が終了する<ref name="pmid20467902">{{cite journal | vauthors = Nakamoto T | title = Mechanisms of the initiation of protein synthesis: in reading frame binding of ribosomes to mRNA | journal = Molecular Biology Reports | volume = 38 | issue = 2 | pages = 847–55 | date = February 2011 | pmid = 20467902 | doi = 10.1007/s11033-010-0176-1 | s2cid = 22038744 }}</ref>。ポリペプチドの終止は、リボソームのA部位がmRNA上の終止コドン(UAA、UAG、UGA)に占有されたときに起こり、タンパク質の一次構造が形成される。tRNAは通常、終止コドンを認識することも、結合することもできない。その代わりに終止コドンは、リボソームのペプチジルトランスフェラーゼ活性中心<ref name="PTC" />からポリペプチド鎖を加水分解することによって、リボソームとmRNA複合体全体の分解を促す{{Ill2|終結因子|en|Release factor|label=}}というタンパク質(RF1およびRF2)の結合を誘導する<ref>{{cite journal | vauthors = Baggett NE, Zhang Y, Gross CA | title = Global analysis of translation termination in E. coli | journal = PLOS Genetics | volume = 13 | issue = 3 | pages = e1006676 | date = March 2017 | pmid = 28301469 | pmc = 5373646 | doi = 10.1371/journal.pgen.1006676 | veditors = Ibba M }}</ref><ref>{{cite journal | vauthors = Mora L, Zavialov A, Ehrenberg M, Buckingham RH | title = Stop codon recognition and interactions with peptide release factor RF3 of truncated and chimeric RF1 and RF2 from Escherichia coli | journal = Molecular Microbiology | volume = 50 | issue = 5 | pages = 1467–76 | date = December 2003 | pmid = 14651631 | doi = 10.1046/j.1365-2958.2003.03799.x | doi-access = free }}</ref>。ある種の薬物やmRNA上の特殊な配列[[モチーフ (生物学)|モチーフ]]によってリボソーム構造が変化し、終結因子の代わりに、近同族性tRNA<!-- near-cognate tRNAs -->が終止コドンに結合することがある。このような「翻訳リードスルー(''translational readthrough'')」の場合、リボソームが次の終止コドンに遭遇するまで翻訳が継続される<ref name="readthrough">{{cite journal | vauthors = Schueren F, Thoms S | title = Functional Translational Readthrough: A Systems Biology Perspective | journal = PLOS Genetics | volume = 12 | issue = 8 | pages = e1006196 | date = August 2016 | pmid = 27490485 | pmc = 4973966 | doi = 10.1371/JOURNAL.PGEN.1006196 }}</ref>。 |
|||
===ポリペプチド伸長=== |
|||
アミノ酸のついた開始tRNAがP部位に結合した70Sリボソームが完成すると、ポリペプチドの合成が始まる。ポリペプチドの合成には次の重要な反応が起こる必要がある。 |
|||
#P部位にはホルミルメチオニンをつけたtRNAがA部位に2個目のアミノアシルtRNAが結合(P部位にはホルミルメチオニン-tRNAが存在)。 |
|||
#ホルミルメチオニンと2個目のアミノ酸との間に[[ペプチド結合]]が形成される |
|||
#A部位に生じたペプチジルtRNAと、それに結合したmRNAのコドンをP部位に転位 (translocate) する。その後70Sリボソームが動いてE部位のホルミルメチオニンのtRNAが離脱する(その際、GTP→GDP+Piの反応が起きてエネルギーを供給する) |
|||
#A部位は空になり、次のアミノアシルtRNAが結合できるようになる。 |
|||
4.の後は1.に戻るが、P部位には一つ前のアミノアシルtRNAが入っている。この反応が連続して起きることにより、mRNA内の遺伝子がポリペプチド鎖に翻訳され、[[終止コドン]]までこの反応は続いていく。この反応も同様に[[翻訳伸長因子]] ([[EF-Tu]]、EF-Ts、[[EF-G]]) によって触媒される。 |
|||
真核生物、原核生物のいずれにおいても翻訳過程は高度に制御されている。翻訳が制御されると、細胞の代謝や増殖状態と密接に関連する[[タンパク質合成]]の全体的な速度に影響を与える可能性がある。さらに、最近の研究では、遺伝的な相違や、その後のmRNAとしての発現も、RNA特異的に翻訳速度に影響を与える可能性があることが明らかになった<ref name="Cenik2015">{{cite journal | vauthors = Cenik C, Cenik ES, Byeon GW, Grubert F, Candille SI, Spacek D, Alsallakh B, Tilgner H, Araya CL, Tang H, Ricci E, Snyder MP | display-authors = 6 | title = Integrative analysis of RNA, translation, and protein levels reveals distinct regulatory variation across humans | journal = Genome Research | volume = 25 | issue = 11 | pages = 1610–21 | date = November 2015 | pmid = 26297486 | pmc = 4617958 | doi = 10.1101/gr.193342.115 }}</ref>。 |
|||
===細菌の翻訳終結=== |
|||
リボソームがmRNA上を動き、終止コドンがA部位に入ると翻訳の終結が始まる。この時にA部位のアミノアシルtRNAの入る部位に『[[翻訳終結因子]]』と呼ばれるタンパク質が入り込み、翻訳複合体を[[ポリペプチド]]、tRNA、リボソーム、mRNAに解離する。終結因子の種類と役割は以下の通りである。 |
|||
*RF1:UAA、UAG終止コドンのA部位に結合 |
|||
*RF2:UGA、UAA終止コドンのA部位に結合 |
|||
*RF3:RF1、2の補助的な因子 |
|||
ポリペプチドは伸長されていく段階からすでに特定の[[コンフォメーション]]を取り始めており、終結して遺伝子のコードしていた機能性タンパク質として機能し始める。ただし、タンパク質が発現した後も別のタンパク質によって修飾を受けていくこともあり、'''遺伝子配列がそのままの配列でタンパク質として発現していない'''ことも多々ある。 |
|||
==臨床的意義== |
|||
==真核生物の翻訳== |
|||
翻訳制御は、[[がん]]の発生と生存にとって重要な要素である。がん細胞は、遺伝子発現の翻訳段階を随時制御する必要があるが、なぜ転写のような段階よりも翻訳が標的とされるのか、その理由は完全には理解されていない。がん細胞は、しばしば遺伝的に改変された翻訳因子を持っているが、既存の翻訳因子の量を変化させることの方がはるかに一般的である<ref name=":0">{{Cite journal| vauthors = Xu Y, Ruggero D |date= March 2020 |title=The Role of Translation Control in Tumorigenesis and Its Therapeutic Implications |journal=Annual Review of Cancer Biology |volume=4 |issue=1 |pages=437–457 |doi=10.1146/annurev-cancerbio-030419-033420 |doi-access=free}}</ref>。{{Ill2|MAPK/ERK経路|en|MAPK/ERK pathway|label=RAS-MAPK}}、{{Ill2|PI3K/AKT/mTOR経路|en|PI3K/AKT/mTOR pathway|label=PI3K/ACT/mTOR}}、MYC、および[[Wntシグナル経路|WNT-β-カテニン経路]]など、いくつかの主要な発がん性[[シグナル伝達]]経路は、最終的に翻訳を介して[[ゲノム]]を再プログラムする<ref>{{cite journal | vauthors = Truitt ML, Ruggero D | title = New frontiers in translational control of the cancer genome | journal = Nature Reviews. Cancer | volume = 16 | issue = 5 | pages = 288–304 | date = April 2016 | pmid = 27112207 | pmc = 5491099 | doi = 10.1038/nrc.2016.27 }}</ref>。また、がん細胞は{{Ill2|細胞ストレス応答|en|Cellular stress response|label=細胞ストレス}}に適応するために翻訳を制御している。ストレスがかかると、細胞はそのストレスを緩和して存続を図るためのmRNAを翻訳する。この例として、さまざまながんにおける[[AMPK]]の発現がある。AMPKの活性化は、栄養不足によって引き起こされる[[アポトーシス]]([[プログラム細胞死]])から、がん細胞が最終的に回避するための{{Ill2|生化学カスケード|en|Biochemical cascade|label=カスケード}}を引き起こす。将来のがん治療では、細胞の翻訳機構を妨害することで、がんの下流効果に対抗できる可能性がある<ref name=":0" />。 |
|||
{{See also|真核生物の翻訳}} |
|||
{{節スタブ}} |
|||
真核生物での翻訳は原核生物と比べて複雑である。そのなかでも以下の点が重要である。 |
|||
1,真核生物のリボソームはより大きく、60Sの大サブユニットと40Sの小サブユニットから80Sのリボソームができる。 |
|||
2,合成開始に用いられるのはN-ホルミルメチオニンではなく普通のメチオニンである。しかしtRNAは特殊なものでありtRNA<sub>i</sub>またはtRNA<sub>f</sub>と表記される。(i;initiation、fは試験管内でならホルミル化できることから) |
|||
3,シャイン・ダルガーノ配列が存在せず、Met-tRNA<sub>i</sub>と結合した40SリボソームがmRNA5’末端のキャップ構造に結合し、開始コドンAUGをさがす。配列内リボソーム進入部位([[IRES]])という特殊なRNA配列を利用してキャップを利用せず途中からリボソームが結合することもある) |
|||
4,真核生物のmRNAは5’のキャップに開始因子elFであるelF-4Eがくっつき、また3’のポリAにはポリA尾部結合タンパク質PABPIがくっつき、その両者にelF-4Gが結合することで環状になっている。 |
|||
5,伸長因子、終結因子が異なる |
|||
6,高等生物の翻訳装置は細胞骨格に結合しており、物理的な複合体を形成している。 |
|||
<ref>ストライヤー生化学 第7版 p846〜</ref> |
|||
== |
== 翻訳の数理モデル == |
||
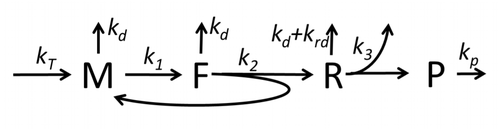
[[File:Model M0 of protein synthesis.png|thumb|500 px|図M0: タンパク質合成の基本的かつ最も単純なモデル''M0''を示す。ここで、Mは翻訳開始部位が集合リボソームに占有されていないmRNAの量、Fは翻訳開始部位が集合リボソームに占有されているmRNAの量、RはmRNAに着いてタンパク質を合成しているリボソームの量、Pは合成されたタンパク質の量を表す<ref name= "GH-BMorZin"/>。]] |
|||
[[古細菌]]の翻訳過程はまだ良く分かっていない。だが、「{{要出典範囲|[[真正細菌]]と[[真核生物]]の中間的な性格を持つ|date=2011-10}}」と考えられている{{誰2|date=2011-10}}。「{{要出典範囲|開始機構は[[シャイン・ダルガノ配列]]を使用する|date=2011-10}}」({{要出典範囲|使わないことも多い|date=2011-10}})と見られており、やや真正細菌に類似する{{要出典|date=2011-10}}。{{要出典範囲|開始t-RNAは[[ホルミル化]]されていない[[メチオニン]]|date=2011-10}}、と言う{{誰2|date=2011-10}}。抗生物質感受性は真核生物の方に似ている{{要出典|date=2011-10}}。 |
|||
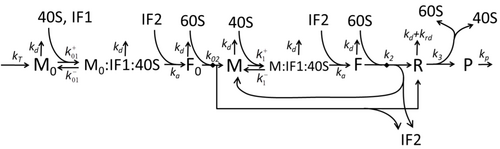
[[File:ModelM1'.png|thumb|500 px|図M1': 40S、60S、および開始因子(IF)結合を明示したタンパク質合成''M1''の拡張モデル<ref name= "GH-BMorZin"/>。]] |
|||
転写 - 翻訳プロセスは、最も基本的な「基礎」過程のみ言及して、次のような構成で記述される。 |
|||
==脚注== |
|||
{{脚注ヘルプ}} |
|||
{{Reflist}} |
|||
# mRNA分子の生成([[スプライシング]]を含む)。 |
|||
==関連項目== |
|||
# 開始因子の助けを借りた各々の分子の導入(たとえば(一般に必要ではないが)環状化の段階を含むことがある)。 |
|||
# 翻訳の開始、リボソーム小サブユニットの動員。 |
|||
# 完全なリボソームの構築。 |
|||
# 伸長、すなわちタンパク質の生産を伴うmRNAに沿ったリボソームの移動。 |
|||
# 翻訳の終了。 |
|||
# mRNA分子の分解。 |
|||
# タンパク質の分解。 |
|||
翻訳によってアミノ酸が組み合わさりタンパク質が生成される過程は、その確率的側面を考慮した初期の詳細な動力学モデルから始まり<ref name="pmid5641411">{{cite journal | vauthors = MacDonald CT, Gibbs JH, Pipkin AC | title = Kinetics of biopolymerization on nucleic acid templates | journal = Biopolymers | volume = 6 | issue = 1 | pages = 1–5 | date = 1968 | pmid = 5641411 | doi = 10.1002/bip.1968.360060102 | s2cid = 27559249 }}</ref>、コンピュータシミュレーションを使用したさまざまな物理モデルの対象となってきた。過去40年間で、[[化学反応速度論]]に基づくタンパク質合成モデルが数多く開発され、解析されてきた<ref>{{cite journal | vauthors = Heinrich R, Rapoport TA | title = Mathematical modelling of translation of mRNA in eucaryotes; steady state, time-dependent processes and application to reticulocytes | journal = Journal of Theoretical Biology | volume = 86 | issue = 2 | pages = 279–313 | date = September 1980 | pmid = 7442295 | doi = 10.1016/0022-5193(80)90008-9 | bibcode = 1980JThBi..86..279H }}</ref><ref name="pmid17031456">{{cite journal | vauthors = Skjøndal-Bar N, Morris DR | title = Dynamic model of the process of protein synthesis in eukaryotic cells | journal = Bulletin of Mathematical Biology | volume = 69 | issue = 1 | pages = 361–93 | date = January 2007 | pmid = 17031456 | doi = 10.1007/s11538-006-9128-2 | s2cid = 83701439 }}</ref>。化学反応速度論のほかにも、タンパク質合成の詳細な動力学やその一部の段階をモデル化するために、TASEP({{Ill2|非対称単純排他過程|en|Asymmetric simple exclusion process|label=Totally Asymmetric Simple Exclusion Process}})<ref name="pmid17031456">{{cite journal | vauthors = Skjøndal-Bar N, Morris DR | title = Dynamic model of the process of protein synthesis in eukaryotic cells | journal = Bulletin of Mathematical Biology | volume = 69 | issue = 1 | pages = 361–93 | date = January 2007 | pmid = 17031456 | doi = 10.1007/s11538-006-9128-2 | s2cid = 83701439 }}</ref>、PBN({{Ill2|確率論的論理ネットワーク|en|Probabilistic Boolean Networks}})、[[ペトリネット]]、および{{Ill2|トロピカル半環|en|Tropical semiring|label=max-plus代数}}などのさまざまなモデリング形式論が適用されてきた。「有用な[[数理モデル|モデル]]は単純で拡張可能である」という[[パラダイム|規範]]に従って<ref name="pmid28341710">{{cite journal | vauthors = Coyte KZ, Tabuteau H, Gaffney EA, Foster KR, Durham WM | title = Reply to Baveye and Darnault: Useful models are simple and extendable | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 114 | issue = 14 | pages = E2804–E2805 | date = April 2017 | pmid = 28341710 | pmc = 5389313 | doi = 10.1073/pnas.1702303114 | bibcode = 2017PNAS..114E2804C | doi-access = free }}</ref>、前述した8つの基本的工程をすべて考慮したタンパク質合成の基本モデルが開発された<ref name="GH-BMorZin">{{cite journal | vauthors = Gorban AN, Harel-Bellan A, Morozova N, Zinovyev A | title = Basic, simple and extendable kinetic model of protein synthesis | journal = Mathematical Biosciences and Engineering | volume = 16 | issue = 6 | pages = 6602–6622 | date = July 2019 | pmid = 31698578 | doi = 10.3934/mbe.2019329 | doi-access = free }}</ref>。最も単純なモデル''M0''は、反応速度論的な機構(図M0)で表される。これは一般化されて、40S、60S、{{Ill2|開始因子|en|Initiation factor}}(IF)結合を含むようになった(図M1')。さらに、[[マイクロRNA]]がタンパク質合成におよぼす影響を含めて拡張された<ref name="pmid22850425">{{cite journal | vauthors = Morozova N, Zinovyev A, Nonne N, Pritchard LL, Gorban AN, Harel-Bellan A | title = Kinetic signatures of microRNA modes of action | journal = RNA | volume = 18 | issue = 9 | pages = 1635–55 | date = September 2012 | pmid = 22850425 | pmc = 3425779 | doi = 10.1261/rna.032284.112 }}</ref>。この階層に含まれるほとんどのモデルは解析的に解くことができる。これらの解法を用いて、合成制御におけるさまざまな特異的な機構の「速度論的特徴<!-- kinetic signatures -->」が得られた。 |
|||
==遺伝暗号== |
|||
{{main|遺伝暗号}} |
|||
遺伝暗号を手作業で翻訳することも(短い配列の場合)または(後述のように適切にプログラミングした)コンピュータで翻訳することもできる。これにより、生物学者や化学者は、コード化タンパク質の化学構造を紙に描いて解釈することができる。 |
|||
まず、下に示すように、鋳型DNAの各塩基をRNA相補体に変換する([[アデニン|アデニン(A)]]の相補体は[[ウラシル|ウラシル(U)]]であることに注意すること)。なお、DNAの鋳型鎖はRNAが重合したものであり、もう一方のDNA鎖はRNAと同じであるが、ウラシルの代わりに[[チミン|チミン(T)]]を持つことに留意すること。 |
|||
DNA -> RNA |
|||
A -> U |
|||
T -> A |
|||
C -> G |
|||
G -> C |
|||
A=T-> A=U |
|||
次に、RNAをトリプレット(3塩基のグループ)に分割する。コードを読み始める場所によって、3つの翻訳ウィンドウ、すなわち[[リーディングフレーム]]があることに注意を要す。最後に、[[遺伝暗号]]の{{Ill2|DNAとRNAのコドン表|en|DNA and RNA codon tables|label=翻訳表}}を使用して、上記を化学で使われる[[構造式]]に変換する。 |
|||
これによってタンパク質の[[一次構造]](アミノ酸配列)が得られる。しかし、タンパク質は、鎖に沿った[[親水性]]セグメントと[[疎水性]]セグメントの部分に依存して[[タンパク質フォールディング|折り畳まれる傾向]]がある。[[二次構造]](部分的な立体構造)を推測できることは多いが、適切な[[三次構造]](立体構造)を決定することは非常に困難である。タンパク質の三次構造やその他の側面は[[タンパク質構造予測|高度なアルゴリズム]]を用いて予測するしかないが、アミノ酸配列は核酸配列から{{Ill2|DNAとRNAのコドン表|en|DNA and RNA codon tables|label=翻訳表}}を使って単独で決定することができる。 |
|||
この方法では、特に、[[セレノシステイン]]のような型にあてはまらない[[アミノ酸]]がタンパク質に組み込まれる場合に、そのタンパク質の正しいアミノ酸組成を得られないことがある。セレノシステインは、型どおりの終止コドンと下流のヘアピン構造({{Ill2|SECIS配列|en|SECIS element|label=SECIS}})の組み合わせによってコード化されている。 |
|||
DNA/RNA配列をタンパク質配列に翻訳することができるコンピュータプログラムは数多く存在する。通常、この処理は標準遺伝コード(''Standard Genetic Code'')を用いて行われるが、生物学的に重要な代替開始コドンの使用など、すべての「特別な」場合を扱えるプログラムはほとんどない。たとえば、まれな代替開始コドンであるCTGは、開始コドンとして使用された場合は[[メチオニン]]をコードし、その他の全ての位置では[[ロイシン]]をコードする。 |
|||
例: 標準遺伝暗号に基づき要約された翻訳表(NCBIタクソノミーのウェブページより)<ref name="NCBI2019">{{Cite web |last1=Elzanowski |first1=Andrzej |last2=Ostell |first2=Jim |date=January 2019 |title=The Genetic Codes |url=https://www.ncbi.nlm.nih.gov/Taxonomy/Utils/wprintgc.cgi |url-status=live |access-date=31 May 2022 |website= |publisher=[[アメリカ国立生物工学情報センター]] (NCBI)}}</ref>。 |
|||
AAs = FFLLSSSSYY**CC*WLLLLPPPPHHQQRRRRIIIMTTTTNNKKSSRRVVVVAAAADDEEGGGG |
|||
Starts = ---M---------------M---------------M---------------------------- |
|||
Base1 = TTTTTTTTTTTTTTTTCCCCCCCCCCCCCCCCAAAAAAAAAAAAAAAAGGGGGGGGGGGGGGGG |
|||
Base2 = TTTTCCCCAAAAGGGGTTTTCCCCAAAAGGGGTTTTCCCCAAAAGGGGTTTTCCCCAAAAGGGG |
|||
Base3 = TCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAG |
|||
「開始(Starts)」の行は、3つの開始コドン、UUG、CUG、そして非常に一般的なAUGを示す。また、開始位置として解釈した場合の最初のアミノ酸残基も示す。この場合、それらはすべてメチオニンである。 |
|||
===翻訳表=== |
|||
{{main|{{ill2|遺伝暗号の一覧|en|List of genetic codes}}|{{ill2|遺伝暗号#代替遺伝暗号|en|Genetic code#Alternative genetic codes}}}} |
|||
酵母ゲノムのような通常の真核生物の配列を扱う場合でも、ミトコンドリア遺伝子翻訳表など、別の翻訳表(''translation table'')を使用したい場合がよくある。2019年現在、[[GenBank]]の配列の翻訳では、[[NCBI]]タクソノミ-グループ(''NCBI Taxonomy Group'')によって以下の翻訳表が定義されている<ref name="NCBI2019"/>。 |
|||
{{Div col|colwidth=25em}} |
|||
# {{ill2|DNAコドン表|en|DNA codon table|label=DNAコドン表}}<!-- standard code --> |
|||
# {{ill2|vertebrate mitochondrial code|en|vertebrate mitochondrial code|label=脊椎動物のミトコンドリアコード}}<!-- vertebrate mitochondrial code --> |
|||
# {{ill2|yeast mitochondrial code|en|yeast mitochondrial code|label=酵母のミトコンドリアコード}}<!-- yeast mitochondrial code --> |
|||
# {{ill2|The mold, protozoan, and coelenterate mitochondrial code and the mycoplasma/spiroplasma code|en|The mold, protozoan, and coelenterate mitochondrial code and the mycoplasma/spiroplasma code|label=カビ、原生動物、腔腸動物のミトコンドリアコードとマイコプラズマ/スピロプラズマコード}}<!-- mold, protozoan, and coelenterate mitochondrial code and the mycoplasma/spiroplasma code --> |
|||
# {{ill2|invertebrate mitochondrial code|en|invertebrate mitochondrial code|label=無脊椎動物のミトコンドリアコード}}<!-- invertebrate mitochondrial code --> |
|||
# {{ill2|ciliate, dasycladacean and hexamita nuclear code|en|ciliate, dasycladacean and hexamita nuclear code|label=繊毛虫、ダシクラダ科、ヘキサミタ属の核コード}}<!-- ciliate, dasycladacean and hexamita nuclear code --> |
|||
# {{ill2|The mold, protozoan, and coelenterate mitochondrial code and the mycoplasma/spiroplasma code|en|The mold, protozoan, and coelenterate mitochondrial code and the mycoplasma/spiroplasma code|label=キネトプラストのコード}}<!-- kinetoplast code --> |
|||
# <li value="9"> {{ill2|echinoderm and flatworm mitochondrial code|en|echinoderm and flatworm mitochondrial code|label=棘皮動物と扁形動物のミトコンドリアコード}}<!-- echinoderm and flatworm mitochondrial code --> |
|||
# {{ill2|euplotid nuclear code|en|euplotid nuclear code|label=ユープロテス目の核コード}}<!-- euplotid nuclear code --> |
|||
# {{ill2|bacterial, archaeal and plant plastid code|en|bacterial, archaeal and plant plastid code|label=細菌、古細菌、植物の色素体コード}}<!-- bacterial, archaeal and plant plastid code --> |
|||
# {{ill2|alternative yeast nuclear code|en|alternative yeast nuclear code|label=代替酵母の核コード}}<!-- alternative yeast nuclear code --> |
|||
# {{ill2|ascidian mitochondrial code|en|ascidian mitochondrial code|label=ホヤ類のミトコンドリアコード}}<!-- ascidian mitochondrial code --> |
|||
# {{ill2|alternative flatworm mitochondrial code|en|alternative flatworm mitochondrial code|label=扁形動物の代替ミトコンドリアコード}}<!-- alternative flatworm mitochondrial code --> |
|||
# {{ill2|Blepharisma nuclear code|en|Blepharisma nuclear code|label=ブレファリスマ属の核コード}}<!-- ''Blepharisma'' nuclear code --> |
|||
# {{ill2|chlorophycean mitochondrial code|en|chlorophycean mitochondrial code|label=葉緑体のミトコンドリアコード}}<!-- chlorophycean mitochondrial code --> |
|||
# <li value="21"> {{ill2|trematode mitochondrial code|en|trematode mitochondrial code|label=トレマトード綱のミトコンドリアコード}}<!-- trematode mitochondrial code --> |
|||
# {{ill2|Scenedesmus obliquus mitochondrial code|en|Scenedesmus obliquus mitochondrial code|label=セネデスムス属のミトコンドリアコード}}<!-- ''Scenedesmus obliquus'' mitochondrial code --> |
|||
# {{ill2|Thraustochytrium mitochondrial code|en|Thraustochytrium mitochondrial code|label=スラウストキトリウム属のミトコンドリアコード}}<!-- ''Thraustochytrium'' mitochondrial code --> |
|||
# {{ill2|Pterobranchia mitochondrial code|en|Pterobranchia mitochondrial code|label=翼鰓類(いさいるい)のミトコンドリアコード}}<!-- Pterobranchia mitochondrial code --> |
|||
# {{ill2|candidate division SR1 and gracilibacteria code|en|candidate division SR1 and gracilibacteria code|label=候補門SR1およびグラシリバクテリアのコード}}<!-- candidate division SR1 and gracilibacteria code --> |
|||
# {{ill2|Pachysolen tannophilus nuclear code|en|Pachysolen tannophilus nuclear code|label=パチソレン・タノフィルスの核コード}}<!-- ''Pachysolen tannophilus'' nuclear code --> |
|||
# {{ill2|karyorelict nuclear code|en|karyorelict nuclear code|label=カリオレリクタの核コード}}<!-- karyorelict nuclear code --> |
|||
# {{ill2|Condylostoma_nuclear_code|en|Condylostoma_nuclear_code|label=コンジロストマの核コード}}<!-- ''Condylostoma'' nuclear code --> |
|||
# {{ill2|Mesodinium_nuclear_code|en|Mesodinium_nuclear_code|label=メソジニウムの核コード}}<!-- ''Mesodinium'' nuclear code --> |
|||
# {{ill2|peritrich nuclear code|en|peritrich nuclear code|label=ペリトリッチの核コード}}<!-- peritrich nuclear code --> |
|||
# {{ill2|Blastocrithidia nuclear code|en|Blastocrithidia nuclear code|label=ブラストクリシジアの核コード}}<!-- ''Blastocrithidia'' nuclear code --> |
|||
# <li value="33"> {{ill2|Cephalodiscidae mitochondrial code|en|Cephalodiscidae mitochondrial code|label=エラフサカツギ科のミトコンドリアコード}}<!-- Cephalodiscidae mitochondrial code --> |
|||
{{Div col end}} |
|||
== 関連項目 == |
|||
{{div col|colwidth=25em}} |
|||
* [[細胞]] - 生物の基本的な構造・機能単位 |
|||
* [[細胞分裂]] - 親細胞が2つの娘細胞に分裂する過程 |
|||
* {{Ill2|DNAとRNAのコドン表|en|DNA and RNA codon tables}} - 遺伝暗号をアミノ酸配列に変換するのに用いる表 |
|||
* [[エピジェネティクス]] - DNA塩基配列の変化を伴わない表現型の変化を研究する学問 |
|||
* {{ill2|拡張遺伝暗号|en|Expanded genetic code}} - 人為的に修正された遺伝暗号 |
|||
* [[遺伝子発現]] - 遺伝子の情報がタンパク質などの生成を経て表現型に影響を及ぼす過程 |
|||
* [[遺伝子発現の調節]] - 細胞が特定の遺伝子産物(タンパク質またはRNA)の産生を増加または減少させる機構 |
|||
* [[遺伝子]] - 遺伝の基本単位 |
|||
* [[ゲノム]] - 生物のすべての遺伝情報 |
|||
* [[生命]] - シグナル伝達や自立プロセスなど生物学的プロセスを持つ物質 |
|||
* {{ill2|タンパク質法|en|Protein methods}} - タンパク質を研究するために用いられる技術 |
|||
* [[開始コドン]] - メッセンジャーRNA(mRNA)上の最初のコドン |
|||
{{Div col end}} |
|||
== 脚注 == |
|||
{{reflist}} |
|||
== 推薦文献 == |
|||
{{refbegin}} |
|||
* {{Cite book|title=ストライヤー生化学 (第8版)|url=https://www.worldcat.org/oclc/1052771234|publisher=Tokyokagakudojin|date=2018.8|isbn=978-4-8079-0929-2|oclc=1052771234|others=Jeremy Mark Berg, John L Tymoczko, Gregory Joseph Gatto, Tatsuro Irimura, Hiroto Okayama, Takao Shimizu}} |
|||
* {{cite book | last1 = Champe | first1 = Pamela C | last2 = Harvey | first2 = Richard A | last3 = Ferrier | first3 = Denise R | name-list-style = vanc | title = Lippincott's Illustrated Reviews: Biochemistry |publisher=Lippincott Williams & Wilkins |location=Hagerstwon, MD |year=2004 |edition=3rd |isbn=0-7817-2265-9 }} |
|||
* {{cite book | last1 = Cox | first1 = Michael | last2 = Nelson | first2 = David R. | last3 = Lehninger | first3 = Albert L | name-list-style = vanc | title=Lehninger principles of biochemistry |publisher=W.H. Freeman |location=San Francisco... |year=2005 |isbn=0-7167-4339-6 |edition=4th}} |
|||
* {{cite journal | vauthors = Malys N, McCarthy JE | title = Translation initiation: variations in the mechanism can be anticipated | journal = Cellular and Molecular Life Sciences | volume = 68 | issue = 6 | pages = 991–1003 | date = March 2011 | pmid = 21076851 | doi = 10.1007/s00018-010-0588-z | s2cid = 31720000 }} |
|||
{{refend}} |
|||
== 外部リンク == |
|||
{{Commons category|Translation (biology)}} |
{{Commons category|Translation (biology)}} |
||
=== ツール === |
|||
*[[エピジェネティクス]] |
|||
* [http://web.expasy.org/translate Translate - Expasy] - DNAやRNA配列をタンパク質配列に翻訳する |
|||
*[[ゲノム]] |
|||
*[[ナンセンス変異依存mRNA分解機構]] |
|||
*[[プロテオーム]] |
|||
*[[リボソーム]] |
|||
*[[相補的DNA]] |
|||
*[[細胞]] |
|||
*[[細胞分裂]] |
|||
*[[転写 (生物学)|転写]] |
|||
*[[遺伝子]] |
|||
*[[遺伝子発現]] |
|||
*[[遺伝子発現の調節]] |
|||
*{{仮リンク|タンパク質法|en|Protein methods}} |
|||
== |
=== 解説動画 === |
||
*[[理化学研究所]]オミックス基盤研究領域「[https://www.youtube.com/watch?v=DB0gnar0Ndw |
* [[理化学研究所]]オミックス基盤研究領域「[https://www.youtube.com/watch?v=DB0gnar0Ndw セントラルドグマ]」2008年 |
||
*理化学研究所ゲノム科学総合研究センター遺伝子構造・機能研究グループ「[https://www.youtube.com/watch?v=EgweXtBCynE セントラルドグマ ~ゲノム情報からタンパク質ができるまで~ |
* 理化学研究所ゲノム科学総合研究センター遺伝子構造・機能研究グループ「[https://www.youtube.com/watch?v=EgweXtBCynE セントラルドグマ ~ゲノム情報からタンパク質ができるまで~]」2007年 |
||
*原核生物の翻訳開始機構「[https://www.youtube.com/watch? |
* 原核生物の翻訳開始機構「[https://www.youtube.com/watch?v=KZBljAM6B1s Animation of Protein Synthesis (Translation) in Prokaryotes.]」{{En icon}} |
||
*真核生物の翻訳開始機構「[https://www.youtube.com/watch? |
* 真核生物の翻訳開始機構「[https://www.youtube.com/watch?v=qIwrhUrvX-k Eukaryotic Translation (Protein Synthesis), Animation.]」{{En icon}} |
||
{{MolBioGeneExp|state=expanded}} |
|||
{{遺伝子発現}} |
|||
<!-- |
|||
{{Portal bar|生物学}} |
|||
{{GeneticTranslation|state=expanded}} |
|||
{{biosci-stub}} |
|||
{{Self-replicating organic structures|state=collapsed}} |
|||
--> |
|||
{{Authority control}} |
|||
{{DEFAULTSORT:ほんやく}} |
{{DEFAULTSORT:ほんやく}} |
||
| 112行目: | 169行目: | ||
[[Category:遺伝子発現]] |
[[Category:遺伝子発現]] |
||
[[Category:細胞プロセス]] |
[[Category:細胞プロセス]] |
||
{{Portal bar|生物学}} |
|||
2022年11月25日 (金) 20:20時点における版

(上) 開始段階: メチオニンとそのアンチコドンを輸送するイニシエーターtRNAが、リボソームのP部位でmRNAの開始コドンAUGと遭遇する。
(下) 伸長段階: リボソームが5'から3'方向に移動する。そのとき、ペプチド結合でP部位のtRNAに結合したアミノ酸がA部位のtRNAに結合し、mRNA上のコドンに基づいて長いアミノ酸鎖を合成する。リボソームが移動する際、tRNAはEサイトを通ってリボソームから離れ、新しいtRNAがA部位に入って、アミノ酸鎖の伸長を継続する。

①開始 (Initiation): ポリメラーゼがDNA鎖に結合してから、リボソーム小サブユニットがDNAに結合するまで。
②伸長 (Elongation): 大サブユニットが結合すると伸長が開始する。
③終止 (Termination): 伸長の過程が終了する。
分子生物学や遺伝学において、翻訳(ほんやく、英: translation)とは、細胞質または小胞体でリボソームがタンパク質を合成する過程であり、これは細胞の核でDNAを元にRNAが合成される転写に続くものである。この一連の過程は、遺伝子発現と呼ばれる。
概説
翻訳では、メッセンジャーRNA(mRNA)が核の外にあるリボソームで解読され、特定のアミノ酸鎖(ポリペプチドともよぶ)が作られる。その後、ポリペプチドは活性タンパク質に折り畳まれ、細胞内でその役割を果たす。リボソームは、mRNAコドンに相補的なtRNAアンチコドン配列の結合を導くことによって解読を進める。転移RNA(tRNA)は特定のアミノ酸を輸送し、mRNAがリボソームを通過して「読み取られる」ときにそのアミノ酸がポリペプチドに連結される。
翻訳は次の3つの段階で進行する。
- 開始: 標的mRNAの周囲にリボソームが集結する。最初のtRNAがmRNAの開始コドンに結合する。
- 伸長: リボソーム小サブユニットによって確認された(収容)tRNAは、運んだアミノ酸をリボソーム大サブユニットに移し、その前に収容されたアミノ酸に結合する(ペプチド転移)。その後、リボソームは次のmRNAコドンに移動してプロセスを継続し(転座)、アミノ酸の鎖を形成する。
- 終結: 終止コドンに到達すると、リボソームはポリペプチドを放出する。リボソーム複合体はそのまま残り、次に翻訳されるmRNAへ移動する。
原核生物(細菌および古細菌)の場合、翻訳は細胞質基質で行われ、リボソームの大サブユニットと小サブユニットがmRNAに結合する。真核生物の場合、翻訳は細胞質内または小胞体の膜を越えて共翻訳転座と呼ばれる過程で行われる。共翻訳転座では、リボソームとmRNAの複合体全体が粗面小胞体(ER)の外膜に結合し、新しいタンパク質が合成されてER内に放出される。新しく作られたポリペプチドは、将来の小胞輸送や細胞外への分泌のためにER内に貯蔵されるか、または直ちに分泌される。
転移RNA(tRNA)、リボソームRNA(rRNA)、核内低分子RNA(snRNA)など、多くの種類の転写RNAはタンパク質に翻訳されない。
多くの抗生物質は、翻訳を阻害することで働く。たとえば、アニソマイシン、シクロヘキシミド、クロラムフェニコール、テトラサイクリン、ストレプトマイシン、エリスロマイシン、およびピューロマイシンがある。細菌などの原核生物のリボソームは真核生物のリボソームと構造が異なるため、抗生物質は真核生物の宿主細胞に害を与えることなく、感染した細菌を特異的に標的にすることができる。
基本的な機構


タンパク質を生成する基本的な過程は、タンパク質の末端にアミノ酸を1つずつ付加することである。この働きは、リボソームによって行われる[1]。リボソームは、小サブユニットと大サブユニットの2つのサブユニットから構成されている。これらのサブユニットは、mRNAがタンパク質に翻訳される前に一体となり、翻訳が行われてポリペプチドが生成される場所を提供する。ポリペプチドに付加するアミノ酸の種類と配列はmRNA分子によって決定される[2]。付加された各アミノ酸は、mRNA上の3連ヌクレオチド配列(トリプレットまたは三連符という)と符合する。このようなトリプレットの組み合わせ可能なそれぞれについて、対応するアミノ酸が認められる。鎖に追加された連続したアミノ酸は、mRNAの連続したヌクレオチド・トリプレットに符合する。このようにして、mRNA鎖のヌクレオチド配列が鋳型となり、生成されるアミノ酸鎖のアミノ酸の配列を決定する[3]。アミノ酸の付加はペプチドのC末端で起こるので、翻訳はアミンからカルボキシルへ向かうと呼ばれる[4]。
リボヌクレオチドの配列としてコード化された遺伝情報は、mRNAによって染色体からリボソームへ送られる。リボヌクレオチドは、コドンと呼ばれるヌクレオチド・トリプレットの配列として翻訳機構によって読み取られる。これらのトリプレットはそれぞれ特定のアミノ酸をコードしている。
リボソーム分子は、このコードを特定のアミノ酸の配列へ翻訳する。リボソームは、rRNAとタンパク質からなる多サブユニット構造体であり、アミノ酸をタンパク質に組み立てる「工場」の役割を担っている。tRNAは、アミノ酸をリボソームへ輸送する小さなノンコーディングRNA鎖(74-93ヌクレオチド)であり、アミノ酸が結合する部位と、アンチコドンと呼ばれる部位を持っている。アンチコドンはRNAのトリプレットで、積荷のアミノ酸をコードするmRNAトリプレットに相補的になっている。
酵素であるアミノアシルtRNA合成酵素は、特定のtRNAと、そのアンチコドン配列に対応するアミノ酸との結合を触媒する。この反応の産物はアミノアシルtRNAである。細菌の場合、このアミノアシルtRNAは転写因子EF-Tuによってリボソームへ輸送され、そこでmRNAコドンと特定のtRNAアンチコドンが相補的塩基対を形成することで符合する。アミノアシルtRNA合成酵素が誤ったアミノ酸とtRNAとの対合を形成すると、誤った結合のアミノアシルtRNAが生成し、その結果、タンパク質の対応する位置に不適切なアミノ酸が生じる可能性がある。このような遺伝暗号の「誤訳」は、ほとんどの生物で低いレベルで自然に起こるが[5]、ある種の細胞環境では、mRNA解読の許容範囲が増して細胞の利益につながる場合もある。
リボソームには、tRNAと結合する部位が2つある。それぞれ、アミノアシル部位(Aと略す)、ペプチジル部位/出口部位(P/Eと略す)である。リボソームはmRNAの3'末端に向かって移動するため、mRNAに対して3つの部位は5'から3'へE-P-Aの順で方向付いている(最初の図を参照)。A部位では、入ってくるtRNAをmRNA上の相補的なコドンと結合する。P/E部位では、そのtRNAと成長中のポリペプチド鎖を保持する。アミノアシルtRNAがmRNA上の対応するコドンと最初に結合するのはA部位で行われる。次に、A部位にあるtRNAのアミノ酸と、P/E部位にある充填tRNA(charged tRNA)のアミノ酸との間にペプチド結合が形成される。成長するポリペプチド鎖はA部位のtRNAに転移する。P/E部位のアミノ酸を持たないtRNAが移動して転座が起こる。A部位にあったtRNAは、ポリペプチド鎖と結合した状態でP/E部位に移動し、そのtRNAは離れて別のアミノアシルtRNAがA部位に入り、この過程が繰り返される[6]。
新しいアミノ酸が鎖に付加され、tRNAがリボソームから細胞質へ遊離した後、トランスロカーゼ(転移酵素)であるEF-G(細菌の場合)またはa/eEF-2(真核生物および古細菌の場合)に結合したグアノシン三リン酸(GTP)の加水分解で供給されるエネルギーによって、リボソームは3'末端の方向へ1コドン移動する。タンパク質の翻訳に必要なエネルギーはかなり多い。n個のアミノ酸を含むタンパク質の場合、翻訳に必要な高エネルギーリン酸結合の数は4n-1個である[7]。翻訳速度はさまざまで、原核細胞は(1秒間に17-21個のアミノ酸残基)真核細胞(1秒間に6-9個のアミノ酸残基)よりもかなり速い[8]。
一般に、リボソームは正確でプロセッシブ(mRNAに沿って連続してアミノ酸鎖を合成すること)な機械と考えられているが、翻訳プロセスは誤りを前提としていて、tRNAが誤ったコドンに結合したり誤ったアミノ酸に結合するために、誤ったタンパク質の合成や翻訳の早期断念につながる可能性がある[9]。タンパク質の合成における誤り率は、実験条件にもよるが、1/105から1/103の間でアミノ酸が誤って取り込まれると推定されている[10]。一方、翻訳を早期に断念する割合は、翻訳されたコドンあたり10−4イベントのオーダーであると推定されている[11]。アミノアシルトランスフェラーゼによって、正しいアミノ酸と正しい転移RNA(tRNA)が共有結合する。アミノ酸はカルボキシル基によってtRNAの3'OHにエステル結合する。アミノ酸が結合したtRNAは「チャージしている(charged)」と呼ばれる。タンパク質合成の開始過程では、開始因子(IF)の助けを借りて、リボソーム小サブユニットがmRNAの5'末端に結合する。細菌および少数種の古細菌の場合、開始には、シャイン・ダルガノ配列と呼ばれるmRNA上のプリンに富む開始配列の認識を伴う。シャイン・ダルガノ配列は、30Sリボソームサブユニットの16S rRNA部分の3'末端にある相補的なピリミジンに富む配列と結合する。これらの相補的な配列が結合することによって、30SリボソームサブユニットがmRNAと結合し、開始コドンがP部位の30S部分に配置されるように確実に整列する。mRNAと30Sサブユニットが適切に結合すると、開始因子がイニシエーターtRNA・アミノ酸複合体のfMet-tRNAを30SのP部位に輸送する。50Sサブユニットが30Sサブユニットに結合し、活性型70Sリボソームが形成されると開始段階が終了する[12]。ポリペプチドの終止は、リボソームのA部位がmRNA上の終止コドン(UAA、UAG、UGA)に占有されたときに起こり、タンパク質の一次構造が形成される。tRNAは通常、終止コドンを認識することも、結合することもできない。その代わりに終止コドンは、リボソームのペプチジルトランスフェラーゼ活性中心[1]からポリペプチド鎖を加水分解することによって、リボソームとmRNA複合体全体の分解を促す終結因子というタンパク質(RF1およびRF2)の結合を誘導する[13][14]。ある種の薬物やmRNA上の特殊な配列モチーフによってリボソーム構造が変化し、終結因子の代わりに、近同族性tRNAが終止コドンに結合することがある。このような「翻訳リードスルー(translational readthrough)」の場合、リボソームが次の終止コドンに遭遇するまで翻訳が継続される[15]。
真核生物、原核生物のいずれにおいても翻訳過程は高度に制御されている。翻訳が制御されると、細胞の代謝や増殖状態と密接に関連するタンパク質合成の全体的な速度に影響を与える可能性がある。さらに、最近の研究では、遺伝的な相違や、その後のmRNAとしての発現も、RNA特異的に翻訳速度に影響を与える可能性があることが明らかになった[16]。
臨床的意義
翻訳制御は、がんの発生と生存にとって重要な要素である。がん細胞は、遺伝子発現の翻訳段階を随時制御する必要があるが、なぜ転写のような段階よりも翻訳が標的とされるのか、その理由は完全には理解されていない。がん細胞は、しばしば遺伝的に改変された翻訳因子を持っているが、既存の翻訳因子の量を変化させることの方がはるかに一般的である[17]。RAS-MAPK、PI3K/ACT/mTOR、MYC、およびWNT-β-カテニン経路など、いくつかの主要な発がん性シグナル伝達経路は、最終的に翻訳を介してゲノムを再プログラムする[18]。また、がん細胞は細胞ストレスに適応するために翻訳を制御している。ストレスがかかると、細胞はそのストレスを緩和して存続を図るためのmRNAを翻訳する。この例として、さまざまながんにおけるAMPKの発現がある。AMPKの活性化は、栄養不足によって引き起こされるアポトーシス(プログラム細胞死)から、がん細胞が最終的に回避するためのカスケードを引き起こす。将来のがん治療では、細胞の翻訳機構を妨害することで、がんの下流効果に対抗できる可能性がある[17]。
翻訳の数理モデル
転写 - 翻訳プロセスは、最も基本的な「基礎」過程のみ言及して、次のような構成で記述される。
- mRNA分子の生成(スプライシングを含む)。
- 開始因子の助けを借りた各々の分子の導入(たとえば(一般に必要ではないが)環状化の段階を含むことがある)。
- 翻訳の開始、リボソーム小サブユニットの動員。
- 完全なリボソームの構築。
- 伸長、すなわちタンパク質の生産を伴うmRNAに沿ったリボソームの移動。
- 翻訳の終了。
- mRNA分子の分解。
- タンパク質の分解。
翻訳によってアミノ酸が組み合わさりタンパク質が生成される過程は、その確率的側面を考慮した初期の詳細な動力学モデルから始まり[20]、コンピュータシミュレーションを使用したさまざまな物理モデルの対象となってきた。過去40年間で、化学反応速度論に基づくタンパク質合成モデルが数多く開発され、解析されてきた[21][22]。化学反応速度論のほかにも、タンパク質合成の詳細な動力学やその一部の段階をモデル化するために、TASEP(Totally Asymmetric Simple Exclusion Process)[22]、PBN(確率論的論理ネットワーク)、ペトリネット、およびmax-plus代数などのさまざまなモデリング形式論が適用されてきた。「有用なモデルは単純で拡張可能である」という規範に従って[23]、前述した8つの基本的工程をすべて考慮したタンパク質合成の基本モデルが開発された[19]。最も単純なモデルM0は、反応速度論的な機構(図M0)で表される。これは一般化されて、40S、60S、開始因子(IF)結合を含むようになった(図M1')。さらに、マイクロRNAがタンパク質合成におよぼす影響を含めて拡張された[24]。この階層に含まれるほとんどのモデルは解析的に解くことができる。これらの解法を用いて、合成制御におけるさまざまな特異的な機構の「速度論的特徴」が得られた。
遺伝暗号
遺伝暗号を手作業で翻訳することも(短い配列の場合)または(後述のように適切にプログラミングした)コンピュータで翻訳することもできる。これにより、生物学者や化学者は、コード化タンパク質の化学構造を紙に描いて解釈することができる。
まず、下に示すように、鋳型DNAの各塩基をRNA相補体に変換する(アデニン(A)の相補体はウラシル(U)であることに注意すること)。なお、DNAの鋳型鎖はRNAが重合したものであり、もう一方のDNA鎖はRNAと同じであるが、ウラシルの代わりにチミン(T)を持つことに留意すること。
DNA -> RNA A -> U T -> A C -> G G -> C A=T-> A=U
次に、RNAをトリプレット(3塩基のグループ)に分割する。コードを読み始める場所によって、3つの翻訳ウィンドウ、すなわちリーディングフレームがあることに注意を要す。最後に、遺伝暗号の翻訳表を使用して、上記を化学で使われる構造式に変換する。
これによってタンパク質の一次構造(アミノ酸配列)が得られる。しかし、タンパク質は、鎖に沿った親水性セグメントと疎水性セグメントの部分に依存して折り畳まれる傾向がある。二次構造(部分的な立体構造)を推測できることは多いが、適切な三次構造(立体構造)を決定することは非常に困難である。タンパク質の三次構造やその他の側面は高度なアルゴリズムを用いて予測するしかないが、アミノ酸配列は核酸配列から翻訳表を使って単独で決定することができる。
この方法では、特に、セレノシステインのような型にあてはまらないアミノ酸がタンパク質に組み込まれる場合に、そのタンパク質の正しいアミノ酸組成を得られないことがある。セレノシステインは、型どおりの終止コドンと下流のヘアピン構造(SECIS)の組み合わせによってコード化されている。
DNA/RNA配列をタンパク質配列に翻訳することができるコンピュータプログラムは数多く存在する。通常、この処理は標準遺伝コード(Standard Genetic Code)を用いて行われるが、生物学的に重要な代替開始コドンの使用など、すべての「特別な」場合を扱えるプログラムはほとんどない。たとえば、まれな代替開始コドンであるCTGは、開始コドンとして使用された場合はメチオニンをコードし、その他の全ての位置ではロイシンをコードする。
例: 標準遺伝暗号に基づき要約された翻訳表(NCBIタクソノミーのウェブページより)[25]。
AAs = FFLLSSSSYY**CC*WLLLLPPPPHHQQRRRRIIIMTTTTNNKKSSRRVVVVAAAADDEEGGGG Starts = ---M---------------M---------------M---------------------------- Base1 = TTTTTTTTTTTTTTTTCCCCCCCCCCCCCCCCAAAAAAAAAAAAAAAAGGGGGGGGGGGGGGGG Base2 = TTTTCCCCAAAAGGGGTTTTCCCCAAAAGGGGTTTTCCCCAAAAGGGGTTTTCCCCAAAAGGGG Base3 = TCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAG
「開始(Starts)」の行は、3つの開始コドン、UUG、CUG、そして非常に一般的なAUGを示す。また、開始位置として解釈した場合の最初のアミノ酸残基も示す。この場合、それらはすべてメチオニンである。
翻訳表
酵母ゲノムのような通常の真核生物の配列を扱う場合でも、ミトコンドリア遺伝子翻訳表など、別の翻訳表(translation table)を使用したい場合がよくある。2019年現在、GenBankの配列の翻訳では、NCBIタクソノミ-グループ(NCBI Taxonomy Group)によって以下の翻訳表が定義されている[25]。
- DNAコドン表
- 脊椎動物のミトコンドリアコード
- 酵母のミトコンドリアコード
- カビ、原生動物、腔腸動物のミトコンドリアコードとマイコプラズマ/スピロプラズマコード
- 無脊椎動物のミトコンドリアコード
- 繊毛虫、ダシクラダ科、ヘキサミタ属の核コード
- キネトプラストのコード
- 棘皮動物と扁形動物のミトコンドリアコード
- ユープロテス目の核コード
- 細菌、古細菌、植物の色素体コード
- 代替酵母の核コード
- ホヤ類のミトコンドリアコード
- 扁形動物の代替ミトコンドリアコード
- ブレファリスマ属の核コード
- 葉緑体のミトコンドリアコード
- トレマトード綱のミトコンドリアコード
- セネデスムス属のミトコンドリアコード
- スラウストキトリウム属のミトコンドリアコード
- 翼鰓類(いさいるい)のミトコンドリアコード
- 候補門SR1およびグラシリバクテリアのコード
- パチソレン・タノフィルスの核コード
- カリオレリクタの核コード
- コンジロストマの核コード
- メソジニウムの核コード
- ペリトリッチの核コード
- ブラストクリシジアの核コード
- エラフサカツギ科のミトコンドリアコード
関連項目
- 細胞 - 生物の基本的な構造・機能単位
- 細胞分裂 - 親細胞が2つの娘細胞に分裂する過程
- DNAとRNAのコドン表 - 遺伝暗号をアミノ酸配列に変換するのに用いる表
- エピジェネティクス - DNA塩基配列の変化を伴わない表現型の変化を研究する学問
- 拡張遺伝暗号 - 人為的に修正された遺伝暗号
- 遺伝子発現 - 遺伝子の情報がタンパク質などの生成を経て表現型に影響を及ぼす過程
- 遺伝子発現の調節 - 細胞が特定の遺伝子産物(タンパク質またはRNA)の産生を増加または減少させる機構
- 遺伝子 - 遺伝の基本単位
- ゲノム - 生物のすべての遺伝情報
- 生命 - シグナル伝達や自立プロセスなど生物学的プロセスを持つ物質
- タンパク質法 - タンパク質を研究するために用いられる技術
- 開始コドン - メッセンジャーRNA(mRNA)上の最初のコドン
脚注
- ^ a b “The Peptidyl Transferase Center: a Window to the Past”. Microbiol Mol Biol Rev 85 (4): e0010421. (November 2021). doi:10.1128/MMBR.00104-21. PMC 8579967. PMID 34756086.
- ^ Biology (Third international student ed.). New York, NY: McGraw Hill Education. (2014). pp. 249. ISBN 978-981-4581-85-1
- ^ Neill, Campbell (1996). Biology (Fourth ed.). The Benjamin/Cummings Publishing Company. pp. 309–310. ISBN 0-8053-1940-9
- ^ Stryer, Lubert (2002). Biochemistry (Fifth ed.). W. H. Freeman and Company. p. 826. ISBN 0-7167-4684-0
- ^ “Mistranslation of the genetic code”. FEBS Letters 588 (23): 4305–10. (November 2014). doi:10.1016/j.febslet.2014.08.035. PMC 4254111. PMID 25220850.
- ^ Griffiths, Anthony (2008). “9”. Introduction to Genetic Analysis (9th ed.). New York: W.H. Freeman and Company. pp. 335–339. ISBN 978-0-7167-6887-6
- ^ “Computational Analysis of Genomic Sequences utilizing Machine Learning”. scholar.googleusercontent.com. 2022年1月12日閲覧。
- ^ “Growth-rate-dependent adjustment of ribosome function in chemostat-grown cells of the fungus Mucor racemosus”. Journal of Bacteriology 149 (2): 650–3. (February 1982). doi:10.1128/JB.149.2.650-653.1982. PMC 216554. PMID 6799491.
- ^ “Errors in translational decoding: tRNA wobbling or misincorporation?”. PLOS Genetics 15 (3): 2979–2986. (March 2019). doi:10.1371/journal.pgen.1008017. PMC 3158919. PMID 21930591.
- ^ “Evolutionary optimization of speed and accuracy of decoding on the ribosome”. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences 366 (1580): 2979–86. (October 2011). doi:10.1098/rstb.2011.0138. PMC 6438450. PMID 30921315.
- ^ “Quantitative assessment of ribosome drop-off in E. coli”. Nucleic Acids Research 44 (6): 2528–37. (April 2016). doi:10.1093/nar/gkw137. PMC 4824120. PMID 26935582.
- ^ “Mechanisms of the initiation of protein synthesis: in reading frame binding of ribosomes to mRNA”. Molecular Biology Reports 38 (2): 847–55. (February 2011). doi:10.1007/s11033-010-0176-1. PMID 20467902.
- ^ “Global analysis of translation termination in E. coli”. PLOS Genetics 13 (3): e1006676. (March 2017). doi:10.1371/journal.pgen.1006676. PMC 5373646. PMID 28301469.
- ^ “Stop codon recognition and interactions with peptide release factor RF3 of truncated and chimeric RF1 and RF2 from Escherichia coli”. Molecular Microbiology 50 (5): 1467–76. (December 2003). doi:10.1046/j.1365-2958.2003.03799.x. PMID 14651631.
- ^ “Functional Translational Readthrough: A Systems Biology Perspective”. PLOS Genetics 12 (8): e1006196. (August 2016). doi:10.1371/JOURNAL.PGEN.1006196. PMC 4973966. PMID 27490485.
- ^ “Integrative analysis of RNA, translation, and protein levels reveals distinct regulatory variation across humans”. Genome Research 25 (11): 1610–21. (November 2015). doi:10.1101/gr.193342.115. PMC 4617958. PMID 26297486.
- ^ a b “The Role of Translation Control in Tumorigenesis and Its Therapeutic Implications”. Annual Review of Cancer Biology 4 (1): 437–457. (March 2020). doi:10.1146/annurev-cancerbio-030419-033420.
- ^ “New frontiers in translational control of the cancer genome”. Nature Reviews. Cancer 16 (5): 288–304. (April 2016). doi:10.1038/nrc.2016.27. PMC 5491099. PMID 27112207.
- ^ a b c “Basic, simple and extendable kinetic model of protein synthesis”. Mathematical Biosciences and Engineering 16 (6): 6602–6622. (July 2019). doi:10.3934/mbe.2019329. PMID 31698578.
- ^ “Kinetics of biopolymerization on nucleic acid templates”. Biopolymers 6 (1): 1–5. (1968). doi:10.1002/bip.1968.360060102. PMID 5641411.
- ^ “Mathematical modelling of translation of mRNA in eucaryotes; steady state, time-dependent processes and application to reticulocytes”. Journal of Theoretical Biology 86 (2): 279–313. (September 1980). Bibcode: 1980JThBi..86..279H. doi:10.1016/0022-5193(80)90008-9. PMID 7442295.
- ^ a b “Dynamic model of the process of protein synthesis in eukaryotic cells”. Bulletin of Mathematical Biology 69 (1): 361–93. (January 2007). doi:10.1007/s11538-006-9128-2. PMID 17031456.
- ^ “Reply to Baveye and Darnault: Useful models are simple and extendable”. Proceedings of the National Academy of Sciences of the United States of America 114 (14): E2804–E2805. (April 2017). Bibcode: 2017PNAS..114E2804C. doi:10.1073/pnas.1702303114. PMC 5389313. PMID 28341710.
- ^ “Kinetic signatures of microRNA modes of action”. RNA 18 (9): 1635–55. (September 2012). doi:10.1261/rna.032284.112. PMC 3425779. PMID 22850425.
- ^ a b “The Genetic Codes”. アメリカ国立生物工学情報センター (NCBI) (January 2019). 31 May 2022閲覧。
推薦文献
- ストライヤー生化学 (第8版). Jeremy Mark Berg, John L Tymoczko, Gregory Joseph Gatto, Tatsuro Irimura, Hiroto Okayama, Takao Shimizu. Tokyokagakudojin. (2018.8). ISBN 978-4-8079-0929-2. OCLC 1052771234
- Champe, Pamela C; Harvey, Richard A; Ferrier, Denise R (2004). Lippincott's Illustrated Reviews: Biochemistry (3rd ed.). Hagerstwon, MD: Lippincott Williams & Wilkins. ISBN 0-7817-2265-9
- Cox, Michael; Nelson, David R.; Lehninger, Albert L (2005). Lehninger principles of biochemistry (4th ed.). San Francisco...: W.H. Freeman. ISBN 0-7167-4339-6
- “Translation initiation: variations in the mechanism can be anticipated”. Cellular and Molecular Life Sciences 68 (6): 991–1003. (March 2011). doi:10.1007/s00018-010-0588-z. PMID 21076851.
外部リンク
ツール
- Translate - Expasy - DNAやRNA配列をタンパク質配列に翻訳する
解説動画
- 理化学研究所オミックス基盤研究領域「セントラルドグマ」2008年
- 理化学研究所ゲノム科学総合研究センター遺伝子構造・機能研究グループ「セントラルドグマ ~ゲノム情報からタンパク質ができるまで~」2007年
- 原核生物の翻訳開始機構「Animation of Protein Synthesis (Translation) in Prokaryotes.」
- 真核生物の翻訳開始機構「Eukaryotic Translation (Protein Synthesis), Animation.」
