「リン」の版間の差分
m 外部リンク修正 |
|||
| 84行目: | 84行目: | ||
|covalent radius=[[1 E-10 m|107±3]] |
|covalent radius=[[1 E-10 m|107±3]] |
||
|Van der Waals radius=[[1 E-10 m|180]] |
|Van der Waals radius=[[1 E-10 m|180]] |
||
|magnetic ordering=(白リン、赤リン、紫リン、黒リン)[[反磁性]]<ref>{{PDF|[https://web.archive.org/web/20040324080747/http://www-d0.fnal.gov/hardware/cal/lvps_info/engineering/elementmagn.pdf Magnetic susceptibility of the elements and inorganic compounds]}}(2004年3月24日時点の[[インターネット |
|magnetic ordering=(白リン、赤リン、紫リン、黒リン)[[反磁性]]<ref>{{PDF|[https://web.archive.org/web/20040324080747/http://www-d0.fnal.gov/hardware/cal/lvps_info/engineering/elementmagn.pdf Magnetic susceptibility of the elements and inorganic compounds]}}(2004年3月24日時点の[[インターネットアーカイブ|アーカイブ]]), in Handbook of Chemistry and Physics 81st edition, CRC press.</ref> |
||
|electrical resistivity= |
|electrical resistivity= |
||
|electrical resistivity at 0= |
|electrical resistivity at 0= |
||
2017年9月4日 (月) 13:44時点における版
| |||||||||||||||||||||||||
| 外見 | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
無色、ロウ状白色、黄色、真紅色、赤色、紫色、黒色 左から白リン(黄リン)、赤リン、紫リン、黒リン | |||||||||||||||||||||||||
| 一般特性 | |||||||||||||||||||||||||
| 名称, 記号, 番号 | リン, P, 15 | ||||||||||||||||||||||||
| 分類 | 非金属 | ||||||||||||||||||||||||
| 族, 周期, ブロック | 15, 3, p | ||||||||||||||||||||||||
| 原子量 | 30.973762(2) | ||||||||||||||||||||||||
| 電子配置 | [Ne] 3s2 3p3 | ||||||||||||||||||||||||
| 電子殻 | 2, 8, 5(画像) | ||||||||||||||||||||||||
| 物理特性 | |||||||||||||||||||||||||
| 密度(室温付近) | (白リン)1.823、(赤リン)≈ 2.2 – 2.34、(紫リン)2.36、(黒リン)2.69 g/cm3 | ||||||||||||||||||||||||
| 融点 | (白リン)44.2 °C、(黒リン)610 °C | ||||||||||||||||||||||||
| 昇華点 | (赤リン)≈ 416 – 590 °C、(紫リン)620 °C | ||||||||||||||||||||||||
| 沸点 | (白リン)280.5 °C | ||||||||||||||||||||||||
| 融解熱 | (白リン)0.66 kJ/mol | ||||||||||||||||||||||||
| 蒸発熱 | (白リン)12.4 kJ/mol | ||||||||||||||||||||||||
| 熱容量 | (25 °C) (白リン)23.824 J/(mol·K) | ||||||||||||||||||||||||
| 蒸気圧(白リン) | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 蒸気圧(赤リン、bp. 431 °C) | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 原子特性 | |||||||||||||||||||||||||
| 酸化数 | 5, 4, 3, 2[1], 1[2], −1, −2, −3 (弱酸性酸化物) | ||||||||||||||||||||||||
| 電気陰性度 | 2.19(ポーリングの値) | ||||||||||||||||||||||||
| イオン化エネルギー | 第1: 1011.8 kJ/mol | ||||||||||||||||||||||||
| 第2: 1907 kJ/mol | |||||||||||||||||||||||||
| 第3: 2914.1 kJ/mol | |||||||||||||||||||||||||
| 共有結合半径 | 107±3 pm | ||||||||||||||||||||||||
| ファンデルワールス半径 | 180 pm | ||||||||||||||||||||||||
| その他 | |||||||||||||||||||||||||
| 結晶構造 | 立方晶系(白リン) | ||||||||||||||||||||||||
| 磁性 | (白リン、赤リン、紫リン、黒リン)反磁性[3] | ||||||||||||||||||||||||
| 熱伝導率 | (300 K) (白リン)0.236、(黒リン)12.1 W/(m⋅K) | ||||||||||||||||||||||||
| 体積弾性率 | (白リン)5、(赤リン)11 GPa | ||||||||||||||||||||||||
| CAS登録番号 | 7723-14-0 | ||||||||||||||||||||||||
| 主な同位体 | |||||||||||||||||||||||||
| 詳細はリンの同位体を参照 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
リン(燐、英語: phosphorus、新ラテン語: phosphorus[4])は原子番号 15、原子量 30.97 の元素である。元素記号は P。窒素族元素の一つ。白リン(黄リン)・赤リン・紫リン・黒リンなどの同素体が存在する。+III(例:六酸化四リン P4O6)、+IV(例:八酸化四リン P4O8)、+V(例:五酸化二リン P2O5)などの酸化数をとる。
同素体
リンは数種類の同素体をもつことが古くから知られている。白リン以外の同素体は、安定でほぼ無毒である。
白リン (P4) は四面体形の分子からなり、比重が1.82、融点が44.1 ℃、沸点が280 ℃の、常温常圧で白色ロウ状の固体である。発火点は約60 ℃で些細な事で自然発火するため、水中で保存する。空気中で室温でも徐々に酸化され、熱および青白い光を発する。現在燐光は別の発光現象の意味で用いられているがその語源でもある。ベンゼン、二硫化炭素 (CS2) などの有機溶媒によく溶ける。強い毒性を持ち[5]、にんにくのような臭いがある。日光にあたると赤リンに変化する。
黒リンは比重が2.69の固体である。黄リンを約12000気圧で加圧し、約200 ℃で加熱すると得られる。リンの同素体中で最も安定である。半導体であり鉄灰色の金属光沢をもちβ金属リンともよばれる。空気中ではなかなか発火しない。
紫リンは比重が2.36の固体である。褐色を帯びた暗紫色で金属光沢をもちα金属リンともよばれる。密閉して、黄リンに鉛を加え加熱することで得られる。電気伝導性は小さい。真の同素体ではなく、赤リンと黒リンの混合物と考えられている。
赤リンは紫リンを主成分とする白リンとの混合体で、融点590 ℃、発火点260 ℃の赤褐色の粉末である。二硫化炭素に不溶。マッチの材料に使われる。密閉した容器で白リンを約250 ℃で加熱すると得られる。
紅リンは比重が1.88の深紅色の粉末である。微細な粒子からなる赤リンと考えられている。
二リン (P2, P≡P) は、リン同士が三重結合して二原子分子になったものである。
- 結晶構造
-
白リンの結晶構造
-
黒リンの結晶構造
-
黒リンの結晶構造
同素体ではないもの
黄リンは同素体とされていたが、実際には不純物(赤リンなど)を含む粗製白リンであり同素体ではない。 リン鉱石(リン酸カルシウム)をケイ砂、コークスと共に混合強熱して得られる淡黄色蝋状固体である。 黄色は白リンの表面が微量の赤リンの膜で覆われたもので、融点沸点などの物理的性質は白リンに準じる。 19世紀にマッチの材料として使用されたが、自然発火事故や健康被害により20世紀初頭に使用が禁止された。赤リンの乾留でも得られる。
反応
歴史
1669年にドイツの商人・ヘニッヒ・ブラントが、錬金術の実験としてバケツ60杯の尿を蒸発させていたところ、尿の残留物からリンを発見した[7]。ギリシャ語で「光をはこぶもの」という意味の “phosphoros” から命名された。phos が「光」、phoros が「はこぶもの」の意味。
生化学
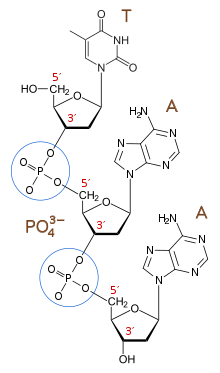
生体内では、遺伝情報の要である DNA や RNA のポリリン酸エステル鎖として存在するほか、生体エネルギー代謝に欠かせない ATP、細胞膜の主要な構成要素であるリン脂質など、重要な働きを担う化合物中に存在している。また、脊椎動物ではリン酸カルシウムが骨格の主要構成要素としての役割も持つ。このため、あらゆる生物にとっての必須元素であり、地球上におけるリンの存在量が、地球生態系のバイオマスの限界量を決定すると言われている。農業においてはリン酸が、カリウム・窒素などとともに肥料の主要成分である。
リンの原子が地上に現れる主な循環システムは、植物を起点として考えた場合、
- 植物が枯死するか、その植物を食べた動物が死ぬ
- 微生物に分解され土壌に戻る
- 再び植物の根から吸い上げられる
となる[8]。この循環は短期間で一巡する場合もあるが、10年単位の時間を要する場合もある。雨や風によってループから外れ、海に流出してしまうリンもあり、そうしたリンが海底で堆積してできるのがリン灰石である。プレートテクトニクスによってリン灰石が地表に現れるには100万年以上の時間がかかる[8]。
海洋においては浅い地域に多く、元素の中では偏在性が強い。メキシコ、コンゴ、南米付近の海底には大規模なリンの鉱床がある[9]。
用途
用途としては、化学肥料の原料として使われるものが最も大きい。近年では、過リン酸石灰の生産が落ち込んでいるのに加え、従来の重過リン酸石灰の生産量は減少し、代わりにリン酸アンモニウム肥料がその重要性を増している。リン酸は金属の表面加工や工業用触媒に用いられるほか、食品添加物としてコーラなどにも少量添加されている。
代表的なリン酸の関連化合物の用途については、農薬や殺虫剤としての利用も多く、化学兵器として研究されるほど強力な毒性を持った製品も開発されたが、その多くは使用が中止されている。現在はリン酸エステル系の殺虫剤が主力になっている。
同じくリン酸化合物であるリン酸ナトリウム水溶液は強塩基性を示すため、単独で金属の洗浄剤として使われるほか、次亜塩素酸と混合することで強力な洗剤となるので、三リン酸ナトリウムは洗剤として広く利用されていたが、排水に高濃度のリンが含まれるために微生物の異常な繁殖の原因となり、赤潮などの公害を引き起こした。それゆえ、環境への配慮から日本国内での使用はほとんどなくなってきている。リン酸水素カルシウムは研磨剤として歯磨きなどに含まれ、フッ素を含む歯磨きには二リン酸カルシウムなど、口腔衛生にかかわる場面でもリン酸化合物が数多く配合されている。
そのほかにも、コーンフレークやベーキングパウダー、飼料にもリン酸化合物が含まれるほか、ハムやチーズなどの製造時にも使用されている。燃料の不凍液にリン酸化合物が加えられたり繊維製品の難燃加工にも利用されている。製紙工業では消泡剤として、核燃料の再処理では、ウラン・プルトニウム抽出の際の溶剤としてなど、多様なリン酸化合物が開発され、さまざまな場面で利用がある。
一般的に工業用の材料として使用されるものは、無機被覆または樹脂被覆処理を行った被覆リンとして流通している。被覆されることによって有毒なホスフィンの発生を抑制して自然発火がおきないようにすることで取り扱いを容易にしている。販売されている被覆リンは保存に特別な設備を必要とせず、常温の空気中に保存することが出来る。
潤滑用途では様々な種類のリン系添加剤が使用されており、特に耐摩耗性、極圧性に優れたものが多く存在する。ジチオリン酸亜鉛などは磨耗防止、酸化防止、腐食防止といった機能を持つ多機能添加剤であるため昔から潤滑油用途で多用され、現在でも一般的な4ストローク用エンジンオイルの殆どに添加されている。
規制
リンは細胞の不可欠な構成要素であるため、環境中に過剰に存在すると、微生物の大量増殖を導いてしまう。赤潮などの公害が多発した1960年代以降、合成洗剤の洗浄助剤としての使用が禁止されるなどの対策が講じられ、その後も閉鎖性水域を中心に、環境基準の項目として定番となっている。
ガソリンエンジンの排気ガスを浄化する三元触媒はエンジンオイルに含まれるリンによって被毒する。そのためILSACなどのエンジンオイル規格においてリンの含有量規制が存在する。ただしリンは磨耗防止など様々な機能を担っている重要な要素であり、現状では潤滑性能を維持する観点から最低含有量も同時に設定されている。
リンの化合物
- その他
- ホスフィン (PH3)
- リン化カルシウム (Ca3P2 など)
- リン酸 (H3PO4) - 生体にとっても重要、核酸を構成する。
- リン酸ナトリウム (Na3PO4)
- ヘキサフルオロリン酸 (HPF6)
リンのオキソ酸
リンのオキソ酸は慣用名をもつ。次にそれらを挙げる。

| オキソ酸の名称 | 化学式 (酸化数) |
オキソ酸塩の名称 | 備考 |
|---|---|---|---|
| ホスフィン酸 (phosphinic acid) |
HPH2O2 (+I) |
ホスフィン酸塩 ( - phosphinate) |
水素原子のうち2個がリンに直接結合しているため、リンの原子価は5価。 |
| ホスホン酸 (phosphonic acid) |
H2PHO3 (+III) |
ホスホン酸塩 ( - phosphorite) |
亜リン酸の互変異性体。水素原子のうち1個がリンに直接結合しているため、リンの原子価は5価。 |
| 亜リン酸 (phosphorous acid) |
H3PO3 (+III) |
亜リン酸塩 ( - phosphite) |
詳しくは亜リン酸、三酸化二リンを参照。 |
| リン酸 (phosphoric acid) |
H3PO4 (+V) |
リン酸塩 ( - phosphate) |
詳しくはリン酸、五酸化二リンを参照。 |
| ペルオキソ一リン酸 (peroxomonophosphoric acid) |
H3PO5 (+V) |
ペルオキソ一リン酸塩 ( - peroxomonophosphorate) |
水溶液としてのみ得られ、強い酸化力がある。 |
※オキソ酸塩名称の '-' にはカチオン種の名称が入る。
同位体
脚注
- ^ Phosphorus: diphosphorus tetrahydride
- ^ Ellis, Bobby D.; MacDonald, Charles L. B. (2006). “Phosphorus(I) Iodide: A Versatile Metathesis Reagent for the Synthesis of Low Oxidation State Phosphorus Compounds”. Inorganic Chemistry 45 (17): 6864. doi:10.1021/ic060186o. PMID 16903744.
- ^ Magnetic susceptibility of the elements and inorganic compounds (PDF) (2004年3月24日時点のアーカイブ), in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ The Free Dictionary
- ^ PHOSPHORUS (YELLOW) 国際化学物質安全性カード
- ^ アメリカ有害物質・疾病登録局 (ATSDR) が 1997年に作成したTOXICOLOGICAL PROFILE FOR WHITE PHOSPHORUSによる。
- ^ 桜井弘『元素111の新知識』講談社、1998年、94頁。ISBN 4-06-257192-7。
- ^ a b ルース・ドフリース『食糧と人類:飢餓を克服した大増産の文明史』小川敏子訳 日本経済新聞出版社 2016年、ISBN 9784532169817 pp. 90–95.
- ^ 臼井朗「海底鉱物資源」(オーム社)53ページ






