電子伝達系


電子伝達系(でんしでんたつけい、英: Electron transport chain)は、生物が好気呼吸を行う時に起こす複数の代謝系の最終段階の反応系であり、酸化還元反応により電子供与体から電子受容体へ電子を移動する一連の生物学的過程のことである。別名水素伝達系、電子伝達鎖、呼吸鎖などとも呼ばれる。水素伝達系という言葉は高校の教科改定で正式になくなった(ただ言葉として使っている人はいる)。
概要
[編集]電子伝達系の最終的な電子受容体は、酸素分子である。電子伝達系は、光合成による太陽光からのエネルギーの抽出や、糖の酸化、細胞呼吸等に用いられる。真核生物では、ATP合成酵素による酸化的リン酸化の場となっているミトコンドリア内膜で重要な電子伝達系が発見されている。また、葉緑体のチラコイド膜でも見られる。
電子伝達系は、電子供与体から電子受容体に電子を移動させる酸化還元反応である。電子伝達系は、空間的に離れた酸化還元系を形成し、その中で電子は電子供与体から電子受容体に伝達される。これらの反応を駆動する力は、反応物と生成物のギブス自由エネルギーである。系全体のギブス自由エネルギーを減らす全ての反応は、熱力学的に自発的に起こる。電子の移動は、膜を通したプロトンの移動と共役しており、プロトン勾配を作る。プロトン勾配は仕事を生み出すのに用いられる。1つの電子の移動から約30単位の仕事が行われる。
生体膜の内側と外側にプロトン(水素イオン)の濃度の差を生じさせることが目的であり、このプロトン濃度勾配を利用して、最終的にATP合成酵素がATPを生成する。ここでいう膜とは、真核生物の場合はミトコンドリアの内膜であり、原核生物の場合は細胞膜のことである。これらの膜上に存在する呼吸鎖複合体に電子が流れることによってプロトンポンプおよびスカラー反応がおこり、プロトンが膜の内側から外側に汲み出されプロトン濃度勾配が生じる。
電子伝達系の機能は、酸化還元反応の結果として、膜の内外にプロトン勾配を作り出すことである[1]。プロトンが膜を通して戻れば、細菌の鞭毛の回転等の機械的な仕事を行うことができる。ATP合成酵素はこの機械的な仕事を化学エネルギーに変換し細胞のエネルギー源とするもので、全ての生物で高い保存性を持つ[2]。
また、光合成でも電子伝達系は存在しており、これは葉緑体のチラコイド膜に存在するシトクロムb6/f複合体にて行われる。葉緑体では、光が水から酸素、NADP+からNADPHへの変換を駆動し、細胞膜を通してプロトンを移動させる。ミトコンドリアでは、プロトン勾配の形成に必要な酸素から水、NADHからNAD+、コハク酸からフマル酸への変換が起こる。
電子伝達系は、酸素に電子が渡る主な場となって超酸化物を生じ、酸化ストレスを増加させる。
電子伝達系のポイントとなるのは、解糖系やクエン酸回路で生じた還元型補酵素NADH+H^+とFADH2がもっている水素イオンH+と電子e-である。これらがミトコンドリアを包む二重膜で働くことで、最終的にたくさんのATPとH2Oになる。
6O2 + 10(NADH+H^+)+ 2FADH2 + 34(ADP+リン酸)→12H2O+10NAD+ + 2FAD + 34ATP
呼吸鎖複合体
[編集]呼吸鎖複合体(こきゅうさふくごうたい)とは、細胞呼吸(好気呼吸、嫌気呼吸関わらず)を行うほとんどの生物に見られる膜(ミトコンドリア内膜、チラコイド膜、原核生物の細胞膜)に存在する分子量10万から100万程度の巨大タンパク質である。呼吸鎖複合体 I, II, III, IV からなり、ATP合成酵素を呼吸鎖複合体 V とする事もある。
ミトコンドリアにおける電子伝達系
[編集]ほとんどの真核生物細胞はミトコンドリアを持ち、クエン酸回路、β酸化、タンパク質代謝の生成物(NADHやFADH2)からATPを合成する。ミトコンドリア内膜では、NADHとコハク酸由来の電子が電子伝達系を通って酸素に渡され、酸素は水に還元される。電子伝達系には、電子供与体と電子受容体に関わる一連の酵素が含まれる。各々の電子供与体は、電気陰性度がより低い電子受容体に電子を渡し、この電子は次の電子受容体に与えられ、この一連のプロセスは、この鎖で最も電気陰性度が低い酸素に電子が届くまで続く。電子供与体から電子受容体に電子が渡されるとエネルギーが放出され、このエネルギーによりプロトンポンプを動かすことで、ミトコンドリア膜の内外にプロトン勾配が形成される。この全体のプロセスでは、水素の酸化エネルギーを用いてADPがATPにリン酸化されるため、酸化的リン酸化と呼ばれる。
ミトコンドリアの電子伝達系では、4つの膜結合複合体が同定されており、各々が非常に複雑な膜貫通構造によって内膜に埋め込まれている。この構造は電気的に、脂質可溶電子キャリア、水可溶電子キャリアと繋がっている。
- 複合体I - NADH:ユビキノン還元酵素 (水素イオン輸送型)(EC 1.6.5.3)
- 複合体II - コハク酸デヒドロゲナーゼ(EC 1.3.5.1)
- 複合体III - 補酵素Q-シトクロムcレダクターゼ(EC 1.10.2.2)
- 複合体IV - シトクロムcオキシダーゼ(EC 1.9.3.1)、
この順番に、電子は一連の酸化還元反応を通してNADHやユビキノール等の電子供与体から、最終的な電子受容体である酸素分子に移動する。これに伴い、複合体I、複合体III、複合体IVがプロトンポンプ機構ならびにスカラー反応を起こして、プロトンを膜外に能動輸送する。複合体IIは好気呼吸におけるプロトン濃度勾配形成には寄与しないが、電子伝達系の一部である還元型ユビキノンを生じる。
複合体Iは、クエン酸回路の電子キャリアであるNADHから電子を受け取ってコエンザイムQ(ユビキノン)に渡す。ユビキノンは複合体IIからも電子を受け取る。ユビキノンは複合体IIIに電子を渡し、次いでその電子はシトクロムc、複合体IVに順に渡り、ここで電子と水素イオンは、酸素分子を水に還元するために用いられる。
NADH+H+ ↓ 複合体 I ↓ ← 複合体 II ← コハク酸 ユビキノン ↓ 複合体 III ↓ シトクロム c ↓ 複合体 IV ↓ O2
電子の伝達によって得られたエネルギーは、ミトコンドリアマトリックスから膜間空間にプロトンを汲み出すのに用いられ、このとき輸送されたプロトンによりミトコンドリア内膜の内外に、ΔΨと呼ばれる電気化学的ポテンシャル(プロトンによって生じるpH差および電荷の差)が作り出される。これがプロトン駆動力の原動力となり、ATP合成酵素がマトリックス側に戻るプロトンを利用して、ADPと無機リン酸からATPを合成する(酸化的リン酸化)ことが可能となる。
一連のプロセスを経ず、酸素に直接渡される電子もわずかに存在し、酸化ストレスをもたらし病気や老化を引き起こすと考えられている超酸化フリーラジカルを形成する。
複合体I
[編集]
複合体Iでは、解糖系およびクエン酸回路から得られたNADHから2つの電子が取り除かれ、脂質可溶キャリアであるユビキノンに移される。ユビキノンの還元生成物であるユビキノールは膜の内部を自由に拡散し、次の複合体IIIに電子伝達を行う。複合体Iはプロトンポンプ機構(プロトンが膜を通過する機構)およびキノンサイクル機構を用いて4つのプロトンを膜を通して移動させ、プロトン勾配を作る。複合体Iは、電子が酸素に「漏れ」、超酸化物が形成される主な場所である[3]。
電子の伝達経路は、以下の通りである。
一段階の二電子反応で、NADHはNAD+に酸化され、FMNはFMNH2に還元される。FMNH2はその後、二段階の一電子反応でセミキノン中間体を経て酸化される。各々の電子は、FMNH2から鉄・硫黄クラスターへ、鉄・硫黄クラスターからユビキノンへ伝達される。1つ目の電子の伝達によってフリーラジカル(セミキノン)が生じ、2つ目の電子の伝達によってセミキノンを還元し、ユビキノールが生じる。このプロセスの過程で、4つのプロトンがマトリックス側から膜間空間に移動される[3]。
複合体Iは NADH からユビキノンへ電子伝達を行う反応を担い、NADH を電子伝達体に用いる生物群は全て複合体I を所持している。複合体I は以下の構成を示している。
- 原核生物:分子量約 50 万、サブユニット数:14 個、nuo,nqr オペロンにコードされる。
- ミトコンドリア:分子量約 100 万、サブユニット数:42 個(mtDNA に 7 個、核ゲノムに 35 個)
- 葉緑体:分子量約 55 万、他の詳細は明らかになっていない
最小機能単位は原核生物の複合体 I である。膜貫通型サブユニットおよび細胞質に突出する表在性サブユニットからなり L 字構造を取っている。表在性サブユニットの構造が2006年に、膜貫通型サブユニットも含めた全体構造が2010年に明らかにされた。
- 表在性サブユニット
- フラビンタンパク質(NADH を酸化)
- 鉄-硫黄(以後 Fe-S)タンパク質(電子伝達を仲介する)
- 膜貫通型サブユニット
- 鉄-硫黄タンパク質
- プロトンポンプ
- ユビキノン酸化還元タンパク質
電子伝達は以下の手順で行われる。
ユビキノールは膜内を拡散し、ユビキノールを還元する複合体III あるいはIV(原核生物の複合体IV はユビキノールを還元する)に電子伝達をおこなう。
複合体I はもともと水素酸化型 [NiFe]-ヒドロゲナーゼを起源に持つ。その後、NADH 酸化能、フラビン (FMN) の獲得および NiFe 活性中心を失い、現在の形に至ったと考えられている。シアノバクテリアにも複合体 I は存在し、「NADPH:プラストキノン酸化還元酵素」として稼動していると言われているが詳細は明らかになっておらず、今後の研究が待たれる。
複合体II
[編集]
複合体IIはSDHA・SDHB・SDHC・SDHDの4つのタンパク質サブユニットから構成され、コハク酸に由来する追加の電子がキノンプールに入り、FADを介してキノンに移される。脂肪酸やグリセロール3-リン酸等の別の電子供与体も、キノンに電子を供給できる。複合体IIは複合体Iと平行な電子伝達経路であるが、複合体Iとは異なり、この経路では膜間空間にプロトンが輸送されない。このため、複合体IIでは電子伝達系全体にもたらすエネルギーが少ない。
複合体II はコハク酸の酸化およびフマル酸の還元の両方向の反応を担い、以下の役割をになう。
- 好気条件 — コハク酸からキノンへの電子伝達を行う「コハク酸:ユビキノン酸化還元酵素」
- 嫌気条件 — ロドキノールからフマル酸への電子伝達を行う「ロドキノール:フマル酸酸化還元酵素」
呼吸鎖複合体では唯一、プロトンの電気化学的ポテンシャル形成には関与しないが、嫌気条件の反応と共役して複合体 I のプロトンポンプ機構を稼動させるシステムをになう。
複合体II は以下の構成からなる。
- 表在性サブユニット
- コハク酸、フマル酸の酸化還元に関わるフラビンタンパク質 (FAD)
- 膜内サブユニット
- Fe-S タンパク質
- シトクロム b(ユビキノン酸化還元に関わる)
好気的な電子伝達は以下の手順で行われる。
収支式は
- コハク酸 + ユビキノン → フマル酸 + ユビキノール
嫌気的な電子伝達は以下の手順で行われる。
- 複合体I 由来のロドキノール → Fe-S クラスター → フマル酸
収支式は
- フマル酸 + 2 プロトン + ロドキノール → コハク酸 + ロドキノン
複合体IIはフマル酸還元酵素を起源とする。その後ユビキノン酸化能などを獲得していき、現在の形になったと考えられる。
複合体III
[編集]
複合体IIIでは複合体Iあるいは複合体IIにて生じたユビキノールを酸化してスカラー反応(膜の内側で還元反応が起こり、それによって膜の外側で酸化反応が起こってプロトンを間接的に放出する機構)によってプロトンを膜外に放出する。反応式は以下の通りである。
- ユビキノール+2シトクロムc (Fe3+) +2H+in → ユビキノン+2シトクロムc (Fe2+) +4H+out
電子伝達体としてシトクロムcの還元型を生じ、次の複合体IVに電子伝達を行う。
複合体IIIでは、ユビキノンサイクルが非対称なプロトンの吸収/放出によってプロトン勾配を作る。QO部位のユビキノールから2つの電子が除かれ、膜間空間に位置する水可溶電子キャリアであるシトクロムcに伝達される。続いて別の2つの電子はQi部位に至り、ここでユビキノンのキノン部分がキノールに還元される。プロトン勾配は、QO部位でのキノールの酸化で形成され、Qi部位でキノールを形成する(合計で6つのプロトンが移動する。2つがキノンをキノールに還元し、2分子のユビキノールから2つのプロトンが放出される)。
アンチマイシンA等の作用で電子伝達が減ると、複合体IIIから酸素分子に直接電子が渡るようになり、超酸化物が形成される。
複合体IIIはユビキノールからシトクロム cに電子伝達を行い、正しくは「ユビキノール:シトクロムc 酸化還元酵素」と呼ばれる。好気呼吸を行う真核生物はすべてミトコンドリア内膜に複合体 III を所持している。また、葉緑体のシトクロム b6/f 複合体は複合体 III に対応する。現在、ウシシトクロム bc1 複合体の立体構造が明らかになっている。複合体 III の構成は以下のようになっている。
- シトクロム b(ユビキノールの酸化を行う)
- リスケ鉄硫黄タンパク質
- シトクロム c1(シトクロム c に電子伝達を行う)
葉緑体ではシトクロム b のヘムが b6 であり、シトクロム c1 の代わりにシトクロム f およびサブユニット IV が結合している。
電子伝達は以下の手順で行われる。
- ユビキノール → リスケ Fe-S タンパク質 → シトクロム cFe2+
ただし、シトクロム b でのスカラー反応により、以下の電子伝達も行われる。
- ユビキノール → ヘム bL → ヘム bH → リスケ Fe-S タンパク質 → シトクロム cFe2+
複合体IIIはシトクロム b を起源に Fe-S タンパク質およびシトクロム c が付加されてできたとされている。
複合体IV
[編集]
複合体IVでは複合体IIIで生じた還元型シトクロムcを酸化してプロトンポンプ機構によりプロトンを膜外に放出すると同時に、好気呼吸の最終電子受容体である酸素に電子伝達を行ない、水を生成する。反応式は以下の通りである。
- O2+4シトクロムc2++8H+in → 2H2O+4シトクロム3++4H+out
細菌ではシトクロムcの代わりにキノン(メナキノン、カルダリエラキノンなど)が用いられている。ただし、キノール酸化酵素の場合はプロトンポンプ機構ではなくスカラー反応によってプロトンが放出される。
複合体IVでは、4分子のシトクロムcから4つの電子が酸素分子に移され、2分子の水が形成される。同時に、4つのプロトンがマトリックス側から除かれ、プロトン勾配が形成される。シトクロムcオキシダーゼの作用は、シアン化物によって阻害される。
複合体IVは還元型シトクロムcあるいはユビキノール(真核生物はシトクロムc、一部の原核生物はユビキノールあるいはメナキノール)から最終電子受容体へ電子伝達を行う。シトクロムcを酸化するものは「シトクロムcオキシダーゼ」と呼ばれる。電子伝達の最終の反応をになう重要な酵素であり、この酵素の存在がゆえに好気呼吸が成立すると言っても過言ではない。好気呼吸を行う全生物がこの複合体を所持している。現在、脱窒細菌である Paracoccus denitrificans の複合体 IV の立体構造が明らかになっている。複合体 IV の構成は以下の通りである。
- サブユニットI(銅原子、ヘム a3、a を持ちプロトンポンプ機構および最終電子受容に関与する)
- サブユニットII(銅原子を持ち、還元型シトクロムcの酸化を行う)
- サブユニットIII(立体構造の安定化)
- サブユニットIV(立体構造の安定化)
サブユニットI, IIでシトクロムcオキシダーゼ活性を発揮することが明らかになっている。また、上記のサブユニット構成は真核生物のものだが、原核生物はサブユニットI に配位されているヘムの種類が異なっている(ヘムb,oなど)。
電子伝達は以下の手順で行われる。
- シトクロム c Fe2+ → ヘムa,a3 → 酸素(最終電子受容体)
複合体IVは嫌気呼吸の硝酸塩呼吸をになう NOR(一酸化窒素還元酵素)および N2OR(亜酸化窒素還元酵素)を起源に持つとされている。その後、これらの酵素が酸素への耐性を獲得したものが複合体IVとされている。
プロトン濃度勾配の生成
[編集]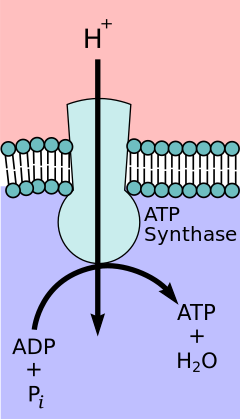
複合体I、III、IVを電子1個が通過すると、約5個のプロトンが膜外に放出される。したがって、クエン酸回路で得られたNADHやFADH2の総数を合わせると、グルコース1分子辺り計100個以上のプロトンが膜外に放出される。これによって膜の内側のpHはおよそ8.0、膜の外側はpH7.0と10倍のプロトン濃度勾配が形成される。
ATP合成酵素(ミトコンドリアor細胞膜、F0F1)はプロトン濃度勾配を利用し、酸化的リン酸化によってアデノシン三リン酸 (ATP) の合成を行う。ATP合成酵素のF0部分は、プロトンをマトリックス側に戻すイオンチャネルとして働く。この逆流により酸化型の電子キャリアを生み出す際に、自由エネルギーが放出される。自由エネルギーは、複合体のF1部分に触媒されるATP合成を駆動する。プロトン濃度勾配が電子伝達系と酸化的リン酸化を共役させるというプロセスは化学浸透共役説によって説明されるもので、これはノーベル化学賞受賞者のピーター・ミッチェルが提唱したものである。ATP合成酵素を呼吸鎖複合体Vとする教科書も存在している。実際、高等学校の生物学では酸化的リン酸化も電子伝達系に含んでいる場合も多い。しかしながら、多くの専門書では呼吸鎖複合体はIVまでしか存在せず、『ATP合成酵素』として表記されている。
また、プロトン濃度勾配を用いて、ATPの膜外への放出や共輸送によって膜内に物質を取り込むこともできる。
ミトコンドリアの役割
[編集]ミトコンドリアはピルビン酸と脂肪酸、酸素、ADP、Pi(リン酸)を周囲の細胞質から取り込み、ピルビン酸と脂肪酸はマトリックス内でアセチルCoAに変えられ、クエン酸回路を経由することでNADHと二酸化炭素に分解される。二酸化炭素はミトコンドリア外に排出される。
NADHは内膜に移り、NADに変換される過程でNADH脱水素酵素複合体、チトクロム複合体、チトクロム酸化酵素複合体の3呼吸酵素複合体からなる電子伝達系へ電子を供給し、電子伝達系はプロトン(H+)をマトリックス側から内外包膜の膜間部分に放出する。
3呼吸酵素複合体と同じく内膜に付いたATP合成酵素は膜間部分のプロトンをマトリックス側に戻る時のエネルギーによって、ADPとPiから大量のATPを合成する。
嫌気性分解では1分子のグルコースから2分子のATPしか得られなかったのが、ミトコンドリアによる好気性分解によって、1分子のグルコースから38分子のATPが合成できるようになった[4]。
ミトコンドリアの遺伝子の欠落
[編集]ミトコンドリアは自身の環状DNAを持ち、多くのタンパク質合成を行なえるが、内部で働くタンパク質の一部などは、宿主である細胞のタンパク質生産に依存しているものがある。
- ATP合成酵素
- ATP合成酵素を作る為に必要な8つのタンパク質遺伝子の内、2つはミトコンドリアにあるが、6つは細胞核のゲノムによって生産されており、これらの細胞側で作られたサブユニット・タンパク質がミトコンドリアへ運ばれ、他のミトコンドリア製のサブユニット・タンパク質と組合わされてATP合成酵素が完成し、内膜で機能を発揮する。
- 解糖系
- 好気性細菌時代には備えていたと考えられる解糖系は、宿主である細胞が備えているために失われている。解糖は細胞側で行なわれる。
- tRNA
- ミトコンドリア内でタンパク質合成時に必要なtRNAの内のいくつかはミトコンドリアで作れないために、宿主の細胞から完成したtRNAを持ってきて使用している[4]。
光合成における電子伝達系
[編集]
シトクロムb6/f複合体では光化学系IIから生じたプラストキノン (PQ) を酸化してスカラー反応によって4個のプロトンをチラコイド膜内に放出する。そして、電子をプラストシアニン (PC) に伝達し、光化学系Iに電子伝達を行う。反応式は以下の通りである。
- プラストキノール+酸化型プラストシアニン+2H+out → プラストキノン+還元型プラストシアニン+4H+in
チラコイド内腔に放出されたプロトンはプロトン濃度勾配を利用してATP合成酵素(葉緑体、CFoCF1)でATP合成に用いられる(光リン酸化)。シトクロムb6/f複合体は呼吸鎖複合体IIIに該当し、反応もよく似ている。
酸化的リン酸化反応において、電子は電子伝達系を通って、NADH等の低エネルギーの電子供与体から酸素等の電子供与体に運ばれる。光リン酸化では、高エネルギーの電子供与体と電子受容体の形成に日光のエネルギーが使われる。その後、電子は別の電子伝達系によって電子供与体から電子受容体に移動する。
光合成の電子伝達系は、上述の酸化鎖と多くの点で似ている。これらは可動の脂質可溶キャリア(キノン)と可動の水可溶キャリア(シトクロム等)を用いる。
細菌における電子伝達系
[編集]一般的に、細菌の電子伝達経路は誘導可能である。その環境に応じ、細菌は異なる貫膜複合体を合成し、細胞膜内に異なる電子伝達系を作り出す。細菌は、複数の脱水素酵素、末端オキシダーゼ及び末端レダクターゼを含むDNAライブラリーから電子伝達系を選択する。このことから、細菌の電子伝達系は、分岐式、モジュール式、誘導可能であると言われる。
フマル酸脱水素酵素
真核生物では、NADHは最も重要な電子供与体である。関連する電子伝達系は、以下の通りである。
NADH → 複合体 I → ユビキノン → 複合体 III → シトクロム c → 複合体 IV → O2
ここで、複合体I、III、IVはプロトンポンプ、ユビキノンとシトクロムcは電子キャリアであり、電子受容体は酸素分子である。
細菌や古細菌等の原核生物では、電子供与体や電子受容体は種類がさらに多いため、状況はより複雑である。一般的な細菌の電子伝達系は、以下のようなものである。
電子供与体→ 脱水素酵素
↓
電子供与体→ キノン →オキシダーゼまたはレダクターゼ→電子受容体
↓
bc1
↓
電子供与体→ シトクロム →オキシダーゼまたはレダクターゼ→電子受容体
電子は、脱水素酵素、キノンプール、シトクロム電子キャリアの3つの位置から電子伝達系に入ることができる。この3つの位置は、その後のより小さな、酸化還元反応全体に対するギブス自由エネルギーの変化に対応する。
個々の細菌は、しばしば同時に複数の電子伝達系を用いる。細菌は、多くの異なる電子供与体、脱水素酵素、オキシダーゼやレダクターゼ、電子受容体を用いることができる。例えば、大腸菌は(グルコースをエネルギー源として好気的に育てると)、2種類の異なるNADH脱水素酵素と2種類の異なるキノールオキシダーゼを用い、合計で4種類の異なる電子伝達系が同時に動いている。
全ての電子伝達系の共通の特徴は、プロトン勾配を作るためのプロトンポンプの存在である。細菌の電子伝達系には、ミトコンドリアと同様に3つか、または1ないし2つのプロトンポンプを持つ。
電子供与体
[編集]今日の生物圏では、最も一般的な電子供与体は有機分子である。有機分子をエネルギー源として用いる生物は、有機栄養生物と呼ばれる。動物、菌類、原生成物等の有機栄養生物と植物、菌類等の光合成生物で、全ての生物の大多数を占める。
原核生物の中には、無機物質をエネルギー源として用いることのできるものもあり、このような生物は無機栄養生物と呼ばれる。無機の電子供与体には、水素、一酸化炭素、アンモニア、亜硝酸塩、硫黄、硫化物、第一鉄イオン等がある。無機栄養生物は、地球の表面から数千m地下の岩石形成領域で生育しているものも発見されている。その分布域の広さから、実際は無機栄養生物は、有機栄養生物や光合成生物を上回る数が生息しているのかもしれない。
この種の代謝は、有機分子の利用よりも先立っているはずであり、エネルギー源としての無機の電子供与体の利用は、特に進化学の分野で興味が持たれている。
脱水素酵素
[編集]細菌は様々な電子供与体を用いることができる。有機分子がエネルギー源になる場合は、電子供与体はNADHかコハク酸であり、この時電子はNADH脱水素酵素かコハク酸脱水素酵素を通して電子伝達系に入る。その他、様々なエネルギー源に対し、ギ酸脱水素酵素、乳酸脱水素酵素、グリセルアルデヒド-3-リン酸脱水素酵素、ヒドロゲナーゼ等、様々な脱水素酵素が用いられる。これらの脱水素酵素にはプロトンポンプであるものや電子をキノンプールに集めるものがある。
キノンキャリア
[編集]キノンは、膜に埋め込まれた大きく比較的不動の分子複合体を通して電子とプロトンを運ぶ脂質可溶キャリアである。細菌は、ミトコンドリアが使うキノンと同じユビキノンと、関連するメナキノン等の関連するキノンを用いる。
プロトンポンプ
[編集]プロトンポンプは、膜の内外にプロトン勾配を作り出すプロセスである。プロトンは物理的に膜を通り抜けることができ、この現象はミトコンドリアの複合体I及びIVで見られる。同様の作用は、電子が反対側に動くことによっても作り出される。その結果、プロトンが細胞質側から消え、ペリプラズム側に現れたように見える。ミトコンドリアの複合体IIIはこの2つ目の型のプロトンポンプで、キノン(Qサイクル)によって仲介される。
全てではないが脱水素酵素の一部もプロトンポンプである。オキシダーゼやレダクターゼのほとんどはプロトンポンプであるが、違うものもある。シトクロムbc1は、全てではないが多くの細菌で見られるプロトンポンプである(大腸菌では見られない)。その名前が示す通り、細菌のbc1は、ミトコンドリアのbc1(複合体III)に似ている。
プロトンポンプは、電子伝達プロセスの中心であり、膜の内外での電気化学的勾配を作り、ATP合成酵素がATPを合成できるようにする。
シトクロム電子キャリア
[編集]シトクロムは、鉄を含む色素であり、2つの非常に異なった環境で見られる。
シトクロムの一部は水可溶キャリアであり、膜に埋め込まれた大きく不動の分子構造を通して電子を運ぶ。ミトコンドリア内の可動のシトクロム電子キャリアは、シトクロムcである。細菌は、多くの異なる可動のシトクロム電子キャリアを用いる。
別の種類のシトクロムは、複合体IIIやIV等の大きな分子中で見られる。これらの機能も電子キャリアであるが、非常に異なる点は、分子内の固体環境に存在している点である。
電子は、可動のシトクロムかキノンのキャリアから電子伝達系内に入る。例えば、無機の電子供与体由来の電子は、シトクロムから電子伝達系に入る。酸化還元レベルがNADHより大きい電子が入れば、電子伝達系は逆に動いて高エネルギー分子を作る。
末端のオキシダーゼとレダクターゼ
[編集]細菌が好気的環境下で育つと、末端の電子受容体である酸素分子は、オキシダーゼと呼ばれる酵素の働きで還元されて水となる。細菌が嫌気的な環境下で育つと、末端の電子受容体はレダクターゼと呼ばれる酵素で還元される。
ミトコンドリアでは、末端の膜複合体である複合体IVはシトクロムオキシダーゼである。好気性細菌は、多くの異なる末端オキシダーゼを用いる。例えば大腸菌はシトクロムオキシダーゼもbc1複合体も持たない。好気的環境下では、どちらもプロトンポンプである2つの異なるキノールオキシダーゼを用いて酸素を水に還元する。
末端の電子受容体に酸素を用いない嫌気性細菌は、各々の末端電子受容体に応じたレダクターゼを持つ。例えば大腸菌は、その環境で入手できる受容体に応じて、ギ酸レダクターゼ、硝酸レダクターゼ、亜硝酸レダクターゼ、DMSOレダクターゼまたはトリメチルアミン-N-オキシドレダクターゼを用いる。
末端のオキシダーゼとレダクターゼのほとんどは誘導可能である。これらは周囲の環境に応じ、必要に応じて合成される。
電子受容体
[編集]嫌気的な環境下では、硝酸塩、亜硝酸塩、第一鉄イオン、硫黄、二酸化炭素やギ酸等の小分子が電子受容体として用いられる。
電子伝達系は酸化還元プロセスであるため、2つの酸化還元対の合計として記述できる。例えばミトコンドリアの電子伝達系は、NAD+/NADHの酸化還元対とO2/H2Oの酸化還元対の和として記述できる。NADHは電子供与体、O2は電子受容体である。
熱力学的に、全ての供与体-受容体の組合せが可能な訳ではない。受容体の酸化還元ポテンシャルは、供与体のものと比べて正でなければならない。さらに、実際の環境条件は、標準的な酸化還元ポテンシャルを適用できる「標準的な」条件(1 mol濃度、分圧1 atm、pH7)とはかなり異なる。例えば、水素産生細菌は周囲の水素分圧が10-4 atmの環境で生育する。関連する酸化還元反応は、「標準的な」条件下では熱力学的に不可能である。
関連用語
[編集]出典
[編集]- ^ Murray, Robert K.; Daryl K. Granner; Peter A. Mayes; Victor W. Rodwell (2003). Harper's Illustrated Biochemistry. New York, NY: Lange Medical Books/ MgGraw Hill. pp. 96. ISBN 0-07-121766-5
- ^ Karp, Gerald (2008). Cell and Molecular Biology (5th ed.). Hoboken, NJ: John Wiley & Sons. p. 194. ISBN 978-0-470-04217-5
- ^ a b Garrett & Grisham, Biochemistry, Brooks/Cole, 2010, pp 598-611
- ^ a b 黒岩常祥著 『ミトコンドリアはどこからきたか』 日本放送出版 2000年6月30日第1刷発行 ISBN 4140018879
- Fenchel T; King GM; Blackburn TH (September 2006). Bacterial Biogeochemistry: The Ecophysiology of Mineral Cycling (2nd ed.). Elsevier. ISBN 978-0-12-103455-9
- Lengeler JW; Drews G; Schlegel HG (editors) (January 1999). Biology of the Prokaryotes. Blackwell Science. ISBN 978-0-632-05357-5
- Nelson DL; Cox MM (April 2005). Lehninger Principles of Biochemistry (4th ed.). W. H. Freeman. ISBN 978-0-7167-4339-2
- Nicholls DG; Ferguson SJ (July 2002). Bioenergetics 3. Academic Press. ISBN 978-0-12-518121-1
- Stumm W; Morgan JJ (1996). Aquatic Chemistry (3rd ed.). John Wiley & Sons. ISBN 978-0-471-51185-4
- Thauer RK; Jungermann K; Decker K (March 1977). “Energy conservation in chemotrophic anaerobic bacteria”. Bacteriol Rev 41 (1): 100–80. PMC 413997. PMID 860983.
- White D. (September 1999). The Physiology and Biochemistry of Prokaryotes (2nd ed.). Oxford University Press. ISBN 978-0-19-512579-5
- Voet D; Voet JG (March 2004). Biochemistry (3rd ed.). John Wiley & Sons. ISBN 978-0-471-58651-7
- Kim HS.; Patel, K; Muldoon-Jacobs, K; Bisht, KS; Aykin-Burns, N; Pennington, JD; Van Der Meer, R; Nguyen, P et al. (January 2010). “SIRT3 is a mitochondria-localized tumor suppressor required for maintenance of mitochondrial integrity and metabolism during stress”. Cancer Cell 17 (1): 41–52. doi:10.1016/j.ccr.2009.11.023. PMC 3711519. PMID 20129246.
外部リンク
[編集]- 複合体Iの電子移動経路
- 酸化的リン酸化 (英語)
- 電子伝達系と酸化的リン酸化
- Electron Transport Chain Complex Proteins - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス
- Khan Academy, video lecture
- UMich Orientation of Proteins in Membranes families/superfamily-3 - Complexes with cytochrome b-like domains
- UMich Orientation of Proteins in Membranes families/superfamily-4 - Bacterial and mitochondrial cytochrome c oxidases
- UMich Orientation of Proteins in Membranes families/superfamily-2 - Photosynthetic reaction centers and photosystems
- UMich Orientation of Proteins in Membranes families/superfamily-78 - Cytochrome PORN renodoxin reductase
- UMich Orientation of Proteins in Membranes families/superfamily-130 - Electron transfer flavoproteins
