二クロム酸ナトリウム
| 二クロム酸ナトリウム | |
|---|---|
| |

| |
sodium dichromate | |
| 識別情報 | |
| CAS登録番号 | 10588-01-9 |
| PubChem | 25408 |
| ChemSpider | 23723 |
| EC番号 | 234-190-3 |
| 国連/北米番号 | 3288 |
| RTECS番号 | HX7750000 HX7750000(2水和物) |
| |
| |
| 特性 | |
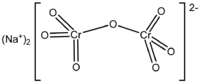
| 化学式 | Na2Cr2O7 |
| モル質量 | 261.97 g/mol(無水物) 298.00 g/mol(2水和物) |
| 密度 | 2.52 g/cm3 |
| 融点 |
356.7 °C |
| 沸点 |
400 °C(分解) |
| 水への溶解度 | 730 g/L (25 °C) |
| 危険性 | |
| 安全データシート(外部リンク) | ICSC 1369 |
| EU分類 | 酸化剤 (O) Carc. Cat. 2 Muta. Cat. 2 Repr. Cat. 2 猛毒 (T+) 刺激性 (Xn) 腐食性 (C) 環境への危険性 (N) |
| EU Index | 024-004-00-7(無水物) 024-004-01-4(2水和物) |
| NFPA 704 | |
| Rフレーズ | R45 R46 R60 R61 R8 R21 R25 R26 R34 R42/43 R48/23 |
| Sフレーズ | S53 S45 S60 S61 |
| 半数致死量 LD50 | 50 mg/kg |
| 関連する物質 | |
| その他の陰イオン | クロム酸ナトリウム モリブデン酸ナトリウム タングステン酸ナトリウム |
| その他の陽イオン | 二クロム酸カリウム 二クロム酸アンモニウム |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
二クロム酸ナトリウム(にクロムさんナトリウム、英: sodium dichromate)もしくは、重クロム酸ナトリウム(じゅうクロムさんナトリウム)は、化学式が Na2Cr2O7 と表されるナトリウムの二クロム酸塩である。通常は2水和物の Na2Cr2O7・2H2O として扱われる。事実上、全てのクロム鉱石は二クロム酸ナトリウムを経て変化し、毎年数百万kgの二クロム酸ナトリウムが生産されている[1]。反応性や応用の点からは、二クロム酸ナトリウムは二クロム酸カリウムと非常によく似ている。しかしナトリウム塩の方がカリウム塩よりも約20倍も水に良く溶け、当量が小さいため、望ましい場合が多い[2]。
生産
[編集]二クロム酸ナトリウムは、酸化クロム(III)を含む鉱物の中で大量に生産される。鉱物は、酸素の存在下、1000 °Cで塩基、特に炭酸カルシウムと融合する。
この過程でクロムは溶解し、熱水に抽出される。この段階で、アルミニウムや鉄等、鉱物に含まれる他の成分はほとんど溶けない。得られた溶液を硫酸や二酸化炭素で酸性化することで二クロム酸が得られ、結晶化によって2水和物として単離される。クロム(VI)は、特に塵状のときに毒性があるので、これらを扱う工場は厳しく規制されている。例えば、精製所の排水に対しては還元剤を用いてクロム(VI)を環境毒性の少ないクロム(III)に還元する処理が行われる[1]。この塩に対しては、19.5 °C以下の10水和物 (CAS# 13517-17-4) から、6水和物、4水和物、2水和物等、様々な種類の水和物が知られている。62 °C以上では、結合水を失い無水物となる。
反応
[編集]二クロム酸塩やクロム酸塩は酸化剤として働く。革なめしでは、二クロム酸ナトリウムはまず二酸化硫黄で還元される。
有機合成においては[2]、ベンジル基やアリル基のC-H結合をカルボニル誘導体に酸化する。例えば、2,4,6-トリニトロトルエンは酸化されてカルボン酸になる[3]。同様に、2,3-ジメチルナフタレンは2,3-ナフタレンジカルボン酸に酸化される[4]。
第二級アルコールはケトンに酸化される。例えば、メントールはメントンに[5]、ジヒドロコレステロールはコレスタノンになる[6]。
カリウム塩と比べ、二クロム酸ナトリウムの主な利点は水や酢酸等の極性溶媒に対する溶解性の大きさである。
安全性
[編集]六価クロムを含む他の化合物と同様に、二クロム酸ナトリウムは有害であると考えられている。また、発がん性を持つことも知られている[7]。
脚注
[編集]- ^ a b Gerd Anger, Jost Halstenberg, Klaus Hochgeschwender, Christoph Scherhag, Ulrich Korallus, Herbert Knopf, Peter Schmidt, Manfred Ohlinger, "Chromium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.
- ^ a b Freeman, F. "Sodium Dichromate" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.
- ^ Clarke, H. T.; Hartman, W. W. (1941). "2,4,6-Trinitrobenzoic Acid". Organic Syntheses (英語).; Collective Volume, vol. 1, p. 543
- ^ Friedman, L. (1973). "2,3-Naphthalenedicarboxylic Acid". Organic Syntheses (英語).; Collective Volume, vol. 5, p. 810
- ^ L. T. Sandborn (1929). "l-Menthone". Organic Syntheses (英語). 9: 59.; Collective Volume, vol. 1, p. 340
- ^ W. F. Bruce (1941). "Cholestanone". Organic Syntheses (英語).; Collective Volume, vol. 2, p. 139
- ^ ILO 1369 - Sodium Dichromate [1]



