 滴定の模式図。ビュレットから試薬を少しずつ滴下し、pH変化を測定する。
滴定の模式図。ビュレットから試薬を少しずつ滴下し、pH変化を測定する。
中和滴定曲線(ちゅうわてきていきょくせん)とは、酸と塩基の中和滴定における、水素イオン指数変化をグラフにしたものである。ここでは水溶液中における中和滴定曲線について、その求め方について解説する。
水素イオン指数  は、水素イオン活量を
は、水素イオン活量を  と表すとき、次式により定義される。なお、対数 (log) は底を10とする常用対数を使用する。
と表すとき、次式により定義される。なお、対数 (log) は底を10とする常用対数を使用する。

なお、活量はデバイ-ヒュッケルの式で近似することが可能であるが、計算が極めて煩雑となるため活量計数はすべて1と仮定し、ここでは活量の代わりにモル濃度を用いる。しかし0.1mol/l程度の水溶液でも活量によるpHの変化は0.1〜0.5程度に及ぶことに注意する必要がある。一般に弱酸を滴定する場合、pHは計算値より低い方へシフトする。イオンの電荷が大きいとき程、この影響は著しい。水素イオンのモル濃度すなわち水素イオン濃度は ![{\displaystyle {[\mathrm {H} ^{+}]}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1df4eead7afb2e3cdcf571a782643d7cc1217007) で表す。
で表す。
![{\displaystyle \mathrm {pH} =-\log _{10}[\mathrm {H} ^{+}]=\log _{10}{\frac {1}{[\mathrm {H} ^{+}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dd162944db28b6b8dc678e0f43a491c953f080d6)
また、溶液のpHを求めるには、まず水素イオン濃度を求めることになる。これには以下のことを考慮する。
これらを用いてそれぞれの電離平衡に関する質量作用の法則の式を立てる。次に
- 溶質の物質収支に関する式
- 電離により生成したイオンについて電気的中性原理の式
これらの連立方程式を解くことになる。また滴定に伴い溶液の体積が増加するため、濃度変化も考慮しなければならない。
塩酸を水酸化ナトリウム水溶液で滴定する場合を考える。
強酸および強塩基は完全に電離しているものと仮定する。また水の自己解離の化学平衡は以下のようになる。またオキソニウムイオン (H3O+)は水素イオンとして扱う。

![{\displaystyle K_{w}=[{\mbox{H}}^{+}][{\mbox{OH}}^{-}]=1.008\times 10^{-14}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/13d0bf8a998ce93edf25b116b53fb06906c90dea)
物質収支を考慮し、塩酸の全濃度 とすると、塩酸はすべてイオン化しているから
とすると、塩酸はすべてイオン化しているから
![{\displaystyle {\ce {C_{A}\ = \ [Cl^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f57f93d938fee2c74188485c738530c262a896ff)
また電気的中性の原理より
![{\displaystyle {\ce {{[H^{+}]}+[{Na}^{+}]\ =\ {[{OH}^{-}]}+[{Cl}^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/767c1c8ceace68ba954401352cbb0b63bd344dfb)
これらの式から水素イオン濃度[H+]に関する二次方程式が得られる。
![{\displaystyle [{\mbox{H}}^{+}]^{2}+[{\mbox{H}}^{+}]([{\mbox{Na}}^{+}]-[{\mbox{Cl}}^{-}])-K_{w}=0\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e532de3f2ce7cb6d3057c3699517dd47fdd353bf)
また塩酸の全濃度  は、滴定前の塩酸の体積を
は、滴定前の塩酸の体積を  、塩酸の初濃度を
、塩酸の初濃度を  、滴下した水酸化ナトリウム水溶液の体積を
、滴下した水酸化ナトリウム水溶液の体積を  、水酸化ナトリウム水溶液の初濃度を
、水酸化ナトリウム水溶液の初濃度を  とし、水酸化ナトリウムおよび、生成した塩化ナトリウムはすべて電離しているとすると、ナトリウムイオンの物質量は
とし、水酸化ナトリウムおよび、生成した塩化ナトリウムはすべて電離しているとすると、ナトリウムイオンの物質量は  となるから
となるから
![{\displaystyle C_{A}={[{\mbox{Cl}}^{-}]}={\frac {C_{A0}V_{A}}{V_{A}+V_{B}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a551c465a1f9e9f139c7793084a15a82620a5521)
![{\displaystyle {[{\mbox{Na}}^{+}]}={\frac {C_{B0}V_{B}}{V_{A}+V_{B}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1560d71151b57fe50fc6e97e450606dfd4a94065)
この二次方程式を解の公式により解き、正の根が水素イオン濃度となり、水素イオン濃度 ![{\displaystyle {[\mathrm {H} ^{+}]}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1df4eead7afb2e3cdcf571a782643d7cc1217007) を
を  に変換すればよい。
に変換すればよい。
![{\displaystyle {[{\mbox{H}}^{+}]}={\frac {-[{\mbox{Na}}^{+}]+[{\mbox{Cl}}^{-}]+{\sqrt {([{\mbox{Na}}^{+}]-[{\mbox{Cl}}^{-}])^{2}+4K_{w}}}}{2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b2c96a04140e51859ce1d9a833cf9f5b40fa4a82)
| 0.1mol/l塩酸10mlを0.1mol/l水酸化ナトリウムVmlで滴定
|
| 滴下量(VB) |
0ml |
5ml |
10ml |
15ml |
20ml
|
| pH(計算値)
|
1.00 |
1.48 |
7.00 |
12.30 |
12.52
|
 0.1mol/l塩酸10mlを0.1mol/l水酸化ナトリウムで滴定
0.1mol/l塩酸10mlを0.1mol/l水酸化ナトリウムで滴定
以下のように近似してもほとんど同じ結果を与える。
滴定開始から当量点までは、二次方程式の の項が無視し得るため
の項が無視し得るため
![{\displaystyle [{\mbox{H}}^{+}]+[{\mbox{Na}}^{+}]-[{\mbox{Cl}}^{-}]\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3de3d0dc5365250a20881dbc2f8930e2642571d8) となり
となり
滴定前の塩酸の物質量は  ミリモル、滴下した水酸化ナトリウムの物質量が
ミリモル、滴下した水酸化ナトリウムの物質量が  ミリモルであるから、未反応の塩酸の水素イオンの物質量は
ミリモルであるから、未反応の塩酸の水素イオンの物質量は  ミリモルとなり、滴定中の溶液の体積が
ミリモルとなり、滴定中の溶液の体積が  ミリリットルであるから、これよりモル濃度を計算する。
ミリリットルであるから、これよりモル濃度を計算する。
![{\displaystyle {[{\mbox{H}}^{+}]}={\frac {C_{A0}V_{A}-C_{B0}V_{B}}{V_{A}+V_{B}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a735a3a96962da04e2fc00c1b01eb9baa243c889)

当量点は塩化ナトリウム水溶液となり中性であるから

当量点以降は、二次方程式の ![{\displaystyle [{\mbox{H}}^{+}]^{2}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4059befb31f6c01025ed9fe018d00883f8eac546) の項は充分小さく
の項は充分小さく
-K_{w}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1646c09c1da238f628d6fb48ed7415303116a7ee) となるから
となるから
過剰の水酸化ナトリウムの物質量  と濃度を考える。
と濃度を考える。
![{\displaystyle {[{\mbox{OH}}^{-}]}={\frac {C_{B0}V_{B}-C_{A0}V_{A}}{V_{A}+V_{B}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/03f77c667caf414e240f83a4417dfa17692320de)
![{\displaystyle {[{\mbox{H}}^{+}]}={\frac {K_{w}}{[{\mbox{OH}}^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/37b2100ecb4c70a9cc38a7ab1a22292e2f39e2fe) であるから
であるから
![{\displaystyle {[{\mbox{H}}^{+}]}={\frac {(V_{A}+V_{B})K_{w}}{C_{B0}V_{B}-C_{A0}V_{A}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4100c44990f7f066218877a8d2ce73fe71c79e78)

酢酸を水酸化ナトリウム水溶液で滴定する場合を考える。酢酸では当量点におけるpH変化は著しいが、極めて酸性の弱いシアン化水素酸では当量点のpH変化が不明瞭になる。
水酸化ナトリウムは完全に電離しているものと仮定する。また酢酸の電離平衡は以下のようになる。

![{\displaystyle K_{a}={\frac {[{\mbox{H}}^{+}][{\mbox{CH}}_{3}{\mbox{COO}}^{-}]}{[{\mbox{CH}}_{3}{\mbox{COOH}}]}}=1.75\times 10^{-5}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/280c37c59dff712faf42a1e45ef97aab98ac3700)
- pKa = 4.76
物質収支を考慮し、酢酸の全濃度  とすると
とすると
![{\displaystyle {\ce {C_{A}\ = \ {[CH3COOH]}+ [CH3COO^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fa6d16f9f3a5d43de05247580fa0bf14c450a017)
また電気的中性の原理より
![{\displaystyle {\ce {[H+] + [Na+] \ = \ [OH^{-}] + [CH3COO^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d32cfdb0533211afbdc22708005abb58521ae109)
これらの式および水の自己解離平衡から水素イオン濃度[H+]に関する三次方程式が得られる。
![{\displaystyle [{\mbox{H}}^{+}]^{3}+[{\mbox{H}}^{+}]^{2}(K_{a}+[{\mbox{Na}}^{+}])+[{\mbox{H}}^{+}](K_{a}[{\mbox{Na}}^{+}]-K_{a}C_{A}-K_{w})-K_{a}K_{w}=0\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/40112a9f25687ec82352d4a6660b37ce5e8b5a43)
また酢酸の全濃度  は、滴定前の酢酸の体積を
は、滴定前の酢酸の体積を  、酢酸の初濃度を
、酢酸の初濃度を  、滴下した水酸化ナトリウム水溶液の体積を
、滴下した水酸化ナトリウム水溶液の体積を  、水酸化ナトリウム水溶液の初濃度を
、水酸化ナトリウム水溶液の初濃度を  とすると
とすると

![{\displaystyle {[{\mbox{Na}}^{+}]}={\frac {C_{B0}V_{B}}{V_{A}+V_{B}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1560d71151b57fe50fc6e97e450606dfd4a94065)
この三次方程式の正の実数根が水素イオン濃度となるが解法が複雑となるため、酸性領域では  の影響、塩基性領域では
の影響、塩基性領域では ![{\displaystyle [{\mbox{H}}^{+}]^{3}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a15effe8db67642094518a653c4e94e2c8132195) の項は充分に小さく無視し得るため二次方程式で近似が可能となる。
の項は充分に小さく無視し得るため二次方程式で近似が可能となる。
酸性領域では
![{\displaystyle [{\mbox{H}}^{+}]^{2}+[{\mbox{H}}^{+}](K_{a}+[{\mbox{Na}}^{+}])+K_{a}[{\mbox{Na}}^{+}]-K_{a}C_{A}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1e110dbcd0ca0f457736765748a678110fa72867)
塩基性領域では
![{\displaystyle [{\mbox{H}}^{+}]^{2}(K_{a}+[{\mbox{Na}}^{+}])+[{\mbox{H}}^{+}](K_{a}[{\mbox{Na}}^{+}]-K_{a}C_{A}-K_{w})-K_{a}K_{w}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/52e37ee08d23514fac7767720c0bc3347b3b6572)
| 0.1mol/l酢酸10mlを0.1mol/l水酸化ナトリウムVmlで滴定
|
| 滴下量(VB) |
0ml |
5ml |
10ml |
15ml |
20ml
|
| pH(計算値)
|
2.88 |
4.76 |
8.73 |
12.30 |
12.52
|

| 0.1mol/l酢酸10mlを0.1mol/l水酸化ナトリウムで滴定 |
| 酢酸のpKa = 4.76 |
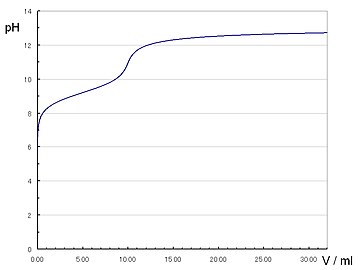
| 0.1mol/lシアン化水素10mlを0.1mol/l水酸化ナトリウムで滴定 |
| シアン化水素酸のpKa = 9.21 |
また以下のような近似が可能であるが、滴定初期および当量点付近で誤差が大きくなる。
滴定前は酢酸の電離度を考える。電離により生成した水素イオンと酢酸イオンの濃度が等しく、電離度が小さいため、未電離の酢酸の濃度 ![{\displaystyle [{\mbox{CH}}_{3}{\mbox{COOH}}]\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/601a1461eb6c5fff6b61a39f3f45da95686bf25e) が、全濃度
が、全濃度  にほぼ等しいと近似して
にほぼ等しいと近似して
![{\displaystyle K_{a}\fallingdotseq {\frac {[{\mbox{H}}^{+}]^{2}}{C_{A0}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a5638b790df979820783a3e90ec3740cba178ec3)
![{\displaystyle {[{\mbox{H}}^{+}]}\fallingdotseq {\sqrt {C_{A0}K_{a}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/54add6defe7d6ea1a0a2be930e22c85f16b51db4)

滴定開始から当量点までは、酢酸の電離平衡の式を変形して
![{\displaystyle \mathrm {pH} ={\mbox{p}}K_{a}+\log _{10}{\frac {[{\mbox{CH}}_{3}{\mbox{COO}}^{-}]}{[{\mbox{CH}}_{3}{\mbox{COOH}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/87db0f5d3be52a6599b86267d0adeda23c3e4e6f)
また、生成した酢酸イオンの物質量は加えた水酸化ナトリウムの物質量にほぼ相当し  、未電離の分子状態の酢酸の物質量はほぼ
、未電離の分子状態の酢酸の物質量はほぼ  であるから
であるから

当量点は酢酸ナトリウム水溶液であるから酢酸イオンの加水分解を考慮する。加水分解により生成した酢酸分子と水酸化物イオンの物質量はほぼ等しいから

![{\displaystyle K_{b}={\frac {[{\mbox{CH}}_{3}{\mbox{COOH}}][{\mbox{OH}}^{-}]}{[{\mbox{CH}}_{3}{\mbox{COO}}^{-}]}}={\frac {K_{w}}{K_{a}}}\fallingdotseq {\frac {[{\mbox{OH}}^{-}]^{2}}{C_{A}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4592b871318d42bc850b749040a5f7bdde7ad752)
これらの式と水の自己解離より
![{\displaystyle {[{\mbox{H}}^{+}]}\fallingdotseq {\sqrt {\frac {K_{a}K_{w}}{C_{A}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eccbd8e3adeeab661ece556a800234e9ea2ca19f)


当量点以降は過剰の水酸化ナトリウムの物質量と濃度を考える。塩酸を水酸化ナトリウムで滴定した場合とほぼ等しい。
![{\displaystyle {[{\mbox{OH}}^{-}]}={\frac {C_{B0}V_{B}-C_{A0}V_{A}}{V_{A}+V_{B}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/03f77c667caf414e240f83a4417dfa17692320de)
![{\displaystyle {[{\mbox{H}}^{+}]}={\frac {K_{w}}{[{\mbox{OH}}^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/37b2100ecb4c70a9cc38a7ab1a22292e2f39e2fe) であるから
であるから
![{\displaystyle {[{\mbox{H}}^{+}]}={\frac {(V_{A}+V_{B})K_{w}}{C_{B0}V_{B}-C_{A0}V_{A}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4100c44990f7f066218877a8d2ce73fe71c79e78)

塩酸をアンモニア水で滴定する場合を考える。アンモニアでは当量点のpH変化が著しいが、より弱い塩基であるピリジンでは当量点は不明瞭になる。
塩酸は完全に電離しているものと仮定する。またアンモニア水の電離平衡は以下のようになる。

![{\displaystyle K_{b}={\frac {[{\mbox{NH}}_{4}^{+}][{\mbox{OH}}^{-}]}{[{\mbox{NH}}_{3}]}}=1.76\times 10^{-5}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/583612f0ca4b72433d4aa824103c0b40181e73d2)
![{\displaystyle K_{a}={\frac {[{\mbox{H}}^{+}][{\mbox{NH}}_{3}]}{[{\mbox{NH}}_{4}^{+}]}}={\frac {K_{w}}{K_{b}}}=5.7\times 10^{-10}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/edfeffeb9ca70cdc72895a171f6d6fd51fc465b4)
- pKa = 9.24
物質収支を考慮し、アンモニアの全濃度を  とすると
とすると
![{\displaystyle {\ce {C_{B}= [NH4+] + [NH3]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0fbfded66cd56670c7b36481c3e0d1f0b00f50ce)
また電気的中性の原理より
![{\displaystyle {\ce {[H+] + [NH4+]\ =\ [OH^{-}] + Cl-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/46f5bb1e5180487a414376a045ecf77774346567)
これらの式および水の自己解離平衡から水素イオン濃度[H+]に関する三次方程式が得られる。
![{\displaystyle [{\mbox{H}}^{+}]^{3}+[{\mbox{H}}^{+}]^{2}(K_{a}+C_{B}-[{\mbox{Cl}}^{-}])-[{\mbox{H}}^{+}](K_{a}[{\mbox{Cl}}^{-}]+K_{w})-K_{a}K_{w}=0\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/38c70d4c22c109e8cf374c73338efaebc71ee7fa)
また塩酸の全濃度  は、滴定前の塩酸の体積を
は、滴定前の塩酸の体積を  、塩酸の初濃度を
、塩酸の初濃度を  、とし、アンモニアの全濃度
、とし、アンモニアの全濃度  は、滴下したアンモニア水の体積を
は、滴下したアンモニア水の体積を  、アンモニア水の初濃度を
、アンモニア水の初濃度を  とすると
とすると
![{\displaystyle C_{A}={[{\mbox{Cl}}^{-}]}={\frac {C_{A0}V_{A}}{V_{A}+V_{B}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a551c465a1f9e9f139c7793084a15a82620a5521)

酸性領域では  の影響は無視し得るため
の影響は無視し得るため
![{\displaystyle [{\mbox{H}}^{+}]^{2}+[{\mbox{H}}^{+}](K_{a}+C_{B}-[{\mbox{Cl}}^{-}])-K_{a}[{\mbox{Cl}}^{-}]\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9e9f350c5d8570fe87ce18d3d0e2fbc1312cdc1d)
塩基性領域では ![{\displaystyle [{\mbox{H}}^{+}]^{3}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a15effe8db67642094518a653c4e94e2c8132195) の項は充分小さく
の項は充分小さく
![{\displaystyle [{\mbox{H}}^{+}]^{2}(K_{a}+C_{B}-[{\mbox{Cl}}^{-}])-[{\mbox{H}}^{+}](K_{a}[{\mbox{Cl}}^{-}]+K_{w})-K_{a}K_{w}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eac33edb5cf7d004618ee64ad7d88ea72a5c2fe0)
| 0.1mol/l塩酸10mlを0.1mol/lアンモニアVmlで滴定
|
| 滴下量(VB) |
0ml |
5ml |
10ml |
15ml |
20ml
|
| pH(計算値)
|
1.00 |
1.48 |
5.27 |
8.94 |
9.24
|

| 0.1mol/l塩酸10mlを0.1mol/lアンモニア水で滴定 |
アンモニウムイオンの |
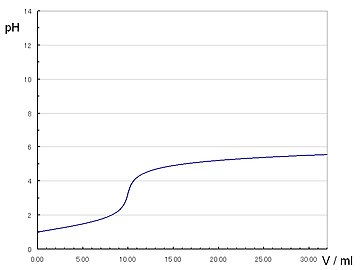
| 0.1mol/l塩酸10mlを0.1mol/lピリジン水溶液で滴定 |
ピリジニウムイオンの |
また以下のような近似が可能であり、アンモニアの場合は誤差は比較的小さい。しかし、より弱い塩基の場合は当量点付近で誤差が大きい。
滴定開始から当量点までは、未反応の塩酸の水素イオンの物質量と濃度を考える。塩酸を水酸化ナトリウムで滴定した場合にほぼ等しい。

当量点は塩化アンモニウム水溶液であるからアンモニウムイオンの酸解離を考慮する。

アンモニウムイオンの酸解離により生成したアンモニア分子と水素イオンの物質量はほぼ等しいから
![{\displaystyle K_{a}\fallingdotseq {\frac {[{\mbox{H}}^{+}]^{2}}{C_{B}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6e875528ca8973367a81b5dc42614b80fac9362d)
![{\displaystyle {[{\mbox{H}}^{+}]}\fallingdotseq {\sqrt {C_{B}K_{a}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5d509a77eadbe057de1f01fa818ae94917e64749)


当量点以降はアンモニウムイオンの電離平衡の式を変形して
![{\displaystyle \mathrm {pH} ={\mbox{p}}K_{a}+\log _{10}{\frac {[{\mbox{NH}}_{3}]}{[{\mbox{NH}}_{4}^{+}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8af330ebcdb7d8b6be870d27fdc934ab3b07e1f1)
また、生成したアンモニウムイオンの物質量は最初に存在した塩酸にほぼ相当し  、分子状態のアンモニアの物質量はほぼ
、分子状態のアンモニアの物質量はほぼ  であるから
であるから

酢酸をアンモニア水で滴定する場合を考える。当量点はやや不明瞭になり、これより弱い酸および塩基の中和では当量点はさらに不明瞭なものになる。
また酢酸、アンモニア水および水の電離平衡は以下のようになる。
![{\displaystyle K_{a1}={\frac {[{\mbox{H}}^{+}][{\mbox{CH}}_{3}{\mbox{COO}}^{-}]}{[{\mbox{CH}}_{3}{\mbox{COOH}}]}}=1.75\times 10^{-5}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b05a1887e57f35ae6b9b420a80f74bf4f9d9e44d)
![{\displaystyle K_{a2}={\frac {[{\mbox{H}}^{+}][{\mbox{NH}}_{3}]}{[{\mbox{NH}}_{4}^{+}]}}={\frac {K_{w}}{K_{b}}}=5.7\times 10^{-10}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b748b4572b7be52057e0a344a2dd6e2f72c1af41)
![{\displaystyle K_{w}=[{\mbox{H}}^{+}][{\mbox{OH}}^{-}]=1.008\times 10^{-14}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/13d0bf8a998ce93edf25b116b53fb06906c90dea)
物質収支を考慮し、酢酸の全濃度を  、アンモニアの全濃度を
、アンモニアの全濃度を  とすると
とすると
![{\displaystyle C_{A}=[{\mbox{CH}}_{3}{\mbox{COOH}}]+[{\mbox{CH}}_{3}{\mbox{COO}}^{-}]\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/989eb3d092cf2bcfc77663f3db4a4f61285d38fd)
![{\displaystyle C_{B}=[{\mbox{NH}}_{4}^{+}]+[{\mbox{NH}}_{3}]\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/aae13ac9c0b8b1ce3a8a134ad13ab60fcc8afbc2)
また電気的中性の原理より
![{\displaystyle [{\mbox{H}}^{+}]+[{\mbox{NH}}_{4}^{+}]=[{\mbox{OH}}^{-}]+[{\mbox{CH}}_{3}{\mbox{COO}}^{-}]\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a86165be91d3bea467daeeffbfd2bee0298c3a7e)
これらの式および水の自己解離平衡から水素イオン濃度[H+]に関する四次方程式が得られる。
![{\displaystyle [{\mbox{H}}^{+}]^{4}+[{\mbox{H}}^{+}]^{3}(K_{a1}+K_{a2}+C_{B})+[{\mbox{H}}^{+}]^{2}(K_{a1}K_{a2}-K_{a1}C_{A}+K_{a1}C_{B}-K_{w})-[{\mbox{H}}^{+}](K_{a1}K_{a2}C_{A}+K_{a1}K_{w}+K_{a2}K_{w})-K_{a1}K_{a2}K_{w}=0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/adf62a43ee1dfcd1236d11a1d4f7f2b2405dcd50)
また酢酸の全濃度  は、滴定前の酢酸の体積を
は、滴定前の酢酸の体積を  、酢酸の初濃度を
、酢酸の初濃度を  、滴下したアンモニア水の体積を
、滴下したアンモニア水の体積を  、とし、アンモニアの全濃度
、とし、アンモニアの全濃度  は、アンモニア水の初濃度を
は、アンモニア水の初濃度を  とすると
とすると


酸性領域ではアンモニウムイオンの解離および  の影響は無視し得るため
の影響は無視し得るため
![{\displaystyle [{\mbox{H}}^{+}]^{2}+[{\mbox{H}}^{+}](K_{a1}+K_{a2}+C_{B})-K_{a1}C_{A}+K_{a1}C_{B}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0e4b26fc7f96bb7a31e5ed1e6dea41b3cdf685fe)
当量点付近では ![{\displaystyle [{\mbox{H}}^{+}]^{4}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d28da52cfbc5acd6d74ff11ccbf3b0b3d32c1301) 項と定数項の寄与は小さく
項と定数項の寄与は小さく
![{\displaystyle [{\mbox{H}}^{+}]^{2}(K_{a1}+K_{a2}+C_{B})+[{\mbox{H}}^{+}](K_{a1}K_{a2}-K_{a1}C_{A}+K_{a1}C_{B}-K_{w})-K_{a1}K_{a2}C_{A}-K_{a1}K_{w}-K_{a2}K_{w}=0\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/80dfb5ec482b0e2e63a6379823458ab2b9f639f5)
塩基性領域では ![{\displaystyle [{\mbox{H}}^{+}]^{4}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d28da52cfbc5acd6d74ff11ccbf3b0b3d32c1301) 項および
項および ![{\displaystyle [{\mbox{H}}^{+}]^{3}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a15effe8db67642094518a653c4e94e2c8132195) 項は充分小さく
項は充分小さく
![{\displaystyle [{\mbox{H}}^{+}]^{2}(K_{a1}K_{a2}-K_{a1}C_{A}+K_{a1}C_{B}-K_{w})-[{\mbox{H}}^{+}](K_{a1}K_{a2}C_{A}+K_{a1}K_{w}+K_{a2}K_{w})-K_{a1}K_{a2}K_{w}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/76ba2076eb6b252b8840671431120f0cdeea50a3)
| 0.1mol/l酢酸10mlを0.1mol/lアンモニアVmlで滴定
|
| 滴下量(VB) |
0ml |
5ml |
10ml |
15ml |
20ml
|
| pH(計算値)
|
2.88 |
4.76 |
7.00 |
8.94 |
9.24
|
 0.1mol/l酢酸10mlを0.1mol/lアンモニア水で滴定
0.1mol/l酢酸10mlを0.1mol/lアンモニア水で滴定
また以下のような近似が可能であるが、滴定初期および当量点付近で誤差が大きくなる。
滴定前は酢酸の電離度を考える。電離により生成した水素イオンと酢酸イオンの濃度が等しいと近似して

滴定開始から当量点までは、酢酸の電離平衡の式を変形して
![{\displaystyle \mathrm {pH} ={\mbox{p}}K_{a}+\log _{10}{\frac {[{\mbox{CH}}_{3}{\mbox{COO}}^{-}]}{[{\mbox{CH}}_{3}{\mbox{COOH}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/87db0f5d3be52a6599b86267d0adeda23c3e4e6f)
また、生成した酢酸イオンの物質量は加えたアンモニアに相当し  、分子状態の酢酸の物質量は
、分子状態の酢酸の物質量は  であるから
であるから

当量点は酢酸アンモニウム水溶液であり、アンモニウムイオンと酢酸イオンの平衡を考える。

ここで生成する酢酸とアンモニアの物質量はほぼ等しい。また酢酸イオンとアンモニウムイオンの濃度もほぼ等しいから、酢酸およびアンモニウムイオンの酸解離定数の積は
![{\displaystyle K_{a1}K_{a2}={\frac {[{\mbox{H}}^{+}]^{2}[{\mbox{CH}}_{3}{\mbox{COO}}^{-}][{\mbox{NH}}_{3}]}{[{\mbox{CH}}_{3}{\mbox{COOH}}][{\mbox{NH}}_{4}^{+}]}}=1.00\times 10^{-14}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bf307939d9d4cc60ffbb9b43be0c86ff03a63822)
これらより以下の式が導かれ、pHは濃度にほとんど依存しない。
![{\displaystyle {[{\mbox{H}}^{+}]}\fallingdotseq {\sqrt {K_{a1}K_{a2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ba29ba16f7dca885e9e6b7906767fdbfcb740923)

当量点以降はアンモニウムイオンの電離平衡の式を変形して
![{\displaystyle \mathrm {pH} ={\mbox{p}}K_{a}+\log _{10}{\frac {[{\mbox{NH}}_{3}]}{[{\mbox{NH}}_{4}^{+}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8af330ebcdb7d8b6be870d27fdc934ab3b07e1f1)
また、生成したアンモニウムイオンの物質量は最初に存在した酢酸にほぼ相当し  、分子状態のアンモニアの物質量はほぼ
、分子状態のアンモニアの物質量はほぼ  であるから
であるから


| 0.1mol/l硫酸10mlを0.1mol/l水酸化ナトリウムで滴定 |
硫酸の |
硫酸を水酸化ナトリウム水溶液で滴定する場合を考える。硫酸は強い二塩基酸であるが二段目の電離はやや不完全である。しかし滴定曲線は2価の強酸としての形に近くpHの急激な変化は第二当量点のみに現れる。
硫酸の一段目は完全に電離しているものと仮定する。また二段目の電離平衡は以下のようになる。

![{\displaystyle K_{a2}={\frac {[{\mbox{H}}^{+}][{\mbox{SO}}_{4}^{2-}]}{[{\mbox{HSO}}_{4}^{-}]}}=1.2\times 10^{-2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5e41a8439a8bca1893e7e3f66546f180ba67db52)
- pKa = 1.92
物質収支を考慮し、硫酸の全濃度を  とすると
とすると
![{\displaystyle {\ce {C_{A}\ = \ [HSO4^{-}] + [SO4^{2-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/88eef6f0bb31488ad951c9236337ecf5afb5d281)
また電気的中性の原理より
![{\displaystyle {\ce {[H+] + [Na+] \ = \ [OH^{-}] + [HSO4^{-}] + 2[SO4^{2-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/74bca24e4526704f654a68c03916057b5d50ec0a)
これらの式および水の自己解離平衡から水素イオン濃度[H+]に関する三次方程式が得られる。
![{\displaystyle [{\mbox{H}}^{+}]^{3}+[{\mbox{H}}^{+}]^{2}(K_{a2}-C_{A}+[{\mbox{Na}}^{+}])+[{\mbox{H}}^{+}](K_{a2}[{\mbox{Na}}^{+}]-2K_{a2}C_{A}-K_{w})-K_{a2}K_{w}=0\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d52962ce23a9506f63d146db0d6b9257d00cdad)
また硫酸の全濃度  は、滴定前の硫酸の体積を
は、滴定前の硫酸の体積を  、硫酸の初濃度を
、硫酸の初濃度を  、滴下した水酸化ナトリウム水溶液の体積を
、滴下した水酸化ナトリウム水溶液の体積を  、水酸化ナトリウム水溶液の初濃度を
、水酸化ナトリウム水溶液の初濃度を  とすると
とすると

![{\displaystyle {[{\mbox{Na}}^{+}]}={\frac {C_{B0}V_{B}}{V_{A}+V_{B}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1560d71151b57fe50fc6e97e450606dfd4a94065)
酸性領域では  の影響は無視し得るため
の影響は無視し得るため
![{\displaystyle [{\mbox{H}}^{+}]^{2}+[{\mbox{H}}^{+}](K_{a2}-C_{A}+[{\mbox{Na}}^{+}])+K_{a2}[{\mbox{Na}}^{+}]-2K_{a2}C_{A}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6315fb4f5435319503b13098cce0863746fd4ed3)
塩基性領域では ![{\displaystyle [{\mbox{H}}^{+}]^{3}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a15effe8db67642094518a653c4e94e2c8132195) の項は充分小さく
の項は充分小さく
![{\displaystyle [{\mbox{H}}^{+}]^{2}(K_{a2}-C_{A}+[{\mbox{Na}}^{+}])+[{\mbox{H}}^{+}](K_{a2}[{\mbox{Na}}^{+}]-2K_{a2}C_{A}-K_{w})-K_{a2}K_{w}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/576599e1eeb2b313c6e66f5c3e83d29e0fa5e1be)
| 0.1mol/l硫酸10mlを0.1mol/l水酸化ナトリウムVmlで滴定
|
| 滴下量(VB) |
0ml |
5ml |
10ml |
15ml |
20ml |
25ml |
30ml
|
| pH(計算値)
|
0.96 |
1.33 |
1.72 |
2.20 |
7.29 |
12.15 |
12.39
|
多段階で電離する酸の解離の計算は大変複雑である。シュウ酸は2価の酸であり、一段目がやや強く電離し、二段目もそれほど小さくないため、第一当量点は明瞭でなく第二当量点のpH変化が著しい。炭酸はより弱酸であるため当量点は不明瞭になる。酒石酸は一段目および二段目の解離定数の差が小さいため、第一当量点は全く検出されず第二等量点のみ顕著に現れる。硫化水素酸は第一当量点のみ観測され、二段目の解離定数が著しく小さいため第二等量点を検出することができない。
リン酸は3価であるが第一および第二当量点で著しいpH変化が見られ、三段目の解離定数が小さいため第三当量点は不明瞭でほとんど観測されない。クエン酸も3価であるが、一段〜三段までの解離定数の差が小さいため、第一および第二当量点は不明瞭で第三当量点のみpHの著しい変化が見られる。
例として、炭酸を水酸化ナトリウム水溶液で滴定する場合を考える。一気圧の二酸化炭素の分圧下でも水溶液の飽和濃度は0.034mol/l程度であり、溶液中ではH2CO3として存在しているのは極一部であり、大部分はCO2であるが、0.1mol/lを仮定し、H2CO3の解離と見做すと一段目の酸解離定数は以下のように表され、二段目の電離平衡とあわせて以下に示す。


![{\displaystyle K_{a1}={\frac {[{\mbox{H}}^{+}][{\mbox{HCO}}_{3}^{-}]}{[{\mbox{H}}_{2}{\mbox{CO}}_{3}]}}=4.45\times 10^{-7}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ee216e506d7c9db332bb8b67d7370b194b896b72)
![{\displaystyle K_{a2}={\frac {[{\mbox{H}}^{+}][{\mbox{CO}}_{3}^{2-}]}{[{\mbox{HCO}}_{3}^{-}]}}=4.78\times 10^{-11}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3d10b8b70f1d28edb99144184ccb0d1e375a7330)


物質収支を考慮し、炭酸の全濃度を  とすると
とすると
![{\displaystyle {\ce {C_{A}\ = \ [H2CO3] + [HCO3^{-}] + [CO3^{2-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/330915f1a213d9b8ec740c7f52a5eb755d555031)
また電気的中性の原理より
![{\displaystyle {\ce {[{H+}] + [Na+]\ =\ [OH^{-}] + [HCO3^{-}] + 2[CO3^{2-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6056d77ab455968e4154ee36f618ba4d8437157d)
これらの式および水の自己解離平衡から水素イオン濃度[H+]に関する四次方程式が得られる。
![{\displaystyle [{\mbox{H}}^{+}]^{4}+[{\mbox{H}}^{+}]^{3}(K_{a1}+[{\mbox{Na}}^{+}])+[{\mbox{H}}^{+}]^{2}(K_{a1}K_{a2}-K_{a1}C_{A}+K_{a1}[{\mbox{Na}}^{+}]-K_{w})-[{\mbox{H}}^{+}](2K_{a1}K_{a2}C_{A}-K_{a1}K_{a2}[{\mbox{Na}}^{+}]+K_{a1}K_{w})-K_{a1}K_{a2}K_{w}=0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b6def2dddcfb4dbc64baaf08d943da1e077f0407)
また炭酸の全濃度  は、滴定前の炭酸の体積を
は、滴定前の炭酸の体積を  、炭酸の初濃度を
、炭酸の初濃度を  、滴下した水酸化ナトリウム水溶液の体積を
、滴下した水酸化ナトリウム水溶液の体積を  、水酸化ナトリウム水溶液の初濃度を
、水酸化ナトリウム水溶液の初濃度を  とすると
とすると

![{\displaystyle {[{\mbox{Na}}^{+}]}={\frac {C_{B0}V_{B}}{V_{A}+V_{B}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1560d71151b57fe50fc6e97e450606dfd4a94065)
酸性領域では第二段階の解離  および
および  の影響は無視し得るため
の影響は無視し得るため
![{\displaystyle [{\mbox{H}}^{+}]^{2}+[{\mbox{H}}^{+}](K_{a1}+[{\mbox{Na}}^{+}])-K_{a1}C_{A}+K_{a1}[{\mbox{Na}}^{+}]\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7f91506623340a64bb597beedb6187717f817d2f)
第一当量点付近では ![{\displaystyle [{\mbox{H}}^{+}]^{4}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d28da52cfbc5acd6d74ff11ccbf3b0b3d32c1301) 項と定数項の寄与は小さく
項と定数項の寄与は小さく
![{\displaystyle [{\mbox{H}}^{+}]^{2}(K_{a1}+[{\mbox{Na}}^{+}])+[{\mbox{H}}^{+}](K_{a1}K_{a2}-K_{a1}C_{A}+K_{a1}[{\mbox{Na}}^{+}]-K_{w})-2K_{a1}K_{a2}C_{A}+K_{a1}K_{a2}[{\mbox{Na}}^{+}]-K_{a1}K_{w}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/560a733e728476a5049ac65b9c500d78f84cbb1c)
塩基性領域では ![{\displaystyle [{\mbox{H}}^{+}]^{4}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d28da52cfbc5acd6d74ff11ccbf3b0b3d32c1301) 項および
項および ![{\displaystyle [{\mbox{H}}^{+}]^{3}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a15effe8db67642094518a653c4e94e2c8132195) 項は充分小さく
項は充分小さく
![{\displaystyle [{\mbox{H}}^{+}]^{2}(K_{a1}K_{a2}-K_{a1}C_{A}+K_{a1}[{\mbox{Na}}^{+}]-K_{w})-[{\mbox{H}}^{+}](2K_{a1}K_{a2}C_{A}-K_{a1}K_{a2}[{\mbox{Na}}^{+}]+K_{a1}K_{w})-K_{a1}K_{a2}K_{w}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0c48c73a8c6cd63f298cdb9d5312181d07274105)
| 0.1mol/l炭酸10mlを0.1mol/l水酸化ナトリウムVmlで滴定
|
| 滴下量(VB) |
0ml |
5ml |
10ml |
15ml |
20ml |
25ml |
30ml
|
| pH(計算値)
|
3.68 |
6.35 |
8.33 |
10.31 |
11.40 |
12.16 |
12.40
|

| 0.1mol/lシュウ酸10mlを0.1mol/l水酸化ナトリウムで滴定 |
シュウ酸の |

| 0.1mol/l炭酸10mlを0.1mol/l水酸化ナトリウムで滴定 |
炭酸の |

| 0.1mol/l酒石酸10mlを0.1mol/l水酸化ナトリウムで滴定 |
酒石酸の |

| 0.1mol/l硫化水素酸10mlを0.1mol/l水酸化ナトリウムで滴定 |
硫化水素酸の |

| 0.1mol/lリン酸10mlを0.1mol/l水酸化ナトリウムで滴定 |
リン酸の |

| 0.1mol/lクエン酸10mlを0.1mol/l水酸化ナトリウムで滴定 |
クエン酸の |
また以下のような近似が可能であるが、滴定初期および当量点付近で誤差が大きくなる。
滴定前は炭酸の電離度を考える。一段目のみの解離を考慮し、二段目は極めて小さいため無視し得る。電離により生成した水素イオンと炭酸水素イオンの濃度が等しいと近似して
![{\displaystyle {[{\mbox{H}}^{+}]}\fallingdotseq {\sqrt {C_{A0}K_{a1}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/36bb1b6f3f597e312d5e88ebe586e0b66d8e025c)

滴定開始から第一当量点までは、炭酸の一段目の電離平衡の式を変形して
![{\displaystyle \mathrm {pH} ={\mbox{p}}K_{a1}+\log _{10}{\frac {[{\mbox{HCO}}_{3}^{-}]}{[{\mbox{H}}_{2}{\mbox{CO}}_{3}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/99880ae534625a9a188621f97fdd8a9dd39c6395)
また、生成した炭酸水素イオンの物質量は加えた水酸化ナトリウムにほぼ相当し  、分子状態の炭酸の物質量はほぼ
、分子状態の炭酸の物質量はほぼ  であるから
であるから

第一当量点は炭酸水素ナトリウム水溶液であり、炭酸水素イオンの不均化を考える。

ここで生成する炭酸および炭酸イオンの物質量はほぼ等しい。次に第一および第二段階の酸解離定数の積は
![{\displaystyle K_{a1}K_{a2}={\frac {[{\mbox{H}}^{+}]^{2}[{\mbox{CO}}_{3}^{2-}]}{[{\mbox{H}}_{2}{\mbox{CO}}_{3}]}}=2.13\times 10^{-17}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b53188672cd36bfacde9db06e0a7e742d56eae67)
これらより以下の式が導かれ、pHは濃度にほとんど依存しない。
![{\displaystyle {[{\mbox{H}}^{+}]}\fallingdotseq {\sqrt {K_{a1}K_{a2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ba29ba16f7dca885e9e6b7906767fdbfcb740923)

第一当量点から第二当量点までは、炭酸の二段目の電離平衡の式を変形して
![{\displaystyle \mathrm {pH} ={\mbox{p}}K_{a2}+\log _{10}{\frac {[{\mbox{CO}}_{3}^{2-}]}{[{\mbox{HCO}}_{3}^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/78d291d9abce7fea5596029a88162d17c3c764fe)
また、生成した炭酸イオンの物質量は加えた水酸化ナトリウムから、第一当量点までに消費された分を差し引いた物質量に相当し  、炭酸水素イオンの物質量は
、炭酸水素イオンの物質量は  であるから
であるから

第二当量点は炭酸ナトリウム水溶液であり、炭酸イオンの加水分解を考慮する。

![{\displaystyle K_{b}={\frac {[{\mbox{HCO}}_{3}^{-}][{\mbox{OH}}^{-}]}{[{\mbox{CO}}_{3}^{2-}]}}={\frac {K_{w}}{K_{a2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/73200496373952e5f2663fad083e3feb147c9fd6)
![{\displaystyle {[{\mbox{H}}^{+}]}\fallingdotseq {\sqrt {\frac {K_{a2}K_{w}}{C_{A}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fc3c7a71425a217ad802b19e72373ec348195133)


当量点以降は過剰の水酸化ナトリウムの物質量  と濃度を考える。
と濃度を考える。
![{\displaystyle {[{\mbox{H}}^{+}]}={\frac {K_{w}}{[{\mbox{OH}}^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/37b2100ecb4c70a9cc38a7ab1a22292e2f39e2fe) であるから
であるから
![{\displaystyle {[{\mbox{H}}^{+}]}={\frac {(V_{A}+V_{B})K_{w}}{C_{B0}V_{B}-2C_{A0}V_{A}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ad8a50ea81076d156b2054879a9fe6ed3c9fc77f)


| 0.1mol/l水酸化バリウム10mlを0.1mol/l塩酸で滴定 |
バリウムイオンの |
水酸化バリウムを塩酸で滴定する場合を考える。水酸化バリウムは強い二酸塩基であるが二段目の電離はやや不完全である。しかし滴定曲線は2価の強塩基としての形に近くpHの急激な変化は第二当量点のみに現れる。
水酸化バリウムの一段目は完全に電離しているものと仮定する。また二段目の電離平衡は以下のようになる。


![{\displaystyle K_{a1}={\frac {K_{w}}{K_{b2}}}={\frac {[{\mbox{H}}^{+}][{\mbox{Ba(OH)}}^{+}]}{[{\mbox{Ba}}^{2+}]}}=4\times 10^{-14}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0a7c44b8073d982f1573f5871ef2e4ba7d6e4738)
- pKa = 13.4
物質収支を考慮し、水酸化バリウムの全濃度を  とすると
とすると
![{\displaystyle {\ce {C_{B}\ = \ [Ba^{2+}] + [Ba(OH)+]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2dce0fce251a3f300062d6706394d020389dea99)
また電気的中性の原理より
![{\displaystyle {\ce {2[Ba^{2+}] + [Ba(OH)+] + [H+] \ = \ [OH^{-}] + [Cl^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7bef5be5fdb37da106cdc60ff8471e2c8f762360)
これらの式および水の自己解離平衡から水素イオン濃度[H+]に関する三次方程式が得られる。
![{\displaystyle [{\mbox{H}}^{+}]^{3}+[{\mbox{H}}^{+}]^{2}(K_{a1}+2C_{B}-[{\mbox{Cl}}^{-}])+[{\mbox{H}}^{+}](K_{a1}C_{B}-K_{a1}[{\mbox{Cl}}^{-}]-K_{w})-K_{a1}K_{w}=0\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/abc874020422e23e645c1b5d0cdf773855f33ef0)
また水酸化バリウムの全濃度  は、滴定前の水酸化バリウムの体積を
は、滴定前の水酸化バリウムの体積を  、水酸化バリウムの初濃度を
、水酸化バリウムの初濃度を  、滴下した塩酸の体積を
、滴下した塩酸の体積を  、塩酸水溶液の初濃度を
、塩酸水溶液の初濃度を  とすると
とすると

![{\displaystyle {[{\mbox{Cl}}^{-}]}={\frac {C_{A0}V_{A}}{V_{A}+V_{B}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/62dc83dfb10c31d5b9965c6c849f571ead525355)
酸性領域では  の影響は無視し得るため
の影響は無視し得るため
![{\displaystyle [{\mbox{H}}^{+}]^{2}+[{\mbox{H}}^{+}](K_{a1}+2C_{B}-[{\mbox{Cl}}^{-}])+K_{a1}C_{B}-K_{a1}[{\mbox{Cl}}^{-}]\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eab0bf63cdb72c2cf1503b331ce3c1db8e800e7e)
塩基性領域では ![{\displaystyle [{\mbox{H}}^{+}]^{3}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a15effe8db67642094518a653c4e94e2c8132195) の項は充分小さく
の項は充分小さく
![{\displaystyle [{\mbox{H}}^{+}]^{2}(K_{a1}+2C_{B}-[{\mbox{Cl}}^{-}])+[{\mbox{H}}^{+}](K_{a1}C_{B}-K_{a1}[{\mbox{Cl}}^{-}]-K_{w})-K_{a1}K_{w}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/adc5d3eb57cd8b0a504e03d435aa3ca4869892ec)
| 0.1mol/l水酸化バリウム10mlを0.1mol/l塩酸Vmlで滴定
|
| 滴下量(VB) |
0ml |
5ml |
10ml |
15ml |
20ml |
25ml |
30ml
|
| pH(計算値)
|
13.20 |
12.92 |
12.63 |
12.24 |
6.97 |
1.85 |
1.60
|
炭酸ナトリウム水溶液を塩酸で滴定する場合を考える。炭酸イオンは2価の塩基と考えることができる。
物質収支を考慮し、炭酸の全濃度を  とすると
とすると
![{\displaystyle {\ce {C_{B}\ = \ [H2CO3] + [HCO3^{-}] + [CO3^{2-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/39eb5f734c89bc49176cad34741c3c55b0475f7a)
また電気的中性の原理より
![{\displaystyle {\ce {[H+] + [Na+] \ = \ [OH^{-}] + [Cl^{-}] + [HCO3^{-}] + 2[CO3^{2-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bc0faad2948c046133a974768f1207bd4c9f421e)
これらの式および水の自己解離平衡から水素イオン濃度[H+]に関する四次方程式が得られる。
![{\displaystyle [{\mbox{H}}^{+}]^{4}+[{\mbox{H}}^{+}]^{3}(K_{a1}+2C_{B}-[{\mbox{Cl}}^{-}])+[{\mbox{H}}^{+}]^{2}(K_{a1}K_{a2}-K_{a1}[{\mbox{Cl}}^{-}]+K_{a1}C_{B}-K_{w})-[{\mbox{H}}^{+}](K_{a1}K_{a2}[{\mbox{Cl}}^{-}]+K_{a1}K_{w})-K_{a1}K_{a2}K_{w}=0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/46caedd52237598ac6282a7201a2c45ef7a64046)
また炭酸の全濃度  は、滴定前の炭酸ナトリウム水溶液の体積を
は、滴定前の炭酸ナトリウム水溶液の体積を  、炭酸ナトリウムの初濃度を
、炭酸ナトリウムの初濃度を  滴下した塩酸の体積を
滴下した塩酸の体積を  、塩酸の初濃度を
、塩酸の初濃度を  とすると
とすると

![{\displaystyle {[{\mbox{Cl}}^{-}]}={\frac {C_{A0}V_{A}}{V_{A}+V_{B}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/62dc83dfb10c31d5b9965c6c849f571ead525355)
塩基性領域では ![{\displaystyle [{\mbox{H}}^{+}]^{4}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d28da52cfbc5acd6d74ff11ccbf3b0b3d32c1301) 項および
項および ![{\displaystyle [{\mbox{H}}^{+}]^{3}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a15effe8db67642094518a653c4e94e2c8132195) 項は充分小さく
項は充分小さく
![{\displaystyle [{\mbox{H}}^{+}]^{2}(K_{a1}K_{a2}-K_{a1}[{\mbox{Cl}}^{-}]+K_{a1}C_{B}-K_{w})-[{\mbox{H}}^{+}](K_{a1}K_{a2}[{\mbox{Cl}}^{-}]+K_{a1}K_{w})-K_{a1}K_{a2}K_{w}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/993beae22c63d258080d75b3a1544eaf6763fdad)
第一当量点付近では ![{\displaystyle [{\mbox{H}}^{+}]^{4}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d28da52cfbc5acd6d74ff11ccbf3b0b3d32c1301) 項と定数項の寄与は小さく
項と定数項の寄与は小さく
![{\displaystyle [{\mbox{H}}^{+}]^{2}(K_{a1}+2C_{B}-[{\mbox{Cl}}^{-}])+[{\mbox{H}}^{+}](K_{a1}K_{a2}-K_{a1}[{\mbox{Cl}}^{-}]+K_{a1}C_{B}-K_{w})-K_{a1}K_{a2}[{\mbox{Cl}}^{-}]-K_{a1}K_{w}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6bec8b35db2bdf3bf73925a55a61954ba93d8ca8)
酸性領域では炭酸の第二段階の解離  および
および  の影響は無視し得るため
の影響は無視し得るため
![{\displaystyle [{\mbox{H}}^{+}]^{2}+[{\mbox{H}}^{+}](K_{a1}+2C_{B}-[{\mbox{Cl}}^{-}])-K_{a1}[{\mbox{Cl}}^{-}]+K_{a1}C_{B}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ab16fdc478aeb84dffa548d3d78f880836cdde8e)
| 0.1mol/l炭酸ナトリウム10mlを0.1mol/l塩酸Vmlで滴定
|
| 滴下量(VA) |
0ml |
5ml |
10ml |
15ml |
20ml |
25ml |
30ml
|
| pH(計算値)
|
11.64 |
10.31 |
8.33 |
6.35 |
3.91 |
1.85 |
1.60
|
 0.1mol/l炭酸ナトリウム10mlを0.1mol/l塩酸で滴定
0.1mol/l炭酸ナトリウム10mlを0.1mol/l塩酸で滴定

| 0.1mol/lエチレンジアミン10mlを0.1mol/l塩酸で滴定 |
エチレンジアンモニウムイオンの |
また以下のような近似が可能であるが、滴定初期および当量点付近で誤差が大きくなる。
滴定前は炭酸イオンの加水分解を考慮する。

![{\displaystyle K_{b}={\frac {[{\mbox{HCO}}_{3}^{-}][{\mbox{OH}}^{-}]}{[{\mbox{CO}}_{3}^{2-}]}}={\frac {K_{w}}{K_{a2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/73200496373952e5f2663fad083e3feb147c9fd6)
![{\displaystyle {[{\mbox{H}}^{+}]}\fallingdotseq {\sqrt {\frac {K_{a2}K_{w}}{C_{B0}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/07e1d51df2ff274bb6080b22cc90de57acc294ce)

滴定開始から第一当量点までは、炭酸の二段目の電離平衡の式を変形して
![{\displaystyle \mathrm {pH} ={\mbox{p}}K_{a2}+\log _{10}{\frac {[{\mbox{CO}}_{3}^{2-}]}{[{\mbox{HCO}}_{3}^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/78d291d9abce7fea5596029a88162d17c3c764fe)
また、生成した炭酸水素イオンの物質量は加えた塩酸に相当し  、炭酸水素イオンの物質量は
、炭酸水素イオンの物質量は  であるから
であるから

第一当量点は炭酸水素ナトリウムと塩化ナトリウムが生成しているから、炭酸水素イオンの不均化を考える。


第一当量点から第二当量点までは、炭酸の一段目の電離平衡の式を変形して
![{\displaystyle \mathrm {pH} ={\mbox{p}}K_{a1}+\log _{10}{\frac {[{\mbox{HCO}}_{3}^{-}]}{[{\mbox{H}}_{2}{\mbox{CO}}_{3}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/99880ae534625a9a188621f97fdd8a9dd39c6395)
また、生成した炭酸の物質量は加えた塩酸から、第一当量点までに消費された分を差し引いた物質量にほぼ相当し  、炭酸水素イオンの物質量はほぼ
、炭酸水素イオンの物質量はほぼ  であるから
であるから

第二当量点は塩化ナトリウムと炭酸が生成しているから、炭酸の電離を考慮する。一段目のみの解離を考慮し、二段目は極めて小さいため無視し得る。
![{\displaystyle {[{\mbox{H}}^{+}]}\fallingdotseq {\sqrt {C_{B}K_{a1}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/06339d0931227cbae46d8e4b8e44cb7b95358ca0)


当量点以降は過剰の塩酸の物質量  と濃度を考える。
と濃度を考える。

- 田中元治『基礎化学選書8 酸と塩基』裳華房、1971年
- Jr. R.A.デイ, A.L.アンダーウッド, 鳥居泰男, 康智三『定量分析化学』培風館、1982年









![{\displaystyle {[\mathrm {H} ^{+}]}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1df4eead7afb2e3cdcf571a782643d7cc1217007)
![{\displaystyle \mathrm {pH} =-\log _{10}[\mathrm {H} ^{+}]=\log _{10}{\frac {1}{[\mathrm {H} ^{+}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dd162944db28b6b8dc678e0f43a491c953f080d6)

![{\displaystyle K_{w}=[{\mbox{H}}^{+}][{\mbox{OH}}^{-}]=1.008\times 10^{-14}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/13d0bf8a998ce93edf25b116b53fb06906c90dea)

![{\displaystyle {\ce {C_{A}\ = \ [Cl^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f57f93d938fee2c74188485c738530c262a896ff)
![{\displaystyle {\ce {{[H^{+}]}+[{Na}^{+}]\ =\ {[{OH}^{-}]}+[{Cl}^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/767c1c8ceace68ba954401352cbb0b63bd344dfb)
![{\displaystyle [{\mbox{H}}^{+}]^{2}+[{\mbox{H}}^{+}]([{\mbox{Na}}^{+}]-[{\mbox{Cl}}^{-}])-K_{w}=0\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e532de3f2ce7cb6d3057c3699517dd47fdd353bf)





![{\displaystyle C_{A}={[{\mbox{Cl}}^{-}]}={\frac {C_{A0}V_{A}}{V_{A}+V_{B}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a551c465a1f9e9f139c7793084a15a82620a5521)
![{\displaystyle {[{\mbox{Na}}^{+}]}={\frac {C_{B0}V_{B}}{V_{A}+V_{B}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1560d71151b57fe50fc6e97e450606dfd4a94065)
![{\displaystyle {[{\mbox{H}}^{+}]}={\frac {-[{\mbox{Na}}^{+}]+[{\mbox{Cl}}^{-}]+{\sqrt {([{\mbox{Na}}^{+}]-[{\mbox{Cl}}^{-}])^{2}+4K_{w}}}}{2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b2c96a04140e51859ce1d9a833cf9f5b40fa4a82)

![{\displaystyle [{\mbox{H}}^{+}]+[{\mbox{Na}}^{+}]-[{\mbox{Cl}}^{-}]\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3de3d0dc5365250a20881dbc2f8930e2642571d8)



![{\displaystyle {[{\mbox{H}}^{+}]}={\frac {C_{A0}V_{A}-C_{B0}V_{B}}{V_{A}+V_{B}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a735a3a96962da04e2fc00c1b01eb9baa243c889)


![{\displaystyle [{\mbox{H}}^{+}]^{2}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4059befb31f6c01025ed9fe018d00883f8eac546)
-K_{w}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1646c09c1da238f628d6fb48ed7415303116a7ee)

![{\displaystyle {[{\mbox{OH}}^{-}]}={\frac {C_{B0}V_{B}-C_{A0}V_{A}}{V_{A}+V_{B}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/03f77c667caf414e240f83a4417dfa17692320de)
![{\displaystyle {[{\mbox{H}}^{+}]}={\frac {K_{w}}{[{\mbox{OH}}^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/37b2100ecb4c70a9cc38a7ab1a22292e2f39e2fe)
![{\displaystyle {[{\mbox{H}}^{+}]}={\frac {(V_{A}+V_{B})K_{w}}{C_{B0}V_{B}-C_{A0}V_{A}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4100c44990f7f066218877a8d2ce73fe71c79e78)


![{\displaystyle K_{a}={\frac {[{\mbox{H}}^{+}][{\mbox{CH}}_{3}{\mbox{COO}}^{-}]}{[{\mbox{CH}}_{3}{\mbox{COOH}}]}}=1.75\times 10^{-5}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/280c37c59dff712faf42a1e45ef97aab98ac3700)
![{\displaystyle {\ce {C_{A}\ = \ {[CH3COOH]}+ [CH3COO^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fa6d16f9f3a5d43de05247580fa0bf14c450a017)
![{\displaystyle {\ce {[H+] + [Na+] \ = \ [OH^{-}] + [CH3COO^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d32cfdb0533211afbdc22708005abb58521ae109)
![{\displaystyle [{\mbox{H}}^{+}]^{3}+[{\mbox{H}}^{+}]^{2}(K_{a}+[{\mbox{Na}}^{+}])+[{\mbox{H}}^{+}](K_{a}[{\mbox{Na}}^{+}]-K_{a}C_{A}-K_{w})-K_{a}K_{w}=0\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/40112a9f25687ec82352d4a6660b37ce5e8b5a43)

![{\displaystyle [{\mbox{H}}^{+}]^{3}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a15effe8db67642094518a653c4e94e2c8132195)
![{\displaystyle [{\mbox{H}}^{+}]^{2}+[{\mbox{H}}^{+}](K_{a}+[{\mbox{Na}}^{+}])+K_{a}[{\mbox{Na}}^{+}]-K_{a}C_{A}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1e110dbcd0ca0f457736765748a678110fa72867)
![{\displaystyle [{\mbox{H}}^{+}]^{2}(K_{a}+[{\mbox{Na}}^{+}])+[{\mbox{H}}^{+}](K_{a}[{\mbox{Na}}^{+}]-K_{a}C_{A}-K_{w})-K_{a}K_{w}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/52e37ee08d23514fac7767720c0bc3347b3b6572)


![{\displaystyle [{\mbox{CH}}_{3}{\mbox{COOH}}]\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/601a1461eb6c5fff6b61a39f3f45da95686bf25e)
![{\displaystyle K_{a}\fallingdotseq {\frac {[{\mbox{H}}^{+}]^{2}}{C_{A0}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a5638b790df979820783a3e90ec3740cba178ec3)
![{\displaystyle {[{\mbox{H}}^{+}]}\fallingdotseq {\sqrt {C_{A0}K_{a}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/54add6defe7d6ea1a0a2be930e22c85f16b51db4)

![{\displaystyle \mathrm {pH} ={\mbox{p}}K_{a}+\log _{10}{\frac {[{\mbox{CH}}_{3}{\mbox{COO}}^{-}]}{[{\mbox{CH}}_{3}{\mbox{COOH}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/87db0f5d3be52a6599b86267d0adeda23c3e4e6f)


![{\displaystyle K_{b}={\frac {[{\mbox{CH}}_{3}{\mbox{COOH}}][{\mbox{OH}}^{-}]}{[{\mbox{CH}}_{3}{\mbox{COO}}^{-}]}}={\frac {K_{w}}{K_{a}}}\fallingdotseq {\frac {[{\mbox{OH}}^{-}]^{2}}{C_{A}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4592b871318d42bc850b749040a5f7bdde7ad752)
![{\displaystyle {[{\mbox{H}}^{+}]}\fallingdotseq {\sqrt {\frac {K_{a}K_{w}}{C_{A}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eccbd8e3adeeab661ece556a800234e9ea2ca19f)


![{\displaystyle K_{b}={\frac {[{\mbox{NH}}_{4}^{+}][{\mbox{OH}}^{-}]}{[{\mbox{NH}}_{3}]}}=1.76\times 10^{-5}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/583612f0ca4b72433d4aa824103c0b40181e73d2)
![{\displaystyle K_{a}={\frac {[{\mbox{H}}^{+}][{\mbox{NH}}_{3}]}{[{\mbox{NH}}_{4}^{+}]}}={\frac {K_{w}}{K_{b}}}=5.7\times 10^{-10}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/edfeffeb9ca70cdc72895a171f6d6fd51fc465b4)

![{\displaystyle {\ce {C_{B}= [NH4+] + [NH3]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0fbfded66cd56670c7b36481c3e0d1f0b00f50ce)
![{\displaystyle {\ce {[H+] + [NH4+]\ =\ [OH^{-}] + Cl-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/46f5bb1e5180487a414376a045ecf77774346567)
![{\displaystyle [{\mbox{H}}^{+}]^{3}+[{\mbox{H}}^{+}]^{2}(K_{a}+C_{B}-[{\mbox{Cl}}^{-}])-[{\mbox{H}}^{+}](K_{a}[{\mbox{Cl}}^{-}]+K_{w})-K_{a}K_{w}=0\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/38c70d4c22c109e8cf374c73338efaebc71ee7fa)

![{\displaystyle [{\mbox{H}}^{+}]^{2}+[{\mbox{H}}^{+}](K_{a}+C_{B}-[{\mbox{Cl}}^{-}])-K_{a}[{\mbox{Cl}}^{-}]\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9e9f350c5d8570fe87ce18d3d0e2fbc1312cdc1d)
![{\displaystyle [{\mbox{H}}^{+}]^{2}(K_{a}+C_{B}-[{\mbox{Cl}}^{-}])-[{\mbox{H}}^{+}](K_{a}[{\mbox{Cl}}^{-}]+K_{w})-K_{a}K_{w}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eac33edb5cf7d004618ee64ad7d88ea72a5c2fe0)





![{\displaystyle K_{a}\fallingdotseq {\frac {[{\mbox{H}}^{+}]^{2}}{C_{B}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6e875528ca8973367a81b5dc42614b80fac9362d)
![{\displaystyle {[{\mbox{H}}^{+}]}\fallingdotseq {\sqrt {C_{B}K_{a}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5d509a77eadbe057de1f01fa818ae94917e64749)

![{\displaystyle \mathrm {pH} ={\mbox{p}}K_{a}+\log _{10}{\frac {[{\mbox{NH}}_{3}]}{[{\mbox{NH}}_{4}^{+}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8af330ebcdb7d8b6be870d27fdc934ab3b07e1f1)

![{\displaystyle K_{a1}={\frac {[{\mbox{H}}^{+}][{\mbox{CH}}_{3}{\mbox{COO}}^{-}]}{[{\mbox{CH}}_{3}{\mbox{COOH}}]}}=1.75\times 10^{-5}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b05a1887e57f35ae6b9b420a80f74bf4f9d9e44d)
![{\displaystyle K_{a2}={\frac {[{\mbox{H}}^{+}][{\mbox{NH}}_{3}]}{[{\mbox{NH}}_{4}^{+}]}}={\frac {K_{w}}{K_{b}}}=5.7\times 10^{-10}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b748b4572b7be52057e0a344a2dd6e2f72c1af41)
![{\displaystyle C_{A}=[{\mbox{CH}}_{3}{\mbox{COOH}}]+[{\mbox{CH}}_{3}{\mbox{COO}}^{-}]\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/989eb3d092cf2bcfc77663f3db4a4f61285d38fd)
![{\displaystyle C_{B}=[{\mbox{NH}}_{4}^{+}]+[{\mbox{NH}}_{3}]\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/aae13ac9c0b8b1ce3a8a134ad13ab60fcc8afbc2)
![{\displaystyle [{\mbox{H}}^{+}]+[{\mbox{NH}}_{4}^{+}]=[{\mbox{OH}}^{-}]+[{\mbox{CH}}_{3}{\mbox{COO}}^{-}]\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a86165be91d3bea467daeeffbfd2bee0298c3a7e)
![{\displaystyle [{\mbox{H}}^{+}]^{4}+[{\mbox{H}}^{+}]^{3}(K_{a1}+K_{a2}+C_{B})+[{\mbox{H}}^{+}]^{2}(K_{a1}K_{a2}-K_{a1}C_{A}+K_{a1}C_{B}-K_{w})-[{\mbox{H}}^{+}](K_{a1}K_{a2}C_{A}+K_{a1}K_{w}+K_{a2}K_{w})-K_{a1}K_{a2}K_{w}=0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/adf62a43ee1dfcd1236d11a1d4f7f2b2405dcd50)
![{\displaystyle [{\mbox{H}}^{+}]^{2}+[{\mbox{H}}^{+}](K_{a1}+K_{a2}+C_{B})-K_{a1}C_{A}+K_{a1}C_{B}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0e4b26fc7f96bb7a31e5ed1e6dea41b3cdf685fe)
![{\displaystyle [{\mbox{H}}^{+}]^{4}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d28da52cfbc5acd6d74ff11ccbf3b0b3d32c1301)
![{\displaystyle [{\mbox{H}}^{+}]^{2}(K_{a1}+K_{a2}+C_{B})+[{\mbox{H}}^{+}](K_{a1}K_{a2}-K_{a1}C_{A}+K_{a1}C_{B}-K_{w})-K_{a1}K_{a2}C_{A}-K_{a1}K_{w}-K_{a2}K_{w}=0\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/80dfb5ec482b0e2e63a6379823458ab2b9f639f5)
![{\displaystyle [{\mbox{H}}^{+}]^{2}(K_{a1}K_{a2}-K_{a1}C_{A}+K_{a1}C_{B}-K_{w})-[{\mbox{H}}^{+}](K_{a1}K_{a2}C_{A}+K_{a1}K_{w}+K_{a2}K_{w})-K_{a1}K_{a2}K_{w}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/76ba2076eb6b252b8840671431120f0cdeea50a3)

![{\displaystyle K_{a1}K_{a2}={\frac {[{\mbox{H}}^{+}]^{2}[{\mbox{CH}}_{3}{\mbox{COO}}^{-}][{\mbox{NH}}_{3}]}{[{\mbox{CH}}_{3}{\mbox{COOH}}][{\mbox{NH}}_{4}^{+}]}}=1.00\times 10^{-14}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bf307939d9d4cc60ffbb9b43be0c86ff03a63822)
![{\displaystyle {[{\mbox{H}}^{+}]}\fallingdotseq {\sqrt {K_{a1}K_{a2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ba29ba16f7dca885e9e6b7906767fdbfcb740923)




![{\displaystyle K_{a2}={\frac {[{\mbox{H}}^{+}][{\mbox{SO}}_{4}^{2-}]}{[{\mbox{HSO}}_{4}^{-}]}}=1.2\times 10^{-2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5e41a8439a8bca1893e7e3f66546f180ba67db52)
![{\displaystyle {\ce {C_{A}\ = \ [HSO4^{-}] + [SO4^{2-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/88eef6f0bb31488ad951c9236337ecf5afb5d281)
![{\displaystyle {\ce {[H+] + [Na+] \ = \ [OH^{-}] + [HSO4^{-}] + 2[SO4^{2-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/74bca24e4526704f654a68c03916057b5d50ec0a)
![{\displaystyle [{\mbox{H}}^{+}]^{3}+[{\mbox{H}}^{+}]^{2}(K_{a2}-C_{A}+[{\mbox{Na}}^{+}])+[{\mbox{H}}^{+}](K_{a2}[{\mbox{Na}}^{+}]-2K_{a2}C_{A}-K_{w})-K_{a2}K_{w}=0\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d52962ce23a9506f63d146db0d6b9257d00cdad)
![{\displaystyle [{\mbox{H}}^{+}]^{2}+[{\mbox{H}}^{+}](K_{a2}-C_{A}+[{\mbox{Na}}^{+}])+K_{a2}[{\mbox{Na}}^{+}]-2K_{a2}C_{A}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6315fb4f5435319503b13098cce0863746fd4ed3)
![{\displaystyle [{\mbox{H}}^{+}]^{2}(K_{a2}-C_{A}+[{\mbox{Na}}^{+}])+[{\mbox{H}}^{+}](K_{a2}[{\mbox{Na}}^{+}]-2K_{a2}C_{A}-K_{w})-K_{a2}K_{w}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/576599e1eeb2b313c6e66f5c3e83d29e0fa5e1be)


![{\displaystyle K_{a1}={\frac {[{\mbox{H}}^{+}][{\mbox{HCO}}_{3}^{-}]}{[{\mbox{H}}_{2}{\mbox{CO}}_{3}]}}=4.45\times 10^{-7}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ee216e506d7c9db332bb8b67d7370b194b896b72)
![{\displaystyle K_{a2}={\frac {[{\mbox{H}}^{+}][{\mbox{CO}}_{3}^{2-}]}{[{\mbox{HCO}}_{3}^{-}]}}=4.78\times 10^{-11}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3d10b8b70f1d28edb99144184ccb0d1e375a7330)


![{\displaystyle {\ce {C_{A}\ = \ [H2CO3] + [HCO3^{-}] + [CO3^{2-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/330915f1a213d9b8ec740c7f52a5eb755d555031)
![{\displaystyle {\ce {[{H+}] + [Na+]\ =\ [OH^{-}] + [HCO3^{-}] + 2[CO3^{2-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6056d77ab455968e4154ee36f618ba4d8437157d)
![{\displaystyle [{\mbox{H}}^{+}]^{4}+[{\mbox{H}}^{+}]^{3}(K_{a1}+[{\mbox{Na}}^{+}])+[{\mbox{H}}^{+}]^{2}(K_{a1}K_{a2}-K_{a1}C_{A}+K_{a1}[{\mbox{Na}}^{+}]-K_{w})-[{\mbox{H}}^{+}](2K_{a1}K_{a2}C_{A}-K_{a1}K_{a2}[{\mbox{Na}}^{+}]+K_{a1}K_{w})-K_{a1}K_{a2}K_{w}=0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b6def2dddcfb4dbc64baaf08d943da1e077f0407)

![{\displaystyle [{\mbox{H}}^{+}]^{2}+[{\mbox{H}}^{+}](K_{a1}+[{\mbox{Na}}^{+}])-K_{a1}C_{A}+K_{a1}[{\mbox{Na}}^{+}]\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7f91506623340a64bb597beedb6187717f817d2f)
![{\displaystyle [{\mbox{H}}^{+}]^{2}(K_{a1}+[{\mbox{Na}}^{+}])+[{\mbox{H}}^{+}](K_{a1}K_{a2}-K_{a1}C_{A}+K_{a1}[{\mbox{Na}}^{+}]-K_{w})-2K_{a1}K_{a2}C_{A}+K_{a1}K_{a2}[{\mbox{Na}}^{+}]-K_{a1}K_{w}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/560a733e728476a5049ac65b9c500d78f84cbb1c)
![{\displaystyle [{\mbox{H}}^{+}]^{2}(K_{a1}K_{a2}-K_{a1}C_{A}+K_{a1}[{\mbox{Na}}^{+}]-K_{w})-[{\mbox{H}}^{+}](2K_{a1}K_{a2}C_{A}-K_{a1}K_{a2}[{\mbox{Na}}^{+}]+K_{a1}K_{w})-K_{a1}K_{a2}K_{w}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0c48c73a8c6cd63f298cdb9d5312181d07274105)












![{\displaystyle {[{\mbox{H}}^{+}]}\fallingdotseq {\sqrt {C_{A0}K_{a1}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/36bb1b6f3f597e312d5e88ebe586e0b66d8e025c)

![{\displaystyle \mathrm {pH} ={\mbox{p}}K_{a1}+\log _{10}{\frac {[{\mbox{HCO}}_{3}^{-}]}{[{\mbox{H}}_{2}{\mbox{CO}}_{3}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/99880ae534625a9a188621f97fdd8a9dd39c6395)


![{\displaystyle K_{a1}K_{a2}={\frac {[{\mbox{H}}^{+}]^{2}[{\mbox{CO}}_{3}^{2-}]}{[{\mbox{H}}_{2}{\mbox{CO}}_{3}]}}=2.13\times 10^{-17}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b53188672cd36bfacde9db06e0a7e742d56eae67)
![{\displaystyle \mathrm {pH} ={\mbox{p}}K_{a2}+\log _{10}{\frac {[{\mbox{CO}}_{3}^{2-}]}{[{\mbox{HCO}}_{3}^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/78d291d9abce7fea5596029a88162d17c3c764fe)



![{\displaystyle K_{b}={\frac {[{\mbox{HCO}}_{3}^{-}][{\mbox{OH}}^{-}]}{[{\mbox{CO}}_{3}^{2-}]}}={\frac {K_{w}}{K_{a2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/73200496373952e5f2663fad083e3feb147c9fd6)
![{\displaystyle {[{\mbox{H}}^{+}]}\fallingdotseq {\sqrt {\frac {K_{a2}K_{w}}{C_{A}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fc3c7a71425a217ad802b19e72373ec348195133)


![{\displaystyle {[{\mbox{H}}^{+}]}={\frac {(V_{A}+V_{B})K_{w}}{C_{B0}V_{B}-2C_{A0}V_{A}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ad8a50ea81076d156b2054879a9fe6ed3c9fc77f)





![{\displaystyle K_{a1}={\frac {K_{w}}{K_{b2}}}={\frac {[{\mbox{H}}^{+}][{\mbox{Ba(OH)}}^{+}]}{[{\mbox{Ba}}^{2+}]}}=4\times 10^{-14}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0a7c44b8073d982f1573f5871ef2e4ba7d6e4738)
![{\displaystyle {\ce {C_{B}\ = \ [Ba^{2+}] + [Ba(OH)+]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2dce0fce251a3f300062d6706394d020389dea99)
![{\displaystyle {\ce {2[Ba^{2+}] + [Ba(OH)+] + [H+] \ = \ [OH^{-}] + [Cl^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7bef5be5fdb37da106cdc60ff8471e2c8f762360)
![{\displaystyle [{\mbox{H}}^{+}]^{3}+[{\mbox{H}}^{+}]^{2}(K_{a1}+2C_{B}-[{\mbox{Cl}}^{-}])+[{\mbox{H}}^{+}](K_{a1}C_{B}-K_{a1}[{\mbox{Cl}}^{-}]-K_{w})-K_{a1}K_{w}=0\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/abc874020422e23e645c1b5d0cdf773855f33ef0)
![{\displaystyle {[{\mbox{Cl}}^{-}]}={\frac {C_{A0}V_{A}}{V_{A}+V_{B}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/62dc83dfb10c31d5b9965c6c849f571ead525355)
![{\displaystyle [{\mbox{H}}^{+}]^{2}+[{\mbox{H}}^{+}](K_{a1}+2C_{B}-[{\mbox{Cl}}^{-}])+K_{a1}C_{B}-K_{a1}[{\mbox{Cl}}^{-}]\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eab0bf63cdb72c2cf1503b331ce3c1db8e800e7e)
![{\displaystyle [{\mbox{H}}^{+}]^{2}(K_{a1}+2C_{B}-[{\mbox{Cl}}^{-}])+[{\mbox{H}}^{+}](K_{a1}C_{B}-K_{a1}[{\mbox{Cl}}^{-}]-K_{w})-K_{a1}K_{w}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/adc5d3eb57cd8b0a504e03d435aa3ca4869892ec)
![{\displaystyle {\ce {C_{B}\ = \ [H2CO3] + [HCO3^{-}] + [CO3^{2-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/39eb5f734c89bc49176cad34741c3c55b0475f7a)
![{\displaystyle {\ce {[H+] + [Na+] \ = \ [OH^{-}] + [Cl^{-}] + [HCO3^{-}] + 2[CO3^{2-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bc0faad2948c046133a974768f1207bd4c9f421e)
![{\displaystyle [{\mbox{H}}^{+}]^{4}+[{\mbox{H}}^{+}]^{3}(K_{a1}+2C_{B}-[{\mbox{Cl}}^{-}])+[{\mbox{H}}^{+}]^{2}(K_{a1}K_{a2}-K_{a1}[{\mbox{Cl}}^{-}]+K_{a1}C_{B}-K_{w})-[{\mbox{H}}^{+}](K_{a1}K_{a2}[{\mbox{Cl}}^{-}]+K_{a1}K_{w})-K_{a1}K_{a2}K_{w}=0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/46caedd52237598ac6282a7201a2c45ef7a64046)
![{\displaystyle [{\mbox{H}}^{+}]^{2}(K_{a1}K_{a2}-K_{a1}[{\mbox{Cl}}^{-}]+K_{a1}C_{B}-K_{w})-[{\mbox{H}}^{+}](K_{a1}K_{a2}[{\mbox{Cl}}^{-}]+K_{a1}K_{w})-K_{a1}K_{a2}K_{w}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/993beae22c63d258080d75b3a1544eaf6763fdad)
![{\displaystyle [{\mbox{H}}^{+}]^{2}(K_{a1}+2C_{B}-[{\mbox{Cl}}^{-}])+[{\mbox{H}}^{+}](K_{a1}K_{a2}-K_{a1}[{\mbox{Cl}}^{-}]+K_{a1}C_{B}-K_{w})-K_{a1}K_{a2}[{\mbox{Cl}}^{-}]-K_{a1}K_{w}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6bec8b35db2bdf3bf73925a55a61954ba93d8ca8)
![{\displaystyle [{\mbox{H}}^{+}]^{2}+[{\mbox{H}}^{+}](K_{a1}+2C_{B}-[{\mbox{Cl}}^{-}])-K_{a1}[{\mbox{Cl}}^{-}]+K_{a1}C_{B}\fallingdotseq 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ab16fdc478aeb84dffa548d3d78f880836cdde8e)

![{\displaystyle {[{\mbox{H}}^{+}]}\fallingdotseq {\sqrt {\frac {K_{a2}K_{w}}{C_{B0}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/07e1d51df2ff274bb6080b22cc90de57acc294ce)




![{\displaystyle {[{\mbox{H}}^{+}]}\fallingdotseq {\sqrt {C_{B}K_{a1}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/06339d0931227cbae46d8e4b8e44cb7b95358ca0)


