フルオロアンチモン酸
| フルオロアンチモン酸 | |
|---|---|

|
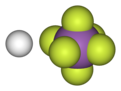
|
Fluoroantimonic acid | |
| 識別情報 | |
| CAS登録番号 | 16950-06-4 |
| PubChem | 21953576 |
| ChemSpider | 20137913 |
| EC番号 | 241-023-8 |
| |
| |
| 特性 | |
| 化学式 | HF6Sb |
| モル質量 | 236.76 g mol−1 |
| 精密質量 | 235.902062306 g mol−1 |
| 外観 | 無色液体 |
| 酸解離定数 pKa | −25 |
| 塩基解離定数 pKb | 39 |
| 危険性 | |
| Hフレーズ | H300, H310, H314, H330, H411 |
| EU分類 | |
| 主な危険性 | 強い腐食性・激しい加水分解性 |
| 眼への危険性 | 大いにあり。 |
| 皮膚への危険性 | 大いにあり。 |
| NFPA 704 | |
| R/Sフレーズ | R26, R29, R35 |
| 関連する物質 | |
| 関連する酸 | HF SbF5 マジック酸 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
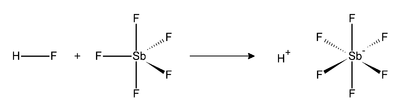
フルオロアンチモン酸(フルオロアンチモンさん、fluoroantimonic acid)あるいはヘキサフルオロアンチモン酸(ヘキサフルオロアンチモンさん、hexafluoroantimonic acid)は、フッ化水素と五フッ化アンチモンの様々な比の混合物である[1]。1対1の混合物はこれまで知られている中で最も強い超酸を形成する。この酸は、炭化水素でさえもプロトン化することができ、カルボカチオンとH2を与える[2]。
フッ化水素 (HF) とSbF5の反応は発熱反応である。HFは非常に優れた酸化剤であり、SbF5分子を攻撃し付加体を与える。フルオロアンチモン分子では、アニオンが水素に配位している。以前は、非常に弱い求核性および非常に弱い塩基性しか示さないため、非配位性陰イオンに分類されていた。
フルオロアンチモン酸分子のプロトンは「裸」であると呼ばれるにもかかわらず、実際はヒドロニウムイオンのように、非常に弱い供与結合によってフッ素原子に常に付加している[3]。しかしながら、この非常に弱い供与結合が、この系の強烈な酸性に必要である。フルオロアンチモン酸は、100%硫酸よりも2×1019(2000京)倍強い[4]。
構造
[編集]組成式 と の2種類の塩が結晶化され、単結晶X線回折により分析された。どちらの塩でも、アニオンは である[5]。先に述べた通り、は弱い塩基に分類されることから、より大きなモノアニオンであるもより弱い塩基であると予想される。
他の酸との比較
[編集]- フルオロアンチモン酸(1990年) (H0値 = −31.3)
- マジック酸(1974年)(H0値 = −19.2)
- カルボラン超酸(1969年)(H0値 = −18.0)
- フルオロスルホン酸(1944年)(H0値 = −15.1)
- トリフルオロメタンスルホン酸(1940年)(H0値 = −14.9)
応用
[編集]この異常に強い酸は、ほぼ全ての有機化合物をプロトン化する。1967年、BickelとHogeveenは、HF-SbF5がイソブタンからH2を、ネオペンタンからメタンを取り除くことを示した[6][7]。
安全性
[編集]HF-SbF5は、水によって迅速かつ爆発的に分解する。また、実質的に知られている全ての溶媒と反応する[1]。HF-SbF5と共存できることが確かめられている溶媒は、塩化フッ化スルフリルおよび液化二酸化硫黄である。クロロフルオロカーボン (Chlorofluorocarbon) も溶媒として使用される。HF-SbF5の容器はPTFE(テフロン)製である。
脚注
[編集]- ^ a b Olah, G. A.; Prakash, G. K. S.; Wang, Q.; Li, X. (2004). “Hydrogen Fluoride–Antimony(V) Fluoride”. In L. Paquette Ed.. Encyclopedia of Reagents for Organic Synthesis. New York: J. Wiley & Sons. doi:10.1002/047084289
- ^ George Andrew Olah (2001). A life of magic chemistry: autobiographical reflections of a nobel prize winner. John Wiley and Sons. pp. 100–101. ISBN 0471157430
- ^ Michael Klein (2000年10月25日). “The quantum chemistry of proton "hopping" or transfer in his acid”. Pittsburgh Supercomputing Center. 2011年4月14日閲覧。
- ^ Olah, George A. (2005). “Crossing Conventional Boundaries in Half a Century of Research”. J. Org. Chem. 70 (7): 2413–2429. doi:10.1021/jo040285o. PMID 15787527.
- ^ Mootz, D.; Bartmann, K. (1988). “The Fluoronium Ions H2F+ and H3F2+: Characterization by Crystal Structure Analysis”. Angew. Che. Int. Ed. 27: 391–392. doi:10.1002/anie.198803911.
- ^ Bickel, A. F.; Gaasbeek, C. J.; Hogeveen, H.; Oelderik, J. M.; Platteeuw, J. C. (1967). “Chemistry and spectroscopy in strongly acidic solutions: reversible reaction between aliphatic carbonium ions and hydrogen”. Chemical Communications 1967: 634–5. doi:10.1039/C19670000634.
- ^ Hogeveen, H.; Bickel, A. F. (1967). “Chemistry and spectroscopy in strongly acidic solutions: electrophilic substitution at alkane-carbon by protons”. Chemical Communications 1967: 635–6. doi:10.1039/C19670000635.


![{\displaystyle {\ce {[H2F^+][Sb2F11^- ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f7f50b43e5d8919d58e6df5980780a4970186ac0)
![{\displaystyle {\ce {[H3F2^+][Sb2F11^- ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2e5512d54022a2183871c492e7025bc5e6ea8e89)



