カルボラン

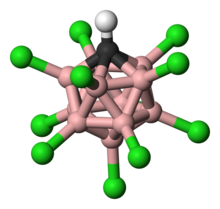
カルボラン (英: carborane) はホウ素原子と炭素原子からなるクラスターである。ほかのボランと同じく分子は多面体型であり、その形状によってcloso-、nido-、arachno-、hypho-などの接頭語を付けることで分類される。closo-は完全な多面体、nido-は頂点が1つ欠けたもの、arachno-などはそれ以上欠けたものである。カルバボラン (carbaborane)とも呼ばれる[1]。
特に安定な20面体型のcloso-カルボランであるo-カルボラン (C2B10H12) が有名である[2]。接頭語のoはオルトに由来し、この化合物はヒュッケル則により超芳香族性を示すので熱力学的に安定である[3]。o-カルボランは420 ℃でメタ異性化する (ベンゼンは1000 ℃で異性化)。アレーンと同じくカルボランは芳香族求核置換反応を起こす[4]。
負電荷を持ったCHB11H11−も重要なカルボランであり、超酸の合成に使われる。
ジカルバドデカボラン
[編集]1.2-closo-ジカルバドデカボランは分子式C2B10H12で表されるカルボランであり、単にカルボランとも呼ばれる。融点は320 ℃であり、アセチレンとデカボラン (Decaborane) から合成される。アセチレンジカルボン酸ジメチルを使うとC2B10H10(CO2C H3)2が得られ、これをC2B10H12へと減成(≒分解)させる[5]。
発見
[編集]デカボラン誘導体は以前から知られていたがいずれも熱力学的に不安定であった。ところが1963年に安定な1.2-closo-ジカルバドデカボランがOlin Corporationとチオコール・ケミカルのthe Reaction Motors Divisionにより同時に報告された[6][7][8][9][10][11][12][13][14]。カルボランへの非破壊的置換基導入法などが示された一般理論が構築され、オルトやメタへの異性化が実証された。

ジカルボリド
[編集]ジカルボリドアニオンは分子式[B9C2H11]2−で表されるかご状の分子である。最初の金属ジカルボリド錯体は1965年、M. Frederick Hawthorneらによって発見された[15]。このアニオンは多くの金属イオンとサンドイッチ化合物であるビス(ジカルボリド)錯体をつくる。このジアニオンはジカルボランの減成によって形成されるnido-クラスターである[16]。
ビス(ジカルボリド)錯体は対応するメタロセンと異なった性質をもつ。たとえばニッケルビス(ジカルボリド)ではNi(IV)という珍しい酸化状態のNiをもつ。応用先としては触媒[17]、放射性廃棄物処理に役立つイオン交換物質、生理活性プロテアーゼ阻害剤、色素増感太陽電池-(DSSC) の化学不活性シャトルなどがある[18]。
カルボリン
[編集]カルボリン (carboryne) または1,2-デヒドロ-o-カルボランはo-カルボランから隣接する2つの水素原子が脱離したものであり、分子式はB10C2H10である。
カルボリンはベンゼンとアイソローバル類似 (Isolobal principle) の関係がある[19][20][21]。カルボリン化合物は1990年に初めて確認された。炭素に結合している水素はテトラヒドロフラン溶媒中のn-ブチルリチウムにより脱離し、生成したジリチオ体は0 ℃で臭素と反応して、ブロモ化されたモノアニオンができる。
反応混合物を35 ℃に加熱するとカルボリンができる。これは適当なジエンと反応し、アントラセン(トリプチセンのような分子も可)やフランが10%から25%の割合で反応する。
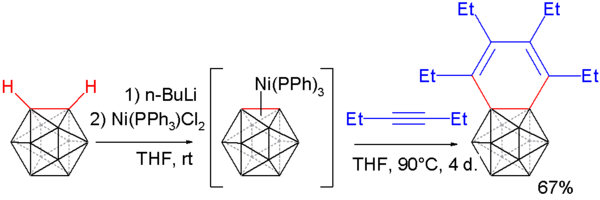
カルボリンはアルキンと反応しベンゾカルボラン (benzocarborane) が生成する[22][23]。まずo-カルボランがn-ブチルリチウムにより脱プロトン化され、ジクロロビス(トリフェニルホスフィン)ニッケルと反応し、カルボリンのニッケル錯体が生成する。つぎに3-ヘキシンと反応させるとベンゾカルボランが生成する。
単結晶のX線回折構造解析により、この化合物のベンゼン環の結合距離は一定でなく、長い結合が164.8 pmで短い結合が133.8 pmであり、芳香族性が崩れていることが確認された。
応用
[編集]カルボランは中性子捕捉療法のホウ素源として使われている[24]。結晶学での構造研究にも使われている[25]。
カルボラン酸 H(CHB11Cl11) は超酸であり、固体超酸の合成に使われる。プロトン脱離で生じるアニオンCHB11Cl11−の安定性とClの電子求引性によりカルボラン酸の酸性度は硫酸の百万倍である[26]。今のところカルボラン酸はC60フラーレンをそのままプロトン化できる唯一の酸である[27][28]。さらにアレニウムイオンC6H7+を塩として単離できる。
配位化学においてカルボランはリガンドとして独特な性質をもつ。同じカルボランでもヘテロ原子への配位の仕方により強い電子求引性を示すものもあれば、逆に電子供与性を示すものもある[29]。
関連項目
[編集]出典
[編集]- ^ F・A・コットン、G・ウィルキンソン『コットン ウィルキンソン 無機化学(上)』中原 勝儼(原書第四版)、培風館、1987年、p.314頁。ISBN 4563041920。
- ^ Jemmis, E. D. (1982). “Overlap control and stability of polyhedral molecules. Closo-Carboranes”. Journal of the American Chemical Society 104 (25): 7017–7020. doi:10.1021/ja00389a021.
- ^ Tsuji M. (2004). “Most Stable Conformation of the Cyclopropane Ring Attached at a Carbon Atom in a 1,2-Dicarba-closo-dodecaborane(12) System”. Journal of Organic Chemistry 69 (12): 4063-4074. doi:10.1021/jo049854i.
- ^ Tsuji M. (2003). “On Attempts at Generation of Carboranyl Carbocation”. Journal of Organic Chemistry 68 (25): 9589-9597. doi:10.1021/jo035090f.
- ^ Kutal, C. R.; Owen, D. A.; Todd, L. J. (1968), “closo-1,2-dicarbadodecaborane(12)”, Inorganic Syntheses 11: 19–23, doi:10.1002/9780470132425.ch5, ISBN 978-0-470-13242-5
- ^ Heying, T. L.; Ager, J. W.; Clark, S. L.; Mangold, D. J.; Goldstein, H. L.; Hillman, M.; Polak, R. J.; Szymanski, J. W. (1963). “A New Series of Organoboranes. I. Carboranes from the Reaction of Decaborane with Acetylenic Compounds”. Inorganic Chemistry 2 (6): 1089–1092. doi:10.1021/ic50010a002.
- ^ Schroeder, H.; Heying, T. L.; Reiner, J. R. (1963). “A New Series of Organoboranes. II. The Chlorination of 1,2-Dicarbaclosododecaborane(12)”. Inorganic Chemistry 2 (6): 1092–1096. doi:10.1021/ic50010a003.
- ^ Heying, T. L.; Ager, J. W.; Clark, S. L.; Alexander, R. P.; Papetti, S.; Reid, J. A.; Trotz, S. I. (1963). “A New Series of Organoboranes. III. Some Reactions of 1,2-Dicarbaclosododecaborane(12) and its Derivatives”. Inorganic Chemistry 2 (6): 1097–1105. doi:10.1021/ic50010a004.
- ^ Papetti, S.; Heying, T. L. (1963). “A New Series of Organoboranes. IV. The Participation of the 1,2-Dicarbaclosododecaborane(12) Nucleus in Some Novel Heteratomic Ring Systems”. Inorganic Chemistry 2 (6): 1105–1107. doi:10.1021/ic50010a005.
- ^ Fein, M. M.; Bobinski, J.; Mayes, N.; Schwartz, N.; Cohen, M. S. (1963). “Carboranes. I. The Preparation and Chemistry of 1-Isopropenylcarborane and its Derivatives (a New Family of Stable Closoboranes)”. Inorganic Chemistry 2 (6): 1111–1115. doi:10.1021/ic50010a007.
- ^ Fein, M. M.; Grafstein, D.; Paustian, J. E.; Bobinski, J.; Lichstein, B. M.; Mayes, N.; Schwartz, N. N.; Cohen, M. S. (1963). “Carboranes. II. The Preparation of 1- and 1,2-Substituted Carboranes”. Inorganic Chemistry 2 (6): 1115–1119. doi:10.1021/ic50010a008.
- ^ Grafstein, D.; Bobinski, J.; Dvorak, J.; Smith, H.; Schwartz, N.; Cohen, M. S.; Fein, M. M. (1963). “Carboranes. III. Reactions of the Carboranes”. Inorganic Chemistry 2 (6): 1120–1125. doi:10.1021/ic50010a009.
- ^ Grafstein, D.; Bobinski, J.; Dvorak, J.; Paustian, J. E.; Smith, H. F.; Karlan, S.; Vogel, C.; Fein, M. M. (1963). “Carboranes. IV. Chemistry of Bis-(1-carboranylalkyl) Ethers”. Inorganic Chemistry 2 (6): 1125–1128. doi:10.1021/ic50010a010.
- ^ Grafstein, D.; Dvorak, J. (1963). “Neocarboranes, a New Family of Stable Organoboranes Isomeric with the Carboranes”. Inorganic Chemistry 2 (6): 1128–1133. doi:10.1021/ic50010a011.
- ^ M. F. Hawthorne, D. C. Young, P. A. Wegner (1965). “Carbametallic Boron Hydride Derivatives. I. Apparent Analogs of Ferrocene and Ferricinium Ion”. J. Am. Chem. Soc. 87: 1818-1819. doi:10.1021/ja01086a053.
- ^ Plešek, J.; Heřmánek, S.; Štíbr, B.; Waksman, L.; Sneddon, L. G. (1983). “Potassium dodecahydro-7, 8-dicarba-nido-undecaborate(1-), k[7, 8-c2b9h12], intermediates, stock solution, and anhydrous salt”. Inorganic Syntheses 22. doi:10.1002/9780470132531.ch53.
- ^ Crowther, D. J., Baenziger, N. C., Jordan, R. F. (1991). “Group 4 metal dicarbollide chemistry. Synthesis, structures and reactivity of electrophilic alkyl complexes (Cp*)(C2B9H11)M(R), M = Hf, Zr.”. J. Am. Chem. Soc. 113: 1455-1457. doi:10.1021/ja00004a080.
- ^ Spokoyny, A. M., Li, T. C., Farha, O. K., Macha, C. W., She, C. Marks, T. J., Hupp, J. T., Mirkin, C. A. (2010). “Electronic tuning of nickel-based bis(dicarbollide) redox shuttles in dye-sensitized solar cells”. Angew. Chem. Int. Ed. 49: 5339-5343. doi:10.1002/anie.201002181.
- ^ Henry L. Gingrich, Tirthankar Ghosh, Qiurong Huang, and Maitland Jones (1990), “1,2-Dehydro-o-carborane”, J. Am. Chem. Soc. 112 (10): 4082–4083, doi:10.1021/ja00166a080
- ^ E. D. Jemmis and B. Kiran (1997), “Structure and Bonding in B10X2H10 (X = C and Si). The Kinky Surface of 1,2-Dehydro-o-Disilaborane”, J. Am. Chem. Soc. 119 (19): 4076–4077, doi:10.1021/ja964385q
- ^ B. Kiran, A. Anoop, E. D. Jemmis (2002), “Control of Stability through Overlap Matching: closo-Carboranes and closo-Silaboranes”, J. Am. Chem. Soc. 124: 4402–4407, doi:10.1021/ja016843n
- ^ Deng, L.; Chan, H.-S.; Xie, Z. (2006). “Nickel-Mediated Regioselective [2 + 2 + 2] Cycloaddition of Carboryne with Alkynes”. Journal of the American Chemical Society 128 (24): 7728–7729. doi:10.1021/ja061605j. PMID 16771473.
- ^ Jemmis, E. D.; Anoop, A. (2004). “Theoretical Study of the Insertion Reactions of Benzyne- and Carboryne- Ni Complexes” (pdf). Maui High Performance Computing Center Application Briefs (Air Force Maui Optical & Supercomputing Site (AMOS)) 2004: 51.
- ^ Soloway, Albert H.; Tjarks, Werner; Barnum, Beverly A.; Rong, Feng-Guang; Barth, Rolf F.; Codogni, Iwona M.; Wilson, J. Gerald (1998). “The Chemistry of Neutron Capture Therapy”. Chemical Reviews 98 (4): 1515–1562. doi:10.1021/cr941195u. ISSN 0009-2665.
- ^ Zhang, Dao-Peng; Dou, Jian-Min; Li, Da-Cheng; Wang, Da-Qi (2007). “Di-μ-chlorido-bis{[1,2-bis(diphenylphosphino)-1,2-dicarba-closo-dodecaborane-κ2P,P′]silver(I)} dichloromethane disolvate”. Acta Crystallographica Section E Structure Reports Online 63 (4): m1086–m1088. doi:10.1107/S1600536807007088. ISSN 1600-5368.
- ^ George A. Olah, G. K. Surya Prakash, Jean Sommer, Arpad Molnar (2009). Superacid Chemistry (2nd ed. ed.). Wiley. pp. 41. ISBN 978-0471596684
- ^ Mark Juhasz, Stephan Hoffmann, Evgenii Stoyanov, Kee-Chan Kim, Christopher A. Reed (2004), “The Strongest Isolable Acid”, Angew. Chem. Intl. Ed. 43 (40): 5352–5355, doi:10.1002/anie.200460005, PMID 15468064
- ^ Christopher A. Reed (2005), “Carborane acids. New "strong yet gentle" acids for organic and inorganic chemistry” (Full article (reprint)), Chem. Commun. 2005 (13): 1669–1677, doi:10.1039/b415425h, PMID 15791295
- ^ Spokoyny, A. M.; Machan, C. W.; Clingerman, D. J.; Rosen, M. S.; Wiester, M. J.; Kennedy, R. D.; Stern, C. L.; Sarjeant, A. A.; Mirkin, C. A. (2011). “A coordination chemistry dichotomy for icosahedral carborane-based ligands”. Nature Chemistry 3 (8): 590–596. Bibcode: 2011NatCh...3..590S. doi:10.1038/nchem.1088. PMID 21778977.