クロム酸酸化
クロム酸酸化(クロムさんさんか)は六価クロム化合物を利用した酸化反応のことである。第1級アルコールからアルデヒドまたはカルボン酸、第2級アルコールからケトンへの酸化反応に利用されることが多い。その他、ベンジル位メチル基のカルボン酸への酸化、アリル位、ベンジル位のメチレン基のカルボニル基への酸化などにも使用される。
反応
[編集]酸化に使用されるのは無水クロム酸(CrO3)、クロム酸(H2CrO4)、二クロム酸(H2Cr2O7)といった化合物の塩や錯体である。これらの化合物は強酸性条件下においては非常に強い酸化力を持ち、有機化合物は完全に分解される。酸化したい官能基だけを選択的に酸化し目的とする化合物を収率良く得るために、pHをコントロールしたり塩基を共存させたりする様々な反応条件の工夫をした酸化方法が開発されている。
クロム酸酸化におけるアルコールおよびアルデヒドの酸化反応は以下のような機構で進行する。まずアルコールのクロム酸エステルが生成し、アルコールの酸素の隣りの炭素上の水素とともに+IV価のクロムが脱離することでアルデヒドまたはケトンとなる。さらにアルデヒドは水和によりgem-ジオールとなった後にクロム酸との反応でクロム酸エステルを生成し、同様に反応してカルボン酸となる。そのため、アルデヒドの段階で酸化を止めるためには水の存在しない条件での反応が必須である。
この反応機構での律速段階は通常は+IV価のクロムの脱離の段階である。そのため、ある程度アルコールの近傍に立体的にかさ高い置換基がある方が脱離の活性化エネルギーが小さくなるために反応が速い傾向がある。
例えばアキシアル位に水酸基を持つシクロヘキサノールの方がエクアトリアル位に水酸基を持つシクロヘキサノールよりも酸化が速い。
六価クロム化合物は強い毒性を持ち、土壌汚染や水質汚染の原因となるために排出が厳しく規制されている。そのため、他の酸化反応が利用されることが多くなっている。
クロム酸混液
[編集]クロム酸混液(-さんこんえき)は六価クロムを硫酸水溶液に溶解することによって調製される酸化剤である。50%程度の硫酸水溶液にクロム酸塩を溶解したクロム酸混液は実験室においてガラス器具に付着した不溶性の有機化合物を分解除去するために使用されてきた。しかし六価クロムは環境への負荷が高く、廃液の処理の問題から現在では使用されることが少なくなっている。
反応に使用するクロム酸混液としては、1889年にE. Beckmannによって報告された二クロム酸カリウムを15%程度の硫酸水溶液に溶解したベックマン試薬(Beckmann reagent)や1901年にH. Kilianiによって報告された二クロム酸ナトリウム二水和物を20%程度の硫酸水溶液に溶解したキリアニ試薬(Kiliani reagent)がある。これらは現在ではベンジル位メチル基をカルボン酸に酸化するのに使用される。アルコールの酸化にも使用されていたが、現在はよりスムーズに反応することが多いジョーンズ酸化にとって代わられている。
また硫酸水溶液の代わりに酢酸を溶媒とした六価クロム化合物も酸化剤として使用されている。これらはアルコールの酸化の他、アリル位、ベンジル位のメチレン基のカルボニル基への酸化に使用される。
ジョーンズ酸化(Jones oxidation)
[編集]
ジョーンズ酸化は、1946年に E. R. H. Jones らによって報告された無水クロム酸の硫酸酸性溶液(ジョーンズ試薬)を酸化剤とし、アセトンを溶媒として用いる酸化反応である。 第1級アルコールのカルボン酸への酸化、第2級アルコールからケトンへの酸化に利用される。 無水クロム酸には目的物のケトンをさらに酸化する酸化力があるが、系内に溶媒として大過剰に存在するアセトンが優先的に酸化されるために過剰の反応を抑えることができる。
サレット酸化(Sarett oxidation)
[編集]サレット酸化は、1953年にL. H. Sarettらによって報告された無水クロム酸のピリジン溶液を用いる酸化反応である。ピリジンの配位によって無水クロム酸の酸化力が低下して過剰な反応が抑えられる。 第2級アルコールからケトンへの酸化反応に利用され、通常の第1級アルコールからアルデヒドへの酸化の収率は低いことが多く、カルボン酸への酸化も目的物がピリジンと塩を形成して回収が困難となる欠点がある。しかし第1級アリルアルコールや第1級ベンジルアルコールのアルデヒドへの酸化は収率が比較的良いことが多い。この反応を行う場合は必ず過剰のピリジンに無水クロム酸を少しずつ加えていく。逆に加えたり、一度に多くの量を加えたりすると発火する危険があるためである。
コリンズ酸化(Collins oxidation)
[編集]1968年にJ. C. Collinsらによって報告されたサレット酸化の改良法で、サレット酸化の活性種であるピリジン-無水クロム酸錯体((C5H5N)2・CrO3)を赤色の結晶として単離し、ジクロロメタン中で反応を行う方法である。
サレット酸化と比較して第1級アルコールからアルデヒドへの酸化の収率が改善している。しかし、ピリジン-無水クロム酸錯体は基質のアルコールに対して大過剰(通常6当量)に使用する必要がある。またピリジン-無水クロム酸錯体が吸湿分解しやすいため保管が難しく使用するごとに調製する必要がある。
PCC酸化
[編集]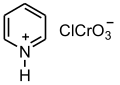
PCC(Pyridinium ChloroChromate、クロロクロム酸ピリジニウム、(C5H5N+H)・ClCrO−
3は1975年にイライアス・コーリーらによって報告された酸化剤で、無水クロム酸の塩酸水溶液をピリジンに加えると得られる結晶である。PCC酸化ではジクロロメタンを溶媒として反応を行う。第1級アルコールからアルデヒドへの酸化、第2級アルコールからケトンへの酸化に使用される。
コリンズ試薬と異なり、試薬に吸湿性は無く普通に保管が可能であり、また基質に対してそれほど過剰に加えなくても反応が完結する。やや強い酸性であるため、それに起因する副反応が起こることがある。また、PCC単独で酸化反応を行うと還元されたクロムとピリジンのペースト状の残渣が生成し、これに生成物が取り込まれて収率が低下する。そのため、粉末のモレキュラーシーブやセライト、シリカゲルなどをかなりの量添加して、これらに残渣を吸着させて生成物を抽出しやすくする手法が一般的である。このペースト状の残渣は濃厚なアルカリ性水溶液には溶解する。
PDC酸化
[編集]PDC(Pyridinium Dichromate、二クロム酸ピリジニウム、(C5H5N+H)2・Cr2O2−
7は1979年にE. J. Coreyらによって調製された酸化剤で無水クロム酸の水溶液にピリジンを加えると得られる結晶である。なお、無水クロム酸の水溶液を過剰のピリジンに加えて得られる酸化試薬はコーンフォース試薬(Cornforth reagent)と呼ばれ1962年にすでに報告されていたが、PDCはこの試薬の活性種と考えられている。
PCCと同様に試薬に吸湿性は無く普通に保管が可能である。 反応性もPCCと類似しているが、PCCとは異なり中性の試薬であるので酸性下で不安定な基質に対しても使用できる。PDC酸化ではジクロロメタンを溶媒として反応を行うが、ジメチルホルムアミド(DMF)を溶媒とすることもある。DMFを溶媒とした場合には、第1級アリルアルコールや第1級ベンジルアルコールはアルデヒドで酸化が止まるが、それ以外の第1級アルコールはカルボン酸まで酸化される。ペースト状残渣の発生を防ぐためにモレキュラーシーブなどを併用するのもPCCと同様である。
関連項目
[編集]
