PPARγ
PPARγ(ピーピーエイアールガンマ、Peroxisome Proliferator-Activated Receptor γ, NR1C3)とは核内受容体スーパーファミリーに属するタンパク質であり、転写因子としても機能する。「ペルオキシソーム増殖因子活性化受容体γ(ガンマ)」と和訳されることもある。PPARはα、β/δ、γの3種類のサブタイプが存在し、その中でもPPARγにはPPARγ1とγ2、γ3の少なくとも3種類のアイソフォームが存在することが知られている。選択的スプライシングの産物であるこれらのアイソフォームはそれぞれ発現や分子構造が異なる。PPARγは主に脂肪組織に分布して脂肪細胞分化などに関与するほか、マクロファージや血管内皮細胞などにも発現が見られる。インスリン抵抗性改善薬の標的分子でもある。
遺伝子および分子構造
[編集]遺伝子
[編集]PPARγはPPARGと呼ばれる遺伝子によりコードされる。PPARの各アイソフォームは遺伝子の選択的スプライシングの産物である。PPARγの遺伝子は5'末端側からA1,A2,B1と呼ばれるエキソンがあり、それに引き続いて各アイソフォームに共通のエキソン1-6が位置している。PPARγ1-3は5'末端側のエキソンがそれぞれ異なっており、PPARγ1の5'末端はエキソンA1とA2から構成されているのに対して、PPARγ2はエキソンB1、γ3はエキソンA2からなる[5]。なお、PPARγ遺伝子を欠損したマウスは胎生致死である[6]。
分子構造
[編集]
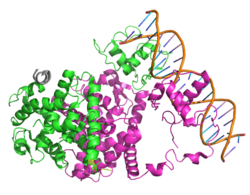
PPARγをはじめ、ビタミンD受容体、甲状腺ホルモン受容体など核内受容体スーパーファミリーに属する分子は基本的にそれぞれが類似した分子構造をとる。PPARγもその例外ではなく、アミノ基(-NH2)側末端から順にA/Bドメイン、Cドメイン、Dドメイン、E/Fドメインにより構成される。PPARγのリガンド結合ポケットは他の核内受容体に比して広いため、多くのリガンドとの結合が可能である。
- A/Bドメイン
- A/Bドメインは活性化に必要なドメイン構造であり、リガンド非依存的な転写活性化に必要なAF-1を持つ。
- Cドメイン
- CドメインはDNA結合領域であり、標的遺伝子のPPAEと結合する。構造中に亜鉛フィンガードメインを有する。DNA結合領域は核内受容体ファミリー間で構造がよく保存されている。
- Dドメイン
- Dドメインはヒンジ領域である。DNA結合領域とリガンド結合領域をリンクする。柔軟性に富み、ステロイド受容体ファミリーの構造可変性に関与するドメインである。
- E/Fドメイン
- E/Fドメインはリガンド依存的な転写活性化に関与するAF-2とリガンド結合ドメインを有する。
発現組織
[編集]PPARγ1は脂肪組織や免疫系細胞、腎臓、肝臓、骨髄、胎盤、血管平滑筋などに、γ2は脂肪細胞をはじめとして幅広く発現している。
PPARγリガンド
[編集]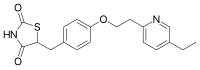
内因性リガンド
[編集]外因性リガンド
[編集]- チアゾリジンジオン系 (TZDs)
- アンギオテンシン受容体拮抗薬 (ARB)
- 非ステロイド性抗炎症薬 (NSAIDs)
転写活性化システム
[編集]
PPARγは9-cis-レチノイン酸をリガンドとし核内受容体の一種であるレチノイドX受容体 (RXR) とヘテロ二量体を形成し(RXRはビタミンD受容体など他の核内受容体とも複合体を形成する)、DNA上のPPAR応答領域 (PPRE) に結合する。PPREはコア配列 (5'-AGGTCA-3') を同一方向に2回繰り返したいわゆるダイレクトリピート型とよばれる型の核酸塩基配列 (DR1) であり、それぞれのコア配列の間には塩基を1つ挟む(5'-AGGTCA-N-AGGTCA-3':Nは任意の塩基)。
PPARγは分子構造の変化によりDNAとの相互作用が可能となるが、これを受容体の『活性化』と呼んでいる。PPARγの活性化はリガンド依存的なものと非依存的なものとが存在しており、それぞれAF-1およびAF-2の活性化ドメインが重要となる。リガンド非依存的な活性化に関してはよくわかっていないところが多いが、転写共役制御因子(コリプレッサー)であるN-CoRやSMATの存在下にDNAと結合して標的遺伝子の発現を抑制する。N-CoRやSMATはヒストンの脱アセチル化に関与する酵素HDACと複合体を形成することで発現される酵素活性によってクロマチンを密な状態に保ち、転写を負に制御する。この機構は"Active Repression"と呼ばれる。
一方、PPARγのリガンド結合ドメインにリガンドが結合すると受容体蛋白質の構造変化によりN-CoRなどのコリプレッサーが解離する。これによりAF-2領域のLXXLLモチーフに活性化補助因子(コアクチベーター)が結合することができるようになる。コアクチベーターはヒストンアセチル化活性(HAT活性)を有するCBP/p300などから構成される複合体であり、PPARγへリガンドが結合することでリクルートされ、転写の活性化を引き起こす。この複合体は、1) HAT活性を有するタンパク質複合体、2) PPARγと基本転写因子複合体(ホロ酵素)を橋渡しするHAT活性を持たない転写共役因子複合体(TRAP/DRIPなど)、3) クロマチンリモデリングに関与する複合体(SWI/SNF複合体など)から形成される。ヒストンのアセチル化はヒストン構造中にあるリジン残基の正電荷の中和を引き起こし、DNAとの結合が緩められる結果基本転写因子やRNAポリメラーゼがアクセスしやすい状態になる。
また、PPARγの活性化レベルはリン酸化により制御されていると考えられている。核内受容体の中ではエストロゲン受容体α (ERα) が比較的研究が進んでおり、ERαのAF-1の中にあるSer118はMAPキナーゼによりリン酸化を受けることが報告されている[7]。一方で、PPARγがリン酸化されることでその活性が抑制されることも報告されている。MAPキナーゼファミリーの一員であるERKはPPARγのA/Bドメインに存在するSer112をリン酸化するとされており、同ファミリーに属するJNKもまたSer82をリン酸化を行い、いずれの場合もPPARγの転写活性を減退させる[8]。
生理活性と臨床応用
[編集]抗糖尿病作用
[編集]
脂肪細胞はレプチンなどのアディポサイトカインと呼ばれる生理活性物質を産生しており、アディポサイトカインはその作用から善玉と悪玉に分けられる。善玉アディポサイトカインの中でもアディポネクチンは膵臓から分泌されるインスリンへの感受性を亢進させる作用を有し、血糖降下作用の発現に寄与することで注目されている。アディポネクチン遺伝子のプロモーター領域にはPPAEが存在し、脂肪細胞の分化に必要不可欠な分子であるPPARγが結合することでアディポネクチンの産生が促進される。また、PPARγアゴニストは前駆脂肪細胞からアディポネクチン産生能を有する小型脂肪細胞への分化誘導と肥大化した脂肪細胞のアポトーシスにより脂肪細胞サイズの小型化を引き起こす。小型化した脂肪細胞はアディポネクチン産生量の亢進に加えて炎症性サイトカインであるTNF-αの産生量低下などインスリン感受性の増強を引き起こす。一方、TNF-αは肥大化した脂肪細胞においては産生量が増加しており、インスリンのシグナルを抑制するため(インスリン抵抗性)、血糖値を上昇させる。
抗動脈硬化作用
[編集]動脈硬化病巣の形成には血液中の単球に由来するマクロファージが重要な役割を果たしている。単球は血管壁に入り込んだ後にマクロファージへと分化し、細胞表面に発現したスカベンジャー受容体を介して酸化LDLの取り込みを行う。この取り込みに寄与するスカベンジャー受容体の代表的なものとしてCD36やクラスAスカベンジャー受容体(SR-A)が知られており、CD36はPPARγの活性化により発現が増強することが報告されている。大量のコレステロールエステルを取り込むことでマクロファージは細胞内に脂肪滴を蓄積した泡沫細胞に変化する。泡沫細胞が血管壁に蓄積すると血管壁が肥厚化するため、血管内腔が狭くなる。
しかし、実際にはPPARγアゴニストは動脈硬化を抑制する作用を示す。そのメカニズムの一つとして提唱されているのがコレステロール逆輸送系の賦活化である[9]。これは組織あるいはマクロファージに発現するABCA1やABCG1とよばれる輸送タンパク質などの働きによりコレステロールを細胞外に排出する経路であり、脂質の沈着を抑制する。PPARγアゴニストによるABCA1の誘導には少なくとも2つの経路が提唱されており、1) PPARγへのリガンドの結合で核内受容体の一つであるLXRαが誘導されることによりABCA1の発現量が亢進するという経路と、2) PPARγが代謝酵素シトクロムP450の一つであるCYP27 (sterol 27-hydroxylase) の発現を誘導し、LXRαのリガンドであるオキシステロールを生成するという経路である[10]。PPARγアゴニストの抗動脈硬化作用はいくつかの大規模な臨床試験でも検討されている。そのひとつとして2型糖尿病患者を対象に行ったPROactive試験が挙げられ、PPARγアゴニストであるピオグリタゾンを使用した患者群において心血管イベントが減少傾向を示している[11]。また、CHICAGO試験ではピオグリタゾンの投与を受けた患者群において動脈硬化度の指標である内中膜複合体厚(IMT)が減少するという結果が得られている[12]。
骨代謝
[編集]骨代謝に関与する骨芽細胞は転写因子Runx2とOsterixの働きにより分化することが知られている。骨芽細胞は脂肪細胞や筋肉細胞、軟骨細胞と共通の前駆細胞(間葉系幹細胞)を有するため、これらの細胞の分化は互いに関連が見られる。PPARγは間葉系幹細胞から脂肪細胞への分化を促進する一方で骨芽細胞への分化を抑制[13]しており、さらにNF-κBおよびMAPキナーゼの活性化抑制により破骨細胞への分化促進[14][15]を行うことも報告されている。PPARγアゴニストであるチアゾリジン誘導体の投与は骨折のリスクを上昇させることがRECORD試験[16]やADOPT試験[17]により示されている。
抗腫瘍作用
[編集]PPARγは乳癌や大腸癌、膵臓癌、前立腺癌、肺癌など様々な癌細胞において発現していることが確認されている[18][19]。PPARγの抗腫瘍効果発現の機序としてまず挙げられるのが細胞増殖抑制である。細胞の増殖には細胞周期と呼ばれるサイクルが深く関与しており、G1期→S期→G2期→M期の順に進行する。PPARγリガンドはG1期での細胞周期進行を抑制することで細胞増殖抑制を引き起こす。その詳細なメカニズムとして提唱されているのは細胞周期進行に関与し、サイクリン依存性キナーゼ阻害因子の一つであるp27Kip1の発現量亢進であり[20]、ユビキチン-プロテアソーム経路の阻害がその原因であると考えられている。ユビキチン-プロテアソーム経路とはタンパク質の分解を司る系であり、ユビキチン修飾を受けたタンパク質が特異的にプロテアソームと呼ばれる酵素複合体に取り込まれ、分解を受ける。p27Kip1のユビキチン化にはskp1というタンパク質が関与しているが、チアゾリジンジオン系薬剤はskp1の発現量を減少させる効果があり、その結果G1期の進行を停止させる。
また、腫瘍細胞のアポトーシス誘導も抗腫瘍効果の一因であると考えられており、そのメカニズムにはp53タンパク質の関与が示唆されている[21]。
さらに、血管新生の抑制も引き起こすということが提唱されており、VEGFと呼ばれる増殖因子の働きを抑制すること神経膠芽腫やルイス肺癌細胞において報告されている。その一方で、前立腺癌細胞[22]や骨芽細胞[23]ではVEGFの発現が増強することが報告されており、抗腫瘍効果があると一概にまとめることができるかについてはまだ議論の余地がある。
抗炎症作用
[編集]PPARγ活性化によりもたらされる抗炎症作用については数多く報告されている。中でも特筆すべき事項として炎症・免疫関連転写因子であるNF-κB活性化抑制作用が挙げられる。関節リウマチや気管支喘息などの炎症性疾患ではNF-κBの活性化が報告されており、NF-κBは炎症性遺伝子プロモーター領域に結合して各種サイトカインや細胞接着分子などの産生を促す。PPARγはリガンド依存的にNF-κBのDNA結合を抑制することで炎症反応に対して抑制的に働く。
出典
[編集]- ^ a b c GRCh38: Ensembl release 89: ENSG00000132170 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000000440 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ Fajas L, Auboeuf D, Raspé E, Schoonjans K, Lefebvre AM, Saladin R, Najib J, Laville M, Fruchart JC, Deeb S, Vidal-Puig A, Flier J, Briggs MR, Staels B, Vidal H and Auwerx J (1997). “The organization, promoter analysis, and expression of the human PPARγ gene”. J. Biol. Chem. 272: 18779-18789. doi:10.1074/jbc.272.30.18779. PMID 9228052.
- ^ Barak Y, Nelson MC, Ong ES, Jones YZ, Ruiz-Lozano P, Chien KR, Koder A and Evans RM (1999). “PPAR γ is required for placental, cardiac, and adipose tissue development”. Mol. Cell 4: 585-595. doi:10.1016/S1097-2765(00)80209-9. PMID 10549290.
- ^ Kato S, Endoh H, Masuhiro Y, Kitamoto T, Uchiyama S, Sasaki H, Masushige S, Gotoh Y, Nishida E, Kawashima H, Metzger D and Chambon P (1995). “Activation of the estrogen receptor through phosphorylation by mitogen-activated protein kinase”. Science 270: 1491–1494. doi:10.1126/science.270.5241.1491. PMID 7491495.
- ^ Takano H and Komuro I (2009). “Peroxisome proliferator-activated receptor γ and cardiovascular diseases”. Circ. J. 73: 214-220. doi:10.1253/circj.CJ-08-1071. PMID 19129679.
- ^ Chawla A, Boisvert WA, Lee CH, Laffitte BA, Barak Y, Joseph SB, Liao D, Nagy L, Edwards PA, Curtiss LK, Evans RM and Tontonoz P (2001). “A PPAR γ-LXR-ABCA1 pathway in macrophages is involved in cholesterol efflux and atherogenesis”. Mol. Cell 7: 161-171. doi:10.1016/S1097-2765(01)00164-2. PMID 11172721.
- ^ Blaschke F, Spanheimer R, Khan M, Law RE (2006). “Vascular effects of TZDs: new implications”. Vascul. Pharmacol. 45: 3-18. doi:10.1016/j.vph.2005.11.009. PMID 16740417.
- ^ Dormandy JA. et al (2005). “Secondary prevention of macrovascular events in patients with type 2 diabetes in the PROactive Study (PROspective pioglitAzone Clinical Trial In macroVascular Events): a randomised controlled trial”. Lancet 366: 1279-1289. doi:10.1016/S0140-6736(05)67528-9. PMID 16214598.
- ^ Mazzone T, Meyer PM, Feinstein SB, Davidson MH, Kondos GT, D'Agostino RB Sr, Perez A, Provost JC and Haffner SM (2006). “Effect of pioglitazone compared with glimepiride on carotid intima-media thickness in type 2 diabetes: a randomized trial”. JAMA 296: 2572-2581. doi:10.1001/jama.296.21.joc60158. PMID 17101640.
- ^ Akune T, Ohba S, Kamekura S, Yamaguchi M, Chung UI, Kubota N, Terauchi Y, Harada Y, Azuma Y, Nakamura K, Kadowaki T and Kawaguchi H (2004). “PPARγ insufficiency enhances osteogenesis through osteoblast formation from bone marrow progenitors”. J. Clin. Invest. 113: 846-855. doi:10.1172/JCI19900. PMC 362117. PMID 15067317.
- ^ Park JY, Bae MA, Cheon HG, Kim SS, Hong JM, Kim TH, Choi JY, Kim SH, Lim J, Choi CH, Shin HI, Kim SY and Park EK (2009). “A novel PPARγ agonist, KR62776, suppresses RANKL-induced osteoclast differentiation and activity by inhibiting MAP kinase pathways”. Biochem. Biopsys. Res. Commun. 378: 645-649. doi:10.1016/j.bbrc.2008.11.115,. PMID 19059209.
- ^ Wan Y, Chong LW and Evans RM (2007). “PPAR-γ regulates osteoclastogenesis in mice”. Nat. Med. 13: 1496-1503. doi:10.1038/nm1672. PMID 18059282.
- ^ Home PD, Pocock SJ, Beck-Nielsen H, Curtis PS, Gomis R, Hanefeld M, Jones NP, Komajda M and McMurray JJ (2009). “Rosiglitazone evaluated for cardiovascular outcomes in oral agent combination therapy for type 2 diabetes (RECORD): a multicentre, randomised, open-label trial”. Lancet 373: 2125-2135. doi:10.1016/S0140-6736(09)60953-3. PMID 19501900.
- ^ Kahn SE, Zinman B, Lachin JM, Haffner SM, Herman WH, Holman RR, Kravitz BG, Yu D, Heise MA, Aftring RP and Viberti G (2008). “Rosiglitazone-associated fractures in type 2 diabetes: an Analysis from A Diabetes Outcome Progression Trial (ADOPT)”. Diabetes Care 31: 845-851. doi:10.2337/dc07-2270. PMID 18223031.
- ^ Grommes C, Landreth GE and Heneka MT (2004). “Antineoplastic effects of peroxisome proliferator-activated receptor gamma agonists”. Lancet Oncol. 5: 419-429. doi:10.1016/S1470-2045(04)01509-8. PMID 15231248.
- ^ Osawa E, Nakajima A, Wada K, Ishimine S, Fujisawa N, Kawamori T, Matsuhashi N, Kadowaki T, Ochiai M, Sekihara H and Nakagama H (2003). “Peroxisome proliferator-activated receptor γ ligands suppress colon carcinogenesis induced by azoxymethane in mice”. Gastroenterology 124: 361-367. doi:10.1053/gast.2003.50067. PMID 12557142.
- ^ Motomura W, Okumura T, Takahashi N, Obara T and Kohgo Y (2000). “Activation of peroxisome proliferator-activated receptor γ by troglitazone inhibits cell growth through the increase of p27KiP1 in human Pancreatic carcinoma cells”. Cancer Res. 60: 5558-5564. PMID 11034103.
- ^ Nagamine M, Okumura T, Tanno S, Sawamukai M, Motomura W, Takahashi N and Kohgo Y (2003). “PPAR γ ligand-induced apoptosis through a p53-dependent mechanism in human gastric cancer cells”. Cancer Sci. 94: 338-343. doi:10.1111/j.1349-7006.2003.tb01443.x. PMID 12824901.
- ^ Haslmayer P, Thalhammer T, Jäger W, Aust S, Steiner G, Ensinger C and Obrist P (2002). “The peroxisome proliferator-activated receptor gamma ligand 15-deoxy-Δ12,14-prostaglandin J2 induces vascular endothelial growth factor in the hormone-independent prostate cancer cell line PC 3 and the urinary bladder carcinoma cell line 5637”. Int. J, Oncol. 21: 915-920. PMID 12239635.
- ^ Yasuda E, Tokuda H, Ishisaki A, Hirade K, Kanno Y, Hanai Y, Nakamura N, Noda T, Katagiri Y and Kozawa O (2005). “PPAR-γ ligands up-regulate basic fibroblast growth factor-induced VEGF release through amplifying SAPK/JNK activation in osteoblasts”. Biochem. Biophys. Res. Commun. 328: 137-143. doi:10.1016/j.bbrc.2004.12.163. PMID 15670761.