EZH2
EZH2(enhancer of zeste homolog 2)はEZH2遺伝子にコードされるヒストンメチルトランスフェラーゼ(EC 2.1.1.43)である。ヒストンのメチル化を行い、最終的には転写の抑制に関与する[5]。EZH2は補因子としてS-アデノシル-L-メチオニンを利用して、ヒストンH3のリジン27番へのメチル基の付加を触媒する。EZH2のメチル化活性はヘテロクロマチン形成を促進し、それによって遺伝子の機能をサイレンシングする[5]。EZH2による染色体のヘテロクロマチンのリモデリングは有糸分裂時にも必要となる。
EZH2はPRC2(Polycomb repressive complex 2)のメチル化活性を担う構成要素であり、PRC2は発生と分化の調節を担う遺伝子のエピジェネティック状態を維持することで正常な胚発生を担う[6]。PRC2には他にも最適な機能のために必要なタンパク質(EED、SUZ12、JARID2、AEBP2、RbAp46/48、PCL1)が含まれている[7]。
EZH2の変異や過剰発現は、多くのがんと関連付けられている[8]。EZH2はがんの発生の抑制を担う遺伝子を阻害するため、EZH2活性の阻止によって腫瘍の成長が遅くなる可能性がある。EZH2は乳がん[9]、前立腺がん[10]、悪性黒色腫[11]、膀胱がん[12]を含む複数のがんでアップレギュレーションされているため、抗がん剤の阻害標的となっている。また、EZH2遺伝子の変異は稀少先天性疾患であるウィーバー症候群と関係しており[13]、EZH2は毛細血管拡張性運動失調症の神経変性症状にも関与している[14]。
機能
[編集]| Histone-lysine N-methyltransferase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 識別子 | |||||||||
| EC番号 | 2.1.1.43 | ||||||||
| データベース | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| PDB構造 | RCSB PDB PDBj PDBe PDBsum | ||||||||
| |||||||||
EZH2はPRC2の触媒サブユニットである[15]。EZH2の触媒活性は、少なくとも他の2つのPRC2構成要素、SUZ12とEEDとの複合体形成に依存している[15]。
EZH2はヒストンメチルトランスフェラーゼであり、EZH2の主な機能はヒストンH3のリジン27番(H3K27)のメチル化である。EZH2は補因子S-アデノシル-L-メチオニン(SAM)からメチル基を転移する。EZH2は、H3K27のモノ-、ジ-、トリメチル化が可能であり、造血、発生、細胞分化における転写調節など、さまざまな生物学的機能と関係している[16][17][18][19]。
近年の研究では、EZH2はヒストン以外のタンパク質のメチル化も可能であることが示唆されている[16][17]。
転写抑制
[編集]EZH2はPRC2の一部としてH3K27のトリメチル化(H3K27me3)を触媒する。H3K27me3はヒストンコードの一部として特徴づけられているヒストン修飾である[15][19][20][21]。ヒストンコードは、ヒストンタンパク質のメチル化、アセチル化、ユビキチン化などの化学修飾が遺伝子の転写のエピジェネティックな調節にそれぞれ特有の役割を果たしているという仮説である。EZH2を介したH3K27me3の触媒は、長期の転写抑制と関係している[15][19][20]。
EZH2は他のポリコーム群タンパク質と同様に、細胞分裂を通して遺伝子の抑制を確立し維持する過程に関与している[16][19]。この転写抑制状態は、PRC2/EZH2-EEDを介したH3K27のメチル化と、その後にクロマチン凝縮とヘテロクロマチン形成を促進するPRC1のリクルートによって確立されると考えられている[19]。ヘテロクロマチンは固くパッキングされたクロマチンであり、DNAへの転写装置のアクセスを制限することで転写を抑制する[22]。
細胞分裂の過程では、ヘテロクロマチンの形成は適切な染色体分離のために必要である[23]。PRC2/EED-EZH2複合体はDNAメチルトランスフェラーゼのリクルートにも関与している可能性があり、他のエピジェネティックな転写抑制機構であるDNAメチル化の増加をもたらす[15][16]。EZH2を介した転写抑制の標的として同定されている具体的な遺伝子としては、HOXA9、HOXC8、MYT1、CDKN2A、レチノイン酸標的遺伝子がある[15]。
転写活性化
[編集]がんにおいては、EZH2はPRC2非依存的に転写の活性化に関与している可能性がある[16]。乳がん細胞では、EZH2はNF-κB標的遺伝子を活性化することが示されている[16]。この活性の機能的役割とその機構については未解明である。
発生と細胞分化
[編集]EZH2は発生に必要不可欠な役割を果たす。特に、EZH2は細胞分化を調節する遺伝子の転写抑制の制御を助ける[16][17][19][20]。胚性幹細胞では、発生遺伝子を含む領域でのEZH2を介したH3K27のトリメチル化は、正常な細胞分化の維持に重要であるようである[19]。またH3K27me3は、メスの発生時にX染色体の一方をサイレンシングする、X染色体の不活性化の駆動にも重要である[21]。X染色体の不活性化時には、EZH2はH3K27のトリメチル化によってヘテロクロマチン形成の開始に関与しており、サイレンシング状態の維持には他のヒストンメチルトランスフェラーゼや他のヒストン修飾も関係している可能性があると考えられている[24]。
さらに、EZH2はB細胞とT細胞の発生と分化に関与する必須のタンパク質としても同定されている[17]。H3K27me3は分化を促進する遺伝子の抑制に関与しており、そのためEZH2はB細胞とT細胞を未分化状態に維持し、造血の調節に重要な役割を果たす。
EZH2の活性の調節
[編集]EZH2の活性は、セリン・スレオニン残基のリン酸化による翻訳後修飾によって調節されている[25]。具体的には、T350のリン酸化はEZH2活性の増加と関連付けられており、一方T492とS21のリン酸化はEZH2活性の低下と関連付けられている[20][25]。T492のリン酸化はEZH2とPRC2複合体中の結合パートナーとの間の接触を阻害し、その触媒活性を妨げることが示唆されている[20]。
リン酸化に加えて、PRC2/EZH2-EEDの活性は、H3K27のアセチル化(H3K27ac)やH3K36のメチル化(H3K36me)などの転写活性化ヒストン修飾と拮抗することが示されている[20][26]。
酵素活性
[編集]EZH2の機能はPRC2複合体へのリクルートに高度に依存している。特に、EEDとSUZ12はEZH2とヒストン基質との相互作用の安定化に必要である[27][28]。近年、ヒトでは、EZH2は2つのアイソフォーム(EZH2αとEZH2β)が選択的スプライシングによって形成されることが明らかにされている[29]。核局在化シグナル、EEDとSUZ12への結合部位、保存されたSETドメインといったEZH2の機能に重要なエレメントは、どちらのアイソフォームにも含まれている[29]。これまでほとんどの研究は長いアイソフォームであるEZH2αに焦点を当てていたが、エクソン4と8を欠くEZH2βにも活性があることが示されている[29]。さらに、PRC2/EZH2β複合体はPRC2/EZH2αとは異なる遺伝子に作用し、各アイソフォームがそれぞれ特異的な遺伝子セットに作用している可能性が示唆される[29]。また、EZH2は高度にアップレギュレーションされている場合、PRC2との結合に依存せずにリジンのメチル化を行う可能性がある[16]。
リジンのメチル化
[編集]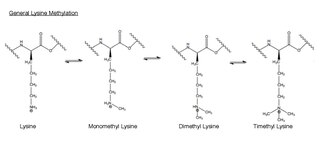
生物学においてはメチル化は典型的には酵素によって触媒され、メチル基はタンパク質または核酸のいずれかに付加される。EZH2によって触媒されるメチル化反応では、ヒストンH3のリジン残基がメチル化される。このアミノ酸の末端のアンモニウム基は最大3回メチル化することができる。こうしたメチル化リジンは哺乳類の遺伝子発現の制御に重要であり、ヘテロクロマチン形成、X染色体の不活性化、転写調節に機能する[30]。哺乳類の染色体では、ヒストンのリジンのメチル化は、部位に応じて遺伝子発現の活性化または抑制のいずれかを行う。近年の研究からは、EZH2複合体のサイレンシング機能の少なくとも一部はヒストンH3のリジン27番残基のメチル化によるものであることが示されている[31]。メチル化修飾はヒストンへのタンパク質の結合に影響を与え、転写を活性化または阻害する[23]。
触媒機構
[編集]
EZH2はリジンメチルトランスフェラーゼ、SETドメインファミリーのメンバーであり、基質タンパク質のリジン側鎖にメチル基を付加する[32]。SETメチルトランスフェラーゼは補因子S-アデノシルメチオニン(SAM)に依存しており、SAMはメチル基の供与体として作用する。SETドメインタンパク質は、基質とSAMが酵素の活性部位にそれぞれ反対側から結合する点で他のSAM依存的メチルトランスフェラーゼとは異なる。この基質と補因子の配向によって、基質との結合を壊すことなくSAMが解離することが可能となり、基質を解離することなく複数回のリジンメチル化を行うことが可能となる[32]。
EZH2に基質やSAMが結合した結晶構造は決定されていないが、ヒトSET7/9メチルトランスフェラーゼとのSTAMPによるアラインメントからは、EZH2の推定活性部位には保存されたチロシン残基がほぼ同一な位置に存在していることが示されている。

EZH2の活性部位のY726は以前は基質のリジンを脱プロトン化する一般塩基として作用することが示唆されていたが、速度論的同位体効果からは活性部位の残基はメチル基転移反応の化学に直接的には関与していないことが示されている[33]。代わりにこれらの実験からは、活性部位残基は基質のリジン残基のpKaを低下させ、同時に水分子が活性部位内のリジン側鎖にアクセスするチャネルを提供するという機構が支持される。その後、バルク溶媒の水分子は容易にリジン側鎖を脱プロトン化して活性化し、SN2様反応によるSAM補因子への求核攻撃によって、SAMからリジン側鎖へのメチル基の転移を引き起こす[33]。

EZH2は主にH3K27のモノメチル化とジメチル化を触媒するが、臨床的関連のあるY641F変異によって高いH3K27トリメチル化活性がもたらされる[33]。Y641からのヒドロキシル基の除去によって立体障害がなくなり、基質のリジンへの3つ目のメチル基の収容が可能となることが提唱されている。
臨床的意義
[編集]がん
[編集]EZH2はがん細胞の分裂と増殖を助けるため、抗がん剤治療の魅力的な標的である。EZH2は乳がん、前立腺がん、膀胱がん、子宮がん、腎臓がん、悪性黒色腫や悪性リンパ腫を含む広範囲のがんにおいて、正常細胞よりも多量に存在することが知られている。EZH2は遺伝子発現の抑制因子であるため、過剰発現時には通常発現している多くのがん抑制遺伝子が抑制される。EZH2の機能の阻害によってがん抑制遺伝子がサイレンシングされなくなるため、悪性腫瘍が縮小することが一部の症例では報告されている[34]。EZH2は健康な成人では通常発現しておらず、胎児の発生時など活発に分裂している細胞にのみ存在する[35]。こうした特性のため、EZH2の過剰発現はがんや一部の神経変性疾患の診断マーカーとして利用可能である[14]。しかしながら、EZH2の過剰発現が疾患の原因であるのか、それとも単に他の要因による結果であるのかを判断することが難しい症例が存在する。もしEZH2の過剰発現が結果にすぎない場合、EZH2の阻害を標的とすることは疾患の治癒にはつながらない。EZH2が関与するがん経路の1つは、Rb-E2F経路である。EZH2はRb-E2F経路の下流に位置し、この経路からのシグナルはEZH2の過剰発現を引き起こす[36]。EZH2の他の重要な特徴は、過剰発現している場合、PRC2を形成することなく遺伝子を活性化することができるという点である。このことは酵素のメチル化活性が複合体形成を介さないため問題となる。乳がん細胞では、EZH2は細胞増殖と生存を促進する遺伝子を活性化する[16]。また、Wntシグナル経路の因子と相互作用することで、c-mycやサイクリンD1などの調節遺伝子の活性化も行う[37]。重要なことに、SETドメインのY641が多数の異なるアミノ酸へ変異していることは一部のB細胞リンパ腫に一般的な特徴である[38]。
阻害剤
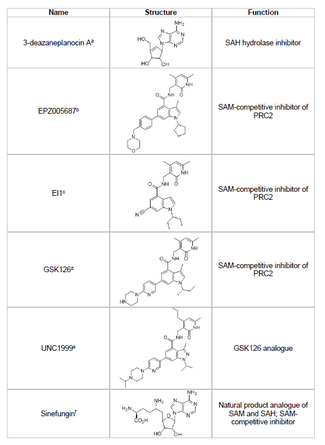
[編集]EZH2の阻害剤の開発とそれによるがん抑制遺伝子の望まないヒストンメチル化の防止は、がん研究の有望な領域である。EZH2の阻害剤の開発はタンパク質のSETドメインの活性部位を標的としたものに焦点が当てられている。2015年時点で、3-デアザネプラノシンA(DZNep)、EPZ005687、EI1、GSK126、UNC1999といった、いくつかのEZH2阻害剤が開発されている。DZNepは、乳がんと大腸がんの細胞でEZH2のレベルを低下させてアポトーシスを誘導するため、抗ウイルス、抗がん作用を有する可能性がある[39]。DZNepはS-アデノシル-L-ホモシステイン(SAH)の加水分解を阻害する、すべてのタンパク質メチルトランスフェラーゼに対する反応産物ベースの阻害剤である。DZNepはSAHの細胞内濃度の上昇を引き起こすことでEZH2を阻害するが、EZH2に対して特異的ではないため、他のDNAメチルトランスフェラーゼなども阻害する。
2012年、Epizyme社はDZNepよりも選択性の高い、S-アデノシル-L-メチオニン(SAM)競合型阻害剤EPZ005687を発表した。この薬剤はEZH1と比較してEZH2に対する選択性が50倍高い。薬剤は酵素のSETドメインの活性部位に結合することでEZH2の活性を遮断する。EPZ005687はEZH2のY641やA677の変異体も阻害することができるため、非ホジキンリンパ腫の治療への適用の可能性がある[40]。2013年、Epizyme社は他のEZH2阻害剤タゼメトスタット(EPZ-6438)のB細胞リンパ腫の患者に対する第I相臨床試験を開始した[44]。2020年、タゼメトスタット(商標名Tazverik)は転移性または局所進行性の類上皮肉腫の治療に対してFDAの承認を受け、その年には再発性濾胞性リンパ腫に対する承認も行われた[45]。
シネフンギン(sinefungin)は他のSAM競合的阻害剤であるが、DZNep同様EZH2に対する特異性はない[43]。メチルトランスフェラーゼの補因子結合ポケットに結合することで作用し、メチル基の転移を防ぐ。EI1はノバルティス社によって開発された阻害剤で、Y641変異型細胞も含め、リンパ腫細胞でEZH2阻害活性を示す[41]。この阻害剤の作用機序も、SAMのEZH2への結合に対する競合である[41]。GSK126はグラクソスミスクライン社によって開発された強力なSAM競合型EZH2阻害剤で、EZH1と比較して150倍の選択性があり、Kiは0.5–3 nMである[42]。UNC1999はGSK126のアナログとして開発され、経口投与で活性を示す最初のEZH2阻害剤である。しかしながら、GSK126と比較して選択性は低く、EZH1にも同様に結合するため、オフターゲット効果の可能性が高くなっている。
一次治療が奏効しなくなった際の治療法として併用療法が研究されている。トポイソメラーゼの阻害剤であるエトポシドは、EZH2阻害剤を併用した際に、BRG1とEGFRに変異を有する非小細胞性肺がんに対する効果が高まる[34]。しかしながら、EZH2とリジンメチル化は腫瘍抑制作用を持つ場合もあるため(例としては骨髄異形成症候群[46])、EZH2の阻害がすべての症例に対して有効なわけではない可能性がある。
ウィーバー症候群
[編集]EZH2遺伝子の変異はウィーバー症候群と関連付けられている。ウィーバー症候群は、骨年齢の促進、大頭症、両眼隔離症によって特徴づけられる稀少疾患である[13]。ウィーバー症候群と診断された患者では、EZH2の活性部位のヒスチジン残基がチロシンに変異している[13]。この変異は補因子の結合を阻害し、タンパク質の正常な機能は失われている可能性が高い[13]。
分類学上の分布
[編集]
Enhancer of zeste(E(z))はもともとキイロショウジョウバエDrosophila melanogasterで同定され、その後に哺乳類ホモログが同定されてEZH1(enhancer of zeste homolog 1)、EZH2(enhancer of zeste homolog 2)と命名された[48]。EZH2は進化を通じて高度に保存されている。EZH2とそのホモログは、植物、昆虫、魚類、そして哺乳類で、発生、細胞分化、細胞分裂に必要不可欠な役割を果たしている[16][20][49][50]。系統樹ではさまざまな生物種におけるEZH2の分布が示されている[51][52]。
出典
[編集]- ^ a b c GRCh38: Ensembl release 89: ENSG00000106462 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000029687 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ a b “The Polycomb group protein EZH2 directly controls DNA methylation”. Nature 439 (7078): 871–4. (2006). doi:10.1038/nature04431. PMID 16357870.
- ^ “Polycomb group protein-mediated repression of transcription”. Trends Biochem. Sci. 35 (6): 323–32. (2010). doi:10.1016/j.tibs.2010.02.009. PMID 20346678.
- ^ “The Polycomb complex PRC2 and its mark in life”. Nature 469 (7330): 343–9. (2011). doi:10.1038/nature09784. PMC 3760771. PMID 21248841.
- ^ Kim, Kimberly; Roberts, Charles (18 December 2015). “Targeting EZH2 in cancer”. Nature Medicine 22 (2): 128–134. doi:10.1038/nm.4036. PMC 4918227. PMID 26845405.
- ^ “EZH2 methyltransferase and H3K27 methylation in breast cancer”. Int. J. Biol. Sci. 8 (1): 59–65. (2012). doi:10.7150/ijbs.8.59. PMC 3226033. PMID 22211105.
- ^ “The polycomb group protein EZH2 is involved in progression of prostate cancer”. Nature 419 (6907): 624–9. (2002). doi:10.1038/nature01075. hdl:2027.42/62896. PMID 12374981.
- ^ “The epigenetic modifier EZH2 controls melanoma growth and metastasis through silencing of distinct tumour suppressors”. Nat Commun 6: 6051. (2015). doi:10.1038/ncomms7051. PMID 25609585.
- ^ “Increased expression of EZH2, a polycomb group protein, in bladder carcinoma”. Urol. Int. 75 (3): 252–7. (2005). doi:10.1159/000087804. PMID 16215315.
- ^ a b c d “Mutations in EZH2 cause Weaver syndrome”. Am. J. Hum. Genet. 90 (1): 110–8. (2012). doi:10.1016/j.ajhg.2011.11.018. PMC 3257956. PMID 22177091.
- ^ a b “EZH2-mediated H3K27 trimethylation mediates neurodegeneration in ataxia-telangiectasia”. Nat. Neurosci. 16 (12): 1745–53. (2013). doi:10.1038/nn.3564. PMC 3965909. PMID 24162653.
- ^ a b c d e f “EZH2 - Histone-lysine N-methyltransferase EZH2 - Homo sapiens (Human) - EZH2 gene & protein” (英語). www.uniprot.org. 2020年12月28日閲覧。
- ^ a b c d e f g h i j “EZH2: biology, disease, and structure-based drug discovery”. Acta Pharmacol. Sin. 35 (2): 161–74. (2014). doi:10.1038/aps.2013.161. PMC 3914023. PMID 24362326.
- ^ a b c d “EZH2 in normal and malignant hematopoiesis”. Leukemia 28 (1): 44–9. (2014). doi:10.1038/leu.2013.288. PMID 24097338.
- ^ “RefSeq”. RefSeq Gene EZH2. February 1, 2015閲覧。
- ^ a b c d e f g “The polycomb protein Ezh2 impacts on induced pluripotent stem cell generation”. Stem Cells Dev. 23 (9): 931–40. (2014). doi:10.1089/scd.2013.0267. PMC 3996971. PMID 24325319.
- ^ a b c d e f g “Inner workings and regulatory inputs that control Polycomb repressive complex 2”. Chromosoma 121 (3): 221–34. (2012). doi:10.1007/s00412-012-0361-1. PMC 3351537. PMID 22349693.
- ^ a b “Histone H3K27”. EpiGenie. 2020年12月28日閲覧。
- ^ “Heterochromatin revisited”. Nat. Rev. Genet. 8 (1): 35–46. (2007). doi:10.1038/nrg2008. PMID 17173056.
- ^ a b “Relationship between histone H3 lysine 9 methylation, transcription repression, and heterochromatin protein 1 recruitment”. Mol. Cell. Biol. 25 (7): 2525–2538. (2005). doi:10.1128/MCB.25.7.2525-2538.2005. PMC 1061631. PMID 15767660.
- ^ Jeanteur, Philippe (2008). Epigenetics and Chromatin. Springer. ISBN 9783540852360
- ^ a b “Phosphorylation of the PRC2 component Ezh2 is cell cycle-regulated and up-regulates its binding to ncRNA”. Genes Dev. 24 (23): 2615–20. (2010). doi:10.1101/gad.1983810. PMC 2994035. PMID 21123648.
- ^ “CBP-mediated acetylation of histone H3 lysine 27 antagonizes Drosophila Polycomb silencing”. Development 136 (18): 3131–41. (2009). doi:10.1242/dev.037127. PMC 2730368. PMID 19700617.
- ^ “SUZ12 is required for both the histone methyltransferase activity and the silencing function of the EED-EZH2 complex”. Mol. Cell 15 (1): 57–67. (2004). doi:10.1016/j.molcel.2004.06.020. PMID 15225548.
- ^ “Point mutations in the WD40 domain of Eed block its interaction with Ezh2”. Mol. Cell. Biol. 18 (10): 5634–42. (1998). doi:10.1128/MCB.18.10.5634. PMC 109149. PMID 9742080.
- ^ a b c d “Functional characterization of EZH2β reveals the increased complexity of EZH2 isoforms involved in the regulation of mammalian gene expression”. Epigenetics & Chromatin 6 (1): 3. (February 28, 2013). doi:10.1186/1756-8935-6-3. PMC 3606351. PMID 23448518.
- ^ “The diverse functions of histone lysine methylation”. Nat. Rev. Mol. Cell Biol. 6 (11): 838–849. (2005). doi:10.1038/nrm1761. PMID 16261189.
- ^ “Polycomb PHF19 binds H3K36me3 and recruits PRC2 and demethylase NO66 to embryonic stem cell genes during differentiation”. Nat. Struct. Mol. Biol. 19 (12): 1273–1281. (2012). doi:10.1038/nsmb.2449. PMID 23160351.
- ^ a b “The SET-domain protein superfamily: protein lysine methyltransferases”. Genome Biol. 6 (8): 227. (2005). doi:10.1186/gb-2005-6-8-227. PMC 1273623. PMID 16086857 February 1, 2015閲覧。.
- ^ a b c “Enzyme-dependent lysine deprotonation in EZH2 catalysis”. Biochemistry 52 (39): 6866–78. (2013). doi:10.1021/bi400805w. PMID 24000826.
- ^ a b “Window of Vulnerability”. Harvard Medical School. 2021年1月4日閲覧。
- ^ a b “An orally bioavailable chemical probe of the Lysine Methyltransferases EZH2 and EZH1”. ACS Chem. Biol. 8 (6): 1324–34. (2013). doi:10.1021/cb400133j. PMC 3773059. PMID 23614352.
- ^ “EZH2 is downstream of the pRB-E2F pathway, essential for proliferation and amplified in cancer”. EMBO J. 22 (20): 5323–35. (2003). doi:10.1093/emboj/cdg542. PMC 213796. PMID 14532106.
- ^ “Integration of estrogen and Wnt signaling circuits by the polycomb group protein EZH2 in breast cancer cells”. Mol. Cell. Biol. 27 (14): 5105–19. (2007). doi:10.1128/MCB.00162-07. PMC 1951944. PMID 17502350.
- ^ “Somatic mutations altering EZH2 (Tyr641) in follicular and diffuse large B-cell lymphomas of germinal-center origin”. Nat. Genet. 42 (2): 181–5. (2010). doi:10.1038/ng.518. PMC 2850970. PMID 20081860.
- ^ a b “Pharmacologic disruption of Polycomb-repressive complex 2-mediated gene repression selectively induces apoptosis in cancer cells”. Genes Dev. 21 (9): 1050–63. (2007). doi:10.1101/gad.1524107. PMC 1855231. PMID 17437993.
- ^ a b “A selective inhibitor of EZH2 blocks H3K27 methylation and kills mutant lymphoma cells”. Nat. Chem. Biol. 8 (11): 890–6. (2012). doi:10.1038/nchembio.1084. PMID 23023262.
- ^ a b c “Selective inhibition of Ezh2 by a small molecule inhibitor blocks tumor cells proliferation”. Proc. Natl. Acad. Sci. U.S.A. 109 (52): 21360–5. (2012). doi:10.1073/pnas.1210371110. PMC 3535655. PMID 23236167.
- ^ a b “EZH2 inhibition as a therapeutic strategy for lymphoma with EZH2-activating mutations”. Nature 492 (7427): 108–12. (2012). doi:10.1038/nature11606. PMID 23051747.
- ^ a b “Catalytic roles for carbon-oxygen hydrogen bonding in SET domain lysine methyltransferases”. J. Biol. Chem. 281 (28): 19280–7. (2006). doi:10.1074/jbc.M602257200. PMID 16682405.
- ^ Epizyme Announced Clinical Data from Phase 1 Trial of EZH2 Inhibitor EPZ-6438 (E7438) to be Presented at EORTC-NCI-AACR Symposium. (2014, October 1).
- ^ Research, Center for Drug Evaluation and (2020-06-18). “FDA granted accelerated approval to tazemetostat for follicular lymphoma” (英語). FDA.
- ^ “Somatic mutations of the histone methyltransferase gene EZH2 in myelodysplastic syndromes”. Nat. Genet. 42 (8): 665–7. (2010). doi:10.1038/ng.620. PMID 20601954.
- ^ “Ensembl”. Gene Tree EZH2. February 19, 2015閲覧。
- ^ “Mammalian homologues of the Polycomb-group gene Enhancer of zeste mediate gene silencing in Drosophila heterochromatin and at S. cerevisiae telomeres”. EMBO J. 16 (11): 3219–32. (1997). doi:10.1093/emboj/16.11.3219. PMC 1169939. PMID 9214638.
- ^ “NCBI UniGene”. Enhancer of zeste homolog 2 (Drosophila) (EZH2). February 1, 2015閲覧。
- ^ “GeneCards”. Enhancer Of Zeste Homolog 2 (Drosophila). February 1, 2015閲覧。
- ^ “Ensembl”. Gene Tree EZH2. February 1, 2015閲覧。
- ^ “Ensembl 2014”. Nucleic Acids Res. 42 (Database issue): D749–55. (2014). doi:10.1093/nar/gkt1196. PMC 3964975. PMID 24316576.
関連文献
[編集]- “The Polycomb group protein Enhancer of Zeste 2: its links to DNA repair and breast cancer”. Journal of Molecular Histology 37 (5–7): 219–23. (Sep 2006). doi:10.1007/s10735-006-9042-9. PMID 16855786.
- “Epigenetic control of hematopoietic stem cell aging the case of Ezh2”. Annals of the New York Academy of Sciences 1106 (1): 233–9. (Jun 2007). doi:10.1196/annals.1392.008. PMID 17332078.
- “Interaction of Vav with ENX-1, a putative transcriptional regulator of homeobox gene expression”. Molecular and Cellular Biology 16 (6): 3066–73. (Jun 1996). doi:10.1128/MCB.16.6.3066. PMC 231301. PMID 8649418.
- “Normalization and subtraction: two approaches to facilitate gene discovery”. Genome Research 6 (9): 791–806. (Sep 1996). doi:10.1101/gr.6.9.791. PMID 8889548.
- “Characterization of EZH1, a human homolog of Drosophila Enhancer of zeste near BRCA1”. Genomics 37 (2): 161–71. (Oct 1996). doi:10.1006/geno.1996.0537. PMID 8921387.
- “Mammalian homologues of the Polycomb-group gene Enhancer of zeste mediate gene silencing in Drosophila heterochromatin and at S. cerevisiae telomeres”. The EMBO Journal 16 (11): 3219–32. (Jun 1997). doi:10.1093/emboj/16.11.3219. PMC 1169939. PMID 9214638.
- “Specific interaction between the XNP/ATR-X gene product and the SET domain of the human EZH2 protein”. Human Molecular Genetics 7 (4): 679–84. (Apr 1998). doi:10.1093/hmg/7.4.679. PMID 9499421.
- “Interaction of mouse polycomb-group (Pc-G) proteins Enx1 and Enx2 with Eed: indication for separate Pc-G complexes”. Molecular and Cellular Biology 18 (6): 3572–9. (Jun 1998). doi:10.1128/MCB.18.6.3572. PMC 108938. PMID 9584197.
- “Characterization of interactions between the mammalian polycomb-group proteins Enx1/EZH2 and EED suggests the existence of different mammalian polycomb-group protein complexes”. Molecular and Cellular Biology 18 (6): 3586–95. (Jun 1998). doi:10.1128/mcb.18.6.3586. PMC 108940. PMID 9584199.
- “Point mutations in the WD40 domain of Eed block its interaction with Ezh2”. Molecular and Cellular Biology 18 (10): 5634–42. (Oct 1998). doi:10.1128/MCB.18.10.5634. PMC 109149. PMID 9742080.
- “Transcriptional repression mediated by the human polycomb-group protein EED involves histone deacetylation”. Nature Genetics 23 (4): 474–8. (Dec 1999). doi:10.1038/70602. PMID 10581039.
- “The human EZH2 gene: genomic organisation and revised mapping in 7q35 within the critical region for malignant myeloid disorders”. European Journal of Human Genetics 8 (3): 174–80. (Mar 2000). doi:10.1038/sj.ejhg.5200439. PMID 10780782.
- “Distinct BMI-1 and EZH2 expression patterns in thymocytes and mature T cells suggest a role for Polycomb genes in human T cell differentiation”. Journal of Immunology 166 (10): 5925–34. (May 2001). doi:10.4049/jimmunol.166.10.5925. PMID 11342607.
- “Polycomblike PHD fingers mediate conserved interaction with enhancer of zeste protein”. The Journal of Biological Chemistry 276 (46): 43065–73. (Nov 2001). doi:10.1074/jbc.M104294200. PMID 11571280.
- “The polycomb group protein EZH2 is involved in progression of prostate cancer”. Nature 419 (6907): 624–9. (Oct 2002). doi:10.1038/nature01075. hdl:2027.42/62896. PMID 12374981.
- “EZH2 is a marker of aggressive breast cancer and promotes neoplastic transformation of breast epithelial cells”. Proceedings of the National Academy of Sciences of the United States of America 100 (20): 11606–11. (Sep 2003). doi:10.1073/pnas.1933744100. PMC 208805. PMID 14500907.