固体脂質ナノ粒子
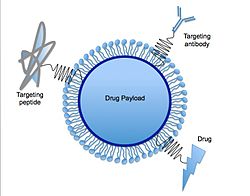
固体脂質ナノ粒子(こたいししつなのりゅうし、英: solid lipid nanoparticle、SLN、sLNP)や脂質ナノ粒子(英: lipid nanoparticle、LNP)は、脂質で構成されるナノ粒子である[1][2]。これらは新しい医薬品送達システム(およびナノ粒子ドラッグデリバリーの一部)であり、新しい医薬製剤である。ドラッグデリバリー担体としてのLNPは、2018年にsiRNA製剤オンパットロで初めて承認された[3]。LNPがより広く知られるようになったのは2020年後半のことで、RNAワクチン技術を用いたCOVID-19ワクチンの中には、壊れやすいmRNA鎖をPEG化した脂質ナノ粒子に封入して送達手段としたものがある(モデルナ社とファイザー - ビオンテック社の両方のワクチンが含まれる)[4]。
特徴
[編集]
固体脂質ナノ粒子は通常、球形であり、平均直径は10 - 1000ナノメートルである。固体脂質ナノ粒子は、親油性の分子を可溶化できる固体脂質コアマトリックスを持っている。脂質コアは、界面活性剤(乳化剤)によって安定化される。その乳化剤は、投与経路によって異なるものが使用され、非経口投与の場合はさらに限定を受ける[5]。脂質という言葉は、ここでは広い意味で使われており、トリグリセリド(例: トリステアリン)、ジグリセリド(例: グリセロールベヘネート)、モノグリセリド(例: グリセロールモノステアレート)、脂肪酸(例: ステアリン酸)、ステロイド(例: コレステロール)、ワックス(例: パルミチン酸セチル)などが含まれる。脂質分散液を安定化するために、すべてのクラスの乳化剤(電荷と分子量に関して)が使用される。乳化剤を組み合わせることで、粒子の凝集をより効率的に防げることが知られている[5][6]。
SLNは一般的に球形で、界面活性剤によって安定化された固体脂質コアで構成されている。コア脂質は、脂肪酸、アシルグリセロール、ワックス、およびこれらの界面活性剤の混合物を使用できる。安定剤として、リン脂質、スフィンゴミエリンなどの生体膜脂質、胆汁酸塩(タウロコール酸ナトリウム)、ステロール(コレステロール)などが用いられる。生物学的脂質は担体毒性が低く、また固体の脂質であるため物質移動抵抗が大きく、薬物の放出をよりよく制御することができる[7]。Shahらは、著書『Lipid Nanoparticles: Production, Characterization and Stability』で、これらについて詳しく述べている[8]。
SARS-CoV-2(COVID-19の原因ウイルス)のmRNAワクチンで使われるLNPは4種類の脂質でできていて、イオン化可能なカチオン性脂質(正電荷が負に帯電したmRNAに結合する)、PEG化された脂質(安定性のため)、リン脂質(構造のため)、コレステロール(構造のため)が含まれている[9]。
合成
[編集]配合方法としては、高せん断ホモジナイザーや超音波処理、溶媒による乳化/蒸発、マイクロエマルションなどがある。超音波処理では30 - 180 nmの粒度分布を得ることができるが、超音波処理時間が長くかかる。溶剤乳化法は、熱を加えずに済むという利点があり、小さくて均一なサイズの脂質ナノ粒子分散液を調製するのに適している[10]。
応用
[編集]固体脂質ナノ粒子の開発は、脂質ナノテクノロジーの新分野の一つであり(脂質ナノテクノロジーに関するレビュー[11]を参照)、ドラッグデリバリー、臨床医学、研究、その他の分野での応用が期待されている。脂質ナノ粒子は、そのユニークなサイズ依存性の特性により、新しい治療法を開発する可能性を秘めている。薬剤をナノキャリアに組み込むことができればバイオアベイラビリティを向上させ、制御された部位特異的なドラッグデリバリーを実現することができ、ドラッグデリバリーの新たなプロトタイプとなる。また、SLNは生理学的に類似した脂質で構成されているので、一般的に忍容性が高いと考えられている。
腸リンパ管へのドラッグデリバリーのために、透過促進剤の使用、表面改質、プロドラッグ合成、複合体形成、コロイド脂質キャリアに基づく戦略などの従来からのアプローチが展開されている。さらに、高分子ナノ粒子、自己乳化型送達システム、リポソーム、マイクロエマルション、ミセル溶液、そして最近では固体脂質ナノ粒子(SLN)が、経口腸リンパ送達の担体として有望な可能性として利用されている[12]。
ドラッグデリバリー
[編集]固体脂質ナノ粒子は、経口および非経口ドラッグデリバリーシステムの基礎をなして働く。SLNは、脂質エマルションとポリマーナノ粒子システムの利点を兼ね備えており、従来のポリマーナノ粒子ドラッグデリバリーアプローチで問題となっていた時間的および生体内での安定性の問題を克服する[5]。SLNは、他のコロイド担体に比べて多くの利点を兼ね備えていることが提案されている。すなわち、親油性および親水性の薬物の取り込みが可能であること、キャリアの生物毒性がないこと、有機溶媒を使用しないこと、薬物放出の制御および薬物標的化が可能であること、薬物の安定性が向上すること、および大規模生産に関して問題がないことである[5]。最近の研究では、親水性分子である硫酸鉄(II)(FeSO4)をステアリン酸で構成された脂質マトリックスに組み込むことにより、栄養ミネラルである鉄を経口投与するためのプラットフォームとして固体脂質ナノ粒子を使用することが実証された[13]。カルベジロールを担持した固体脂質ナノ粒子は、脂質としてCompritolを、界面活性剤としてPoloxamer 188 を用いて、経口投与用の熱均質化法で調製された[14]。SLNを用いたドラッグデリバリーの別の例として蒸留水に懸濁した経口固体SLNがあり、SLN構造内に薬物を閉じ込めるために合成された。消化不良になると、このSLNは胃酸や腸酸にさらされ、SLNが溶解して薬剤を体内に放出する[15]。
多くのナノ構造システムが眼のドラッグデリバリーに採用されており、いくつかの有望な結果が得られている。1990年代から、SLNは、薬剤の担体システムとして注目されてきた。SLNは、生理的脂質から調製されるため、生物毒性を示さない。SLNは、薬物の角膜吸収を促進し、親水性および親油性の薬物の眼内バイオアベイラビリティを向上させることができるため、眼のドラッグデリバリーにおいて特に有用である[16]。また、固体脂質ナノ粒子は、眼科薬の製剤化に必要なステップであるオートクレーブ滅菌ができるという利点もある[17]。
SLNの利点には、生理的的脂質の使用(急性および慢性毒性の危険性を低減)、有機溶媒の不使用、潜在的な幅広い適用範囲(経皮、経口、静脈内の投与)、高圧ホモジナイザーによる製造方法が確立されていることなどが挙げられる。さらに、難水溶性の薬物を固体脂質マトリックスに組み込むことによって、バイオアベイラビリティの向上、水や光などの外部環境から敏感な薬物分子の保護、さらには放出制御特性などが主張された。さらに、SLNは親油性と親水性の両方の薬剤を運ぶことができ、高分子/界面活性剤ベースの担体と比較してより低価格である[18]。
核酸
[編集]LNPを核酸の送達担体として使用する際の大きな障害は、自然界では、脂質と核酸はともに負の電荷を帯びており、互いに混ざり合いにくいことである[19]。Philip Felgnerは、シンテックス社に在籍していた1980年代半ばに[20]、人工的に作られたカチオン性脂質(正に帯電した脂質)を用いて、脂質と核酸を結合させ、核酸を細胞内にトランスフェクションする技術を開発した[21]。しかし、1990年代後半までに、このカチオン性脂質の使用が細胞膜に好ましくない副作用をもたらすことが生体外実験で明らかになった[22]。
1990年代後半から2000年代にかけて、ブリティッシュ・コロンビア大学のPieter Cullisは、「酸性のpHでは正に帯電し、血液中では中性になる」イオン化可能なカチオン性脂質を開発した[9]。Cullisはまた、生体の細胞膜を安全に通過できるLNPを作成するために、材料を混ぜる際にpHを慎重に調整する技術の開発を主導した[19][23]。2021年現在、このようなイオン化可能なカチオン性脂質で製剤化されたLNPは、受容体介在性エンドサイトーシスを経て細胞内に入り、エンドソーム内に到達すると理解されている[9]。エンドソーム内の酸性度により、LNPのイオン化可能なカチオン性脂質が正電荷を帯びることで、LNPがエンドソームから脱出し、RNAのペイロードを放出すると考えられている[9]。
2005年から2010年代初頭にかけて、低分子干渉RNA(siRNA)薬剤のドラッグデリバリーシステムとしてLNPが研究された[9]。2009年、Cullisは自身のLNP研究を商業化するために、アキュイタス・セラピューティックス社を共同設立した。アキュイタス社では、アルナイラム・ファーマシューティカルズ社のsiRNA医薬品用のLNPの開発に取り組んだ[24]。2018年、FDAは、ドラッグデリバリーシステムとしてLNPを使用した最初の医薬品であるアルナイラム社のsiRNA医薬品オンパトロ(パチシラン)を承認した[3][9]。
その時点で、アルナイラム社のようなsiRNA医薬品開発企業は、複合型医薬品のような将来の医薬品のために他の選択肢をすでに検討していた。しかし、2010年代には、siRNAにLNPを使用する以前の研究が、mRNAにLNPを使用する新たな研究の基盤となった[9]。短いsiRNAを対象とした脂質は、はるかに長いmRNAではうまく働かなかったため、2010年代半ばには、mRNAに適した新しいイオン化可能なカチオン性脂質の研究が盛んに行われた[9]。2020年後半の時点で、SARS-CoV-2用のいくつかのmRNAワクチンは、モデルナCOVID-19ワクチンとファイザー - ビオンテックCOVID-19ワクチンの両方を含め、LNPをドラッグデリバリーシステムとして使用している[3]。モデルナ社はSM-102という独自のイオン化可能なカチオン性脂質を使用し、ファイザー社とビオンテック社はアキュイタス社からライセンスを受けたALC-0315というイオン化可能なカチオン性脂質を使用している[9]。
リンパ吸収メカニズム
[編集]Caco-2細胞株を生体外モデルとした固体脂質ナノ粒子からの腸管リンパ吸収メカニズムが解明された[25]。一部の研究者は、難水溶性の薬剤を固体脂質ナノ粒子に封入すると、経口バイオアベイラビリティが向上することを示した。このようなバイオアベイラビリティの向上はリンパ送達を介してなされた。固体脂質ナノ粒子からの吸収メカニズムを解明するために、動物実験前のスクリーニングツールとなる生体外モデルを開発するため、代替組織としてヒト摘出Caco-2細胞単層が考えられた。このモデルで得られた結果から、カルベジロールを担持した固体脂質ナノ粒子の主な吸収メカニズムがエンドサイトーシス、より具体的にはクラスリン媒介エンドサイトーシスである可能性が示唆された[14]。
関連項目
[編集]- ナノメディシン - 一般分野
- ミセル - 脂質を含む
- リポソーム - 脂質二重層シェル、いくつかの制限を持つ初期の形態
- リポプレックス - プラスミドや直鎖状のDNAと脂質の複合体
- 標的化ドラッグデリバリー
- ナノ粒子ドラッグデリバリー - 薬物送達への応用
- エラソメラン - LNPを用いたモデルナ社のワクチン
- トジナメラン - LNPを用いたビオンテック/ファイザー社のワクチン
脚注
[編集]- ^ Saupe, Anne; Rades, Thomas (2006). “Solid Lipid Nanoparticles”. Nanocarrier Technologies. pp. 41. doi:10.1007/978-1-4020-5041-1_3. ISBN 978-1-4020-5040-4
- ^ Jenning, V; Thünemann, AF; Gohla, SH (2000). “Characterisation of a novel solid lipid nanoparticle carrier system based on binary mixtures of liquid and solid lipids”. International Journal of Pharmaceutics 199 (2): 167–77. doi:10.1016/S0378-5173(00)00378-1. PMID 10802410.
- ^ a b c Cooney, Elizabeth (1 December 2020). “How nanotechnology helps mRNA Covid-19 vaccines work”. Stat. 3 December 2020閲覧。
- ^ Pardi, Norbert; Hogan, Michael J.; Porter, Frederick W.; Weissman, Drew (April 2018). “mRNA vaccines — a new era in vaccinology”. Nature Reviews Drug Discovery 17 (4): 261–279. doi:10.1038/nrd.2017.243. PMC 5906799. PMID 29326426.
- ^ a b c d Mehnert et al., 2001
- ^ Small, 1986
- ^ Manzunath et al., 2005
- ^ Lipid nanoparticles : production, characterization and stability. Rohan Shah. Cham. (2014). ISBN 978-3-319-10711-0. OCLC 890371346
- ^ a b c d e f g h i Cross, Ryan (March 6, 2021). “Without these lipid shells, there would be no mRNA vaccines for COVID-19”. Chemical & Engineering News (American Chemical Society) March 6, 2021閲覧。
- ^ Wolfgang Mehnert, Karsten Mäder, Solid lipid nanoparticles: Production, characterization and applications, Advanced Drug Delivery Reviews, Volume 64, 2012, Pages 83-101, ISSN 0169-409X, https://doi.org/10.1016/j.addr.2012.09.021
- ^ Mashaghi, S.; Jadidi, T.; Koenderink, G.; Mashaghi, A. Lipid Nanotechnology. Int. J. Mol. Sci. 2013, 14, 4242-4282.[1]
- ^ Studies on binary lipid matrix-based solid lipid nanoparticles of repaglinide: in vitro and in vivo evaluation. Rawat MK, Jain A and Singh S, Journal of Pharmaceutical Sciences, 2011, volume 100, issue 6, pages 2366-2378
- ^ Zariwala, MG (November 2013). “A novel approach to oral iron delivery using ferrous sulphate loaded solid lipid nanoparticles.”. Int J Pharm 456 (2): 400–7. doi:10.1016/j.ijpharm.2013.08.070. PMID 24012860.
- ^ a b Shah, Mansi K.; Madan, Parshotam; Lin, Senshang (23 May 2013). “Preparation, evaluation and statistical optimization of carvedilol-loaded solid lipid nanoparticle for lymphatic absorption via oral administration”. Pharmaceutical Development and Technology 19 (4): 475–485. doi:10.3109/10837450.2013.795169. PMID 23697916.
- ^ Pandey, Rajesh; Sharma, Sadhna; Khuller, G.K. (2005). “Oral solid lipid nanoparticle-based antitubercular chemotherapy”. Tuberculosis 85 (5–6): 415–420. doi:10.1016/j.tube.2005.08.009. PMID 16256437.
- ^ Arana, Lide; Salado, Clarisa; Vega, Sandra; Aizpurua-Olaizola, Oier; Arada, Igor de la; Suarez, Tatiana; Usobiaga, Aresatz; Arrondo, José Luis R. et al. (2015-11-01). “Solid lipid nanoparticles for delivery of Calendula officinalis extract”. Colloids and Surfaces B: Biointerfaces 135: 18–26. doi:10.1016/j.colsurfb.2015.07.020. PMID 26231862.
- ^ Seyfoddin, Ali; J. Shaw; R. Al-Kassas (2010). “Solid lipid nanoparticles for ocular drug delivery”. Drug Delivery 17 (7): 467–489. doi:10.3109/10717544.2010.483257. PMID 20491540.
- ^ Mukherjee, S et al. “Solid lipid nanoparticles: a modern formulation approach in drug delivery system.” Indian journal of pharmaceutical sciences vol. 71,4 (2009): 349-58. doi:10.4103/0250-474X.57282
- ^ a b Foley, Katherine Ellen (22 December 2020). “The first Covid-19 vaccines have changed biotech forever”. Quartz (Quartz Media) 11 January 2021閲覧。
- ^ “Phil Felgner Interview – July 22, 1997”. UC San Diego Library: San Diego Technology Archive. Regents of the University of California (22 July 1997). 2021年3月13日閲覧。
- ^ Byk, Gerardo (2002). “Cationic lipid-based gene delivery”. In Mahato, Ram I.; Kim, Sung Wan. Pharmaceutical Perspectives of Nucleic Acid-Based Therapeutics. London: Taylor & Francis. pp. 273–303. ISBN 9780203300961
- ^ Lasic, Danilo D. (1997). Liposomes in Gene Delivery. Boca Raton: CRC Press. p. 191. ISBN 9780849331091 11 January 2021閲覧。
- ^ Cullis, Pieter R.; Hope, Michael J. (5 July 2017). “Lipid Nanoparticle Systems for Enabling Gene Therapies”. Molecular Therapy 25 (7): 1467–1475. doi:10.1016/j.ymthe.2017.03.013. PMC 5498813. PMID 28412170.
- ^ Shore, Randy (November 17, 2020). “COVID-19: Vancouver’s Acuitas Therapeutics a key contributor to coronavirus solution”. Vancouver Sun
- ^ Shah, Mansi K.; Madan, Parshotam; Lin, Senshang (29 July 2014). “Elucidation of intestinal absorption mechanism of carvedilol-loaded solid lipid nanoparticle using Caco-2 cell line as an model”. Pharmaceutical Development and Technology 20 (7): 877–885. doi:10.3109/10837450.2014.938857. PMID 25069593.
推薦文献
[編集]- Solid lipid nanoparticles (SLN) for controlled drug delivery - a review of the state of the art. Muller et al. 2000
- Preparation, in vitro evaluation and statistical optimization of carvedilol-loaded solid lipid nanoparticles for lymphatic absorption via oral administration
- Elucidation of intestinal absorption mechanism of carvedilol-loaded solid lipid nanoparticles using Caco-2 cell line as an in-vitro model
