等吸収点
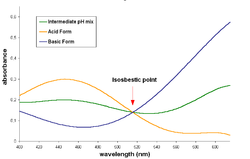
分光法において等吸収点(Isosbestic point)とは、サンプルの物理的・化学的変化にかかわらず全てのサンプルが同じ吸光度を示す光の波長(あるいは周波数)である。Isosbesticは、2つのギリシャ語の単語「iso」(同じ)と「sbestos」(消せる)を組み合わせた言葉である[1]。
等吸収点のプロット
[編集]等吸収点は吸光光度法(モル吸光を用いるか、または両方の化学種の濃度を一定に保って吸光度を測る)によって得られた吸収スペクトルを重ね合わせ、全てのサンプルの吸光スペクトルが交わった波長を等吸収点とする。
また、等吸収点が多数あることもある。
反応が1対1(1モルの反応物から1モルの生成物ができる反応で、平衡状態を含む)であり、反応物と生成物が等吸収点を持つ時、等吸収点において反応している混合物の吸光度は反応進行度や化学平衡の状態によらず一定である。これは反応物と生成物のその波長の光の吸光度が等しく、分析的濃度が一定だからである。
例えば、
という反応があったとする。この反応において、物質の分析的濃度は常に一定である。
反応中の混合物の吸光度A(XやYに依存する)は次のように表せる。
- .
ここでlは光が混合物を通過する長さである。(混合物の光学的距離ではない)
しかし、等吸収点では、それぞれの分子のモル吸光は等しい[2]。
- .
ゆえに、吸光度は
と表され、反応の進行度や、XやYそれぞれの濃度には依存しない。
等吸収点が現れるためには、2つの化学種が化学量において互いに線形的に関わっていることが必要である。例えば、1つの物質においてある特定波長で吸光度がただ一つに決まることなどである。したがって、物質量比が1対1でない混合物でも等吸収点が現れることがある。また、等吸収点がある場合、通常濃度変化によって吸光度が変化し、吸光に関わる化学種は2種類しかない。もし3つめの物質のスペクトルが存在する場合、その交点の波長は一定ではなくなり、濃度によって変わるようになる[3]。それは、3つの化合物がある特定波長での吸光係数について線形の関係を持つことはほとんどないからである。
応用
[編集]
反応速度論では、等吸収点の波長では反応中常に吸光度が一定であるため、等吸収点が反応速度の研究において基準として用いられる。
等吸収点は、ヘモグロビンの濃度を調べるためのオキシメトリーと呼ばれる医療技術に用いられている。これはヘモグロビンの飽和に関係なく使うことができる。オキシヘモグロビンとデオキシヘモグロビンの等吸光点は586nmと808nmにある。
等吸収点は臨床化学(英語版)でも用いられる。分光測色計の品質を保証し、波長の正確性を確かめるために用いられる。これは、pHの異なる2つの標準物質のスペクトルを測定して行われる。(pHはpKaより大きいものと小さいものを使う。)標準物質には二クロム酸カリウム(等吸収点339nmと445nm)、ブロモチモールブルー(等吸収点325nmと498nm)、コンゴーレッド(等吸収点541nm)が用いられる。等吸収点の波長は使った物質の濃度に依存しないので、それはとても信頼できる基準となる。
脚注
[編集]- ^ IUPAC Gold Book (IUPAC)
- ^ 酸塩基指示薬の酸解離平衡と吸光度の変化 - 京都大学理学部化学科所属教員、化学学生実験室
- ^ 『Kinetics and Mechanism』John W. Moore, Ralph G. Pearson, Arthur Atwater Frost (第3版 ジョン・ワイリー・アンド・サンズ, 1981年)、ISBN 0-471-03558-0, ISBN 978-0-471-03558-9





