移動水素化
移動水素化(英語:Transfer hydrogenation)は無機化学あるいは有機金属化学において2個の水素原子が分子に付加する反応のうち水素源として気体の水素分子(H2)を用いない反応である。有機合成化学では、気体の水素が高価で扱いづらいため、工業的に広く利用されている。移動水素化を大きなスケールで利用している例としてテトラリンのようなドナー溶媒を用いた石炭液化がある[1][2]。
有機金属触媒
[編集]有機合成においてはルテニウムやロジウムなどを中心金属とし、ジアミンやホスフィンを配位子とするなど様々な水素移動触媒が開発されている[3]。この代表的なものがジクロロ(シメン)ルテニウムダイマーとトシル化されたジフェニルエチレンジアミンである。これらの触媒は主にケトンやイミンをアルコールやアミンに還元する有機酸化還元反応に用いられる。これらの水素源は典型的にはイソプロパノールが用いられる。イソプロパノールは反応後はアセトンに変化する。移動水素化は出発物質がプロキラルな場合高いエナンチオ選択性で進行する。
- RR'C=O + Me2CHOH → RR'C*H-OH + Me2C=O (RR'C*H-OHはキラルな化合物)
よく用いられる触媒は(シメン)R,R-HNCHPhCHPhNTs(Ts=SO2C6H4Me、R,Rは不斉中心の炭素に対する絶対配置を示す。不斉水素化は2001年の野依良治のノーベル化学賞受賞の対象となった。[4]。
そのほかの移動水素化試薬としてメールワイン・ポンドルフ・バーレー還元に用いられるアルミニウムアルコキシド類(アルミニウムイソプロポキシド)がある。しかし遷移金属触媒に比べて活性は落ちる。

金属触媒を用いない反応
[編集]触媒的水素化が開発されるよりも前に、不飽和化合物の水素化が広く研究されてきた。これらの手法の多くは歴史的あるいは教育的にのみ研究されている。よく使われる水素移動試薬としてジアゼン((NH)2)がある。この化合物は酸化され非常に安定なN2へと変化する。
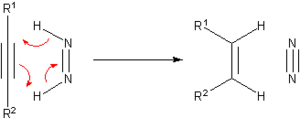
ジイミドはヒドラジンより合成される。水素源となる2つの炭化水素はシクロヘキセンあるいは1,3-シクロヘキサジエンである。このときベンゼンとアルカンが生成する。芳香族になることにより安定化されるためこの反応は進行する。この反応はPdが触媒となり、100°Cで行われる。他にも以下のような反応が報告されている。

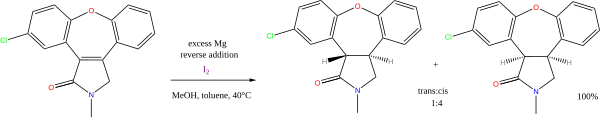
多くの反応ではプロトン源としてアルコールやアミンが、電子源としてアルカリ金属が利用される。この中には金属ナトリウムでアレーン(芳香族炭化水素の別名)を還元するバーチ還元も含まれる。またエステルのブーボー・ブラン還元もこれに該当する。マグネシウムとメタノールを組み合わせることでアルケンを還元することができる。この反応はアセナピンの合成に利用される[5]。
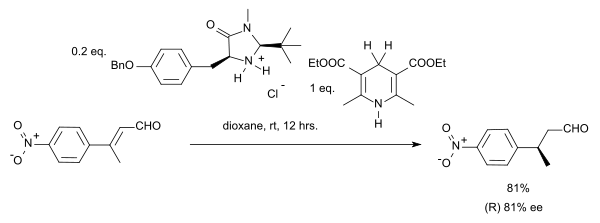
有機触媒的移動水素化
[編集]有機触媒的移動水素化は、2004年にリストによりハンチュのエステルがヒドリド源およびアミン触媒として働く反応が報告されている例がある[6]。

この反応はα,β-不飽和化合物を基質とするものもある。プロトン源は酸化されてピリジンに変化し、補酵素のNADHに似た構造となる。この反応の触媒サイクルはまずアミンとアルデヒドからイミニウムイオンができ、次にプロトンが移動してイミニウムの結合が加水分解し、触媒が再生する。キラルなイミダゾリジノンであるマックミラン触媒を使うことで81% eeで目的の立体異性体が得られる。
マクミランの研究グループはそれに似た不斉反応を2005年に報告している[7]。
立体変換が起こる一例としてE-体とZ-体の両方から(S)-体が生成する反応がある。
この反応は基質のケトン(より正確にはエノン)やハンチュのエステルによって微妙な触媒の調整が必要になる(エノンの場合、ベンジル基をつけ、tert-ブチル基をフランで置き換える。ハンチュのエステルの場合、より嵩高いtert-ブチル基を追加する) [8]。
他の有機触媒を用いた場合、イミンを水素化することができる。ある特定の反応にはリン酸から合成されるBINOLが用いられる。基質がキノリンで目的物がテトラヒドロキノリンである反応は、1,4-付加と 異性化、1,2-付加が連続的に起こるカスケード反応である[9]
この反応の最初のステップはキノリンの窒素原子がリン酸によってプロトン化され、キラルなイミニウムイオンが生成する。金属触媒では芳香族化合物あるいはヘテロ芳香族化合物のプロトン化は進行しない場合が多い。
脚注
[編集]- ^ Speight, J. G. "The Chemistry and Technology of Coal" Marcel Dekker; New York, 1983; p. 226 ff. ISBN 0-8247-1915-8.
- ^ Muñiz, Kilian (2005). “Bifunctional Metal-Ligand Catalysis: Hydrogenations and New Reactions within the Metal-(Di)amine Scaffold13”. Angewandte Chemie International Edition 44 (41): 6622–6627. doi:10.1002/anie.200501787. PMID 16187395.
- ^ T. Ikariya, K. Murata, R. Noyori "Bifunctional Transition Metal-Based Molecular Catalysts for Asymmetric Syntheses" Organic and Biomolecular Chemistry, 2006, volume 4, 393-406.
- ^ Shimizu, H., Nagasaki, I., Matsumura, K., Sayo, N., and Saito, T. "Developments in Asymmetric Hydrogenation from an Industrial Perspective" Acc. Chem. Res. 2007, vol. 40, pp. 1385-1393. doi:10.1021/ar700101x
- ^ Linden, M. V. D.; Roeters, T.; Harting, R.; Stokkingreef, E.; Gelpke, A. S.; Kemperman, G. (2008). “Debottlenecking the Synthesis Route of Asenapine”. Organic Process Research & Development 12 (2): 196–201. doi:10.1021/op700240c.
- ^ Yang; Hechavarria Fonseca, M.; List, B. (2004). “A metal-free transfer hydrogenation: organocatalytic conjugate reduction of alpha,beta-unsaturated aldehydes”. Angewandte Chemie International Edition in English 43 (48): 6660–6662. doi:10.1002/anie.200461816. PMID 15540245.
- ^ Ouellet; Tuttle, J.; MacMillan, D. (2005). “Enantioselective organocatalytic hydride reduction”. Journal of the American Chemical Society 127 (1): 32–33. doi:10.1021/ja043834g. PMID 15631434.
- ^ Tuttle; Ouellet, S.; MacMillan, D. (2006). “Organocatalytic transfer hydrogenation of cyclic enones”. Journal of the American Chemical Society 128 (39): 12662–12663. doi:10.1021/ja0653066. PMID 17002356.
- ^ Rueping; Antonchick, A.; Theissmann, T. (2006). “A highly enantioselective Brønsted acid catalyzed cascade reaction: organocatalytic transfer hydrogenation of quinolines and their application in the synthesis of alkaloids”. Angewandte Chemie International Edition in English 45 (22): 3683–3686. doi:10.1002/anie.200600191. PMID 16639754.