「ウェルシュ菌」の版間の差分
書誌情報 |
編集の要約なし |
||
| 31行目: | 31行目: | ||
== 毒素 == |
== 毒素 == |
||
本菌は主要な毒素(major antigen)がα、β、ε、ιの4種あり、これらの産出のパターンによってA~Eの5型に分けられる。minor antigenとして8つ、すなわちγ、δ、η、θ(溶血素)、κ(コラゲナーゼ)、μ(ヒアルニダーゼ)、λ(プロテアーゼ)、ν(DNase)があげられる。病原性の本体としてもっとも重要なのはα毒素でありA~E型全てが産出する<ref |
本菌は主要な毒素(major antigen)がα、β、ε、ιの4種あり、これらの産出のパターンによってA~Eの5型に分けられる。minor antigenとして8つ、すなわちγ、δ、η、θ(溶血素)、κ(コラゲナーゼ)、μ(ヒアルニダーゼ)、λ(プロテアーゼ)、ν(DNase)があげられる。病原性の本体としてもっとも重要なのはα毒素でありA~E型全てが産出する<ref>[https://www.jstage.jst.go.jp/article/jsb1944/61/4/61_4_367/_pdf 日本細菌学雑誌61(4):367-379,2006]</ref>。minor antigenは局所での病巣の広がりと栄養調達に役にたっている。A型菌がヒトへの病原性を示す。一方、B~E型菌の自然の生息場所は動物の腸管内と考えられている。A型菌はα毒素、B型菌はα, β, ε毒素、C型菌はα, β毒素、D型菌はα, ε毒素、E型菌はα, ι毒素を産生する。 |
||
* (α) アルファー毒素は、ガス壊疽の際の毒素で組織破壊作用があり、肺から吸引した場合、致命的な肺の障害を起こす恐れがあり他の生物兵器同様、テロリストによる使用が懸念されている。 |
* (α) アルファー毒素は、ガス壊疽の際の毒素で組織破壊作用があり、肺から吸引した場合、致命的な肺の障害を起こす恐れがあり他の生物兵器同様、テロリストによる使用が懸念されている。 |
||
* (β) ベータ毒素は、壊死性腸炎の際の毒素で組織破壊作用がある。 |
* (β) ベータ毒素は、壊死性腸炎の際の毒素で組織破壊作用がある。 |
||
* (ε) イプシロン毒素は、動物実験で[[神経毒性]]が見つかっている。 |
* (ε) イプシロン毒素は、動物実験で[[神経毒性]]が見つかっている。 |
||
* (ι) イオタ毒素は[[細胞毒性]]を示す<ref |
* (ι) イオタ毒素は[[細胞毒性]]を示す<ref>[http://wwwsoc.nii.ac.jp/jsb/journal/abst61-4.html ウエルシュ菌主要毒素の構造と機能及び活性発現機構に関する研究] 日本細菌学雑誌 第61巻 第4号 367-379, 2006</ref>。 |
||
=== α毒素 === |
=== α毒素 === |
||
| 82行目: | 82行目: | ||
==== 構造と物理化学的性状 ==== |
==== 構造と物理化学的性状 ==== |
||
CPEは319アミノ酸からなる分子量35317Da、等電点4,3、易熱性の蛋白質である。活性発揮のためにプロテアーゼによる切断などの翻訳後プロセシングは必要とされない<ref> |
CPEは319アミノ酸からなる分子量35317Da、等電点4,3、易熱性の蛋白質である。活性発揮のためにプロテアーゼによる切断などの翻訳後プロセシングは必要とされない<ref>[https://www.jstage.jst.go.jp/article/jcrsj/55/3/55_223/_pdf 日本結晶学会誌 55,223-229(2013)]</ref>。しかし、トリプシン処理によりN末端側25アミノ酸を切断することにより、活性が数倍上昇する<ref>Infect Immun. 1983 Jun;40(3):943-9. PMID 6303961</ref>。[[アミノ酸配列]]上、他の細菌由来のPore-forming toxin(孔形成毒素)との相同性は認められない<ref>Anaerobe. 2016 Oct;41:18-26. PMID 27090847</ref>。例外として、[[ボツリヌス菌]]が産出するAntp70/C1蛋白質との間にアミノ酸配列の相同性がわずかに認められるが、その意義は明らかになっていない<ref>Infect Immun. 1993 Aug;61(8):3429-39. PMID 8335373</ref>。 |
||
CPE分子の186番目の位置に[[システイン]]残基が1つ存在する。CPEはこのシステイン残基をはさんで、N末端側とC末端側の機能ドメインに分割可能である<ref>Infect Immun. 1987 Dec;55(12):2912-5. PMID 2890582</ref>。C末端断片は感受性細胞表面に発現する受容体への結合ドメインが存在し<ref>Infect Immun. 1987 Dec;55(12):2912-5. PMID 2890582</ref><ref>J Biol Chem. 1991 Jun 15;266(17):11037-43. PMID 1645721</ref>、N末端断片には細胞障害性発揮のために必要なドメインが含まれている<ref>Infect Immun. 1999 Nov;67(11):5634-41. PMID 10531210</ref>。active domainとbinding domainに分かれるA-B型毒素に分類される。CPEは[[電気泳動]]の際に、[[ドデシル硫酸ナトリウム]](SDS)を加えて、変性条件下におくことにより、高分子量の自己凝集体を形成する。C末端ドメイン(アミノ酸186~319)は単一バンドとして電気泳動されることから、自己凝集活性はNドメインにあると考えられている。その後の研究ではアミノ酸290~319のC末端断片でもCPE受容体と結合した<ref>J Biol Chem. 1991 Jun 15;266(17):11037-43. PMID 1645721</ref>。またC-CPE184-319の変異体を用いた研究ではY306、Y310、Y312、L315などがCPEとCPE受容体の結合に重要な役割を果たすことがわかった<ref>Biochem Pharmacol. 2007 Jan 15;73(2):206-14. PMID 17097620</ref>。C-CPE184-319のC末端の16アミノ酸を欠失させたC-CPE303はクローディン-4とC-CPEは相互作用できなくなった<ref>J Control Release. 2005 Nov 2;108(1):56-62. PMID 16091298</ref><ref>Biol Pharm Bull. 2006 Sep;29(9):1783-9. PMID 16946486</ref>。 |
CPE分子の186番目の位置に[[システイン]]残基が1つ存在する。CPEはこのシステイン残基をはさんで、N末端側とC末端側の機能ドメインに分割可能である<ref>Infect Immun. 1987 Dec;55(12):2912-5. PMID 2890582</ref>。C末端断片は感受性細胞表面に発現する受容体への結合ドメインが存在し<ref>Infect Immun. 1987 Dec;55(12):2912-5. PMID 2890582</ref><ref>J Biol Chem. 1991 Jun 15;266(17):11037-43. PMID 1645721</ref>、N末端断片には細胞障害性発揮のために必要なドメインが含まれている<ref>Infect Immun. 1999 Nov;67(11):5634-41. PMID 10531210</ref>。active domainとbinding domainに分かれるA-B型毒素に分類される。CPEは[[電気泳動]]の際に、[[ドデシル硫酸ナトリウム]](SDS)を加えて、変性条件下におくことにより、高分子量の自己凝集体を形成する。C末端ドメイン(アミノ酸186~319)は単一バンドとして電気泳動されることから、自己凝集活性はNドメインにあると考えられている。その後の研究ではアミノ酸290~319のC末端断片でもCPE受容体と結合した<ref>J Biol Chem. 1991 Jun 15;266(17):11037-43. PMID 1645721</ref>。またC-CPE184-319の変異体を用いた研究ではY306、Y310、Y312、L315などがCPEとCPE受容体の結合に重要な役割を果たすことがわかった<ref>Biochem Pharmacol. 2007 Jan 15;73(2):206-14. PMID 17097620</ref>。C-CPE184-319のC末端の16アミノ酸を欠失させたC-CPE303はクローディン-4とC-CPEは相互作用できなくなった<ref>J Control Release. 2005 Nov 2;108(1):56-62. PMID 16091298</ref><ref>Biol Pharm Bull. 2006 Sep;29(9):1783-9. PMID 16946486</ref>。 |
||
2020年3月1日 (日) 14:53時点における版
| ウェルシュ菌 | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
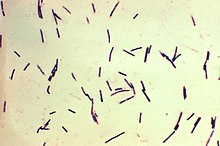 ウェルシュ菌のグラム染色像
| |||||||||||||||||||||
| 分類 | |||||||||||||||||||||
| |||||||||||||||||||||
| 学名 | |||||||||||||||||||||
| Clostridium perfringens (Veillon & Zuber 1898) Hauduroy et al. 1937 |
ウェルシュ菌(ウェルシュきん、学名:Clostridium perfringens)とは、クロストリジウム属に属する嫌気性桿菌である。河川、下水、海、土壌中など自然界に広く分布している[1]。
ヒトを含む動物の腸内細菌叢における主要な構成菌であることが多い。 少なくとも12種類の毒素を作り、α, β, ε, ιの4種の主要毒素の産生性により、A, B, C, D, E型の5つの型に分類される。特にB型菌の毒素は、ヒツジの赤痢の原因となる。
かつてClostridium welchiiという学名で呼ばれていたことがある。ウィリアム・H・ウェルチが分離培養し1892年にBacillus aerogenes capsulatusと命名したが、後年ウェルチにちなんでBacterium welchii Migula 1900という学名が与えられ、ついでBacillus welchiiやClostridium welchiiと呼ばれるようになった。しかし命名規約上はBacterium welchiiよりも早く命名されたBacillus perfringens Veillon and Zuber 1898に優先権があるため、これが1937年にクロストリジウム属に移されて、現在の学名として登録されている。
一般にビフィズス菌などと対比され、悪玉菌の代表とされている。臭い放屁の原因、悪玉の常在菌である。
分布
A型菌はヒトや動物の腸管内に定常的にかなりの数が存在し、糞便や土壌中に栄養型、芽胞型のいずれでも多数存在している。一方B~E型菌の自然の生存場所は動物の腸管内と考えられている。
性状
グラム陽性で大きさは0.6~2.4×1.3~19.0μmの大型桿菌である。菌体はまっすぐで、両端は鈍円である。芽胞は楕円形で、菌体中央または一端近くに位置して菌体より膨隆しない。
本菌はほかのクロストリジウム属と異なり、鞭毛を持たず、運動性がない。活性酸素処理機構が弱体なため、酸素濃度によって障害を受ける偏性嫌気性菌である。生体内または血清添加培地で増殖した場合、莢膜を形成する。一般に芽胞は形成されにくい。至適増殖温度は43-47℃。分裂時間は45℃で約10分間と短い。37℃で最も多くの毒素を産生する[1]。
毒素
本菌は主要な毒素(major antigen)がα、β、ε、ιの4種あり、これらの産出のパターンによってA~Eの5型に分けられる。minor antigenとして8つ、すなわちγ、δ、η、θ(溶血素)、κ(コラゲナーゼ)、μ(ヒアルニダーゼ)、λ(プロテアーゼ)、ν(DNase)があげられる。病原性の本体としてもっとも重要なのはα毒素でありA~E型全てが産出する[2]。minor antigenは局所での病巣の広がりと栄養調達に役にたっている。A型菌がヒトへの病原性を示す。一方、B~E型菌の自然の生息場所は動物の腸管内と考えられている。A型菌はα毒素、B型菌はα, β, ε毒素、C型菌はα, β毒素、D型菌はα, ε毒素、E型菌はα, ι毒素を産生する。
- (α) アルファー毒素は、ガス壊疽の際の毒素で組織破壊作用があり、肺から吸引した場合、致命的な肺の障害を起こす恐れがあり他の生物兵器同様、テロリストによる使用が懸念されている。
- (β) ベータ毒素は、壊死性腸炎の際の毒素で組織破壊作用がある。
- (ε) イプシロン毒素は、動物実験で神経毒性が見つかっている。
- (ι) イオタ毒素は細胞毒性を示す[3]。
α毒素
A型菌の主要毒素がα毒素である。A~E型菌の全てがα毒素を産出するが、A型菌で最も多く作られる。α毒素の本体はホスホリパーゼC(レシチナーゼC)である。細胞膜を構成するレシチン含有リポ蛋白に作用し膜に傷害を与えて細胞を破壊する。A型菌はヒトや腸管内に定常的にかなりの数が存在し、糞便や土壌中に栄養型、芽胞型のいずれでも多数存在している。
β毒素
C型菌による壊疽性腸炎の原因毒素と考えられている。
ε毒素
D型菌はヒツジやヤギやウシなど草食獣に感染し、腸性中毒症を起こすことが知られていた。この感染症は急激に衰弱し死にいたる。ボツリヌス毒素、破傷風毒素に次ぐ強力な致死活性を示す毒素である。病理学的には脳組織の軟化と壊死を招き、腎組織も破壊され、四肢の痙攣がおこることが特徴である。稀にヒトにも感染する。D型菌の病原因子がε毒素と考えられている。ε毒素の受容体はシアロ糖タンパクと脂質が関与すると推察されている。D型菌の感染症はε毒素が腸管において腸間膜の透過性を亢進させ、その結果本毒素が生体内に取り込まれ、脳血管の透過性を亢進させ四肢の痙攣や脳浮腫や痙攣を起こすと推察されている。
ι毒素
E型菌の産出するι(イオタ)トキシンは二元毒素(二成分毒素、binary toxin)として知られている[4]。E型ウェルシュ菌はα毒素とι毒素を産出する。E型ウェルシュ菌は牛や馬の腸炎の原因と考えられている。stilesとWlikinsはイオタ毒素を精製し、毒素は互いに結合や相互作用がなく、Ia成分(軽鎖、イオタa成分)とIb成分(重鎖、イオタb成分)からなる二成分毒素で、両者の共存下で毒素作用を示すことを報告した[5]。イオタ毒素はディフィシル菌のCDT、ボツリヌス菌のC2毒素、スピロフォルム菌ι毒素様毒素、セレウス菌とバチルス・チューリンゲンシスの昆虫殺虫性蛋白質とともに防御抗原ファミリーに属する。また防御抗原ファミリーの中でクロストリジウム属のディフィシル菌のCDT、ボツリヌス菌のC2毒素、ウェルシュ菌のイオタ毒素、スピロフォルム菌イオタ毒素様毒素はADPリボシル化酵素活性をもつ二成分毒素である。
イオタ毒素遺伝子はE型ウェルシュ菌のプラスミドDNAからクローニングされた[6]。Ia遺伝子、Ib遺伝子の順に並び、同じ方向で転写され両者の間に存在する短い非コード領域が243b.p存在する。その塩基配列から推定されるIaのアミノ酸配列よりIaは454残基で発現する。N末側の41残基のシグナルペプチドが外れて、413残基の分子量47,605の蛋白質として産出される。このプロトキシンからN末端の13残基のプロペプチドがはずれ活性体は400残基である。Ibは876残基(分子量98,467)で発現され、N末側の39残基のシグナルペプチドがはずれ、836残基(分子量941.023)から成るプロトキシンとして菌体外に放出される。プロトキシンはタンパク分解酵素の作用で211残基のプロペプチドがはずれ664残基のアミノ酸からなる分子量74,147の成熟タンパクとなることが知られている。Iaの推定アミノ酸配列と他の蛋白質の配列を比較すると、スピロフォルム菌が産出するι毒素様毒素の酵素成分であるSaとは約80%と高いアミノ酸相同性を示す。さらに同じADPリボシル化毒素ファミリーの酵素成分(A成分)セレウス菌とバチルス・チューリンゲンシスのVIP2の配列とは32%の相同性が認められ、C2毒素のC2Ⅰとは10%の相同性である。百日咳毒素、大腸菌易熱性エンテロトキシン、コレラ毒素、ボツリヌスC2毒素、ボツリヌスC3毒素、セレウス菌殺虫毒素といった種々のADPリボシル化酵素のアミノ酸配列には芳香族アミノ酸-Arg、芳香族アミノ酸-疎水性アミノ酸-Ser-Thr-Ser-疎水性アミノ酸、Glu/Gln-x-Gluの配列はよく保存されている[7]。この部位はNAD+の結合や触媒活性に関与する共通モチーフと考えられている。さらにADPリボシル化毒素の中で立体構造が明らかになっているジフテリア毒素やコレラ毒素などと比較するとアミノ酸配列に相同性は認められないが、ADPリボシル化活性に寄与する触媒cavityの構造は著しく類似している[8]。コレラ毒素、百日咳毒素、ジフテリア毒素はA-B毒素として知られている。
イオタ毒素は致死、皮膚壊死活性、細胞毒性(細胞の円形化)などの作用がある。ι毒素はIaとIbの両方の投与で致死作用を示す。すなわちマウスにIa(4ng以上)、Ib(50ng以上)の静注をするとマウスは死亡する[9]。マウスのいずれかの成分を静注し、120分後に他方の成分を静注しても致死活性が認められる。一方、Iaを投与後、抗Ia抗体、その後Ibを投与すると致死活性は阻害されるが、Ibを投与して、次に抗Ib抗体、さらにIaを投与しても致死活性は阻害されない。モルモット皮膚壊死活性は、Ibを皮下に投与後、Iaを腹腔内投与しても認められるが、この逆の投与は活性を示さない。これらのことから生体内における毒素の作用はIbが特異的な受容体に結合することによって開始することが報告された[10]。かつては、二成分毒素は単独では生物活性は示さないと考えられていたが、IbがVero細胞においてモノマーで細胞膜に結合後、7量体のオリゴマーを形成し、ラフトに集積後Kイオン遊離を誘導すること、さらにIb単独でエンドサイトーシスを誘導して細胞内に進入することが明らかになった[11]。細胞膜上で7量体のオリゴマーを形成し、細胞からカリウムイオンの遊離作用を示すが細胞死は引き起こさない。Iaは筋肉、または非筋肉のGアクチンのArg残基をADPリボシル化する。一方、同じ二成分毒素でADPリボシル化毒素でもあるボツリヌスC2毒素のC2Ⅰは非筋肉のGアクチンのみをADPリボシル化する。Iaは基質特異性が広いのが特徴である。ADPリボシル化活性は、NAD+をニコチンアミドとADP-リボースに水解するNAD+グリコハイドロラーゼ(NADase)活性と、このADP-リボース部をアクチンに転移させるトランスフェラーゼ(ARTase)活性から成る。徳島文理大学の永浜らはIaの分子中で、酵素活性に関与しているアミノ酸残基をアミノ酸置換とカイネティック分析より解析した[12]。295位Argと338位Ser残基はNAD+の結合に関与し、295位Arg、338位Ser、380位Glu残基はNADase活性に、378位Glu残基はARTase活性に関与していることを報告している。さらに彼らはIaとNADH共結晶のX線結晶解析を行った[13]。彼らはその立体構造からIaはNドメイン(N末端側1~210残基)とCドメイン(C末端側211~413残基)の2つのドメインからなることを明らかにした。これら2つのドメインはいずれも大きなcavityを有し、非常によく似た立体構造を示した。IaのNドメインは酵素活性に重要なアミノ酸残基が全て存在し、そこにNADHが結合する。IaのCドメインはIbと相互作用すると考えられている。
まとめると、イオタ毒素の作用機序はIbモノマーが細胞膜のLSRに結合し 7量体オリゴマーを形成し脂質ラフトに集積する。IbオリゴマーにIaのNドメインが結合する。IaとIbオリゴマーの複合体はエンドサイトーシスで細胞内に取り込まれる。初期エンドソームの酸性化によりIaが細胞質に遊離する。遊離したIaが細胞質のアクチンをADPリボシル化して細胞毒性を示す。ι毒素はアクチンArg177にADPリボシルグループを転移させる。Ιa毒素は非筋肉、筋肉のアクチン両方に作用する。Gアクチン(球状アクチン)をADPリボシル化するが、Fアクチン(Gアクチンが重合したマイクロフィラメント)には作用しない。GアクチンがADPリボシル化すると、GアクチンのFアクチン重合能が消失し、細胞骨格の構造が変化して細胞の変形が起こると推察されている。
Ib自体は、アミノ酸配列は炭疽菌防御抗原(PA)と34%、ボツリヌス菌C2毒素のC2Ⅱと41%の相同性を示す。立体構造から4つのドメインからなる。ドメイン1(1-84)が酵素成分との結合、ドメイン2(84-302)が膜侵入領域、ドメイン3(302-416)がオリゴマー形成、ドメイン4(416-664)が細胞への結合へ関与している。PAとIbのドメインごとのアミノ酸配列のそれぞれは41%、40%、35%、16%であり、ドメイン4の配列類似性が低い。これは両者の結合部位の違いと考えられている[14]。またボツリヌスC2毒素のC2Ⅱとドメインごとのアミノ酸配列はドメイン1は34%、ドメイン2は38%、ドメイン3は36%と高い相同性があるが、ドメイン4は相同性が存在しない[15]。
イオタ毒素の受容体は、クロストリジウム・ディフィシルの二成分毒素毒素であるCDTと同様に、LSRである[16]。LSRは肝臓、小腸、大腸、肺、腎臓、副腎、精巣、卵巣を含む多くの組織で高発現している[17]。またLSR以外にCD44も受容体である可能性が示されている[18]。
Ibのドメイン4の一部である442-664アミノ酸残基からなるリコンビナント蛋白質Ib442-664は、LSRと相互作用する。angubindin-1と言われるようになった[19][20]。LSRは脳微小血管内皮にも発現しているためangubindin-1を用いると分子量5000程度のアンチセンスオリゴヌクレオチドが血液脳関門を通過し中枢神経系に送達される[21]。angubindin-1は細胞毒性を示さず[22]、マウスにも安全に投与可能である[23]。
腸毒素(エンテロトキシン)
1953年、イギリスのベティ・コンスタンス・ホブス(Betty Constance Hobbs)により、ウェルシュ菌が食中毒の原因になることが確認された。
ウェルシュ菌A型菌がヒトへの病原性を示す。A型菌は、主要抗原 (major antigen)ではα毒素のみを産出する。A型菌のうち、(組織傷害性毒素とは別に)エンテロトキシンを産出する株によってウェルシュ菌食中毒が起こる。これがヒトへの毒性で頻度が高い。アメリカではサルモネラ中毒、ブドウ球菌食中毒に次いで多く、日本でも原因別患者数で常に上位を占めている。エンテロトキシンはウェルシュ菌の他の毒素とは異なり、芽胞を形成するときにだけ産出され、栄養型菌の増殖中には産出されない。
ウェルシュ菌による食中毒は、多量の生菌を含む食物の摂取により起こる。発症の原因は毒素であるが、食物中で予め産出された毒素によるものではなく、生菌の摂取が前提になることから、本症は感染型食中毒に分類される。ウェルシュ菌エンテロトキシンは、芽胞形成時に産出される特徴的な毒素と考えられている。
本菌で汚染された食物を加熱調理すると、耐熱性の芽胞は生残していて、調理後の冷却とともに発芽し、食物中に急激に増殖する。食物とともに腸管に達した菌は芽胞を形成する。このときにエンテロトキシンが作られ、菌体の融解に伴って放出され、腸管粘膜細胞に作用して症状が発現する。
分離されるウェルシュ菌のうち約5%がウェルシュ菌エンテロトキシン(CPE、Clostridium perfringens enterotoxin)を産出する[24][25]。ほとんどCPE陽性株はA型ウェルシュ菌に分類されるが、C型やD型であることも一般的である[26]。変異CPEを産出する菌も認められるが。A型、C型、D型のウェルシュ菌が産出するCPE蛋白質のアミノ酸配列は、原則として同一と考えられている。E型ウェルシュ菌の産出するCPEは、10アミノ酸程度の変異が知られている[27]。
CPEは、N末端の細胞障害性領域とC末端の結合領域の2つの機能的ドメインからなるA-B毒素である[28][29][30]。1997年にCPE受容体が同定され[31]、1999年にCPE受容体がクローディン-4と同一であることが判明した[32]。
遺伝子
A型ウェルシュ菌由来のエンテロトキシン遺伝子(cpe遺伝子)の全塩基配列(GenBank accession no.M98037)はすでに報告されている[33][34]。cpe遺伝子は染色体上またはプラスミド上に存在する。
ヒトの食中毒事例に由来するcpe遺伝子の大部分は染色体上にある。かつてはヒトの食中毒事例では染色体上[35]、家畜から分離される場合はプラスミド上と考えられていた[36]。
構造と物理化学的性状
CPEは319アミノ酸からなる分子量35317Da、等電点4,3、易熱性の蛋白質である。活性発揮のためにプロテアーゼによる切断などの翻訳後プロセシングは必要とされない[37]。しかし、トリプシン処理によりN末端側25アミノ酸を切断することにより、活性が数倍上昇する[38]。アミノ酸配列上、他の細菌由来のPore-forming toxin(孔形成毒素)との相同性は認められない[39]。例外として、ボツリヌス菌が産出するAntp70/C1蛋白質との間にアミノ酸配列の相同性がわずかに認められるが、その意義は明らかになっていない[40]。
CPE分子の186番目の位置にシステイン残基が1つ存在する。CPEはこのシステイン残基をはさんで、N末端側とC末端側の機能ドメインに分割可能である[41]。C末端断片は感受性細胞表面に発現する受容体への結合ドメインが存在し[42][43]、N末端断片には細胞障害性発揮のために必要なドメインが含まれている[44]。active domainとbinding domainに分かれるA-B型毒素に分類される。CPEは電気泳動の際に、ドデシル硫酸ナトリウム(SDS)を加えて、変性条件下におくことにより、高分子量の自己凝集体を形成する。C末端ドメイン(アミノ酸186~319)は単一バンドとして電気泳動されることから、自己凝集活性はNドメインにあると考えられている。その後の研究ではアミノ酸290~319のC末端断片でもCPE受容体と結合した[45]。またC-CPE184-319の変異体を用いた研究ではY306、Y310、Y312、L315などがCPEとCPE受容体の結合に重要な役割を果たすことがわかった[46]。C-CPE184-319のC末端の16アミノ酸を欠失させたC-CPE303はクローディン-4とC-CPEは相互作用できなくなった[47][48]。
大阪大学大学院薬学研究科の研究グループは、C-CPE184-319のC末端の16アミノ酸をそれぞれ置換することで、ドメイン・マップを作成した[49]。その結果から作成されたC-CPE変異体のひとつであるC-CPEY306/L315Aはクローディン4との結合が弱いだけではなく、多くのクローディン・ファミリーとも結合が弱いため[50][51]、C-CPEを用いた実験で陰性対照群としてしばしば用いられる。
生物活性
生物活性としては細胞膜への小孔形成、小孔形成による膜透過性の変化と細胞の形態変化、細胞死が知られている。これらの細胞に対する毒性は、実験的には腸管のみならず、腎臓、肝臓などに由来する上皮系培養細胞で認められた[52][53][54][55]。多くの膜孔形成性毒素が細胞膜に存在するコレステロールなどの脂質を受容体とし、比較的広範囲の細胞種に対して作用するのに対してCPEは腸管、腎臓、肝臓などに由来する上皮系細胞に対してのみ作用することが古くから知られていた。1990年代にCPE受容体とよばれる4回膜貫通型蛋白質が同定された[56][57]。後にCPE受容体はタイトジャンクションを形成するクローディン・ファミリータンパクの一つであることが明らかにされた[58][59]。
クローディン・ファミリーのうちCPE受容体と証明されているものはクローディン3、4、6、8、14である。クローディン1、2、5、10は通常の病態生理学的に想定される毒素濃度ではCPEと結合しない[60]。CPEの一部であるC-CPE(C末端CPE)はクローディンバインダーとして知られている。C-CPEはマウスにおいて大量投与した場合は肝障害を示すことが報告されている[61]。CPE感受性のあるクローディンを発現する培養細胞にC-CPEを添加するとイムノブロッティングでクローディン蛋白質の発現が低下することからC-CPEと結合したクローディンは細胞内に取り込まれ分解されると予想された[62]。タイトジャンクションのリモデリングの際にクローディンがエンドサイトーシスで細胞内に取り込まれることが報告されており[63]、クローディンとC-CPEの複合体も同様に細胞内に取り込まれ分解されると考えられている[64]。
作用機構
CPEの上皮細胞への作用機構は以下の3つのプロセスからなる。すなわち、標的細胞への結合、細胞膜上の多量体化、細胞膜への孔形成というプロセスが必要である。上皮経細胞のクローディンに結合するが、この結合はキメラクローディンを用いた研究ではECS-2の領域が重要と言われていた[65]。その後の構造生物学的な検討ではECS-1とECS-2の両方との相互作用が重要であるとわかった[66]。
具体的にはECS-1を構成するA39からI41が、C-CPEとCPE受容体の結合に重要であることがわかった。しかしECS-1のこの部分の配列はCPE感受性のないクローディンでも保存されているため、変異体ではないクローディン・ファミリーにおいては、ECS-2のアミノ酸配列でCPE感受性が決まっている[67]。クローディンに接着したCPEは細胞膜上で多量体を形成する。CPEは単量体では可溶であるが多量体では膜蛋白質となるため、大きな構造変化があると考えられている。多量体形成後に細胞膜に孔を形成し、カルシウムイオンを流入させることで細胞死を起こす。
病原性
ウェルシュ菌は様々な症状をおこす。
- 食中毒
- 給食病または給食菌 (food service germ) やカフェテリア菌 (cafeteria germ) の別名で呼ばれることもある、A型菌の産生するエンテロトキシンによる生体内毒素型の食中毒である。芽胞が一旦高温処理される事で芽胞形成能が活性化され、同時に溶存酸素が減少すると共に競合する他の菌が減少し、増殖の好条件が成立し、緩徐に冷却される間(至適増殖温度)に食品中で増殖する。
- 毒素の摂取ではなく原因菌の1千万-1億個以上の摂取により、腸管内で菌の増殖と共に芽胞が形成され、同時に毒素が産生され、毒素により発症する[68]。8〜20時間の潜伏期の後、水様性の下痢を引き起こす。腹痛と下痢は必発であるが、嘔吐、発熱は見られない、1-2日で回復し、予後は良好である[69]。
- 芽胞のみ100℃・1気圧・1時間の加熱で不活性化されず、残存する可能性がある[68]。タンパク性食品が原因食となる場合が多い。
- ガス壊疽
- 主にA型菌により全身中毒症状を示す。但し、全てのA型菌がエンテロトキシン生産性を示すわけではない。
- 出血性腸炎またはピグベル (pigbel)
- C型菌により腸炎を発症、腸管に壊死性病変、出血性病変を形成する。パプアニューギニアの高地で多い。
- エンテロトキセミア
- 毒血症を示す。→詳細は「エンテロトキセミア」を参照
脚注
- ^ a b 『スタンダード栄養・食物シリーズ8 食品衛生学(第3版)』 一色賢司編、2010年、東京化学同人、p.69-70、ISBN 978-4-8079-1603-0
- ^ 日本細菌学雑誌61(4):367-379,2006
- ^ ウエルシュ菌主要毒素の構造と機能及び活性発現機構に関する研究 日本細菌学雑誌 第61巻 第4号 367-379, 2006
- ^ Toxins (Basel). 2009 Dec;1(2):208-28. PMID 22069542
- ^ Infect Immun. 1986 Dec;54(3):683-8. PMID 2877949
- ^ Infect Immun. 1993 Dec;61(12):5147-56. PMID 8225592
- ^ Mol Microbiol. 1996 Aug;21(4):667-74. PMID 8878030
- ^ Mol Microbiol. 1996 Aug;21(4):667-74. PMID 8878030
- ^ J Bacteriol. 2000 Apr;182(8):2096-103. PMID 10735850
- ^ Microbiol Immunol. 1995;39(4):249-53. PMID 7651239
- ^ Infect Immun. 2002 Apr;70(4):1909-14. PMID 11895954
- ^ J Bacteriol. 2000 Apr;182(8):2096-103. PMID 10735850
- ^ J Struct Biol. 1999 Jun 15;126(2):175-7. PMID 10388629
- ^ J Biol Chem. 2002 Nov 15;277(46):43659-66. PMID 12221101
- ^ Toxins (Basel). 2009 Dec;1(2):208-28. PMID 22069542
- ^ Proc Natl Acad Sci U S A. 2011 Sep 27;108(39):16422-7. PMID 21930894
- ^ Eur J Biochem. 2004 Aug;271(15):3103-14. PMID 15265030
- ^ PLoS One. 2012;7(12):e51356. PMID 23236484
- ^ Infect Immun. 2002 Apr;70(4):1909-14. PMID 11895954
- ^ J Control Release. 2017 Aug 28;260:1-11. PMID 28528740
- ^ J Control Release. 2018 Aug 10;283:126-134. PMID 29753959
- ^ J Control Release. 2017 Aug 28;260:1-11. PMID 28528740
- ^ J Control Release. 2018 Aug 10;283:126-134. PMID 29753959
- ^ J Clin Microbiol. 1994 Oct;32(10):2533-9. PMID 7814493
- ^ Am J Vet Res. 1996 Apr;57(4):496-501. PMID 8712513
- ^ PLoS One. 2010 Jun 3;5(6):e10932. PMID 20532170
- ^ PLoS One.2011;6(5):e20376. PMID 21655254
- ^ Infect Immun. 1986 Apr;52(1):31-5. PMID 2870028
- ^ J Biol Chem. 1991 Jun 15;266(17):11037-43. PMID 1645721
- ^ Infect Immun. 1992 May;60(5):2110-4. PMID 1373406
- ^ J Cell Biol. 1997 Mar 24;136(6):1239-47. PMID 9087440
- ^ J Cell Biol. 1999 Oct 4;147(1):195-204. PMID 10508866
- ^ J Gen Microbiol. 1989 Apr;135(4):903-9. PMID 2557378
- ^ Infect Immun. 1993 Aug;61(8):3429-39. PMID 8335373
- ^ Mol Microbiol. 1992 Jun;6(11):1421-9. PMID 1625573
- ^ Mol Microbiol. 1995 Feb;15(4):639-47. PMID 7783636
- ^ 日本結晶学会誌 55,223-229(2013)
- ^ Infect Immun. 1983 Jun;40(3):943-9. PMID 6303961
- ^ Anaerobe. 2016 Oct;41:18-26. PMID 27090847
- ^ Infect Immun. 1993 Aug;61(8):3429-39. PMID 8335373
- ^ Infect Immun. 1987 Dec;55(12):2912-5. PMID 2890582
- ^ Infect Immun. 1987 Dec;55(12):2912-5. PMID 2890582
- ^ J Biol Chem. 1991 Jun 15;266(17):11037-43. PMID 1645721
- ^ Infect Immun. 1999 Nov;67(11):5634-41. PMID 10531210
- ^ J Biol Chem. 1991 Jun 15;266(17):11037-43. PMID 1645721
- ^ Biochem Pharmacol. 2007 Jan 15;73(2):206-14. PMID 17097620
- ^ J Control Release. 2005 Nov 2;108(1):56-62. PMID 16091298
- ^ Biol Pharm Bull. 2006 Sep;29(9):1783-9. PMID 16946486
- ^ Biochem Pharmacol. 2008 Apr 15;75(8):1639-48. PMID 18342294
- ^ Eur J Pharm Sci. 2014 Feb 14;52:132-7. PMID 24231339
- ^ Cell Mol Life Sci. 2015 Apr;72(7):1417-32. PMID 25342221
- ^ Biochemistry. 1980 Oct 14;19(21):4801-7. PMID 6252960
- ^ J Cell Physiol. 1979 May;99(2):191-200. PMID 222780
- ^ Biochem Biophys Res Commun. 1979 Nov 28;91(2):629-36. PMID 229852
- ^ Infect Immun. 1982 Aug;37(2):486-91. PMID 6288564
- ^ J Cell Biol. 1997 Mar 24;136(6):1239-47. PMID 9087440
- ^ J Biol Chem. 1997 Oct 17;272(42):26652-8. PMID 9334247
- ^ J Cell Biol. 1999 Oct 4;147(1):195-204. PMID 10508866
- ^ Proc Natl Acad Sci U S A. 1999 Jan 19;96(2):511-6. PMID 9892664
- ^ Toxins (Basel). 2016 Mar 16;8(3). PMID 26999202
- ^ Eur J Pharm Sci. 2014 Feb 14;52:132-7. PMID 24231339
- ^ J Cell Biol. 1999 Oct 4;147(1):195-204. PMID 10508866
- ^ J Cell Sci. 2004 Mar 1;117(Pt 7):1247-57. PMID 14996944
- ^ Biochem Pharmacol. 2008 Apr 15;75(8):1639-48. PMID 18342294
- ^ FEBS Lett. 2000 Jul 7;476(3):258-61. PMID 10913624
- ^ Science. 2015 Feb 13;347(6223):775-8. PMID 25678664
- ^ Anaerobe. 2016 Oct;41:18-26. PMID 27090847
- ^ a b ウエルシュ菌による食中毒について 横浜市衛生研究所感染症・疫学情報課
- ^ ウェルシュ菌 財団法人 日本中毒情報センター
参考文献
- 鹿江雅光、新城敏晴、高橋英司、田淵清、原澤亮編 『最新家畜微生物学』 朝倉書店 1998年 ISBN 4254460198
- 獣医学大辞典編集委員会編集 『明解獣医学辞典』 チクサン出版 1991年 ISBN 4885006104
- 戸田新細菌学 第34版 ISBN 9784525161149
- ADPリボシル化毒素と標的分子 ISBN 9784782000786
- 毒素ハンドブック ISBN 9784916164544
- Toxins (Basel). 2009 Dec;1(2):208-28. PMID 22069542
関連項目
外部リンク
- 津下英明「アクチン特異的ADPリボシル化毒素の構造と機能」『生物物理』第43巻第4号、日本生物物理学会、2003年7月25日、168-173頁、doi:10.2142/biophys.43.168、NAID 110001157629。
- Clostridium perfringensA型菌による新生豚の死亡例 - ウェイバックマシン(2003年5月11日アーカイブ分) 北海道渡島家畜保健衛生所
- ウエルシュ菌 Clostridium perfringens - ウェイバックマシン(2002年6月14日アーカイブ分) 岡山県立大学
- 国立感染症研究所 感染症情報センター
