「タンタル」の版間の差分
m Botによる: {{Cite doi}}から{{Cite journal}}への移行作業 |
m 外部リンクの修正 http:// -> https:// (mric.jogmec.go.jp) (Botによる編集) |
||
| (32人の利用者による、間の47版が非表示) | |||
| 19行目: | 19行目: | ||
|electrons per shell=2, 8, 18, 32, 11, 2 |
|electrons per shell=2, 8, 18, 32, 11, 2 |
||
|phase=固体 |
|phase=固体 |
||
|density gpcm3nrt=16.654(293 K、固体)<ref name="SAKURAI_111_p302">桜井 弘 編 『元素111の新知識』 p.302 講談社 (ブルーバックス B1192) 1997年10月20日発行 ISBN 4-06-257192-7</ref> |
|||
|density gpcm3nrt=16.69 |
|||
|density gpcm3mp=15.000(融点、液体)<ref name="SAKURAI_111_p302">桜井 弘 編 『元素111の新知識』 p.302 講談社 (ブルーバックス B1192) 1997年10月20日発行 ISBN 4-06-257192-7</ref> |
|||
|density gpcm3mp=15 |
|||
|melting point K=3258<ref name="SAKURAI_118_p330">桜井 弘 編 『元素118の新知識』 p.330 講談社 (ブルーバックス B2028) 2017年8月20日発行 ISBN 978-4-06-502028-9</ref> |
|||
|melting point K=3290 |
|||
|melting point C=2985<ref name="SAKURAI_118_p330">桜井 弘 編 『元素118の新知識』 p.330 講談社 (ブルーバックス B2028) 2017年8月20日発行 ISBN 978-4-06-502028-9</ref> |
|||
|melting point C=3017 |
|||
|boiling point K=5783<ref name="SAKURAI_118_p330">桜井 弘 編 『元素118の新知識』 p.330 講談社 (ブルーバックス B2028) 2017年8月20日発行 ISBN 978-4-06-502028-9</ref> |
|||
|melting point F=5463 |
|||
|boiling point C=5510<ref name="SAKURAI_118_p330">桜井 弘 編 『元素118の新知識』 p.330 講談社 (ブルーバックス B2028) 2017年8月20日発行 ISBN 978-4-06-502028-9</ref> |
|||
|boiling point K=5731 |
|||
|boiling point C=5458 |
|||
|boiling point F=9856 |
|||
|heat fusion=36.57 |
|heat fusion=36.57 |
||
|heat vaporization=732.8 |
|heat vaporization=732.8 |
||
| 38行目: | 36行目: | ||
|vapor pressure comment= |
|vapor pressure comment= |
||
|crystal structure=body-centered cubic |
|crystal structure=body-centered cubic |
||
|japanese crystal structure=α-Ta: [[体心立方構造]]<br />β-Ta: [[正方晶系]]<ref>{{ |
|japanese crystal structure=α-Ta: [[体心立方構造]]<br />β-Ta: [[正方晶系]]<ref>{{doi|10.1107/S0567740873004140}}</ref> |
||
|oxidation states='''5''', 4, 3, 2, -1(弱[[酸性酸化物]]) |
|oxidation states='''5''', 4, 3, 2, -1(弱[[酸性酸化物]]) |
||
|electronegativity=1.5 |
|electronegativity=1.5 |
||
|number of ionization energies=2 |
|number of ionization energies=2 |
||
|1st ionization energy=761<ref>久保田 晴寿、桜井 弘 編著 『無機医薬品化学(第3版)』 p.13 廣川書店 1997年3月15日発行 ISBN 4-567-46054-5</ref> |
|||
|1st ionization energy=761 |
|||
|2nd ionization energy=1500 |
|2nd ionization energy=1500 |
||
|atomic radius=[[1 E-10 m|146]] |
|atomic radius=[[1 E-10 m|146]] |
||
| 74行目: | 72行目: | ||
| dm2=[[ベータ崩壊|β<sup>-</sup>]] | de2=0.708 | pn2=[[タングステン180|180]] | ps2=[[タングステン|W]]}} |
| dm2=[[ベータ崩壊|β<sup>-</sup>]] | de2=0.708 | pn2=[[タングステン180|180]] | ps2=[[タングステン|W]]}} |
||
{{Elementbox_isotopes_decay3 | mn=[[タンタル180m|180m]] | sym=Ta |
{{Elementbox_isotopes_decay3 | mn=[[タンタル180m|180m]] | sym=Ta |
||
| na=0.012% | hl=> [[1 E22 s|1.2×10<sup>15</sup> y]]<br />(未確認) |
| na=0.012% | hl= > [[1 E22 s|1.2×10<sup>15</sup> y]]<br />(未確認) |
||
| dm1=[[電子捕獲|ε]] | de1=0.929 | pn1=[[ハフニウム180|180]] | ps1=[[ハフニウム|Hf]] |
| dm1=[[電子捕獲|ε]] | de1=0.929 | pn1=[[ハフニウム180|180]] | ps1=[[ハフニウム|Hf]] |
||
| dm2=[[ベータ崩壊|β<sup>-</sup>]] | de2=0.783 | pn2=[[タングステン180|180]] | ps2=[[タングステン|W]] |
| dm2=[[ベータ崩壊|β<sup>-</sup>]] | de2=0.783 | pn2=[[タングステン180|180]] | ps2=[[タングステン|W]] |
||
| 87行目: | 85行目: | ||
|isotopes comment= |
|isotopes comment= |
||
}} |
}} |
||
'''タンタル'''({{lang-de-short|Tantal}}、{{lang-en-short|tantalum}})は[[原子番号]]73の[[元素]]。[[元素記号]]は '''Ta'''。 |
|||
'''タンタル'''({{lang-de-short|Tantal}} {{IPA-de|ˈtantal|}}、{{lang-en-short|tantalum}} {{IPA-en|ˈtæntələm|}})は、[[原子番号]]73の[[第6周期元素|第6周期]]に属する[[第5族元素]]である。[[元素記号]]は '''Ta'''。タンタルの[[単体]]は比較的密度が高くて硬く、銀白色を呈し、[[光沢]]があって腐食耐性の高い[[遷移金属]]である。[[レアメタル]]の1つに数えられており合金の微量成分などとして広く用いられる他、比較的化学的に安定で融点も高く、[[耐火金属]]としても知られる。化学的に不活性な特性から、実験用設備の材料や[[白金]]の代替品として有用である。今日におけるタンタルの主な用途は、[[携帯電話]]、[[DVDプレーヤー]]、[[ゲーム機]]、[[パーソナルコンピュータ]]といった電子機器に用いられる[[コンデンサ|タンタル電解コンデンサ]]である。タンタルは、[[タンタル石]]、[[コルンブ石]]あるいは[[コルタン]](タンタル石とコルンブ石の混合物であるとされ独立した鉱物とみなされていない)といった鉱物に含まれ、化学的に類似する[[ニオブ]]と共に産出する<ref name="mindat.org">http://www.mindat.org</ref>。 |
|||
== 概要 == |
|||
[[バナジウム族元素]]の一つ。灰色の金属([[遷移金属]])で、比重は16.65、[[融点]]は3027 {{℃}}(異なる実験値あり)、[[沸点]]は4100 {{℃}}(5534 {{℃}}という実験値もあり)。空気中で[[不動態]]となり耐食性がある。特にタンタルは耐酸性が強い<ref name="metal965">{{Cite journal |和書|author =木村啓造|author2 =佐々木靖男|title =タンタル|date =1965|publisher =日本金属学会|journal =日本金属学会会報|volume =4|issue =9|doi=10.2320/materia1962.4.585|pages =585-598|ref = }}</ref>。[[王水]]に不溶。[[硝酸]]と[[フッ化水素]]の混合溶液には可溶。展性、延性に富み加工しやすい。反射率が全金属中最も低いため、外見は純金属としては最も黒い。安定な[[原子価]]は+5価。[[絶対温度]]4.5 Kで超伝導転移を起こす。 |
|||
== 名称 == |
|||
タンタル石([[コルタン]])((Fe,Mn)(Ta,Nb)<sub>2</sub>O<sub>6</sub>) から得られる。 |
|||
タンタルという名前は、[[ギリシア神話]]で[[ニオベー]]の父とされている[[タンタロス]]から取られている。神話においては、タンタロスは死後、あごまで届くほどの深さの水の中に立たされ、頭上には果物が豊かに実っているが、どちらも永遠に彼には手に入らずじらされるという罰を受ける(水を飲もうとすると、届かないくらい水位が下がり、果物に手を伸ばそうとすると、枝が手の届く範囲から遠ざかる、英語で{{Lang|en|tantalize}}という単語はじらして苦しめるという意味がある)。[[アンデシュ・エーケベリ]]は、「私がタンタルと呼ぶこの金属、酸に浸しても何かを吸収したり飽和したりする能力がほとんどないということを部分的に暗示する名前である」と書いている<ref>{{Greenwood&Earnshaw|page=1138}}</ref>。 |
|||
== 歴史 == |
|||
タンタルは、1802年に[[スウェーデン]]において[[アンデシュ・エーケベリ]]によって発見された<ref>{{cite journal | journal = Journal of Natural Philosophy, Chemistry, and the Arts | pages = 251–255 | volume = 3 | year = 1802| first = Anders | last = Ekeberg | title = Of the Properties of the Earth Yttria, compared with those of Glucine; of Fossils, in which the first of these Earths in contained; and of the Discovery of a metallic Nature (Tantalium) | url = https://www.biodiversitylibrary.org/item/15589#page/265/mode/1up}}</ref><ref>{{cite journal | journal = Kungliga Svenska vetenskapsakademiens handlingar |year = 1802 | pages = 68–83 | volume = 23| first = Anders | last = Ekeberg | title = Uplysning om Ytterjorden egenskaper, i synnerhet i aemforelse med Berylljorden:om de Fossilier, havari förstnemnde jord innehales, samt om en ny uptäckt kropp af metallik natur | url = https://archive.org/details/kungligasvenskav2231kung}}</ref>。その前年に[[チャールズ・ハチェット]]がコロンビウム(現在の[[ニオブ]])を発見しており<ref>{{cite journal|title = Charles Hatchett FRS (1765–1847), Chemist and Discoverer of Niobium|first = William P.|last = Griffith|author2=Morris, Peter J. T. |journal = Notes and Records of the Royal Society of London|volume = 57|issue = 3|page = 299|date = 2003|jstor = 3557720|doi = 10.1098/rsnr.2003.0216}}</ref>、1809年にイングランドの化学者[[ウイリアム・ウォラストン]]がニオブの酸化物[[コルンブ石]]の密度を5.918 g/cm<sup>3</sup>、タンタルの酸化物[[タンタル石]]の密度を7.935 g/cm<sup>3</sup>と測定して比較した。ウォラストンは測定された密度が異なるにもかかわらず、両者は同じであるものと結論付け、タンタルの方の名前を残すことにした<ref name="Wolla">{{cite journal|title = On the Identity of Columbium and Tantalum|pages = 246–252|journal = Philosophical Transactions of the Royal Society of London|first = William Hyde|last = Wollaston|authorlink = William Hyde Wollaston|doi = 10.1098/rstl.1809.0017| jstor = 107264|volume = 99|date = 1809}}</ref>。[[フリードリヒ・ヴェーラー]]がこの結論を確認したことから、これ以降コロンビウムとタンタルは同じ元素であるとされてきた。しかし1846年にドイツの化学者[[ハインリヒ・ローゼ]]が、タンタル石にはさらに2種類の元素が含まれていると主張し、ギリシア神話でタンタロスの子とされている名前にちなんで、ニオブ([[ニオベー]]から)とペロピウム([[ペロプス]]から)と名付けた<ref name="Pelop">{{cite journal|title = Ueber die Zusammensetzung der Tantalite und ein im Tantalite von Baiern enthaltenes neues Metall|pages = 317–341|journal = Annalen der Physik|authorlink = Heinrich Rose|language=German|first = Heinrich|last = Rose|doi = 10.1002/andp.18441391006|url = http://gallica.bnf.fr/ark:/12148/bpt6k15148n/f327.table|volume = 139|issue = 10|date = 1844|bibcode = 1844AnP...139..317R }}</ref><ref>{{cite journal|title = Ueber die Säure im Columbit von Nordamérika|language=German|pages = 572–577|first = Heinrich|last = Rose|journal = Annalen der Physik|doi = 10.1002/andp.18471460410|url = http://gallica.bnf.fr/ark:/12148/bpt6k15155x/f586.table |date=1847| volume = 146|issue = 4|authorlink = Heinrich Rose|bibcode = 1847AnP...146..572R }}</ref>。ここで想定されていたペロピウムという元素は、後にタンタルとニオブの混合物であると確認され、またニオブは1801年にハチェットが発見していたコロンビウムと同一のものであると確認された。 |
|||
タンタルとニオブが違うものであることは、{{仮リンク|クリスチャン・ヴィルヘルム・ブロムストラント|sv|Christian Wilhelm Blomstrand}}<ref name="Ilmen" />や[[アンリ・サント=クレール・ドビーユ]]が1864年にはっきりと示し、また{{仮リンク|ルイ・ジョゼフ・トロースト|fr|Louis Joseph Troost}}も1865年にいくつかの化合物の実験式を示した<ref name="Ilmen">{{cite journal|title = Tantalsäure, Niobsäure, (Ilmensäure) und Titansäure|journal = Fresenius' Journal of Analytical Chemistry|volume = 5|issue = 1|date = 1866|doi = 10.1007/BF01302537|pages = 384–389|author= Marignac, Blomstrand|author2= H. Deville|author3= L. Troost|author4= R. Hermann|last-author-amp= yes}}</ref><ref name="Gupta"/>。[[スイス]]の化学者[[ジャン・マリニャック]]もさらなる確認を行い<ref>{{cite journal|journal = Annales de chimie et de physique|title = Recherches sur les combinaisons du niobium|pages = 7–75|authorlink = Jean Charles Galissard de Marignac|language=French| first = M. C.|last= Marignac|url = http://gallica.bnf.fr/ark:/12148/bpt6k34818t/f4.table|date= 1866|volume = 4|issue = 8}}</ref>、1866年に2種類の元素のみが含まれていることを証明した。しかしこうした発見があったにもかかわらず、1871年まで{{仮リンク|イルメニウム|en|Ilmenium}}という実在しない元素に関して科学者たちが文献を出していた<ref>{{cite journal|title = Fortgesetzte Untersuchungen über die Verbindungen von Ilmenium und Niobium, sowie über die Zusammensetzung der Niobmineralien (Further research about the compounds of ilmenium and niobium, as well as the composition of niobium minerals)|first = R.|last = Hermann|journal = Journal für Praktische Chemie|language=German|volume = 3|issue = 1|pages =373–427|doi = 10.1002/prac.18710030137|date = 1871}}</ref>。マリニャックはまた、1864年にタンタルの塩化物を[[水素]]雰囲気中で熱して[[酸化還元反応|還元]]することで、タンタルの金属形態を初めて得た<ref name="nauti">{{cite web|url = http://nautilus.fis.uc.pt/st2.5/scenes-e/elem/e04100.html|title = Niobium|publisher = Universidade de Coimbra|accessdate = 2008-09-05}}</ref>。初期には不純なタンタルしか得ることができなかったが、1903年に{{仮リンク|ヴェルナー・フォン・ボルトン|de|Werner von Bolton}}が{{仮リンク|ベルリン=シャルロッテンブルク|en|Charlottenburg|label=シャルロッテンブルク}}において、かなり純粋で延性のある金属タンタルを得ることに成功した。金属タンタルから作られた線は、[[タングステン]]製のものに置き換えられるまで、[[電球]]のフィラメントとして用いられていた<ref>{{cite journal|title = Scanning Our Past from London The Filament Lamp and New Materials|journal = Proceedings of the IEEE|volume = 89|issue = 3|date = 2001|doi = 10.1109/5.915382|author = Bowers, B.|page = 413}}</ref>。 |
|||
いわゆる[[レアメタル]]の一つであり、産業的にきわめて重要な物質である。近年、価格高騰が著しい。 |
|||
何十年もの間、ニオブからタンタルを分離する商業的な技術は、[[ジャン・マリニャック]]が1866年に発見した、{{仮リンク|フッ化タンタル酸カリウム|en|Potassium heptafluorotantalate}}を[[分別晶析法|分別晶析]]によりフッ化ニオブ酸カリウム<!--またはフッ化酸化ニオブ酸カリウム一水和物-->から分離するという方法であった。この方法は、フッ化物含有のタンタル水溶液を[[溶媒抽出法|溶媒抽出]]するという方法に置き換えられている<ref name="Gupta">{{cite book|title = Extractive Metallurgy of Niobium|first = C. K.|last = Gupta|author2=Suri, A. K. |publisher = CRC Press|date = 1994|isbn = 0-8493-6071-4}}</ref>。 |
|||
タンタルの化合物質である[[炭化タンタル]] (TaC) は、モース硬度約9 - 10と非常に硬く、融点が3985 {{℃}}で、全物質中最も融点が高い。導電性及び熱伝導性を持ち、化学的に安定である。 |
|||
== 性質 == |
|||
タンタルにはαとβの2種類の結晶構造が存在する。α-Taは体心立方構造を持ち、比較的やわらかく、展延性がある。(空間群は''lm3m''、格子定数はa=0.33058nm)一方、β-Taは正方晶系で、かたく、脆い。(空間群は''P42/mmm''、格子定数はa=1.0194nm,c=0.5313nm) |
|||
=== 物理的性質 === |
|||
タンタルは銀灰色で<ref>{{cite book | chapter = Tantalum | url = https://books.google.com/?id=5o3Lr2Swz8sC&pg=PA204 | isbn = 978-0-86516-573-1 | title = Classical Mythology & More: A Reader Workbook | author1 = Colakis, Marianthe | author2 = Masello, Mary Joan | date = 2007-06-30}}</ref>、密度や延性が高く、非常に硬いが加工はしやすい。熱や電気の伝導度が高く、酸による腐食にも強い。金属を侵す能力の高い[[王水]]であっても、摂氏150度以下ではタンタルはまったく溶けない。[[フッ化水素酸]]や[[フッ化物]]と[[三酸化硫黄]]を含む酸性溶液、[[水酸化カリウム]]には溶ける。タンタルの融点は摂氏3,017度(沸点は摂氏5,458度)と高く、これを上回る元素は[[タングステン]]、[[レニウム]]、[[オスミウム]]、[[炭素]]だけである。 |
|||
タンタルにはαとβの2種類の結晶構造が存在する。α-Taは比較的やわらかく、展延性がある。[[体心立方格子]]構造を持ち(空間群はlm3m、格子定数はa=0.33058nm)、[[ヌープ硬度]]は200 - 400 HN、電気抵抗は15 - 60 µΩ・cmである。β-Taは硬いがもろく、結晶構造は[[正方晶系]]を持ち(空間群はP42/mnm、格子定数はa=1.0194nm,c=0.5313nm)、ヌープ硬度は1000 - 1300 HN、電気抵抗は比較的高く170 - 210 µΩ・cmである。β構造は準安定で、摂氏750 - 775度に加熱することでα構造に転移する。大量のタンタルはほぼすべてα構造であり、通常β構造は、[[溶融塩]][[共晶]]から[[マグネトロン]][[スパッタリング]]、[[化学気相成長]]あるいは電気化学析出で得られる薄膜として存在する<ref>{{cite journal|doi=10.1016/j.surfcoat.2003.06.008|title=Texture, structure and phase transformation in sputter beta tantalum coating|date=2004|last1=Lee|first1=S.|journal=Surface and Coatings Technology|volume=177–178|page=44|last2=Doxbeck|first2=M.|last3=Mueller|first3=J.|last4=Cipollo|first4=M.|last5=Cote|first5=P.}}</ref>。 |
|||
タンタルの単体は、[[超伝導]]の研究が始まって間もない1930年頃までには、臨界温度4.5 [[ケルビン|K]]で超伝導となることが発見されている<ref>{{Cite book | 和書 | author = 足立 吟也、南 努 | title = 現代無機材料科学 | publisher = 化学同人 | date = 2007-01-01 | pages = 179 - 180 | isbn = 978-4759810745}}</ref>。一方、[[タンタル酸カリウム]]単結晶の表面付近が0.005 K未満で超伝導になる現象も2011年に発見されている<ref>{{Cite web|和書| url = https://www.natureasia.com/ja-jp/nnano/pr-highlights/1229 | title = 絶対零度付近で初の超伝導 | date = 2011-05-23 | publisher = Nature Japan K.K. | accessdate = 2018-10-03}}</ref>。 |
|||
=== 同位体 === |
|||
{{Main|タンタルの同位体}} |
|||
天然のタンタルは、<sup>180m</sup>Ta (0.012 %) と<sup>181</sup>Ta (99.988 %)という2つの[[同位体]]で構成されている。<sup>181</sup>Taは安定同位体である。<sup>180m</sup>Taは[[核異性体]]で、基底状態の<sup>180</sup>Taへの[[核異性体転移]]、<sup>180</sup>[[タングステン|W]]への[[ベータ崩壊]]、[[電子捕獲]]によって<sup>180</sup>[[ハフニウム|Hf]]への崩壊の3種類の崩壊をすると予測されている。しかし、この核異性体の放射性崩壊は1度も観測されたことがなく、最低でも[[半減期]]2.0 × 10<sup>16</sup>年(2京年)を持つと、半減期の下限値を示されているに過ぎない<ref>{{cite journal|last1=Hult|first1=Mikael|last2=Wieslander|first2=J. S. Elisabeth|last3=Marissens|first3=Gerd|last4=Gasparro|first4=Joël|last5=Wätjen|first5=Uwe|last6=Misiaszek|first6=Marcin|title=Search for the radioactivity of 180mTa using an underground HPGe sandwich spectrometer|url=http://www.sciencedirect.com/science/article/pii/S0969804309000657|accessdate=23 September 2014|doi=10.1016/j.apradiso.2009.01.057|volume=67|issue=5|journal=Applied Radiation and Isotopes|pages=918–921|year=2009}}</ref>。基底状態である<sup>180</sup>Taは、わずか8時間の半減期である。放射性壊変によって生じる、あるいは宇宙線生成による短寿命の核種を除けば、<sup>180m</sup>Taは自然界に存在する唯一の核異性体である。これもまた放射性壊変によって生じる、あるいは宇宙線生成による短寿命の核種を除けば、<sup>180m</sup>Taはタンタルの元素存在比および天然同位体構成比を考慮すれば、宇宙でもっとも希少な同位体である<ref name="NUBASE">{{cite journal| first = Audi| last = Georges|title = The NUBASE Evaluation of Nuclear and Decay Properties| journal = Nuclear Physics A| volume = 729| pages= 3–128| publisher = Atomic Mass Data Center| date = 2003| doi=10.1016/j.nuclphysa.2003.11.001| bibcode=2003NuPhA.729....3A| last2 = Bersillon| first2 = O.| last3 = Blachot| first3 = J.| last4 = Wapstra| first4 = A. H.| url = http://hal.in2p3.fr/in2p3-00014184}}</ref>。 |
|||
タンタルは、[[核兵器]]に「加塩」(放射性物質の放出量を増強する)する材料として理論的に検討されてきた([[コバルト]]の方が加塩材料として良く知られている)。仮説上、核兵器が爆発するときに出る強力な高エネルギー中性子線が外殻の<sup>181</sup>Taに放射線を浴びせる。これによってタンタルを半減期114.4日の放射性同位体である<sup>182</sup>Taに変化させ、これが112万[[電子ボルト]]のエネルギーを持つ[[ガンマ線]]を出し、核爆発で生じた[[放射性降下物]]の放射能を数か月にわたって大幅に強化することになる。こうした加塩された核兵器は、少なくとも公的に知られている限りでは実際に作られたことも試験されたこともなく、実際に兵器として使用されたことは1度もない<ref>{{cite journal|last1=Win|first1=David Tin|last2=Al Masum|first2=Mohammed|title=Weapons of Mass Destruction|date=2003|journal=Assumption University Journal of Technology|volume=6|issue=4|pages=199–219|url=http://www.journal.au.edu/au_techno/2003/apr2003/aujt6-4_article07.pdf|format = PDF}}</ref>。 |
|||
タンタルは、[[陽子線]]を当てて<sup>8</sup>[[リチウム|Li]]、<sup>80</sup>[[ルビジウム|Rb]]、and <sup>160</sup>[[イッテルビウム|Yb]]といった様々な短寿命放射性同位体を作るためのターゲット材として用いられる<ref>https://mis.triumf.ca/science/planning/yield/target/Ta</ref>。 |
|||
== 化合物 == |
|||
タンタルは[[酸化数]]+2, +3, +4, +5の化合物を形成する。これらの中では酸化数+5が最も安定である<ref name = "britannica">{{Cite web | url = https://www.britannica.com/science/tantalum | title = Tantalum | publisher = Encyclopædia Britannica | accessdate = 2018-09-30}}</ref>。なお、+5価のイオン半径は、73 pmである<ref>久保田 晴寿、桜井 弘 編著 『無機医薬品化学(第3版)』 p.18 廣川書店 1997年3月15日発行 ISBN 4-567-46054-5</ref>。タンタルの化合物としては酸化物が安定で、タンタルの鉱物はすべて[[酸化鉱物]]である。酸化数が3より小さい無機化合物は、タンタル原子間の化学結合を特徴とする<ref name="Housecroft">{{Cite book |和書 |last=Housecroft |first=Catherine E. |author2=Sharpe, A. G |others=巽 和行、西原 寛、穐田 宗隆、酒井 健 監訳|year=2012 |title=ハウスクロフト無機化学 |volume=(下) |publisher=東京化学同人 |edition=原著第3版 |pages=741-746 |isbn=978-4-8079-0778-6}}</ref>。炭素原子がタンタル原子と化学結合している有機タンタル化合物では、+1, 0, −1などのさらに低い酸化数も取る。 |
|||
タンタルとニオブの化学的特性はよく似ている。同じ[[第5族元素]]の[[バナジウム]]と似ているところもあるが、バナジウムでよくみられる酸化数+2, +3の化合物はタンタルとニオブでは少ない<ref name="新村">{{Cite book |和書 |author=新村 陽一 |year=1984 |title=無機化学 |publisher=朝倉書店 |pages=187-189|isbn=4-254-14025-8}}</ref>。 |
|||
=== 酸化物 === |
|||
[[ファイル:Lindquist M6.jpg|144px|thumb|ヘキサタンタル酸イオン {{chem|[Ta|6|O|19|]|8-}}]] |
|||
[[五酸化タンタル]] {{chem|(Ta|2|O|5|)}} は、実用上の観点からはもっとも重要な化合物である。4価の酸化物 {{chem|(TaO|2|)}} は[[不定比化合物]]で、[[ルチル]]構造を取る。3価の酸化物 {{chem|(Ta|2|O|3|)}} は知られていない<ref name="Greenwood">{{Greenwood&Earnshaw2nd|pages=976–1001}}</ref>。 |
|||
タンタル酸塩と呼ばれる化合物は、実際には[[複酸化物]]であることがほとんどで、孤立したタンタル酸イオンを含む化合物はまれである<ref>{{Cite book|和書 |chapter=タンタル酸塩 |title=標準化学用語辞典 |publisher=丸善出版 |edition=第2版 |others=日本化学会 編 |year=2005 |isbn=978-4-621-07531-9}}</ref>。前者の例として、[[イルメナイト]]類似構造を取る[[タンタル酸リチウム]] (LiTaO<sub>3</sub>) や、[[ペロブスカイト構造]]を取る[[タンタル酸カリウム]] (KTaO<sub>3</sub>) が挙げられる。これらの結晶ではタンタル原子が6個の酸素原子に囲まれており、孤立した {{chem|[TaO|3|]|-}} イオンは存在しない。タンタル酸イットリウム {{chem|(YTaO|4|)}} は後者の例で、[[灰重石]]に似た構造を持つ結晶には、孤立した四面体状のタンタル(V)酸イオン {{chem|[TaO|4|]|3-}} が含まれる<ref>{{Cite journal |和書|author=宮脇 律郎 |title=新種鉱物の記載と結晶構造 |year=2011 |journal=日本結晶学会誌 |volume=53 |issue=1 |pages=58-63 |doi=10.5940/jcrsj.53.58 |url=https://doi.org/10.5940/jcrsj.53.58 }}</ref>。 |
|||
五酸化タンタルと水酸化アルカリを溶融し、生成物を水で処理すると、水溶性の[[イソポリ酸]]塩が得られる<ref name="Housecroft" />。カリウムイオン {{chem|(K|+|)}} とヘキサタンタル酸イオン {{chem|[Ta|6|O|19|]|8-}} からなる {{chem|K|8|[Ta|6|O|19|]⋅16H|2|O}} がよく知られている。{{chem|[Ta|6|O|19|]|8-}}は、6個の{{chem|TaO|6}}八面体が稜共有でつながった構造をしており、[[タングステン]]のイソポリ酸イオン {{chem|[W|6|O|19|]|2-}} と同じ形である。25個の原子からなる大きなイオンであるが、水溶液中でもこのままの形で存在する<ref name="新村" />。 |
|||
=== 窒化物・炭化物・ホウ化物 === |
|||
[[ファイル:Magnesium-diboride-3D-balls.png|144px|thumb|[[ホウ化タンタル]] {{chem|(TaB|2|)}}]] |
|||
他の[[耐火金属]]と同様に、発見されているタンタル化合物の中でもっとも硬いのは、ホウ化物や炭化物である。[[炭化タンタル]] (TaC) は、同様の用途で用いられている[[炭化タングステン]]と同様、硬い[[セラミックス]]で、切削工具に使われる。[[窒化タンタル]]は、マイクロエレクトロニクスの分野において薄膜絶縁体として用いられる<ref>{{cite journal|title=Microstructure of amorphous tantalum nitride thin films|first=S.|last=Tsukimoto| author2= Moriyama, M.| author3= Murakami, Masanori| journal=Thin Solid Films|date=1961|volume= 460|issue=1–2|pages=222–226|doi=10.1016/j.tsf.2004.01.073|bibcode = 2004TSF...460..222T }}</ref>。 |
|||
=== 硫化物 === |
|||
もっとも研究されているタンタルの[[カルコゲン化物]]は硫化タンタル(IV) (TaS<sub>2</sub>) であり、他の[[カルコゲン化物#ジカルコゲン化物|遷移金属ジカルコゲナイド]]に見られるように、[[層状半導体]]である。タンタルと[[テルル]]の合金は[[準結晶]]を形成する<ref name="HollemanAF">{{cite book|title=Lehrbuch der Anorganischen Chemie|first=|date=2007|publisher=de Gruyter|year=|isbn=978-3-11-017770-1|edition=102nd|location=|pages=|language=German|author=Holleman, A. F.|author2=Wiberg, E.|author3=Wiberg, N.}}</ref>。 |
|||
=== ハロゲン化物 === |
|||
タンタルのハロゲン化物の酸化数は+5、+4、+3を取る。[[フッ化タンタル(V)]] {{chem|(TaF|5|)}} は融点が摂氏97.0度の白い固体である。気相の孤立{{chem|TaF|5}}分子は[[三方両錐形分子構造]]を取るが、固体中では{{chem|TaF|6}}八面体が頂点共有した四量体として存在する。ヘプタフルオロタンタル(V)酸イオン {{chem|[TaF|7|]|2-}} は、タンタルをニオブから分離する際に用いられる<ref name="ICE">{{cite journal|title=Staff-Industry Collaborative Report: Tantalum and Niobium|first=Donald J.|last=Soisson|author2=McLafferty, J. J. |author3=Pierret, James A. | journal=Ind. Eng. Chem.|date=1961|volume= 53|issue=11|pages=861–868|doi=10.1021/ie50623a016}}</ref>。[[塩化タンタル(V)]]、[[臭化タンタル(V)]]、[[ヨウ化タンタル(V)]] {{chem|(TaCl|5|, TaBr|5|, TaI|5|)}} は、固体中では{{chem|TaX|6}}八面体が稜共有した[[二量体]]として存在し、水にあうと加水分解してハロゲン化酸化物となる<ref>{{Cite book|和書 |chapter=タンタル化合物 |title=岩波理化学辞典 |publisher=岩波書店 |edition=第5版CD-ROM版 |year=1999 |isbn=4-00-130102-4}}</ref>。塩化タンタル(V)は、有機タンタル化合物の合成において出発物質として用いられる<ref>{{Cite book|和書 |chapter=有機タンタル錯体 |title=有機金属化合物・超分子錯体|series = 実験化学講座 |volume=21 |publisher=丸善出版 |edition=第5版 |others=日本化学会 編 |year=2004 |isbn=4621073206| pages=99-107}}</ref>。 |
|||
フッ化タンタル(IV) {{chem|(TaF|4|)}} は知られていない。他のハロゲン化タンタル(IV) {{chem|(TaX|4|)}} も不安定で、空気中で容易に酸化されてハロゲン化酸化物を与える。また加熱により酸化数+5のハロゲン化物 {{chem|(TaX|5|)}} と酸化数+3のハロゲン化物 {{chem|(TaX|3|)}} に[[不均化]]する<ref name="Housecroft" />。 |
|||
見かけの酸化数が+2.5または+2.33となる塩化物、臭化物、ヨウ化物が知られている。これらのハロゲン化物では、6個のタンタル原子が正八面体状に並んだ、{{chem|[Ta|6|X|12|]|3+}}または{{chem|[Ta|6|X|12|]|2+}}が構成単位として認められる。この構成単位に含まれるハロゲン原子はタンタル原子がつくる八面体の外側に位置しており、化合物内の金属原子の間に化学結合が存在していること示している<ref name="Housecroft"/><ref name="Greenwood"/>。 |
|||
=== 有機タンタル化合物 === |
|||
[[ファイル:DOSBIWoneRotamer.png|144px|thumb|ペンタメチルタンタル {{chem|(Ta(CH|3|)|5|)}}]] |
|||
有機タンタル化合物としては、{{仮リンク|ペンタメチルタンタル|en|pentamethyltantalum}}、塩化アルキルタンタル、水素化アルキルタンタル、および[[カルベン錯体]]や[[シクロペンタジエニル錯体]]などがある<ref name=Schrock>{{Cite journal|last=Schrock|first=Richard R.|date=1979-03-01|title=Alkylidene complexes of niobium and tantalum|url=https://doi.org/10.1021/ar50135a004|journal=Accounts of Chemical Research|volume=12|issue=3|pages=98–104|doi=10.1021/ar50135a004|issn=0001-4842}}</ref><ref>{{cite journal|doi=10.1021/om701189e|title=Ethylene Complexes of the Early Transition Metals: Crystal Structures of {{chem|[HfEt|4|(C|2|H|4|)|2-|]}} and the Negative-Oxidation-State Species {{chem|[TaHEt(C|2|H|4|)|3|3-|]}} and {{chem|[WH(C|2|H|4|)|4|3-|]}}|author=Morse, P. M.|journal=Organometallics|date=2008|volume=27|issue=5|page=984|displayauthors=1|author2=Shelby, Q. D. |author3=Kim, D. Y. |author4=Girolami, G. S. |last-author-amp=yes}}</ref>。[[金属カルボニル]]は、ヘキサカルボニルタンタル(−I)酸イオン {{chem|[Ta(CO)|6|]|-}} や関連する[[イソシアニド]]について、多様な塩や置換誘導体が知られている。 |
|||
== 存在 == |
|||
タンタルの宇宙における存在度は重量比では0.08 [[ppb]]程度<ref name = "webelements">{{Cite web | url = https://www.webelements.com/tantalum/ | title = WebElements Periodic Table Tantalum | publisher = WebElements | accessdate = 2018-09-30}}</ref>、原子数では全原子数の8×10<sup>-9</sup>パーセント程度とされ、原子数では安定元素として宇宙でもっとも希少である<ref>{{Cite web | url = http://periodictable.com/Properties/A/UniverseAbundance.v.log.html | title = Abundance in the Universe of the elements | publisher = periodictable.com | accessdate = 2018-09-30}}</ref>。宇宙において鉄より重い元素のほとんどは、[[超新星爆発]]や[[恒星]]内部での[[中性子捕獲]]反応によって生成される<ref name = "国立天文台204">{{Cite journal | 和書 | author = 梶野敏貴、早川岳人、千葉敏 | title = 太陽系で最も希少な同位体タンタル180の起源は超新星爆発のニュートリノ | journal = 国立天文台ニュース | issue = 204 | pages = 3 - 5 | year = 2010 | month = 7 | url = https://www.nao.ac.jp/contents/naoj-news/data/nao_news_0204.pdf | format = PDF | accessdate = 2018-09-30}}</ref>。中性子捕獲による元素生成では、鉄が中性子捕獲により質量数が大きな[[鉄の同位体]]になり、[[ベータ崩壊]]によって原子番号の1つ大きな元素となる反応を繰り返して、各種の同位体が生成されるが、中性子捕獲やベータ崩壊の起きやすさによって、どの同位体が多くなるかが決定され、この結果タンタルは希少なものとなっている<ref name = "Quora">{{Cite web | url = https://www.quora.com/Why-is-tantalum-the-least-abundant-stable-element-in-the-universe | title = Why is tantalum the least abundant stable element in the universe? | publisher = Quora | accessdate = 2018-09-30}}</ref>。 |
|||
タンタルには、<sup>180</sup>Ta (0.012 %) と<sup>181</sup>Ta (99.988 %) の2種類の天然同位体が存在し、このうち<sup>180</sup>Taは全核種の中でもっとも少ない。従来の超新星爆発や中性子捕獲による機構では、この<sup>180</sup>Taの少なさを説明できずにいたが、超新星爆発の際に放出される[[ニュートリノ]]が<sup>180</sup>[[ハフニウム|Hf]]や<sup>181</sup>Taと[[弱い相互作用]]を起こして<sup>180</sup>Taを生成するモデルが新たに提案された。<sup>180</sup>Taは基底状態で半減期8.15時間のものと、半減期10<sup>15</sup>年以上の準安定な[[核異性体]]があり、弱い相互作用によって生成される<sup>180</sup>Taの基底状態と核異性体のうち、基底状態のものはすべて放射性壊変により消滅するため、半減期の長い核異性体のみが残り、基底状態と核異性体の生成比率の理論計算値から求めた核異性体の推定量が実在量と一致することから、<sup>180</sup>Taの生成起源が説明され、またその希少さの理由も説明されることになった<ref name = "国立天文台204" />。 |
|||
タンタルは、[[地殻中の元素の存在度|地球の地殻に重量比]]で1 [[ppm]]<ref name="Emsley">{{cite book|title = Nature's Building Blocks: An A-Z Guide to the Elements|last = Emsley|first= John|publisher = Oxford University Press|date = 2001|location = Oxford, England, UK|isbn = 0-19-850340-7|chapter = Tantalum|page=420}}</ref>から2 ppm<ref name="Aguly">{{cite book|first=Anatoly|last=Agulyansky|title=The Chemistry of Tantalum and Niobium Fluoride Compounds|publisher=Elsevier|date=2004| isbn=978-0-444-51604-6| url=https://books.google.com/?id=Z-4QXNB5Hp8C|accessdate=2008-09-02}}</ref>程度含まれていると推計されている。 |
|||
タンタルを含む鉱物はたくさんあるが、工業的に原材料として利用されているのはそのごく一部だけである。[[タンタル石]](鉄タンタル石、マンガンタンタル石、マグネシウムタンタル石などで構成される)、[[マイクロ石]]、{{仮リンク|ウォッジナイト|en|Wodginite}}、{{仮リンク|ユークセン石|en|Euxenite}}(より正確にはイットリウムユークセン石)、{{仮リンク|ポリクレース石|en|Polycrase}}(より正確にはイットリウムポリクレース石)といった鉱物がある<ref name="mindat.org"/>。タンタル抽出の観点では、タンタル石 ([[鉄|Fe]], [[マンガン|Mn]])Ta<sub>2</sub>[[酸素|O]]<sub>6</sub> がもっとも重要である。タンタル石と[[コルンブ石]] ([[鉄|Fe]], [[マンガン|Mn]]) (Ta, [[ニオブ|Nb]])<sub>2</sub>[[酸素|O]]<sub>6</sub> と同じ鉱石構造をしている。ニオブよりタンタルが多いものをタンタル石と呼び、タンタルよりニオブが多いものをコルンブ石(あるいはニオブ石)と呼ぶ。タンタル石やそのほかタンタル含有鉱物は密度が高いため、選鉱には{{仮リンク|重力選鉱|en|Gravity separation}}が最良の手段である。他に[[サマルスキー石]]や[[フェルグソン石]]といった鉱物がタンタルを含むことがある。 |
|||
こうした鉱石類の鉱床は、古い時代に起きた、大陸地殻内部の物質が溶融して[[マグマ]]が生じ、[[結晶分化作用]]によって濃集したことによるものや、化学的風化作用によって難溶性の鉱物のみが残って形成される風化残留鉱床によるものなどで形成されている。その生成の由来から、古い地殻にのみ存在する鉱床であるとされている<ref name = "地質ニュース658">{{Cite journal | 和書 | author = 石原 舜三 | title = タンタル資源とオーストラリアのグリーンブッシュ ペグマタイト見学記 | journal = 地質ニュース | issue = 658 | pages = 72 - 80 | year = 2009 | month = 6 | publisher = 産業技術総合研究所 | url = https://www.gsj.jp/data/chishitsunews/09_06_20.pdf | format = PDF | accessdate = 2018-09-30}}</ref>。 |
|||
また、[[スズ]]の原料鉱石である[[錫石]]の微量成分としてもタンタルが含まれることがある。錫石の鉱床も、花崗岩質マグマや熱水鉱液に由来し、風化・流出して地表水や海水により重力選別を受けて形成される<ref name = "地質ニュース658" />。 |
|||
== 生産 == |
|||
[[ファイル:Tantalite.jpg|thumb|left|オーストラリア・[[ピルバラ]]産の[[タンタル石]]]] |
|||
[[ファイル:Tantalum world production.svg|thumb|upright=1|2012年までのタンタル生産量の変化<ref>[http://minerals.usgs.gov/ds/2005/140 U.S. Geological Survey] {{Webarchive|url=https://web.archive.org/web/20130604121254/http://minerals.usgs.gov/ds/2005/140/ |date=2013-06-04 }}</ref>]] |
|||
タンタルの生産は、スズの精錬に際して出てくる鉱滓(スラグ)に含まれるものから抽出するものと、タンタル鉱石を採掘して生産するものがある<ref name = "金属資源レポート" />。タンタルの精錬は、冶金工業においても要求の厳しい分野である。精錬上の主な問題は、タンタルの鉱石にはかなりの量の[[ニオブ]]が含まれており、その化学的性質がタンタルとほとんど同じという点にある。この問題を解決するために多くの方式が開発されてきた。現代では、この分離は[[湿式精錬]]によって実施されている<ref name=Chang>{{cite journal|title=Solvent extraction technology for the separation and purification of niobium and tantalum: A review|author1=Zhaowu Zhu|author2=Chu Yong Cheng|journal=Hydrometallurgy|volume=107|year=2011|pages=1–12|doi=10.1016/j.hydromet.2010.12.015}}</ref>。 |
|||
=== 精錬 === |
|||
スズスラグを起点としてタンタルを抽出する場合、電気炉中でスラグを[[コークス]]と反応させて炭化物とし、これを精製してアルカリ処理してタンタル分を濃縮して精鉱を得る。これ以降は、タンタル鉱石を起点としてタンタルを抽出する場合と同じである<ref name = "金属資源レポート" />。 |
|||
タンタル鉱石を起点とする場合、鉱石は砕かれて、重力選鉱により選別される。一般的にこの処理は、鉱山の近くで実施される。 |
|||
[[フッ化水素酸]]と[[硫酸]]または[[塩酸]]を使って、鉱石の{{仮リンク|浸出 (鉱業)|en|Leaching (metallurgy)|label=浸出}}を行うところから抽出が始まる。これにより鉱石に含まれる多くの非金属不純物からタンタルとニオブを分離することができる。タンタルは様々な形態で鉱石に含まれるが、こうした条件下ではほとんどのタンタルの5価の酸化物は同じようにふるまうので、五酸化物を代表として取り扱うことができる。この抽出を簡単な式で示せば以下の通りとなる。 |
|||
: <chem>Ta2O5 + 14 HF -> 2H2[TaF7] + 5H2O</chem> |
|||
これとほぼ同じ反応がニオブ側の成分にも起きるが、この抽出条件においては六フッ化物が主に得られる。 |
|||
: <chem>Nb2O5 + 12HF -> 2H[NbF6] + 5H2O</chem> |
|||
この式は単純化されたものである。硫酸および塩酸を使った際に、それぞれ硫酸水素イオン (HSO<sub>4</sub><sup>−</sup>) および塩化物イオンがニオブ(V)イオンとタンタル(V)イオンの[[配位子]]として競合すると推測されている<ref name=Chang/>。タンタルのフッ化物とニオブのフッ化物の[[錯体]]が、[[水溶液]]から[[シクロヘキサノン]]、[[オクタノール]]、[[メチルイソブチルケトン]]といった有機[[溶媒]]に[[液液抽出]]によって抽出される。この単純な操作によって、鉄、[[マンガン]]、[[チタン]]、[[ジルコニウム]]といったほとんどの金属含有不純物が水溶液にフッ化物やそのほかの錯体として残り、取り除くことができる。 |
|||
タンタルをニオブから分離する操作は、混合された酸の[[イオン強度]]を下げていくことによって、ニオブが水溶液に溶け出すことで行われる。この条件では、オキシフッ化物 {{chem|H|2|[NbOF|5|]}} が形成されると見られている。ニオブの除去後、精製された {{chem|H|2|[TaF|7|]}} の溶液は[[アンモニア]]水溶液によって中和され、酸化タンタルの水和物が固体として得られ、これを[[煆焼]]して五酸化タンタル {{chem|(Ta|2|O|5|)}} を得る<ref>{{cite book|last=Agulyanski|first=Anatoly|title=Chemistry of Tantalum and Niobium Fluoride Compounds|date=2004|publisher=Elsevier|location=Burlington|isbn=9780080529028|edition=1st}}</ref>。 |
|||
あるいは、ニオブ除去後の{{chem|H|2|[TaF|7|]}} の溶液を[[加水分解]]する代わりに、[[フッ化カリウム]]で処理して{{仮リンク|ヘプタフルオロタンタル(V)酸カリウム|en|Potassium heptafluorotantalate}}(フッ化タンタル酸カリウム)を得ることもできる。{{chem|H|2|[TaF|7|]}} と異なりカリウム塩は容易に結晶化し、固体として取り扱うことができる。 |
|||
: <chem>H2[TaF7] + 2KF -> K2[TaF7] + 2HF</chem> |
|||
マリニャック法と呼ばれる古い手段では、{{chem|H|2|[TaF|7|]}} と {{chem|H|2|[NbOF|5|]}} の混合物を {{chem|K|2|[TaF|7|]}} と {{chem|K|2|[NbOF|5|]}} の混合物に変化させ、これを水への[[溶解度]]の差を利用する[[分別晶析法]]により分離していた。 |
|||
=== 金属タンタルの製造 === |
|||
精錬によって得られたフッ化タンタル酸カリウムあるいは五酸化タンタルは、その後フッ化タンタル酸カリウムの[[ナトリウム]]還元あるいは五酸化タンタルの[[溶融塩電解]]、炭素還元、フッ化物・塩化物・酸化物などの水素還元といった方法で金属タンタルにする<ref name = "日本鉱業会誌100">{{Cite journal | 和書 | author = 門 智 | title = ニオブ・タンタルの製錬・用途およびその開発状況 | journal = 日本鉱業会誌 | volume = 100 | issue = 1152 | year = 1984 | month = 2 | pages = 28 - 38 | publisher = 資源・素材学会 | url = https://doi.org/10.2473/shigentosozai1953.100.1152_142 | doi = 10.2473/shigentosozai1953.100.1152_142}}</ref>。工業的に用いられる方法は、ナトリウム還元法または溶融塩電解である<ref name = "金属資源レポート" />。 |
|||
フッ化タンタル酸カリウムのナトリウム還元は、反応るつぼに原料のフッ化タンタル酸カリウムを積み重ね、[[アルゴン]]などの不活性ガスで満たし、ヒーターで加熱しながら金属ナトリウムを導入する。ナトリウムの沸点である摂氏883度に達するとナトリウムが蒸発してフッ化タンタル酸カリウムの表面に達し、これによって還元反応が進行する<ref name = "日本鉱業会誌100" />。還元後、温水やメタノールで洗浄することでタンタルの粗金属が得られる<ref name = "金属資源レポート" />。 |
|||
: <chem>K2[TaF7] + 5Na -> Ta + 5NaF + 2KF</chem> |
|||
溶融塩電解法は、[[ホール・エルー法]]を改良したものを用いる。タンタル溶融塩電解では、入力として酸化物、出力として金属の、どちらも液体を利用するのではなく、粉末状の酸化物を用いて実行される。この手法の最初の発見は1997年のことで、ケンブリッジ大学の研究者がある種の酸化物の小さなサンプルを溶融塩に浸し、電流によりこの酸化物を還元したことによる。陰極には金属酸化物の粉末を使っていた。陽極は炭素製であった。摂氏約1,000度の溶融塩が電解質として用いられた。この方法の最初の精錬装置は、全世界の年間需要の3 - 4パーセント程度を供給できる能力を持っている<ref>{{cite news|url=https://www.economist.com/news/science-and-technology/21571847-exotic-useful-metals-such-tantalum-and-titanium-are-about-become-cheap |title=Manufacturing metals: A tantalising prospect |publisher=The Economist |date=2013-02-16 |accessdate=2013-04-17}}</ref>。 |
|||
こうした方法で得られるタンタルは、真空熱処理によって脱水素を行ったり、電子ビーム溶解によってインゴット化したりする。タンタルをさらに高純度化するためには、電子ビーム帯域溶解法を用いる<ref name = "金属資源レポート" />。 |
|||
=== タンタルの加工 === |
|||
タンタルの[[溶接]]は、大気中の気体による汚染を防ぐために[[アルゴン]]や[[ヘリウム]]などの不活性気体の中で行わなければならない。タンタルははんだ付け不能である。タンタルを切削加工するのは難しく、特に[[焼なまし]]をしたタンタルについては難しい。焼きなましをした状態では、タンタルは非常に[[展延性]]が高く、簡単に金属板に加工することができる<ref>{{Cite web|url = http://www.nfpa.org/assets/files/aboutthecodes/484/nfpa484-2002.pdf|title = NFPA 484 – Standard for Combustible Metals, Metal Powders, and Metal Dusts – 2002 Edition|date = 2002-08-13|access-date = 2016-02-12|website = National Fire Protection Association|publisher = NFPA|last = |first = }}</ref>。 |
|||
=== 生産国および生産量 === |
|||
[[ファイル:World Tantalum Production 2015.svg|upright=1.4|thumb|2015年時点のタンタル生産国、ルワンダが首位]] |
|||
[[ファイル:World Tantalum Production 2006.svg|upright=1.4|thumb|2006年時点のタンタル生産国、オーストラリアが首位]] |
|||
21世紀初頭の時点では、[[オーストラリア]]および[[ブラジル]]が主なタンタル生産国であったが、それ以降はタンタル生産の大きな地理的変化が進んでいる。2007年から2014年にかけて、鉱山からのタンタル生産は[[コンゴ民主共和国]]、[[ルワンダ]]やその他アフリカ諸国へと大規模に移っている<ref>{{cite web| url = http://pubs.usgs.gov/fs/2015/3079/fs20153079.pdf | title = Shift in Global Tantalum Mine Production, 2000–2014 | last1 = Bleiwas, | first1 = Donald I. | last2 =Papp| first2 = John F.| last3 =Yager | first3 = Thomas R. | publisher = U.S. Geological Survey | year = 2015 | accessdate = 2018-09-30}}</ref>。2017年のタンタル生産国上位は、1位がルワンダで390トン、2位がコンゴ民主共和国で370トン、3位が[[ナイジェリア]]で190トン、4位がブラジルで100トン、5位が[[中華人民共和国]]で95トンの順となっている<ref name="USGS2018">{{cite web| title = Minerals commodity survey 2018 Tantalum | publisher = United States Geological Survey |year = 2018| format = PDF | url = https://minerals.usgs.gov/minerals/pubs/commodity/niobium/mcs-2018-tanta.pdf | accessdate = 2018-10-03}}</ref>。将来的なタンタル供給源は、推計されている埋蔵量順に、[[サウジアラビア]]、[[エジプト]]、[[グリーンランド]]、[[中華人民共和国]]、[[モザンビーク]]、[[カナダ]]、[[オーストラリア]]、[[アメリカ合衆国]]、[[フィンランド]]、[[ブラジル]]である<ref name="Mining Journal">{{cite journal|journal = Mining Journal|author = M. J.|format = PDF|title = Tantalum supplement|date = November 2007|url = http://www.noventa.net/pdf/presentations/tanatalumSCR_presentation.pdf|accessdate = 2008-06-03}}</ref><ref>{{cite journal|url = http://www.doir.wa.gov.au/documents/gswa/gsdMRB_22_chap10.pdf|archiveurl = https://web.archive.org/web/20070926195547/http://www.doir.wa.gov.au/documents/gswa/gsdMRB_22_chap10.pdf|archivedate = 2007-09-26|format = PDF|journal = GSWA Mineral Resources Bulletin|volume = 22|title = International tantalum resources — exploration and mining|issue = 10}}</ref>。 |
|||
長らくタンタルの最大生産国であった[[オーストラリア]]では、最大生産者の{{仮リンク|タリソン・ミネラルズ|en|Talison Minerals}}が[[西オーストラリア州]]の南西部のグリーンブッシュおよび[[ピルバラ]]地区のウドギナという2か所で鉱山を操業している。世界的な金融危機のために、ウドギナ鉱山は2008年末に操業を中止していたが、2011年1月に再開された<ref>{{cite news| url = https://af.reuters.com/article/drcNews/idAFLDE6530TW20100609 | publisher = Reuters |title = Talison Tantalum eyes mid-2011 Wodgina restart 2010-06-09 | accessdate = 2010-08-27 | date=2010-06-09}}</ref>。再開から1年経たないうちに、タリソン・ミネラルズは「タンタル需要の軟化」とその他の原因を理由として、2012年2月末にタンタル採掘を中断することを発表した<ref name="Wodgina-tant-closed">{{cite news| url=http://au.news.yahoo.com/thewest/business/a/-/business/12702333/gam-closes-wodgina-tantalum-mine/| title=GAM closes Wodgina tantalum mine| last=Emery| first=Kate| date=24 Jan 2012| work=The West Australian| accessdate=20 March 2012| quote=Worldwide softening tantalum demand and delays in receiving Governmental approval for installation of necessary crushing equipment are among contributing factors in this decision| deadurl=yes| archiveurl=https://web.archive.org/web/20121204055041/http://au.news.yahoo.com/thewest/business/a/-/business/12702333/gam-closes-wodgina-tantalum-mine/| archivedate=4 December 2012| df=}}</ref>。ウドギナではタンタルの鉱物を採掘し、グリーンブッシュにおいてさらに精製が行われてから顧客に売却されている<ref name="Talison">{{cite web|publisher = Global Advanced Metals |date = 2008|url = http://globaladvancedmetals.com/our-operations/gam-resources/wodgina-australia.aspx |title = Wodgina Operations|accessdate = 2011-03-28}}</ref>。ニオブの大規模生産国は[[ブラジル]]や[[カナダ]]であるが、そうした場所で生産される鉱物からも少ないがタンタルが得られる。他に、[[中華人民共和国]]、[[エチオピア]]、[[モザンビーク]]といった場所の鉱山がタンタルの比率の高い鉱物を産出し、世界のタンタル生産量の上位を占めている。また、[[タイ王国|タイ]]や[[マレーシア]]の[[スズ]]生産の副産物としてもタンタルが得られる。{{仮リンク|砂鉱床|en|Placer deposit}}からの鉱石を重力選鉱する際に、[[錫石]] (SnO<sub>2</sub>) だけではなく、少ない比率ではあるがタンタル石も含まれてくる。この結果、スズ溶鉱炉から出てくる鉱滓には、経済的に有用な量のタンタルが含まれている<ref name="Gupta"/><ref name="USGS2006">{{cite web|publisher = US Geological Survey|last = Papp|first = John F.|title = 2006 Minerals Yearbook Nb & Ta|date = 2006|url = http://minerals.usgs.gov/minerals/pubs/commodity/niobium/#pubs|accessdate = 2008-06-03}}</ref>。 |
|||
タンタルの年間生産量は、1997年から2001年にかけては純タンタル換算で1,478トンから2,257トン程度であった<ref name = "地質ニュース658" />。現状の生産量で考えれば、タンタルの残存埋蔵量は50年以下であると見積もられており、リサイクルの必要性が高まっていることを示している<ref>{{cite web|url = http://www.scientificamerican.com/article.cfm?id=how-much-is-left |title=How much is left?|accessdate=2013-01-13}}</ref>。 |
|||
タンタルは[[コモディティ]]として市場で取引される商品ではなく、また金属単体での取引も基本的に行われていない。鉱石の形態で、売り手と買い手の直接交渉により値段が決定されている<ref name = "metalary">{{Cite web | url = https://www.metalary.com/tantalum-price/ | title = Tantalum Price - Metalary | publisher = Metalary | accessdate = 2018-10-02}}</ref>。タンタルの価格は、30パーセントTa<sub>2</sub>O<sub>5</sub>の鉱石ベースにして、1[[ポンド (質量)|ポンド]](約454グラム)あたりの価格が雑誌等で掲載されている。1980年代から1990年代にかけて長らく20 - 30ドル程度で推移していたが、2000年以降はIT需要の拡大により高騰と、IT不況による停滞がたびたびあり、2007年末時点では35ドル程度となっている<ref name = "金属資源レポート">{{Cite journal | 和書 | url = https://mric.jogmec.go.jp/wp-content/old_uploads/reports/resources-report/2008-01/MRv37n5-08.pdf | format = PDF | author = 南 博志 | title = タンタルの需要・供給・価格動向等 | journal = 金属資源レポート | pages = 79 - 84 | year = 2008 | month = 1 | publisher = 独立行政法人石油天然ガス・金属鉱物資源機構 | accessdate = 2018-09-30}}</ref>。その後は高騰し、2011年から2012年にかけては1ポンド当たりに換算して120ドルを超える高値で取引されていた<ref name = "metalary" />。 |
|||
== 紛争資源として == |
|||
タンタルは[[紛争鉱物]]の1種であるとされる。コルンブ石とタンタル石の産業上の名称である[[コルタン]]からはニオブとタンタルが抽出されるが<ref>[http://www.tanb.org/coltan Tantalum-Niobium International Study Center: Coltan] Retrieved 2008-01-27</ref>、[[中部アフリカ]]でも採掘される鉱石であり、[[コンゴ民主共和国]](かつてのザイール)における[[第二次コンゴ戦争]]とタンタルが関わってくる理由となっている。2003年10月23日の国連報告によれば<ref>{{cite web|title = S/2003/1027|date = 2003-10-26|url = https://www.un.org/Docs/journal/asp/ws.asp?m=S/2003/1027|accessdate =2008-04-19}}</ref>、密輸も含めたコルタンの輸出が、第二次世界大戦以来最悪の死者数記録となる、1998年以降だけで約540万人が死んだコンゴにおける戦争を助長しているとされる<ref>{{cite web|publisher = International Rescue Committee|title = Special Report: Congo|url = http://www.rescue.org/special-reports/special-report-congo-y|accessdate = 2008-04-19}}</ref>。コンゴ盆地の武力紛争地帯においてコルタンのような資源を収奪することに伴う、責任ある企業行動、人権、野生生物の危機といった倫理上の問題が問われるようになっている<ref>{{cite book|title = Coltan Mining in the Democratic Republic of Congo: How tantalum-using industries can commit to the reconstruction of the DRC|first = Karen|last = Hayes|author2=Burge, Richard |journal = Fauna & Flora|isbn = 1-903703-10-7|pages = 1–64}}</ref><ref>{{cite web|url = http://pulitzercenter.org/video/congos-bloody-coltan|date=January 6, 2011|work=Pulitzer Center on Crisis Reporting|author=Dizolele, Mvemba Phezo|title=Congo's Bloody Coltan|accessdate=2009-08-08}}</ref><ref>{{cite web|url=http://www1.american.edu/ted/ice/congo-coltan.htm|title=Congo War and the Role of Coltan|accessdate=2009-08-08|deadurl=yes|archiveurl=https://web.archive.org/web/20090713173610/http://www1.american.edu/TED/ice/congo-coltan.htm|archivedate=2009-07-13|df=}}</ref><ref>{{cite web|url = http://www.panda.org/what_we_do/where_we_work/congo_basin_forests/problems/mining/coltan_mining/ |archiveurl = https://web.archive.org/web/20090330005811/http://www.panda.org/what_we_do/where_we_work/congo_basin_forests/problems/mining/coltan_mining/ |archivedate = 2009-03-30 |title=Coltan mining in the Congo River Basin|accessdate =2009-08-08}}</ref>。しかし、コルタンの採掘はコンゴの地域経済にとっては重要であるが、世界のタンタル供給に占める割合は通常は小さい。[[アメリカ地質調査所]]の年鑑は、この地域のタンタル生産量は、2002年から2006年にかけての世界のタンタル生産量の1パーセント未満で、2000年と2008年に10パーセントに達したのが最高であるとしている<ref name="USGS2006"/>。 |
|||
「ソリューションズ・フォー・ホープ・タンタルプロジェクト」の目的は、「コンゴ民主共和国から紛争と関係しないタンタルを供給する」ことであるとされている<ref>{{cite web|title=‘Solutions for Hope’ Tantalum Project Offers Solutions and Brings Hope to the People of the DRC|url=http://solutions-network.org/site-sfhtantalum/|website=Solutions Network|accessdate=18 September 2014}}</ref>。 |
|||
== 用途 == |
== 用途 == |
||
=== |
=== 電気・電子機器 === |
||
[[File:Tantal-P1100196c.jpg|thumb|各種のタンタル電解コンデンサ、左がリード型、右がチップ型。大きさの比較としてマッチ棒を示した。]] |
|||
最もよく利用されるのは、[[コンデンサ]]である。{{仮リンク|タンタルコンデンサ|en|Tantalum capacitor}}は他種のコンデンサに比べて小型で、漏れ電流が少ない上、安定度がよい。[[パーソナルコンピュータ|パソコン]]や[[携帯電話]]など、小さな[[エレクトロニクス]]製品には多数のタンタルコンデンサが使用されているが、高価なこと、故障モードがオープンでなくショートであるため逆接による破壊時などに大電流を流してしまい発火性もあること、そして何より産出地が限られ国際問題に関わるため、製品への利用は減少させる方向である。{{独自研究範囲|date=2017年2月|なお、前述の特性の良さなどから、電子部品の計測のためのサンプル実装などで部品として例示されていることがあるが、実用に供する回路での使用は故障モード関して十分に考慮すべきであり、そのままサンプルの仕様を流用してはいけない。}} |
|||
タンタルの主な用途は、電子機器の製造であり、主に[[コンデンサ]](キャパシタ)や高出力[[抵抗器]]などに金属粉末の形態で用いられる。{{仮リンク|タンタルコンデンサ|en|Tantalum capacitor|label=タンタル電解コンデンサ}}は、タンタルが表面に保護酸化被膜を形成する性質を利用し、タンタルの粉末をペレット状の形態に焼き固めたものを一方の極板とし、酸化物 (Ta<sub>2</sub>O<sub>5</sub>) を[[誘電体]]とし、電解液または伝導性のある固体をもう一方の極板としたものである。誘電体の層が非常に薄くなる(同様のアルミニウム電解コンデンサなどに比べてもかなり薄い)ことから、小容積でも大きな[[静電容量]]を実現できる。大きさと重量の利点から、[[携帯電話]]、[[パーソナルコンピュータ]]、{{仮リンク|自動車エレクトロニクス|en|Automotive electronics}}、[[カメラ]]といった用途に適する<ref name="USGSCR08">{{cite web|url = http://minerals.usgs.gov/minerals/pubs/commodity/niobium/mcs-2008-tanta.pdf|title = Commodity Report 2008: Tantalum|publisher = United States Geological Survey|accessdate = 2008-10-24|format = PDF}}</ref>。 |
|||
=== フィラメント === |
|||
昔は[[フィラメント]]に使用されたが、[[タングステン]]に取って代わられた。 |
|||
また、[[表面弾性波フィルター]](SAWフィルター)の材料としても用いられる。これは特定の信号波のみを選択的に通すフィルターであり、携帯電話などにおいて決められた送受信周波数以外の周波数成分をカットするために用いられる。電気信号を[[圧電効果]]を利用して一旦機械的な振動に変換し、固体表面を伝搬する弾性表面波とした上で、その圧電結晶基盤の上に形成されたパターンの構造により選択的に周波数フィルターを適用し、再び電気信号に変換する仕組みとなっている。このための圧電単結晶として[[タンタル酸リチウム]] (LiTaO<sub>3</sub>) または[[ニオブ酸リチウム]] (LiNbO<sub>3</sub>) が用いられている<ref>{{Cite journal | 和書 | title = SAWフィルター | journal = セラミックス | year = 2006 | month = 8 | volume = 41 | issue = 8 | pages = 627 - 628 | publisher = 日本セラミックス協会 | url = http://www.ceramic.or.jp/museum/contents/pdf/2006_08_01.pdf | format = PDF}}</ref>。 |
|||
=== インプラントや医療用途 === |
|||
また、タンタルは体液と反応しない人体に無害な金属であるため、人工骨や人工関節など整形外科向け医療材料としての他、手術用縫合糸、人工心臓の材料、あるいは[[歯]]の[[デンタルインプラント|インプラント]](フィクスチャー)の材料にも使われる。 |
|||
[[スパッタリング]]によって薄膜を形成する際に、ターゲット材(薄膜材料)としてタンタル(五酸化タンタル)を用いることがある<ref>{{Cite web|和書| url = http://www.toishi.info/pro/seimaku/sputteringtarget.html | title = スパッタリングターゲット材 | accessdate = 2018-10-04}}</ref>。これによって高誘電率・高絶縁耐圧の薄膜形成が行われる<ref>{{Cite journal | 和書 | author = 藤川久喜、野田浩司、多賀康訓 | title = Ta2O5系高誘電率絶縁膜の作成 | journal = 豊田中央研究所R&Dレビュー | volume = 30 | issue = 4 | year = 1995 | month = 12 | pages = 13 - 23 | url = https://www.tytlabs.com/japanese/review/rev304pdf/304_013fujikawa.pdf | format = PDF}}</ref>。 |
|||
=== 宝飾品 === |
|||
ほか、宝飾品や高級時計に用いられることもある。 |
|||
かつて白熱電球の[[フィラメント (電気)|フィラメント]]の製造にタンタルが利用されていたことがある。フィラメントは当初炭素(カーボン)のものが使用されていたが、その性能を向上させるために様々な金属フィラメントの開発が行われ、1902年に[[ドイツ]]の[[ジーメンス・ウント・ハルスケ]]の技術者{{仮リンク|ヴェルナー・フォン・ボルトン|de|Werner von Bolton}}がタンタルを利用したフィラメントを開発した。この電球は効率が良く明るく白い光を出すことから好評であった。アメリカの[[ゼネラル・エレクトリック]]はライセンス生産の権利を買って1910年まで生産しており、ジーメンス自体は1913年まで生産していたが、1904年に発明され1906年に商品化された[[タングステン]]フィラメントを利用した電球がより効率が高く寿命が長かったことから、タンタル電球は時代遅れとなった<ref name = "白熱電球">{{Cite web|和書| author = 石﨑 有義 | url = https://sts.kahaku.go.jp/diversity/document/system/pdf/070.pdf | format = PDF | title = 白熱電球の技術の系統化調査 | year = 2011 | publisher = 産業技術史資料情報センター | accessdate = 2018-10-01}}</ref><ref>{{Cite web | url = http://www.lamptech.co.uk/Spec%20Sheets/IN%20TA%20GE%2025W.htm | title = GE Tantalum Filament 25W of American Design | accessdate = 2018-10-01 | publisher = Museum of Electric Lamp Technology}}</ref><ref>{{Cite web | url = http://www.lamptech.co.uk/IN%20Tantalum.htm | title = Incandescent - Tantalum Filament | accessdate = 2018-10-01 | publisher = Museum of Electric Lamp Technology}}</ref>。 |
|||
== 歴史 == |
|||
[[1802年]]、[[スウェーデン]]の[[アンデルス・エーケベリ]]が発見した<ref name="sakurai">{{Cite |和書 |author =[[桜井弘]]|title = 元素111の新知識|date = 1998| pages = 302|publisher =[[講談社]]|isbn=4-06-257192-7 |ref = harv }}</ref>。このときエーケベリが発見したのは性質がよく似ている[[ニオブ]]との混合酸化物であったが、[[1846年]]に[[ドイツ]]の[[ハインリヒ・ローゼ]]が単体として分離した。名称は[[ギリシャ神話]]のフリギアの王、[[タンタロス]]に因む。 |
|||
タンタルは無線送信機の[[極超短波]][[真空管]]の製造に広く用いられている。タンタルは、窒化物や酸化物を形成して窒素や酸素を捕獲できるので、グリッドやプレートといった真空管内部の部品に使って、真空管内に必要な高い真空度を維持するための{{仮リンク|ゲッター|en|Getter}}としても利用できる<ref name="ICE"/><ref name="Balke"/>。 |
|||
== タンタルの化合物 == |
|||
* [[炭化タンタル]] (TaC) |
|||
** [[炭化タンタルハフニウム]] (Ta<sub>x</sub>Hf<sub>1-x</sub>C<sub>y</sub>) |
|||
* [[タンタル酸リチウム]] (LiTaO<sub>3</sub>) |
|||
* [[タンタル酸カリウム]] (KTaO<sub>3</sub>) |
|||
=== 合金および耐食金属 === |
|||
== 同位体 == |
|||
タンタルは、高い融点や強度、展延性などを持つ様々な種類の[[合金]]を製造するために用いられる。他の金属と合金とすることで、金属加工用の超硬工具を製作したり、ジェットエンジン部品、化学処理装置、原子炉、ミサイル部品、熱交換器、タンクや容器向けの[[超合金]]の生産といった目的で用いられる<ref>{{Cite news|url=https://www.admatinc.com/tantalum/sheetplate/|title=Tantalum Products: Tantalum Sheet & Plate {{!}} Admat Inc|work=Admat Inc.|accessdate=2018-08-28|language=en-US}}</ref><ref name="USGSCR08"/><ref>{{cite journal|title = New applications for tantalum and tantalum alloys|journal = JOM Journal of the Minerals, Metals and Materials Society|volume = 52|issue = 3|date = 2000|doi = 10.1007/s11837-000-0100-6|page=40|first = R. W.|last = Buckman Jr.|bibcode = 2000JOM....52c..40B }}</ref>。展延性が高いことから、細いワイヤやフィラメントをタンタルから作って、アルミニウムのような金属の蒸着処理に用いられる。 |
|||
{{Main|タンタルの同位体}} |
|||
天然のタンタルは、99.988%の[[タンタル181|<sup>181</sup>Ta]]と0.012%の[[タンタル180m1|<sup>180m1</sup>Ta]]で構成されている。このうちの<sup>180m1</sup>Taは、天然に存在する唯一の[[核異性体]]である。 |
|||
タンタルはほとんどの酸に対して不活性であるため、化学反応を行う容器や腐食性流体の配管などに有用な金属である。塩酸を蒸気で熱するための熱交換材はタンタルで作られる<ref name="Balke">{{cite journal|page= 1166|journal = Industrial and Engineering Chemistry|volume = 20|issue = 10|title = Columbium and Tantalum|first = Clarence W.|last = Balke|doi=10.1021/ie50310a022|date= 1935}}</ref>。化学工業においてグラスライニングの反応容器等を用いるが、その内面が損傷した場合の補修方法の一つとしてタンタルを使用する場合がある。<ref>{{Cite web|和書 |
|||
== 主な産出国 == |
|||
| url = https://www.kobelco-eco.co.jp/process_equipment/pdf/aftersales_service/mente09.pdf |
|||
* [[オーストラリア]] |
|||
| title = タンタル補修 |
|||
* [[コンゴ民主共和国]] |
|||
| publisher = 株式会社神鋼環境ソリューション |
|||
* [[カナダ]] |
|||
| accessdate = 2022-04-28 }}</ref> |
|||
* [[タイ王国|タイ]] |
|||
ただし、[[フッ化水素酸]]、熱[[硫酸]]、熱[[アルカリ]]水溶液などはタンタルを腐食する。 |
|||
* [[中華人民共和国|中国]] |
|||
* [[カザフスタン]] |
|||
融点が高く酸化耐性があることから、{{仮リンク|真空炉|en|Vacuum furnace}}の部品の生産にタンタルが使われる。また白金坩堝の代用品としてタンタル坩堝が使用されることがある。タンタルは不活性であることから、{{仮リンク|サーモウェル|en|Thermowell}}、バルブ本体、タンタル製締結部品などの腐食耐性のある様々な部品の製造に用いられる。 |
|||
== 関連項目 == |
|||
* [[APFSDS]] - 対戦車砲弾、装弾筒付翼安定徹甲弾とも訳される。[[運動エネルギー]]を利用して高速で大質量の金属をぶつける事で装甲を貫徹する砲弾。タンタルが最も弾体に適しているがコストがかさむため代わりに劣化ウランやタングステンが用いられている。 |
|||
=== その他 === |
|||
* [[コルタン]] |
|||
[[File:Tantalio.png|thumb|320x320px|カザフスタン銀行発行の[[バイメタル貨]]。外周のリング部分が銀で、中央がタンタルである。]] |
|||
密度の高さから、[[成型炸薬]]や[[自己鍛造弾]]の内張りがタンタルで作られる<ref>{{cite journal|title = Microstructure of high-strain, high-strain-rate deformed tantalum|first = Sia|last = Nemat-Nasser|author2 = Isaacs, Jon B.|author3 = Liu, Mingqi|journal = Acta Materialia|volume = 46|page= 1307|date = 1998|doi = 10.1016/S1359-6454(97)00746-5|issue = 4}}</ref>。タンタルはその高い密度と融点から、成形炸薬弾の装甲貫徹能力を大いに増進する<ref>{{cite journal|doi = 10.1016/S0734-743X(01)00135-X|title = The penetration resistance of a titanium alloy against jets from tantalum shaped charge liners|date = 2001|last1 = Walters|first1 = William|author2 = Cooch, William|author3 = Burkins, Matthew|journal = International Journal of Impact Engineering|volume = 26|page= 823|last4 = Burkins|first4 = Matthew}}</ref><ref>{{cite book|isbn = 978-0-471-64952-6|author = Russell, Alan M.|author2 = Lee, Kok Loong| date = 2005|publisher = Wiley-Interscience|location = Hoboken, NJ|title = Structure-property relations in nonferrous metals|url = https://books.google.com/?id=fIu58uZTE-gC&pg=PA129&lpg=PP128#PPA218|page = 218}}</ref>。 |
|||
またときには、その耐食性と重厚な高級感から[[オーデマ・ピゲ]]、[[ウブロ]]、[[モンブラン (企業)|モンブラン]]、[[オメガ]]、[[オフィチーネ・パネライ]]といった高級[[腕時計]]、高級宝飾品の製造にも用いられる。 |
|||
タンタルは体液に耐え、生体に対して不活性で刺激性が少ないため、外科用医療用具や人体埋め込み材(インプラント材)などの製作に広く用いられる。たとえば、タンタルは硬組織に直接接着する能力が高いことから、多孔性のタンタルコーティングが整形外科用の埋め込み物の製作に用いられる<ref>{{cite journal|first = R.|last = Cohen|date = 2006|title = Applications of porous tantalum in total hip arthroplasty|journal = Journal of the American Academy of Orthopaedic Surgeons|volume = 14|pmid=17077337|last2 = Della Valle|first2 = C. J.|last3 = Jacobs|first3 = J. J.|issue = 12|pages = 646–55}}</ref><ref name="Gerald L. Burke 1940">{{cite journal|journal = Canadian Medical Association Journal |author = Gerald L. Burke |date = 1940 |title =The Corrosion of Metals in Tissues; and An Introduction to Tantalum |volume = 43}}</ref>。タンタルは剛性が高いことから、{{仮リンク|応力遮蔽|en|Stress shielding}}を避けるために、多孔質発泡体や低い剛性の骨格の形態で人工股関節置換術に用いられる<ref>{{cite journal|journal = Clinical Materials|date = 1994|volume = 16|issue = 3|pages =167–173|title = Biological performance of tantalum|last = Black|first = J.|pmid=10172264|doi = 10.1016/0267-6605(94)90113-9}}</ref>。タンタルは非鉄・非磁性の金属であるので、こうしたインプラント材を埋め込まれた患者も[[核磁気共鳴画像法]] (MRI) の検査を受けられるとされている<ref name="PaganiasTsakotos2012">{{cite journal|last1=Paganias|first1=Christos G.|last2=Tsakotos|first2=George A.|last3=Koutsostathis|first3=Stephanos D.|last4=Macheras|first4=George A.|title=Osseous integration in porous tantalum implants|journal=Indian Journal of Orthopaedics|volume=46|issue=5|year=2012|pages=505|issn=0019-5413|doi=10.4103/0019-5413.101032|pmid=23162141}}</ref>。 |
|||
またタンタル酸化物は、カメラのレンズ用に特別に高い[[屈折率]]のガラスを作るために用いられる<ref>{{cite book|title = Optical Materials: An Introduction to Selection and Application|chapter = Optical Glass Composition|first = Solomon|last = Musikant|publisher = CRC Press|date = 1985|page = 28|isbn = 978-0-8247-7309-0|chapter-url = https://books.google.com/?id=iJEXMF3JBtQC&pg=PA28}}</ref>。 |
|||
== 環境問題 == |
|||
タンタルは地球科学からの関心に比べて、環境分野ではほとんど関心を持たれていない。上部地殻でのタンタル濃度や地殻あるいは鉱物におけるニオブ/タンタル比率の計測は地球化学的な道具として有用であるため、値が計測されている<ref>{{Cite journal|last=Green|first=TH.|date=1995|title=Significance of Nb/Ta as an indicator of geochemical processes in the crust-mantle system|url=https://doi.org/10.1016/0009-2541(94)00145-X|journal=Chemical Geology|volume=120|pages=347|via=|bibcode=1995ChGeo.120..347G|doi=10.1016/0009-2541(94)00145-X}}</ref>。2008年時点で最新の上部地殻でのタンタル濃度は0.92 ppmで、ニオブ/タンタル比は12.7である<ref>{{Cite journal|last=Hu|first=Z.|last2=Gao|first2=S.|date=2008|title=Upper crustal abundances of trace elements: a revision and update|url=https://doi.org/10.1016/j.chemgeo.2008.05.010|journal=Chemical Geology|volume=253|pages=205|via=|bibcode=2008ChGeo.253..205H|doi=10.1016/j.chemgeo.2008.05.010}}</ref>。 |
|||
環境中の様々な場所におけるタンタルの濃度に関する情報はあまりなく、特に自然の海水や淡水に溶けているタンタルの濃度に関する信頼性のあるデータが得られたことはない<ref name=":0">{{Cite journal|last=Filella|first=M.|date=2017|title=Tantalum in the environment|url=https://doi.org/10.1016/j.earscirev.2017.07.002|journal=Earth-Science Reviews|volume=173|pages=122|via=}}</ref>。海水中に溶けているタンタルの濃度に関する値がいくつか発表されているが、それらには矛盾がある。淡水中の値に関しても海水の測定値に比べいくらかましであるにすぎないが、しかし自然の水中における溶解濃度は現在の分析能力の限界未満であることから、おそらく1リットル当たり1ナノグラムを下回っていると考えられている<ref>{{Cite journal|last=Filella|first=M.|last2=Rodushkin|first2=I.|date=2018|title=A concise guide for the determination of less-studied technology-critical elements (Nb, Ta, Ga, In, Ge, Te) by inductively coupled plasma mass spectrometry in environmental samples|url=https://doi.org/10.1016/j.sab.2018.01.004|journal=Spectrochimica Acta Part B|volume=141|pages=80|via=}}</ref>。分析には予備濃縮法を用いる必要があるが、今のところは一貫性のある結果とならない。そしていずれにせよ、タンタルは自然界の水の中では溶けているというよりはほぼ微粒子の状態で存在しているものと思われる<ref name=":0" />。 |
|||
土壌、河床堆積物、大気エーロゾルなどに含まれる濃度の値はより容易に入手できる<ref name=":0" />。土壌中の濃度はほぼ1 ppmであり、地殻中のタンタル濃度である。これは砕岩質に由来することを示唆している。大気エーロゾルに含まれる値はさまざまであり、また限られている。タンタルの濃縮が観測される場合は、雲の中のエーロゾルの水により溶ける物質が失われたことによるものであろう<ref>{{Cite journal|last=Vlastelic|first=I.|last2=Suchorski|first2=K.|last3=Sellegri|first3=K.|last4=Colomb|first4=A.|last5=Nauret|first5=F.|last6=Bouvier|first6=L.|last7=Piro|first7=J-L.|date=2015|title=The high field strength element budget of atmospheric aerosols (puy de Dôme, France)|url=https://doi.org/10.1016/j.gca.2015.07.006|journal=Geochimica et Cosmochimica Acta|volume=167|pages=253|jstor=|via=|bibcode=2015GeCoA.167..253V|doi=10.1016/j.gca.2015.07.006}}</ref>。 |
|||
人間がタンタルを利用していることに伴う汚染が発見されたことはない<ref>{{Cite journal|last=Filella|first=M.|last2=Rodríguez-Murillo|first2=JC.|date=2017|title=Less-studied TCE: are their environmental concentrations increasing due to their use in new technologies?|url=https://doi.org/10.1016/j.chemosphere.2017.05.024|journal=Chemosphere|volume=182|pages=605|via=}}</ref>。生物地球化学的にはタンタルは非常に変化の少ないものだと思われるが、その循環や反応性についてはいまだ完全に理解されているとは言えない。 |
|||
== 人体への危険性 == |
|||
タンタルは[[生体適合性]]が高く<ref name="Gerald L. Burke 1940"/>、また化学的に安定で体液とも反応しにくいために人体への害は少ないと見られている<ref name="SAKURAI_118_p330">桜井 弘 編 『元素118の新知識』 p.330 講談社 (ブルーバックス B2028) 2017年8月20日発行 ISBN 978-4-06-502028-9</ref>。むしろ、医療材料として体内に埋め込んだ場合などは、タンタルよりも医療材料に使用されている他の元素や化合物の性質に注意が向けられる<ref>{{cite journal|journal = Biomaterials|author = Matsuno H|author2 = Yokoyama A|author3 = Watari F|author4 = Uo M|author5 = Kawasaki T.|date = 2001|volume = 22|title = Biocompatibility and osteogenesis of refractory metal implants, titanium, hafnium, niobium, tantalum and rhenium. Biocompatibility of tantalum.|doi = 10.1016/S0142-9612(00)00275-1|pmid=11336297|issue = 11|pages = 1253–62}}</ref>。 |
|||
職場においては、吸入、皮膚への接触、眼球への接触といった形でタンタルに人体が暴露される可能性がある。アメリカの{{仮リンク|労働安全衛生局|en|Occupational Safety and Health Administration}}は、職場におけるタンタル暴露の法的限界({{仮リンク|許容暴露限界|en|permissible exposure limit}})を1日8時間労働に対して5 mg/m<sup>3</sup>と設定している。{{仮リンク|アメリカ国立労働安全衛生研究所|en|National Institute for Occupational Safety and Health}}では、{{仮リンク|推奨される暴露限度|en|Recommended exposure limit}}として、1日8時間労働に対しては5 mg/m<sup>3</sup>、短期限界として10 mg/m<sup>3</sup>を設定している。2,500 mg/m<sup>3</sup>に達すると、タンタルは{{仮リンク|生命または健康に対する差し迫った危険|en|Immediately dangerous to life or health}}であるとされる<ref>{{Cite web|title = CDC – NIOSH Pocket Guide to Chemical Hazards – Tantalum (metal and oxide dust, as Ta)|url = https://www.cdc.gov/niosh/npg/npgd0585.html|website = www.cdc.gov|accessdate = 2015-11-24}}</ref>。 |
|||
== 脚注 == |
== 脚注 == |
||
{{脚注ヘルプ}} |
{{脚注ヘルプ}} |
||
{{Reflist}} |
{{Reflist|30em}} |
||
== 外部リンク == |
== 外部リンク == |
||
* {{ICSC|1596}} |
|||
{{Commons|Tantalum}} |
{{Commons|Tantalum}} |
||
* {{ICSC|1596}} |
|||
* [https://anzeninfo.mhlw.go.jp/anzen/gmsds/7440-25-7.html 職場の安全サイト タンタル] 厚生労働省 |
|||
{{元素周期表}} |
{{元素周期表}} |
||
{{タンタルの化合物}} |
{{タンタルの化合物}} |
||
{{Normdaten}} |
{{Normdaten}} |
||
{{Good article}} |
|||
{{DEFAULTSORT:たんたる}} |
{{DEFAULTSORT:たんたる}} |
||
[[Category:タンタル|*]] |
[[Category:タンタル|*]] |
||
[[Category:元素]] |
|||
[[Category:遷移金属]] |
|||
[[Category:第5族元素]] |
|||
[[Category:第6周期元素]] |
|||
2024年9月15日 (日) 17:16時点における最新版
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外見 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
銀灰色
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 一般特性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称, 記号, 番号 | タンタル, Ta, 73 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分類 | 遷移金属 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族, 周期, ブロック | 5, 6, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子量 | 180.94788 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子配置 | [Xe] 4f14 5d3 6s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子殻 | 2, 8, 18, 32, 11, 2(画像) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理特性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 相 | 固体 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度(室温付近) | 16.654(293 K、固体)[1] g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 融点での液体密度 | 15.000(融点、液体)[1] g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 融点 | 3258[2] K, 2985[2] °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 5783[2] K, 5510[2] °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 融解熱 | 36.57 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 蒸発熱 | 732.8 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱容量 | (25 °C) 25.36 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 蒸気圧 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子特性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 酸化数 | 5, 4, 3, 2, -1(弱酸性酸化物) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電気陰性度 | 1.5(ポーリングの値) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| イオン化エネルギー | 第1: 761[3] kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 第2: 1500 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 146 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共有結合半径 | 170±8 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| その他 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 結晶構造 | α-Ta: 体心立方構造 β-Ta: 正方晶系[4] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁性 | 常磁性[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電気抵抗率 | (20 °C) 131 nΩ⋅m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱伝導率 | (300 K) 57.5 W/(m⋅K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱膨張率 | (25 °C) 6.3 μm/(m⋅K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 音の伝わる速さ (微細ロッド) |
(20 °C) 3400 m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ヤング率 | 186 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剛性率 | 69 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 体積弾性率 | 200 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ポアソン比 | 0.34 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| モース硬度 | 6.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ビッカース硬度 | 873 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ブリネル硬度 | 800 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS登録番号 | 7440-25-7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 主な同位体 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細はタンタルの同位体を参照 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
タンタル(独: Tantal [ˈtantal]、英: tantalum [ˈtæntələm])は、原子番号73の第6周期に属する第5族元素である。元素記号は Ta。タンタルの単体は比較的密度が高くて硬く、銀白色を呈し、光沢があって腐食耐性の高い遷移金属である。レアメタルの1つに数えられており合金の微量成分などとして広く用いられる他、比較的化学的に安定で融点も高く、耐火金属としても知られる。化学的に不活性な特性から、実験用設備の材料や白金の代替品として有用である。今日におけるタンタルの主な用途は、携帯電話、DVDプレーヤー、ゲーム機、パーソナルコンピュータといった電子機器に用いられるタンタル電解コンデンサである。タンタルは、タンタル石、コルンブ石あるいはコルタン(タンタル石とコルンブ石の混合物であるとされ独立した鉱物とみなされていない)といった鉱物に含まれ、化学的に類似するニオブと共に産出する[6]。
名称
[編集]タンタルという名前は、ギリシア神話でニオベーの父とされているタンタロスから取られている。神話においては、タンタロスは死後、あごまで届くほどの深さの水の中に立たされ、頭上には果物が豊かに実っているが、どちらも永遠に彼には手に入らずじらされるという罰を受ける(水を飲もうとすると、届かないくらい水位が下がり、果物に手を伸ばそうとすると、枝が手の届く範囲から遠ざかる、英語でtantalizeという単語はじらして苦しめるという意味がある)。アンデシュ・エーケベリは、「私がタンタルと呼ぶこの金属、酸に浸しても何かを吸収したり飽和したりする能力がほとんどないということを部分的に暗示する名前である」と書いている[7]。
歴史
[編集]タンタルは、1802年にスウェーデンにおいてアンデシュ・エーケベリによって発見された[8][9]。その前年にチャールズ・ハチェットがコロンビウム(現在のニオブ)を発見しており[10]、1809年にイングランドの化学者ウイリアム・ウォラストンがニオブの酸化物コルンブ石の密度を5.918 g/cm3、タンタルの酸化物タンタル石の密度を7.935 g/cm3と測定して比較した。ウォラストンは測定された密度が異なるにもかかわらず、両者は同じであるものと結論付け、タンタルの方の名前を残すことにした[11]。フリードリヒ・ヴェーラーがこの結論を確認したことから、これ以降コロンビウムとタンタルは同じ元素であるとされてきた。しかし1846年にドイツの化学者ハインリヒ・ローゼが、タンタル石にはさらに2種類の元素が含まれていると主張し、ギリシア神話でタンタロスの子とされている名前にちなんで、ニオブ(ニオベーから)とペロピウム(ペロプスから)と名付けた[12][13]。ここで想定されていたペロピウムという元素は、後にタンタルとニオブの混合物であると確認され、またニオブは1801年にハチェットが発見していたコロンビウムと同一のものであると確認された。
タンタルとニオブが違うものであることは、クリスチャン・ヴィルヘルム・ブロムストラント[14]やアンリ・サント=クレール・ドビーユが1864年にはっきりと示し、またルイ・ジョゼフ・トローストも1865年にいくつかの化合物の実験式を示した[14][15]。スイスの化学者ジャン・マリニャックもさらなる確認を行い[16]、1866年に2種類の元素のみが含まれていることを証明した。しかしこうした発見があったにもかかわらず、1871年までイルメニウムという実在しない元素に関して科学者たちが文献を出していた[17]。マリニャックはまた、1864年にタンタルの塩化物を水素雰囲気中で熱して還元することで、タンタルの金属形態を初めて得た[18]。初期には不純なタンタルしか得ることができなかったが、1903年にヴェルナー・フォン・ボルトンがシャルロッテンブルクにおいて、かなり純粋で延性のある金属タンタルを得ることに成功した。金属タンタルから作られた線は、タングステン製のものに置き換えられるまで、電球のフィラメントとして用いられていた[19]。
何十年もの間、ニオブからタンタルを分離する商業的な技術は、ジャン・マリニャックが1866年に発見した、フッ化タンタル酸カリウムを分別晶析によりフッ化ニオブ酸カリウムから分離するという方法であった。この方法は、フッ化物含有のタンタル水溶液を溶媒抽出するという方法に置き換えられている[15]。
性質
[編集]物理的性質
[編集]タンタルは銀灰色で[20]、密度や延性が高く、非常に硬いが加工はしやすい。熱や電気の伝導度が高く、酸による腐食にも強い。金属を侵す能力の高い王水であっても、摂氏150度以下ではタンタルはまったく溶けない。フッ化水素酸やフッ化物と三酸化硫黄を含む酸性溶液、水酸化カリウムには溶ける。タンタルの融点は摂氏3,017度(沸点は摂氏5,458度)と高く、これを上回る元素はタングステン、レニウム、オスミウム、炭素だけである。
タンタルにはαとβの2種類の結晶構造が存在する。α-Taは比較的やわらかく、展延性がある。体心立方格子構造を持ち(空間群はlm3m、格子定数はa=0.33058nm)、ヌープ硬度は200 - 400 HN、電気抵抗は15 - 60 µΩ・cmである。β-Taは硬いがもろく、結晶構造は正方晶系を持ち(空間群はP42/mnm、格子定数はa=1.0194nm,c=0.5313nm)、ヌープ硬度は1000 - 1300 HN、電気抵抗は比較的高く170 - 210 µΩ・cmである。β構造は準安定で、摂氏750 - 775度に加熱することでα構造に転移する。大量のタンタルはほぼすべてα構造であり、通常β構造は、溶融塩共晶からマグネトロンスパッタリング、化学気相成長あるいは電気化学析出で得られる薄膜として存在する[21]。
タンタルの単体は、超伝導の研究が始まって間もない1930年頃までには、臨界温度4.5 Kで超伝導となることが発見されている[22]。一方、タンタル酸カリウム単結晶の表面付近が0.005 K未満で超伝導になる現象も2011年に発見されている[23]。
同位体
[編集]天然のタンタルは、180mTa (0.012 %) と181Ta (99.988 %)という2つの同位体で構成されている。181Taは安定同位体である。180mTaは核異性体で、基底状態の180Taへの核異性体転移、180Wへのベータ崩壊、電子捕獲によって180Hfへの崩壊の3種類の崩壊をすると予測されている。しかし、この核異性体の放射性崩壊は1度も観測されたことがなく、最低でも半減期2.0 × 1016年(2京年)を持つと、半減期の下限値を示されているに過ぎない[24]。基底状態である180Taは、わずか8時間の半減期である。放射性壊変によって生じる、あるいは宇宙線生成による短寿命の核種を除けば、180mTaは自然界に存在する唯一の核異性体である。これもまた放射性壊変によって生じる、あるいは宇宙線生成による短寿命の核種を除けば、180mTaはタンタルの元素存在比および天然同位体構成比を考慮すれば、宇宙でもっとも希少な同位体である[25]。
タンタルは、核兵器に「加塩」(放射性物質の放出量を増強する)する材料として理論的に検討されてきた(コバルトの方が加塩材料として良く知られている)。仮説上、核兵器が爆発するときに出る強力な高エネルギー中性子線が外殻の181Taに放射線を浴びせる。これによってタンタルを半減期114.4日の放射性同位体である182Taに変化させ、これが112万電子ボルトのエネルギーを持つガンマ線を出し、核爆発で生じた放射性降下物の放射能を数か月にわたって大幅に強化することになる。こうした加塩された核兵器は、少なくとも公的に知られている限りでは実際に作られたことも試験されたこともなく、実際に兵器として使用されたことは1度もない[26]。
タンタルは、陽子線を当てて8Li、80Rb、and 160Ybといった様々な短寿命放射性同位体を作るためのターゲット材として用いられる[27]。
化合物
[編集]タンタルは酸化数+2, +3, +4, +5の化合物を形成する。これらの中では酸化数+5が最も安定である[28]。なお、+5価のイオン半径は、73 pmである[29]。タンタルの化合物としては酸化物が安定で、タンタルの鉱物はすべて酸化鉱物である。酸化数が3より小さい無機化合物は、タンタル原子間の化学結合を特徴とする[30]。炭素原子がタンタル原子と化学結合している有機タンタル化合物では、+1, 0, −1などのさらに低い酸化数も取る。
タンタルとニオブの化学的特性はよく似ている。同じ第5族元素のバナジウムと似ているところもあるが、バナジウムでよくみられる酸化数+2, +3の化合物はタンタルとニオブでは少ない[31]。
酸化物
[編集]
五酸化タンタル (Ta2O5) は、実用上の観点からはもっとも重要な化合物である。4価の酸化物 (TaO2) は不定比化合物で、ルチル構造を取る。3価の酸化物 (Ta2O3) は知られていない[32]。
タンタル酸塩と呼ばれる化合物は、実際には複酸化物であることがほとんどで、孤立したタンタル酸イオンを含む化合物はまれである[33]。前者の例として、イルメナイト類似構造を取るタンタル酸リチウム (LiTaO3) や、ペロブスカイト構造を取るタンタル酸カリウム (KTaO3) が挙げられる。これらの結晶ではタンタル原子が6個の酸素原子に囲まれており、孤立した [TaO3]− イオンは存在しない。タンタル酸イットリウム (YTaO4) は後者の例で、灰重石に似た構造を持つ結晶には、孤立した四面体状のタンタル(V)酸イオン [TaO4]3− が含まれる[34]。
五酸化タンタルと水酸化アルカリを溶融し、生成物を水で処理すると、水溶性のイソポリ酸塩が得られる[30]。カリウムイオン (K+) とヘキサタンタル酸イオン [Ta6O19]8− からなる K8[Ta6O19]⋅16H2O がよく知られている。[Ta6O19]8−は、6個のTaO6八面体が稜共有でつながった構造をしており、タングステンのイソポリ酸イオン [W6O19]2− と同じ形である。25個の原子からなる大きなイオンであるが、水溶液中でもこのままの形で存在する[31]。
窒化物・炭化物・ホウ化物
[編集]
他の耐火金属と同様に、発見されているタンタル化合物の中でもっとも硬いのは、ホウ化物や炭化物である。炭化タンタル (TaC) は、同様の用途で用いられている炭化タングステンと同様、硬いセラミックスで、切削工具に使われる。窒化タンタルは、マイクロエレクトロニクスの分野において薄膜絶縁体として用いられる[35]。
硫化物
[編集]もっとも研究されているタンタルのカルコゲン化物は硫化タンタル(IV) (TaS2) であり、他の遷移金属ジカルコゲナイドに見られるように、層状半導体である。タンタルとテルルの合金は準結晶を形成する[36]。
ハロゲン化物
[編集]タンタルのハロゲン化物の酸化数は+5、+4、+3を取る。フッ化タンタル(V) (TaF5) は融点が摂氏97.0度の白い固体である。気相の孤立TaF5分子は三方両錐形分子構造を取るが、固体中ではTaF6八面体が頂点共有した四量体として存在する。ヘプタフルオロタンタル(V)酸イオン [TaF7]2− は、タンタルをニオブから分離する際に用いられる[37]。塩化タンタル(V)、臭化タンタル(V)、ヨウ化タンタル(V) (TaCl5, TaBr5, TaI5) は、固体中ではTaX6八面体が稜共有した二量体として存在し、水にあうと加水分解してハロゲン化酸化物となる[38]。塩化タンタル(V)は、有機タンタル化合物の合成において出発物質として用いられる[39]。
フッ化タンタル(IV) (TaF4) は知られていない。他のハロゲン化タンタル(IV) (TaX4) も不安定で、空気中で容易に酸化されてハロゲン化酸化物を与える。また加熱により酸化数+5のハロゲン化物 (TaX5) と酸化数+3のハロゲン化物 (TaX3) に不均化する[30]。
見かけの酸化数が+2.5または+2.33となる塩化物、臭化物、ヨウ化物が知られている。これらのハロゲン化物では、6個のタンタル原子が正八面体状に並んだ、[Ta6X12]3+または[Ta6X12]2+が構成単位として認められる。この構成単位に含まれるハロゲン原子はタンタル原子がつくる八面体の外側に位置しており、化合物内の金属原子の間に化学結合が存在していること示している[30][32]。
有機タンタル化合物
[編集]
有機タンタル化合物としては、ペンタメチルタンタル、塩化アルキルタンタル、水素化アルキルタンタル、およびカルベン錯体やシクロペンタジエニル錯体などがある[40][41]。金属カルボニルは、ヘキサカルボニルタンタル(−I)酸イオン [Ta(CO)6]− や関連するイソシアニドについて、多様な塩や置換誘導体が知られている。
存在
[編集]タンタルの宇宙における存在度は重量比では0.08 ppb程度[42]、原子数では全原子数の8×10-9パーセント程度とされ、原子数では安定元素として宇宙でもっとも希少である[43]。宇宙において鉄より重い元素のほとんどは、超新星爆発や恒星内部での中性子捕獲反応によって生成される[44]。中性子捕獲による元素生成では、鉄が中性子捕獲により質量数が大きな鉄の同位体になり、ベータ崩壊によって原子番号の1つ大きな元素となる反応を繰り返して、各種の同位体が生成されるが、中性子捕獲やベータ崩壊の起きやすさによって、どの同位体が多くなるかが決定され、この結果タンタルは希少なものとなっている[45]。
タンタルには、180Ta (0.012 %) と181Ta (99.988 %) の2種類の天然同位体が存在し、このうち180Taは全核種の中でもっとも少ない。従来の超新星爆発や中性子捕獲による機構では、この180Taの少なさを説明できずにいたが、超新星爆発の際に放出されるニュートリノが180Hfや181Taと弱い相互作用を起こして180Taを生成するモデルが新たに提案された。180Taは基底状態で半減期8.15時間のものと、半減期1015年以上の準安定な核異性体があり、弱い相互作用によって生成される180Taの基底状態と核異性体のうち、基底状態のものはすべて放射性壊変により消滅するため、半減期の長い核異性体のみが残り、基底状態と核異性体の生成比率の理論計算値から求めた核異性体の推定量が実在量と一致することから、180Taの生成起源が説明され、またその希少さの理由も説明されることになった[44]。
タンタルは、地球の地殻に重量比で1 ppm[46]から2 ppm[47]程度含まれていると推計されている。
タンタルを含む鉱物はたくさんあるが、工業的に原材料として利用されているのはそのごく一部だけである。タンタル石(鉄タンタル石、マンガンタンタル石、マグネシウムタンタル石などで構成される)、マイクロ石、ウォッジナイト、ユークセン石(より正確にはイットリウムユークセン石)、ポリクレース石(より正確にはイットリウムポリクレース石)といった鉱物がある[6]。タンタル抽出の観点では、タンタル石 (Fe, Mn)Ta2O6 がもっとも重要である。タンタル石とコルンブ石 (Fe, Mn) (Ta, Nb)2O6 と同じ鉱石構造をしている。ニオブよりタンタルが多いものをタンタル石と呼び、タンタルよりニオブが多いものをコルンブ石(あるいはニオブ石)と呼ぶ。タンタル石やそのほかタンタル含有鉱物は密度が高いため、選鉱には重力選鉱が最良の手段である。他にサマルスキー石やフェルグソン石といった鉱物がタンタルを含むことがある。
こうした鉱石類の鉱床は、古い時代に起きた、大陸地殻内部の物質が溶融してマグマが生じ、結晶分化作用によって濃集したことによるものや、化学的風化作用によって難溶性の鉱物のみが残って形成される風化残留鉱床によるものなどで形成されている。その生成の由来から、古い地殻にのみ存在する鉱床であるとされている[48]。
また、スズの原料鉱石である錫石の微量成分としてもタンタルが含まれることがある。錫石の鉱床も、花崗岩質マグマや熱水鉱液に由来し、風化・流出して地表水や海水により重力選別を受けて形成される[48]。
生産
[編集]

タンタルの生産は、スズの精錬に際して出てくる鉱滓(スラグ)に含まれるものから抽出するものと、タンタル鉱石を採掘して生産するものがある[50]。タンタルの精錬は、冶金工業においても要求の厳しい分野である。精錬上の主な問題は、タンタルの鉱石にはかなりの量のニオブが含まれており、その化学的性質がタンタルとほとんど同じという点にある。この問題を解決するために多くの方式が開発されてきた。現代では、この分離は湿式精錬によって実施されている[51]。
精錬
[編集]スズスラグを起点としてタンタルを抽出する場合、電気炉中でスラグをコークスと反応させて炭化物とし、これを精製してアルカリ処理してタンタル分を濃縮して精鉱を得る。これ以降は、タンタル鉱石を起点としてタンタルを抽出する場合と同じである[50]。
タンタル鉱石を起点とする場合、鉱石は砕かれて、重力選鉱により選別される。一般的にこの処理は、鉱山の近くで実施される。
フッ化水素酸と硫酸または塩酸を使って、鉱石の浸出を行うところから抽出が始まる。これにより鉱石に含まれる多くの非金属不純物からタンタルとニオブを分離することができる。タンタルは様々な形態で鉱石に含まれるが、こうした条件下ではほとんどのタンタルの5価の酸化物は同じようにふるまうので、五酸化物を代表として取り扱うことができる。この抽出を簡単な式で示せば以下の通りとなる。
これとほぼ同じ反応がニオブ側の成分にも起きるが、この抽出条件においては六フッ化物が主に得られる。
この式は単純化されたものである。硫酸および塩酸を使った際に、それぞれ硫酸水素イオン (HSO4−) および塩化物イオンがニオブ(V)イオンとタンタル(V)イオンの配位子として競合すると推測されている[51]。タンタルのフッ化物とニオブのフッ化物の錯体が、水溶液からシクロヘキサノン、オクタノール、メチルイソブチルケトンといった有機溶媒に液液抽出によって抽出される。この単純な操作によって、鉄、マンガン、チタン、ジルコニウムといったほとんどの金属含有不純物が水溶液にフッ化物やそのほかの錯体として残り、取り除くことができる。
タンタルをニオブから分離する操作は、混合された酸のイオン強度を下げていくことによって、ニオブが水溶液に溶け出すことで行われる。この条件では、オキシフッ化物 H2[NbOF5] が形成されると見られている。ニオブの除去後、精製された H2[TaF7] の溶液はアンモニア水溶液によって中和され、酸化タンタルの水和物が固体として得られ、これを煆焼して五酸化タンタル (Ta2O5) を得る[52]。
あるいは、ニオブ除去後のH2[TaF7] の溶液を加水分解する代わりに、フッ化カリウムで処理してヘプタフルオロタンタル(V)酸カリウム(フッ化タンタル酸カリウム)を得ることもできる。H2[TaF7] と異なりカリウム塩は容易に結晶化し、固体として取り扱うことができる。
マリニャック法と呼ばれる古い手段では、H2[TaF7] と H2[NbOF5] の混合物を K2[TaF7] と K2[NbOF5] の混合物に変化させ、これを水への溶解度の差を利用する分別晶析法により分離していた。
金属タンタルの製造
[編集]精錬によって得られたフッ化タンタル酸カリウムあるいは五酸化タンタルは、その後フッ化タンタル酸カリウムのナトリウム還元あるいは五酸化タンタルの溶融塩電解、炭素還元、フッ化物・塩化物・酸化物などの水素還元といった方法で金属タンタルにする[53]。工業的に用いられる方法は、ナトリウム還元法または溶融塩電解である[50]。
フッ化タンタル酸カリウムのナトリウム還元は、反応るつぼに原料のフッ化タンタル酸カリウムを積み重ね、アルゴンなどの不活性ガスで満たし、ヒーターで加熱しながら金属ナトリウムを導入する。ナトリウムの沸点である摂氏883度に達するとナトリウムが蒸発してフッ化タンタル酸カリウムの表面に達し、これによって還元反応が進行する[53]。還元後、温水やメタノールで洗浄することでタンタルの粗金属が得られる[50]。
溶融塩電解法は、ホール・エルー法を改良したものを用いる。タンタル溶融塩電解では、入力として酸化物、出力として金属の、どちらも液体を利用するのではなく、粉末状の酸化物を用いて実行される。この手法の最初の発見は1997年のことで、ケンブリッジ大学の研究者がある種の酸化物の小さなサンプルを溶融塩に浸し、電流によりこの酸化物を還元したことによる。陰極には金属酸化物の粉末を使っていた。陽極は炭素製であった。摂氏約1,000度の溶融塩が電解質として用いられた。この方法の最初の精錬装置は、全世界の年間需要の3 - 4パーセント程度を供給できる能力を持っている[54]。
こうした方法で得られるタンタルは、真空熱処理によって脱水素を行ったり、電子ビーム溶解によってインゴット化したりする。タンタルをさらに高純度化するためには、電子ビーム帯域溶解法を用いる[50]。
タンタルの加工
[編集]タンタルの溶接は、大気中の気体による汚染を防ぐためにアルゴンやヘリウムなどの不活性気体の中で行わなければならない。タンタルははんだ付け不能である。タンタルを切削加工するのは難しく、特に焼なましをしたタンタルについては難しい。焼きなましをした状態では、タンタルは非常に展延性が高く、簡単に金属板に加工することができる[55]。
生産国および生産量
[編集]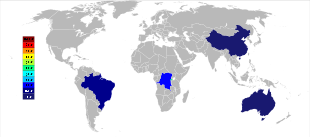
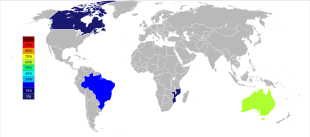
21世紀初頭の時点では、オーストラリアおよびブラジルが主なタンタル生産国であったが、それ以降はタンタル生産の大きな地理的変化が進んでいる。2007年から2014年にかけて、鉱山からのタンタル生産はコンゴ民主共和国、ルワンダやその他アフリカ諸国へと大規模に移っている[56]。2017年のタンタル生産国上位は、1位がルワンダで390トン、2位がコンゴ民主共和国で370トン、3位がナイジェリアで190トン、4位がブラジルで100トン、5位が中華人民共和国で95トンの順となっている[57]。将来的なタンタル供給源は、推計されている埋蔵量順に、サウジアラビア、エジプト、グリーンランド、中華人民共和国、モザンビーク、カナダ、オーストラリア、アメリカ合衆国、フィンランド、ブラジルである[58][59]。
長らくタンタルの最大生産国であったオーストラリアでは、最大生産者のタリソン・ミネラルズが西オーストラリア州の南西部のグリーンブッシュおよびピルバラ地区のウドギナという2か所で鉱山を操業している。世界的な金融危機のために、ウドギナ鉱山は2008年末に操業を中止していたが、2011年1月に再開された[60]。再開から1年経たないうちに、タリソン・ミネラルズは「タンタル需要の軟化」とその他の原因を理由として、2012年2月末にタンタル採掘を中断することを発表した[61]。ウドギナではタンタルの鉱物を採掘し、グリーンブッシュにおいてさらに精製が行われてから顧客に売却されている[62]。ニオブの大規模生産国はブラジルやカナダであるが、そうした場所で生産される鉱物からも少ないがタンタルが得られる。他に、中華人民共和国、エチオピア、モザンビークといった場所の鉱山がタンタルの比率の高い鉱物を産出し、世界のタンタル生産量の上位を占めている。また、タイやマレーシアのスズ生産の副産物としてもタンタルが得られる。砂鉱床からの鉱石を重力選鉱する際に、錫石 (SnO2) だけではなく、少ない比率ではあるがタンタル石も含まれてくる。この結果、スズ溶鉱炉から出てくる鉱滓には、経済的に有用な量のタンタルが含まれている[15][63]。
タンタルの年間生産量は、1997年から2001年にかけては純タンタル換算で1,478トンから2,257トン程度であった[48]。現状の生産量で考えれば、タンタルの残存埋蔵量は50年以下であると見積もられており、リサイクルの必要性が高まっていることを示している[64]。
タンタルはコモディティとして市場で取引される商品ではなく、また金属単体での取引も基本的に行われていない。鉱石の形態で、売り手と買い手の直接交渉により値段が決定されている[65]。タンタルの価格は、30パーセントTa2O5の鉱石ベースにして、1ポンド(約454グラム)あたりの価格が雑誌等で掲載されている。1980年代から1990年代にかけて長らく20 - 30ドル程度で推移していたが、2000年以降はIT需要の拡大により高騰と、IT不況による停滞がたびたびあり、2007年末時点では35ドル程度となっている[50]。その後は高騰し、2011年から2012年にかけては1ポンド当たりに換算して120ドルを超える高値で取引されていた[65]。
紛争資源として
[編集]タンタルは紛争鉱物の1種であるとされる。コルンブ石とタンタル石の産業上の名称であるコルタンからはニオブとタンタルが抽出されるが[66]、中部アフリカでも採掘される鉱石であり、コンゴ民主共和国(かつてのザイール)における第二次コンゴ戦争とタンタルが関わってくる理由となっている。2003年10月23日の国連報告によれば[67]、密輸も含めたコルタンの輸出が、第二次世界大戦以来最悪の死者数記録となる、1998年以降だけで約540万人が死んだコンゴにおける戦争を助長しているとされる[68]。コンゴ盆地の武力紛争地帯においてコルタンのような資源を収奪することに伴う、責任ある企業行動、人権、野生生物の危機といった倫理上の問題が問われるようになっている[69][70][71][72]。しかし、コルタンの採掘はコンゴの地域経済にとっては重要であるが、世界のタンタル供給に占める割合は通常は小さい。アメリカ地質調査所の年鑑は、この地域のタンタル生産量は、2002年から2006年にかけての世界のタンタル生産量の1パーセント未満で、2000年と2008年に10パーセントに達したのが最高であるとしている[63]。
「ソリューションズ・フォー・ホープ・タンタルプロジェクト」の目的は、「コンゴ民主共和国から紛争と関係しないタンタルを供給する」ことであるとされている[73]。
用途
[編集]電気・電子機器
[編集]
タンタルの主な用途は、電子機器の製造であり、主にコンデンサ(キャパシタ)や高出力抵抗器などに金属粉末の形態で用いられる。タンタル電解コンデンサは、タンタルが表面に保護酸化被膜を形成する性質を利用し、タンタルの粉末をペレット状の形態に焼き固めたものを一方の極板とし、酸化物 (Ta2O5) を誘電体とし、電解液または伝導性のある固体をもう一方の極板としたものである。誘電体の層が非常に薄くなる(同様のアルミニウム電解コンデンサなどに比べてもかなり薄い)ことから、小容積でも大きな静電容量を実現できる。大きさと重量の利点から、携帯電話、パーソナルコンピュータ、自動車エレクトロニクス、カメラといった用途に適する[74]。
また、表面弾性波フィルター(SAWフィルター)の材料としても用いられる。これは特定の信号波のみを選択的に通すフィルターであり、携帯電話などにおいて決められた送受信周波数以外の周波数成分をカットするために用いられる。電気信号を圧電効果を利用して一旦機械的な振動に変換し、固体表面を伝搬する弾性表面波とした上で、その圧電結晶基盤の上に形成されたパターンの構造により選択的に周波数フィルターを適用し、再び電気信号に変換する仕組みとなっている。このための圧電単結晶としてタンタル酸リチウム (LiTaO3) またはニオブ酸リチウム (LiNbO3) が用いられている[75]。
スパッタリングによって薄膜を形成する際に、ターゲット材(薄膜材料)としてタンタル(五酸化タンタル)を用いることがある[76]。これによって高誘電率・高絶縁耐圧の薄膜形成が行われる[77]。
かつて白熱電球のフィラメントの製造にタンタルが利用されていたことがある。フィラメントは当初炭素(カーボン)のものが使用されていたが、その性能を向上させるために様々な金属フィラメントの開発が行われ、1902年にドイツのジーメンス・ウント・ハルスケの技術者ヴェルナー・フォン・ボルトンがタンタルを利用したフィラメントを開発した。この電球は効率が良く明るく白い光を出すことから好評であった。アメリカのゼネラル・エレクトリックはライセンス生産の権利を買って1910年まで生産しており、ジーメンス自体は1913年まで生産していたが、1904年に発明され1906年に商品化されたタングステンフィラメントを利用した電球がより効率が高く寿命が長かったことから、タンタル電球は時代遅れとなった[78][79][80]。
タンタルは無線送信機の極超短波真空管の製造に広く用いられている。タンタルは、窒化物や酸化物を形成して窒素や酸素を捕獲できるので、グリッドやプレートといった真空管内部の部品に使って、真空管内に必要な高い真空度を維持するためのゲッターとしても利用できる[37][81]。
合金および耐食金属
[編集]タンタルは、高い融点や強度、展延性などを持つ様々な種類の合金を製造するために用いられる。他の金属と合金とすることで、金属加工用の超硬工具を製作したり、ジェットエンジン部品、化学処理装置、原子炉、ミサイル部品、熱交換器、タンクや容器向けの超合金の生産といった目的で用いられる[82][74][83]。展延性が高いことから、細いワイヤやフィラメントをタンタルから作って、アルミニウムのような金属の蒸着処理に用いられる。
タンタルはほとんどの酸に対して不活性であるため、化学反応を行う容器や腐食性流体の配管などに有用な金属である。塩酸を蒸気で熱するための熱交換材はタンタルで作られる[81]。化学工業においてグラスライニングの反応容器等を用いるが、その内面が損傷した場合の補修方法の一つとしてタンタルを使用する場合がある。[84] ただし、フッ化水素酸、熱硫酸、熱アルカリ水溶液などはタンタルを腐食する。
融点が高く酸化耐性があることから、真空炉の部品の生産にタンタルが使われる。また白金坩堝の代用品としてタンタル坩堝が使用されることがある。タンタルは不活性であることから、サーモウェル、バルブ本体、タンタル製締結部品などの腐食耐性のある様々な部品の製造に用いられる。
その他
[編集]
密度の高さから、成型炸薬や自己鍛造弾の内張りがタンタルで作られる[85]。タンタルはその高い密度と融点から、成形炸薬弾の装甲貫徹能力を大いに増進する[86][87]。
またときには、その耐食性と重厚な高級感からオーデマ・ピゲ、ウブロ、モンブラン、オメガ、オフィチーネ・パネライといった高級腕時計、高級宝飾品の製造にも用いられる。
タンタルは体液に耐え、生体に対して不活性で刺激性が少ないため、外科用医療用具や人体埋め込み材(インプラント材)などの製作に広く用いられる。たとえば、タンタルは硬組織に直接接着する能力が高いことから、多孔性のタンタルコーティングが整形外科用の埋め込み物の製作に用いられる[88][89]。タンタルは剛性が高いことから、応力遮蔽を避けるために、多孔質発泡体や低い剛性の骨格の形態で人工股関節置換術に用いられる[90]。タンタルは非鉄・非磁性の金属であるので、こうしたインプラント材を埋め込まれた患者も核磁気共鳴画像法 (MRI) の検査を受けられるとされている[91]。
またタンタル酸化物は、カメラのレンズ用に特別に高い屈折率のガラスを作るために用いられる[92]。
環境問題
[編集]タンタルは地球科学からの関心に比べて、環境分野ではほとんど関心を持たれていない。上部地殻でのタンタル濃度や地殻あるいは鉱物におけるニオブ/タンタル比率の計測は地球化学的な道具として有用であるため、値が計測されている[93]。2008年時点で最新の上部地殻でのタンタル濃度は0.92 ppmで、ニオブ/タンタル比は12.7である[94]。
環境中の様々な場所におけるタンタルの濃度に関する情報はあまりなく、特に自然の海水や淡水に溶けているタンタルの濃度に関する信頼性のあるデータが得られたことはない[95]。海水中に溶けているタンタルの濃度に関する値がいくつか発表されているが、それらには矛盾がある。淡水中の値に関しても海水の測定値に比べいくらかましであるにすぎないが、しかし自然の水中における溶解濃度は現在の分析能力の限界未満であることから、おそらく1リットル当たり1ナノグラムを下回っていると考えられている[96]。分析には予備濃縮法を用いる必要があるが、今のところは一貫性のある結果とならない。そしていずれにせよ、タンタルは自然界の水の中では溶けているというよりはほぼ微粒子の状態で存在しているものと思われる[95]。
土壌、河床堆積物、大気エーロゾルなどに含まれる濃度の値はより容易に入手できる[95]。土壌中の濃度はほぼ1 ppmであり、地殻中のタンタル濃度である。これは砕岩質に由来することを示唆している。大気エーロゾルに含まれる値はさまざまであり、また限られている。タンタルの濃縮が観測される場合は、雲の中のエーロゾルの水により溶ける物質が失われたことによるものであろう[97]。
人間がタンタルを利用していることに伴う汚染が発見されたことはない[98]。生物地球化学的にはタンタルは非常に変化の少ないものだと思われるが、その循環や反応性についてはいまだ完全に理解されているとは言えない。
人体への危険性
[編集]タンタルは生体適合性が高く[89]、また化学的に安定で体液とも反応しにくいために人体への害は少ないと見られている[2]。むしろ、医療材料として体内に埋め込んだ場合などは、タンタルよりも医療材料に使用されている他の元素や化合物の性質に注意が向けられる[99]。
職場においては、吸入、皮膚への接触、眼球への接触といった形でタンタルに人体が暴露される可能性がある。アメリカの労働安全衛生局は、職場におけるタンタル暴露の法的限界(許容暴露限界)を1日8時間労働に対して5 mg/m3と設定している。アメリカ国立労働安全衛生研究所では、推奨される暴露限度として、1日8時間労働に対しては5 mg/m3、短期限界として10 mg/m3を設定している。2,500 mg/m3に達すると、タンタルは生命または健康に対する差し迫った危険であるとされる[100]。
脚注
[編集]- ^ a b 桜井 弘 編 『元素111の新知識』 p.302 講談社 (ブルーバックス B1192) 1997年10月20日発行 ISBN 4-06-257192-7
- ^ a b c d e 桜井 弘 編 『元素118の新知識』 p.330 講談社 (ブルーバックス B2028) 2017年8月20日発行 ISBN 978-4-06-502028-9
- ^ 久保田 晴寿、桜井 弘 編著 『無機医薬品化学(第3版)』 p.13 廣川書店 1997年3月15日発行 ISBN 4-567-46054-5
- ^ doi:10.1107/S0567740873004140
- ^ Magnetic susceptibility of the elements and inorganic compounds Archived 2004年3月24日, at the Wayback Machine., in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ a b http://www.mindat.org
- ^ グリーンウッド, ノーマン; アーンショウ, アラン (1997). Chemistry of the Elements (英語) (2nd ed.). バターワース=ハイネマン. p. 1138. ISBN 978-0-08-037941-8。
- ^ Ekeberg, Anders (1802). “Of the Properties of the Earth Yttria, compared with those of Glucine; of Fossils, in which the first of these Earths in contained; and of the Discovery of a metallic Nature (Tantalium)”. Journal of Natural Philosophy, Chemistry, and the Arts 3: 251–255.
- ^ Ekeberg, Anders (1802). “Uplysning om Ytterjorden egenskaper, i synnerhet i aemforelse med Berylljorden:om de Fossilier, havari förstnemnde jord innehales, samt om en ny uptäckt kropp af metallik natur”. Kungliga Svenska vetenskapsakademiens handlingar 23: 68–83.
- ^ Griffith, William P.; Morris, Peter J. T. (2003). “Charles Hatchett FRS (1765–1847), Chemist and Discoverer of Niobium”. Notes and Records of the Royal Society of London 57 (3): 299. doi:10.1098/rsnr.2003.0216. JSTOR 3557720.
- ^ Wollaston, William Hyde (1809). “On the Identity of Columbium and Tantalum”. Philosophical Transactions of the Royal Society of London 99: 246–252. doi:10.1098/rstl.1809.0017. JSTOR 107264.
- ^ Rose, Heinrich (1844). “Ueber die Zusammensetzung der Tantalite und ein im Tantalite von Baiern enthaltenes neues Metall” (German). Annalen der Physik 139 (10): 317–341. Bibcode: 1844AnP...139..317R. doi:10.1002/andp.18441391006.
- ^ Rose, Heinrich (1847). “Ueber die Säure im Columbit von Nordamérika” (German). Annalen der Physik 146 (4): 572–577. Bibcode: 1847AnP...146..572R. doi:10.1002/andp.18471460410.
- ^ a b Marignac, Blomstrand; H. Deville; L. Troost; R. Hermann (1866). “Tantalsäure, Niobsäure, (Ilmensäure) und Titansäure”. Fresenius' Journal of Analytical Chemistry 5 (1): 384–389. doi:10.1007/BF01302537.
- ^ a b c Gupta, C. K.; Suri, A. K. (1994). Extractive Metallurgy of Niobium. CRC Press. ISBN 0-8493-6071-4
- ^ Marignac, M. C. (1866). “Recherches sur les combinaisons du niobium” (French). Annales de chimie et de physique 4 (8): 7–75.
- ^ Hermann, R. (1871). “Fortgesetzte Untersuchungen über die Verbindungen von Ilmenium und Niobium, sowie über die Zusammensetzung der Niobmineralien (Further research about the compounds of ilmenium and niobium, as well as the composition of niobium minerals)” (German). Journal für Praktische Chemie 3 (1): 373–427. doi:10.1002/prac.18710030137.
- ^ “Niobium”. Universidade de Coimbra. 2008年9月5日閲覧。
- ^ Bowers, B. (2001). “Scanning Our Past from London The Filament Lamp and New Materials”. Proceedings of the IEEE 89 (3): 413. doi:10.1109/5.915382.
- ^ Colakis, Marianthe; Masello, Mary Joan (2007-06-30). “Tantalum”. Classical Mythology & More: A Reader Workbook. ISBN 978-0-86516-573-1
- ^ Lee, S.; Doxbeck, M.; Mueller, J.; Cipollo, M.; Cote, P. (2004). “Texture, structure and phase transformation in sputter beta tantalum coating”. Surface and Coatings Technology 177–178: 44. doi:10.1016/j.surfcoat.2003.06.008.
- ^ 足立 吟也、南 努『現代無機材料科学』化学同人、2007年1月1日、179 - 180頁。ISBN 978-4759810745。
- ^ “絶対零度付近で初の超伝導”. Nature Japan K.K. (2011年5月23日). 2018年10月3日閲覧。
- ^ Hult, Mikael; Wieslander, J. S. Elisabeth; Marissens, Gerd; Gasparro, Joël; Wätjen, Uwe; Misiaszek, Marcin (2009). “Search for the radioactivity of 180mTa using an underground HPGe sandwich spectrometer”. Applied Radiation and Isotopes 67 (5): 918–921. doi:10.1016/j.apradiso.2009.01.057 23 September 2014閲覧。.
- ^ Georges, Audi; Bersillon, O.; Blachot, J.; Wapstra, A. H. (2003). “The NUBASE Evaluation of Nuclear and Decay Properties”. Nuclear Physics A (Atomic Mass Data Center) 729: 3–128. Bibcode: 2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- ^ Win, David Tin; Al Masum, Mohammed (2003). “Weapons of Mass Destruction” (PDF). Assumption University Journal of Technology 6 (4): 199–219.
- ^ https://mis.triumf.ca/science/planning/yield/target/Ta
- ^ “Tantalum”. Encyclopædia Britannica. 2018年9月30日閲覧。
- ^ 久保田 晴寿、桜井 弘 編著 『無機医薬品化学(第3版)』 p.18 廣川書店 1997年3月15日発行 ISBN 4-567-46054-5
- ^ a b c d Housecroft, Catherine E.、Sharpe, A. G『ハウスクロフト無機化学』 (下)、巽 和行、西原 寛、穐田 宗隆、酒井 健 監訳(原著第3版)、東京化学同人、2012年、741-746頁。ISBN 978-4-8079-0778-6。
- ^ a b 新村 陽一『無機化学』朝倉書店、1984年、187-189頁。ISBN 4-254-14025-8。
- ^ a b グリーンウッド, ノーマン; アーンショウ, アラン (1997). Chemistry of the Elements (英語) (2nd ed.). バターワース=ハイネマン. pp. 976–1001. ISBN 978-0-08-037941-8。
- ^ 「タンタル酸塩」『標準化学用語辞典』日本化学会 編(第2版)、丸善出版、2005年。ISBN 978-4-621-07531-9。
- ^ 宮脇 律郎「新種鉱物の記載と結晶構造」『日本結晶学会誌』第53巻第1号、2011年、58-63頁、doi:10.5940/jcrsj.53.58。
- ^ Tsukimoto, S.; Moriyama, M.; Murakami, Masanori (1961). “Microstructure of amorphous tantalum nitride thin films”. Thin Solid Films 460 (1–2): 222–226. Bibcode: 2004TSF...460..222T. doi:10.1016/j.tsf.2004.01.073.
- ^ Holleman, A. F.; Wiberg, E.; Wiberg, N. (2007) (German). Lehrbuch der Anorganischen Chemie (102nd ed.). de Gruyter. ISBN 978-3-11-017770-1
- ^ a b Soisson, Donald J.; McLafferty, J. J.; Pierret, James A. (1961). “Staff-Industry Collaborative Report: Tantalum and Niobium”. Ind. Eng. Chem. 53 (11): 861–868. doi:10.1021/ie50623a016.
- ^ 「タンタル化合物」『岩波理化学辞典』(第5版CD-ROM版)岩波書店、1999年。ISBN 4-00-130102-4。
- ^ 「有機タンタル錯体」『有機金属化合物・超分子錯体』 21巻、日本化学会 編(第5版)、丸善出版〈実験化学講座〉、2004年、99-107頁。ISBN 4621073206。
- ^ Schrock, Richard R. (1979-03-01). “Alkylidene complexes of niobium and tantalum”. Accounts of Chemical Research 12 (3): 98–104. doi:10.1021/ar50135a004. ISSN 0001-4842.
- ^ Morse, P. M.; Shelby, Q. D.; Kim, D. Y.; Girolami, G. S. (2008). “Ethylene Complexes of the Early Transition Metals: Crystal Structures of [HfEt4(C2H4)2−] and the Negative-Oxidation-State Species [TaHEt(C2H4)3−
3] and [WH(C2H4)3−
4]”. Organometallics 27 (5): 984. doi:10.1021/om701189e. - ^ “WebElements Periodic Table Tantalum”. WebElements. 2018年9月30日閲覧。
- ^ “Abundance in the Universe of the elements”. periodictable.com. 2018年9月30日閲覧。
- ^ a b 梶野敏貴、早川岳人、千葉敏「太陽系で最も希少な同位体タンタル180の起源は超新星爆発のニュートリノ」(PDF)『国立天文台ニュース』第204号、2010年7月、3 - 5頁、2018年9月30日閲覧。
- ^ “Why is tantalum the least abundant stable element in the universe?”. Quora. 2018年9月30日閲覧。
- ^ Emsley, John (2001). “Tantalum”. Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. p. 420. ISBN 0-19-850340-7
- ^ Agulyansky, Anatoly (2004). The Chemistry of Tantalum and Niobium Fluoride Compounds. Elsevier. ISBN 978-0-444-51604-6 2008年9月2日閲覧。
- ^ a b c 石原 舜三「タンタル資源とオーストラリアのグリーンブッシュ ペグマタイト見学記」(PDF)『地質ニュース』第658号、産業技術総合研究所、2009年6月、72 - 80頁、2018年9月30日閲覧。
- ^ U.S. Geological Survey Archived 2013-06-04 at the Wayback Machine.
- ^ a b c d e f 南 博志「タンタルの需要・供給・価格動向等」(PDF)『金属資源レポート』、独立行政法人石油天然ガス・金属鉱物資源機構、2008年1月、79 - 84頁、2018年9月30日閲覧。
- ^ a b Zhaowu Zhu; Chu Yong Cheng (2011). “Solvent extraction technology for the separation and purification of niobium and tantalum: A review”. Hydrometallurgy 107: 1–12. doi:10.1016/j.hydromet.2010.12.015.
- ^ Agulyanski, Anatoly (2004). Chemistry of Tantalum and Niobium Fluoride Compounds (1st ed.). Burlington: Elsevier. ISBN 9780080529028
- ^ a b 門 智「ニオブ・タンタルの製錬・用途およびその開発状況」『日本鉱業会誌』第100巻第1152号、資源・素材学会、1984年2月、28 - 38頁、doi:10.2473/shigentosozai1953.100.1152_142。
- ^ “Manufacturing metals: A tantalising prospect”. The Economist. (2013年2月16日) 2013年4月17日閲覧。
- ^ “NFPA 484 – Standard for Combustible Metals, Metal Powders, and Metal Dusts – 2002 Edition”. National Fire Protection Association. NFPA (2002年8月13日). 2016年2月12日閲覧。
- ^ “Shift in Global Tantalum Mine Production, 2000–2014”. U.S. Geological Survey (2015年). 2018年9月30日閲覧。
- ^ “Minerals commodity survey 2018 Tantalum” (PDF). United States Geological Survey (2018年). 2018年10月3日閲覧。
- ^ M. J. (November 2007). “Tantalum supplement” (PDF). Mining Journal 2008年6月3日閲覧。.
- ^ “International tantalum resources — exploration and mining” (PDF). GSWA Mineral Resources Bulletin 22 (10). オリジナルの2007-09-26時点におけるアーカイブ。.
- ^ “Talison Tantalum eyes mid-2011 Wodgina restart 2010-06-09”. Reuters. (2010年6月9日) 2010年8月27日閲覧。
- ^ Emery, Kate (24 Jan 2012). “GAM closes Wodgina tantalum mine”. The West Australian. オリジナルの4 December 2012時点におけるアーカイブ。 20 March 2012閲覧. "Worldwide softening tantalum demand and delays in receiving Governmental approval for installation of necessary crushing equipment are among contributing factors in this decision"
- ^ “Wodgina Operations”. Global Advanced Metals (2008年). 2011年3月28日閲覧。
- ^ a b Papp, John F. (2006年). “2006 Minerals Yearbook Nb & Ta”. US Geological Survey. 2008年6月3日閲覧。
- ^ “How much is left?”. 2013年1月13日閲覧。
- ^ a b “Tantalum Price - Metalary”. Metalary. 2018年10月2日閲覧。
- ^ Tantalum-Niobium International Study Center: Coltan Retrieved 2008-01-27
- ^ “S/2003/1027” (2003年10月26日). 2008年4月19日閲覧。
- ^ “Special Report: Congo”. International Rescue Committee. 2008年4月19日閲覧。
- ^ Hayes, Karen; Burge, Richard. Coltan Mining in the Democratic Republic of Congo: How tantalum-using industries can commit to the reconstruction of the DRC. 1–64. ISBN 1-903703-10-7
- ^ Dizolele, Mvemba Phezo (January 6, 2011). “Congo's Bloody Coltan”. Pulitzer Center on Crisis Reporting. 2009年8月8日閲覧。
- ^ “Congo War and the Role of Coltan”. 2009年7月13日時点のオリジナルよりアーカイブ。2009年8月8日閲覧。
- ^ “Coltan mining in the Congo River Basin”. 2009年3月30日時点のオリジナルよりアーカイブ。2009年8月8日閲覧。
- ^ “‘Solutions for Hope’ Tantalum Project Offers Solutions and Brings Hope to the People of the DRC”. Solutions Network. 18 September 2014閲覧。
- ^ a b “Commodity Report 2008: Tantalum” (PDF). United States Geological Survey. 2008年10月24日閲覧。
- ^ 「SAWフィルター」(PDF)『セラミックス』第41巻第8号、日本セラミックス協会、2006年8月、627 - 628頁。
- ^ “スパッタリングターゲット材”. 2018年10月4日閲覧。
- ^ 藤川久喜、野田浩司、多賀康訓「Ta2O5系高誘電率絶縁膜の作成」(PDF)『豊田中央研究所R&Dレビュー』第30巻第4号、1995年12月、13 - 23頁。
- ^ 石﨑 有義 (2011年). “白熱電球の技術の系統化調査” (PDF). 産業技術史資料情報センター. 2018年10月1日閲覧。
- ^ “GE Tantalum Filament 25W of American Design”. Museum of Electric Lamp Technology. 2018年10月1日閲覧。
- ^ “Incandescent - Tantalum Filament”. Museum of Electric Lamp Technology. 2018年10月1日閲覧。
- ^ a b Balke, Clarence W. (1935). “Columbium and Tantalum”. Industrial and Engineering Chemistry 20 (10): 1166. doi:10.1021/ie50310a022.
- ^ “Tantalum Products: Tantalum Sheet & Plate | Admat Inc” (英語). Admat Inc. 2018年8月28日閲覧。
- ^ Buckman Jr., R. W. (2000). “New applications for tantalum and tantalum alloys”. JOM Journal of the Minerals, Metals and Materials Society 52 (3): 40. Bibcode: 2000JOM....52c..40B. doi:10.1007/s11837-000-0100-6.
- ^ “タンタル補修”. 株式会社神鋼環境ソリューション. 2022年4月28日閲覧。
- ^ Nemat-Nasser, Sia; Isaacs, Jon B.; Liu, Mingqi (1998). “Microstructure of high-strain, high-strain-rate deformed tantalum”. Acta Materialia 46 (4): 1307. doi:10.1016/S1359-6454(97)00746-5.
- ^ Walters, William; Cooch, William; Burkins, Matthew; Burkins, Matthew (2001). “The penetration resistance of a titanium alloy against jets from tantalum shaped charge liners”. International Journal of Impact Engineering 26: 823. doi:10.1016/S0734-743X(01)00135-X.
- ^ Russell, Alan M.; Lee, Kok Loong (2005). Structure-property relations in nonferrous metals. Hoboken, NJ: Wiley-Interscience. p. 218. ISBN 978-0-471-64952-6
- ^ Cohen, R.; Della Valle, C. J.; Jacobs, J. J. (2006). “Applications of porous tantalum in total hip arthroplasty”. Journal of the American Academy of Orthopaedic Surgeons 14 (12): 646–55. PMID 17077337.
- ^ a b Gerald L. Burke (1940). “The Corrosion of Metals in Tissues; and An Introduction to Tantalum”. Canadian Medical Association Journal 43.
- ^ Black, J. (1994). “Biological performance of tantalum”. Clinical Materials 16 (3): 167–173. doi:10.1016/0267-6605(94)90113-9. PMID 10172264.
- ^ Paganias, Christos G.; Tsakotos, George A.; Koutsostathis, Stephanos D.; Macheras, George A. (2012). “Osseous integration in porous tantalum implants”. Indian Journal of Orthopaedics 46 (5): 505. doi:10.4103/0019-5413.101032. ISSN 0019-5413. PMID 23162141.
- ^ Musikant, Solomon (1985). “Optical Glass Composition”. Optical Materials: An Introduction to Selection and Application. CRC Press. p. 28. ISBN 978-0-8247-7309-0
- ^ Green, TH. (1995). “Significance of Nb/Ta as an indicator of geochemical processes in the crust-mantle system”. Chemical Geology 120: 347. Bibcode: 1995ChGeo.120..347G. doi:10.1016/0009-2541(94)00145-X.
- ^ Hu, Z.; Gao, S. (2008). “Upper crustal abundances of trace elements: a revision and update”. Chemical Geology 253: 205. Bibcode: 2008ChGeo.253..205H. doi:10.1016/j.chemgeo.2008.05.010.
- ^ a b c Filella, M. (2017). “Tantalum in the environment”. Earth-Science Reviews 173: 122.
- ^ Filella, M.; Rodushkin, I. (2018). “A concise guide for the determination of less-studied technology-critical elements (Nb, Ta, Ga, In, Ge, Te) by inductively coupled plasma mass spectrometry in environmental samples”. Spectrochimica Acta Part B 141: 80.
- ^ Vlastelic, I.; Suchorski, K.; Sellegri, K.; Colomb, A.; Nauret, F.; Bouvier, L.; Piro, J-L. (2015). “The high field strength element budget of atmospheric aerosols (puy de Dôme, France)”. Geochimica et Cosmochimica Acta 167: 253. Bibcode: 2015GeCoA.167..253V. doi:10.1016/j.gca.2015.07.006.
- ^ Filella, M.; Rodríguez-Murillo, JC. (2017). “Less-studied TCE: are their environmental concentrations increasing due to their use in new technologies?”. Chemosphere 182: 605.
- ^ Matsuno H; Yokoyama A; Watari F; Uo M; Kawasaki T. (2001). “Biocompatibility and osteogenesis of refractory metal implants, titanium, hafnium, niobium, tantalum and rhenium. Biocompatibility of tantalum.”. Biomaterials 22 (11): 1253–62. doi:10.1016/S0142-9612(00)00275-1. PMID 11336297.
- ^ “CDC – NIOSH Pocket Guide to Chemical Hazards – Tantalum (metal and oxide dust, as Ta)”. www.cdc.gov. 2015年11月24日閲覧。
外部リンク
[編集]- 国際化学物質安全性カード タンタル (ICSC:1596) 日本語版(国立医薬品食品衛生研究所による), 英語版
- 職場の安全サイト タンタル 厚生労働省
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| |||||||||||||||||||||||||||||||||


![{\displaystyle {\ce {Ta2O5 + 14 HF -> 2H2[TaF7] + 5H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5202bb026785237e7710894ae74ee2ae10573ac6)
![{\displaystyle {\ce {Nb2O5 + 12HF -> 2H[NbF6] + 5H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3fd9b6d17c468867370ee57de9eee74b11185604)
![{\displaystyle {\ce {H2[TaF7] + 2KF -> K2[TaF7] + 2HF}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b2ae7723a91daaa25802b71e024de5ba3f80dc20)
![{\displaystyle {\ce {K2[TaF7] + 5Na -> Ta + 5NaF + 2KF}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e515e23258e08d017907119a9e3f6f83a7a316fb)