「細胞核」の版間の差分
m編集の要約なし |
m されいない → されていない |
||
| (2人の利用者による、間の3版が非表示) | |||
| 4行目: | 4行目: | ||
(5) [[クロマチン]] (6) '''細胞核''' (7) [[小胞体]] (8) [[核質]]]] |
(5) [[クロマチン]] (6) '''細胞核''' (7) [[小胞体]] (8) [[核質]]]] |
||
'''細胞核'''(さいぼうかく、{{lang-en-short|cell nucleus}})とは、[[真核生物]]の[[細胞]]を構成する[[細胞小器官]]のひとつ。細胞の遺伝情報の保存と伝達を行い、ほぼすべての細胞に存在する。通常は単に'''核'''ということが多い。 |
'''細胞核'''(さいぼうかく、{{lang-en-short|cell nucleus}})とは、[[真核生物]]の[[細胞]]を構成する[[細胞小器官]]のひとつ。細胞の遺伝情報の保存と伝達を行い、ほぼすべての細胞に存在する。通常は単に'''核'''ということが多い。 |
||
細胞核は細胞の遺伝物質の大部分を含んでおり、複数の長い直鎖状の[[デオキシリボ核酸|DNA]]分子がさまざまな種類の[[タンパク質]] ([[ヒストン]]など) と複合体を形成することで、[[染色体]]が形成されている。これらの染色体の内部の[[遺伝子]]が核[[ゲノム]]を構成しており、細胞の機能を促進するよう構造化されている。核は遺伝子の完全性を維持し、[[遺伝子発現の調節]]により細胞の活動を制御する。すなわち、核は細胞のコントロールセンターである。核を作り上げている主要な構造は[[核膜]]と{{仮リンク|核マトリックス|en|Nuclear matrix}}である。核膜は核全体を包む2層の脂質二重膜で、その内容物を[[細胞質]]から分離している。核マトリックス ({{仮リンク|核ラミナ|en|Nuclear lamina}}もこれに含まれる) は核内部のネットワーク構造で、細胞を支える[[細胞骨格]]のように、核構造の機械的支持を行っている。 |
|||
巨大な分子は核膜を透過できないので、核膜を越える輸送の調節には[[核膜孔]]が必要とされる。孔は二重膜を貫通しており、[[輸送タンパク質]]による[[能動輸送]]を必要とする巨大分子が通過するためのチャネルとなっている一方、低分子や[[イオン]]は自由に移動する。タンパク質や[[リボ核酸|RNA]]などの巨大分子の孔を通っての移動は、[[遺伝子発現]]と染色体の維持の両方のプロセスに必要とされる。核の内部には膜結合性の小区画は存在しないが、その内容物が一様であるわけではなく、特定のタンパク質、RNA分子、染色体の特定の部分から構成される、多数の核内構造体が存在する。最もよく知られているのは[[核小体]]で、主に[[リボソーム]]の組み立てに関与している。リボソームは核小体で合成された後、細胞質へ輸送されて[[伝令RNA|mRNA]]の[[翻訳 (生物学)|翻訳]]を行う。 |
|||
== 歴史 == |
== 歴史 == |
||
[[File:Leeuwenhoek1719RedBloodCells.jpg|thumb|left|upright=1.5|細胞と細胞核を描いた最古の例とされる[[アントニ・ファン・レーウェンフック]]による描画、1719年。]] |
|||
[[オーストリア]]の植物画家[[フランツ・バウアー]]によって[[1802年]]に発見された。[[イギリス]]の[[植物学者]][[ロバート・ブラウン]](Robert Brown、[[1773年]][[12月21日]] - [[1858年]][[6月10日]])により[[1831年]]に再発見され、[[ロンドン・リンネ協会]]に説明された。 |
|||
[[Image:Flemming1882Tafel1Fig14.jpg|thumb|1882年に出版された、[[ヴァルター・フレミング]]による[[ユスリカ]]の[[唾液腺]]細胞の描画。核には{{仮リンク|多糸染色体|en|Polytene chromosome}}が含まれている。 |
|||
]] |
|||
核は最初に発見された[[細胞小器官]]である。現存する最古の描画はおそらく、初期の顕微鏡学者であった[[アントニ・ファン・レーウェンフック]] (1632–1723) によるものである。彼は[[サケ]]の[[赤血球]]細胞の中に "lumen" を観察した<ref name=":2">Leeuwenhoek, A. van: Opera Omnia, seu Arcana Naturae ope exactissimorum Microscopiorum detecta, experimentis variis comprobata, Epistolis ad varios illustres viros. J. Arnold et Delphis, A. Beman, Lugdinum Batavorum 1719–1730. Cited after: Dieter Gerlach, Geschichte der Mikroskopie. [[Verlag Harri Deutsch]], Frankfurt am Main, Germany, 2009. {{ISBN|978-3-8171-1781-9}}.</ref>。哺乳類とは異なり、他の脊椎動物の赤血球は核を持っている。 |
|||
また、核は[[オーストリア]]の植物画家[[フランツ・バウアー]]によって1802年<ref>{{Cite journal|last=Pederson|first=Thoru|date=2011-05-01|title=The nucleus introduced|url=https://www.ncbi.nlm.nih.gov/pubmed/20660024|journal=Cold Spring Harbor Perspectives in Biology|volume=3|issue=5|doi=10.1101/cshperspect.a000521|issn=1943-0264|pmid=20660024|pmc=PMC3101846}}</ref>または1804年<ref name="Harris">{{cite book|last=Harris|first=H|title=The Birth of the Cell|edition=|year=1999|publisher=Yale University Press|isbn=0-300-07384-4|location=New Haven}}</ref>に記述された。[[イギリス]]の[[植物学者]][[ロバート・ブラウン]](Robert Brown、[[1773年]][[12月21日]] - [[1858年]][[6月10日]])により1831年に再発見され、[[ロンドン・リンネ協会]]で発表された。ブラウンは顕微鏡下で[[ラン科|ラン]]の研究をしている際、花の外層の細胞に不透明な領域を発見し、それを"areola"または"nucleus"と名付けた<ref name="Robert Brown">{{cite journal|last=Brown|first=Robert|year=1866|title=On the Organs and Mode of Fecundation of Orchidex and Asclepiadea|journal=Miscellaneous Botanical Works I|volume=|pages=511–514}}</ref>。 |
|||
ブラウンはその領域の機能については示唆しなかったが、1838年に[[マティアス・ヤーコプ・シュライデン]]は、核が細胞を生成する役割を持つと提唱し、"cytoblast"という名称を導入した。彼は、新しい細胞が"cytoblast"の周辺に集まっているのを観察したと信じていた。[[フランツ・ユリウス・フェルディナント・マイエン]]はこの見方の強固な反対者で、細胞が分裂によって増殖することをすでに記述しており、多くの細胞は核を持たないと信じていた。"cytoblast"か何かによって細胞が「新たに」生じるという考えは、「全ての細胞は細胞から生じる」("Omnis cellula e cellula") という新たなパラダイムを決定的に広めた、[[ロベルト・レーマク]] (1852) と[[ルドルフ・ルートヴィヒ・カール・フィルヒョウ]] (1855) の業績とも矛盾していた。核の機能は依然不明なままであった<ref name="Cremer">{{cite book|last=Cremer|first=Thomas|title=Von der Zellenlehre zur Chromosomentheorie|edition=|year=1985|publisher=Springer Verlag|isbn=3-540-13987-7|location=Berlin, Heidelberg, New York, Tokyo}} Online Version [http://www.t-cremer.de/main_de/cremer/personen/info_T_Cremer.htm#book here]</ref>。 |
|||
1877年から1878年の間に、{{仮リンク|オスカー・ヘルトヴィヒ|en|Oscar Hertwig}}は[[ウニ]]の卵の[[孵化]]に関するいくつかの研究を発表し、[[精子]]の核が[[卵母細胞]]に進入し、その核と融合することを示した。これは、個体が1個の有核細胞から発生することを初めて示唆したものであった。またこれは、種の系統発生は胚の発生中に完全に反復され、原始的な粘液体 ("Urschleim") の構造化されていない塊 ("monerula") から最初の有核細胞が発生する、としていた[[エルンスト・ヘッケル]]の理論と矛盾するものであった。しかし、ヘルトヴィヒは[[両生類]]や[[軟体動物]]など、他の動物群を用いて自身の観察を確証した。[[エードゥアルト・シュトラースブルガー|エドゥアルト・シュトラスブルガー]]は、1884年に植物でも同じ結果を得た。ここから、遺伝における重要な役割を核へ割り当てる道が開かれた。1873年に[[アウグスト・ヴァイスマン]]は、遺伝に関しては母系と父系の[[生殖細胞]]が等価であると予想した。核の遺伝情報の保持機能は、[[有糸分裂]]が発見され、[[メンデルの法則]]が20世紀の初めに再発見されるまで明らかにされなかった。その後、遺伝の[[染色体説]]が発展した<ref name="Cremer" />。 |
|||
== 構造 == |
== 構造 == |
||
[[Image:HeLa Hoechst 33258.jpg|thumb|350px|right|{{仮リンク|ヘキスト染色|en|Hoechst stain}}によって核のDNAが染色された[[HeLa細胞]]。中央と右の細胞は[[細胞周期|間期]]にあり、各全体が標識されている。左の細胞は[[有糸分裂]]の最中であり、DNAが濃縮している。]]通常、核は細胞に1つある(例外は後述)。核は動物細胞で最大の細胞小器官である<ref name="Lodish">{{cite book|last=Lodish|first=H|title=Molecular Cell Biology|edition=5th|year=2004|publisher=WH Freeman|isbn=0-7167-2672-6|location=New York|author2=Berk A|author3=Matsudaira P|author4=Kaiser CA|author5=Krieger M|author6=Scott MP|author7=Zipursky SL|author8=Darnell J.}}</ref>。哺乳類の細胞では、核の直径は約 6 µm であり、細胞の総体積の約10%を占める<ref name="MBoC">{{cite book|title=Molecular Biology of the Cell, Chapter 4, pages 191–234|edition=4th|year=2002|publisher=Garland Science|editor1=Bruce Alberts|editor2=Alexander Johnson|editor3=Julian Lewis|editor4=Martin Raff|editor5=Keith Roberts|editor6=Peter Walter}}</ref>。核の内部の粘性の液体は[[核質]]と呼ばれ、その組成は核外の[[細胞質基質]]と類似している<ref name=":3">{{cite journal|author=Clegg JS|date=February 1984|title=Properties and metabolism of the aqueous cytoplasm and its boundaries|url=http://ajpregu.physiology.org/cgi/pmidlookup?view=reprint&pmid=6364846|journal=Am. J. Physiol.|volume=246|issue=2 Pt 2|pages=R133–51|pmid=6364846}}</ref>。外観は、濃密で球形または不定形の細胞小器官である。ある種の[[白血球]]細胞、特に[[顆粒球]]では、核には切れ込み ([[:en:Lobation|lobation]]) が入っており、二裂、三裂、または多数に分裂した形で存在する。 |
|||
通常、核は細胞に1つある(例外は後述)。また核内には1つ以上の[[核小体]]がある。細胞の他の部分([[細胞質]])とは、[[核膜]]と呼ばれる2層の脂質二重膜によって隔てられており、核と細胞質間で物質輸送が行われるときには、核膜に空いた多くの穴([[核膜孔]])を通って行われる場合が多い。核内には遺伝情報である[[デオキシリボ核酸|DNA]]のほか、[[核タンパク質]]、RNA([[リボ核酸]])が含まれており、DNAの遺伝情報は核で[[リボ核酸|RNA]]に転写される。[[細胞分裂]]時には、核内のDNAは凝集し、[[染色体]]と呼ばれる棒状の構造をとり、細胞分裂後の2つの細胞に分かれて移動する。このとき、核の表面は二重の核膜で包まれる。その後、それぞれの細胞では、再び核が形成され、染色体が消失、DNAが核内に広がる。 |
|||
また、核内には1つ以上の[[核小体]]がある。細胞の他の部分([[細胞質]])とは、[[核膜]]と呼ばれる2層の脂質二重膜によって隔てられており、核と細胞質間で物質輸送が行われるときには、核膜に空いた多くの穴([[核膜孔]])を通って行われる場合が多い。核内には遺伝情報である[[デオキシリボ核酸|DNA]]のほか、[[核タンパク質]]、RNA([[リボ核酸]])が含まれており、DNAの遺伝情報は核で[[リボ核酸|RNA]]に転写される。[[細胞分裂]]時には、核内のDNAは凝集し、[[染色体]]と呼ばれる棒状の構造をとり、細胞分裂後の2つの細胞に分かれて移動する。このとき、核の表面は二重の核膜で包まれる。その後、それぞれの細胞では、再び核が形成され、染色体が消失、DNAが核内に広がる。 |
|||
核内には、糸状に連なったDNA分子が結合蛋白質と複合体を構成しながら散らばっており、'''[[クロマチン]](chromatin)'''あるいは'''染色質'''と呼ばれる。染色質の名前は、[[ヘマトキシリン・エオシン染色|ヘマトキシリン染色]]などの染色を施した細胞を[[光学顕微鏡]]で観察すると、核内が濃く染色されることに由来する。クロマチンは大きく2種類に分けられる。 |
|||
核内には、糸状に連なったDNA分子が結合蛋白質と複合体を構成しながら散らばっており、'''[[クロマチン]](chromatin)'''あるいは'''染色質'''と呼ばれる。染色質の名前は、[[ヘマトキシリン染色]]などの染色をした細胞を[[光学顕微鏡]]で観察すると、核内が濃く染色されることから、クロマチンは大きく2種類に分けられる。 |
|||
* ユークロマチン(euchromatin)、あるいは真正染色質 - RNA転写活性が高く、DNAがよく広がり、多種の蛋白質と共存する部位 |
* ユークロマチン(euchromatin)、あるいは真正染色質 - RNA転写活性が高く、DNAがよく広がり、多種の蛋白質と共存する部位 |
||
* ヘテロクロマチン(heterochromatin)、あるいは異質染色質 - 遺伝子発現が不活性化され、DNAと結合蛋白質の複合体は凝集されたままの状態になっている部位 |
* ヘテロクロマチン(heterochromatin)、あるいは異質染色質 - 遺伝子発現が不活性化され、DNAと結合蛋白質の複合体は凝集されたままの状態になっている部位 |
||
=== 核膜と核膜孔 === |
|||
{{Main|核膜|核膜孔}} |
|||
[[Image:Diagram human cell nucleus.svg|thumb|280px|right|[[真核生物]]の細胞核。[[リボソーム]] Ribosomes が点在する[[核膜]] Nuclear envelope の二重の脂質膜、DNA ([[クロマチン]] Chromatin)、[[核小体]] Nucleolus が示されている。核の内部は[[核質]] Nucleoplasm と呼ばれる、核外の[[細胞質基質]]と似た粘性の液体である。]] |
|||
[[Image:NuclearPore crop.svg|thumb|right|250px|[[核膜]]表面の[[核膜孔]]の断面図。(1) 核膜、(2) outer ring、(3) スポーク、(4) 核バスケット、(5) 細胞質フィラメント。]] |
|||
[[核膜]]は、内膜と外膜の2層の脂質二重膜によって構成される。内膜と外膜は互いに平行で 10–50 nm 離れている。核膜は核を完全に包んで細胞質から遺伝物質を分離するとともに、高分子が核質と細胞質の間を自由に拡散することを防ぐ障壁の役割を果たしている<ref name="Paine">{{cite journal|year=1975|title=Nuclear envelope permeability|journal=Nature|volume=254|issue=5496|pages=109–114|doi=10.1038/254109a0|pmid=1117994|vauthors=Paine P, Moore L, Horowitz S}}</ref>。外膜は[[粗面小胞体]]の膜と連続しており、粗面小胞体膜と同様に[[リボソーム]]が点在している<ref name="Paine" />。内膜と外膜の間の領域は perinuclear space と呼ばれ、粗面小胞体内腔と連続している。 |
|||
[[核膜孔]]は核膜を通過するチャネルである。複数のタンパク質から構成されており、それらは{{仮リンク|ヌクレオポリン|en|Nucleoporin}}と総称されている。核膜孔はおよそ 125 MDa で、約50 (酵母) から 数百 (脊椎動物) のタンパク質で構成されている<ref name="Lodish" />。孔の直径は約 100 nm であるが、孔の中心部には調節システムが位置しているため、分子が自由に拡散する間隙は約 9 nm の幅しかない。このサイズ選択性のため、水溶性の低分子は通過できる一方、核酸やタンパク質などの巨大な分子は不適切な出入りが防がれており、核内外への輸送は能動的になされる必要がある。典型的な哺乳類細胞の核膜には約3000から4000の核膜孔があり<ref name="Rhoades">{{cite book|title=Human Physiology|edition=3rd|year=1996|publisher=Saunders College Publishing|chapter=Ch3|editor1=Rodney Rhoades|editor2=Richard Pflanzer}}</ref>、内膜と外膜が融合する地点のそれぞれに8回対称のリング状の構造が存在している<ref name="Shulga">{{cite journal|year=2000|title=Yeast nucleoporins involved in passive nuclear envelope permeability|journal=J Cell Biol|volume=149|issue=5|pages=1027–1038|doi=10.1083/jcb.149.5.1027|pmid=10831607|pmc=2174828|vauthors=Shulga N, Mosammaparast N, Wozniak R, Goldfarb D}}</ref>。そのリングから核質側へは核バスケット (nuclear basket) と呼ばれる構造が突出しており、細胞質側へは一連のフィラメントが伸びている。両方の構造が核輸送タンパク質の結合に関与している<ref name="Lodish" />。 |
|||
ほとんどのタンパク質、リボソームのサブユニット、そしていくつかのDNAは、{{仮リンク|カリオフェリン|en|Karyopherin}}として知られる輸送因子ファミリーによって、核膜孔複合体を通って輸送される。核内への移動を媒介するカリオフェリンは[[インポーチン]]、核外への移動を媒介するものは[[エクスポーチン]]と呼ばれる。ほとんどのカリオフェリンはその積み荷 (cargo) と直接相互作用するが、いくつかのものは[[アダプタータンパク質]]を利用する<ref name="Pemberton">{{cite journal|year=2005|title=Mechanisms of receptor-mediated nuclear import and nuclear export|journal=Traffic|volume=6|issue=3|pages=187–198|doi=10.1111/j.1600-0854.2005.00270.x|pmid=15702987|vauthors=Pemberton L, Paschal B}}</ref>。[[コルチゾール]]や[[アルドステロン]]のような[[ステロイドホルモン]]や、細胞間[[シグナル伝達]]に関与する他の脂溶性低分子は細胞膜を通過して細胞質へ拡散するが、そこで[[核内受容体]]に結合し核へと輸送される。核内受容体は[[リガンド]]が結合時には[[転写因子]]として機能し、リガンドがないときには、その多くが遺伝子発現を抑制する[[ヒストン脱アセチル化酵素]]として機能する<ref name="Lodish" />。 |
|||
=== 核ラミナ === |
|||
{{Main|en:Nuclear lamina}} |
|||
動物細胞では、2種類の[[中間径フィラメント]]のネットワークによって核は機械的に支持されている。{{仮リンク|核ラミナ|en|Nuclear lamina}}は核膜の内側にメッシュ状に組織されたネットワークを形成しており、細胞質側は比較的組織されていない。両方のシステムが核膜の機械的支持や、染色体や核膜孔のアンカー部位として機能している<ref name="MBoC" />。 |
|||
核ラミナの大部分は[[ラミン]]タンパク質で構成されている。他の全てのタンパク質と同様、ラミンは細胞質で合成される。その後、核の内部へ輸送され、そこで重合して既存の核ラミナのネットワークに組み込まれる<ref name="Sturrman">{{cite journal|year=1998|title=Nuclear lamins: their structure, assembly, and interactions|journal=J Struct Biol|volume=122|issue=1–2|pages=42–66|doi=10.1006/jsbi.1998.3987|pmid=9724605|vauthors=Stuurman N, Heins S, Aebi U}}</ref><ref name="Goldman">{{cite journal|year=1992|title=Pathway of incorporation of microinjected lamin A into the nuclear envelope|journal=J Cell Biol|volume=119|issue=4|pages=725–735|doi=10.1083/jcb.119.4.725|pmid=1429833|pmc=2289687|vauthors=Goldman A, Moir R, Montag-Lowy M, Stewart M, Goldman R}}</ref>。核ラミナは核膜内側の{{仮リンク|エメリン (タンパク質)|en|Emerin|label=エメリン}}、細胞質側の{{仮リンク|ネスプリン|en|Nesprin}}などを介して細胞骨格と連結されている<ref>{{Cite journal|last=Wehnert|first=Manfred S.|last2=Nguyen|first2=Thuy Duong|last3=Meinke|first3=Peter|date=2011-12-01|title=The LINC complex and human disease|url=http://www.biochemsoctrans.org/content/39/6/1693|journal=Biochemical Society Transactions|volume=39|issue=6|pages=1693–1697|language=en|doi=10.1042/BST20110658|issn=1470-8752|pmid=22103509}}</ref>。ラミンは核質の内部にも見つかり、核質ヴェール (nucleoplasmic veil) として知られる、[[蛍光顕微鏡]]で観察可能な別の構造を形成している<ref name="RGoldman">{{cite journal|year=2002|title=Nuclear lamins: building blocks of nuclear architecture|url=http://www.genesdev.org/cgi/content/full/16/5/533|journal=Genes Dev|volume=16|issue=5|pages=533–547|doi=10.1101/gad.960502|pmid=11877373|vauthors=Goldman R, Gruenbaum Y, Moir R, Shumaker D, Spann T}}</ref>。このヴェールの機能は不明だが、[[核小体]]からは排除されており、[[細胞周期]]の{{仮リンク|間期|en|Interphase}}に存在する<ref name="Moir">{{cite journal|year=2000|title=Nuclear Lamins A and B1: Different Pathways of Assembly during Nuclear Envelope Formation in Living Cells|journal=Journal of Cell Biology|volume=151|issue=6|pages=1155–1168|doi=10.1083/jcb.151.6.1155|pmid=11121432|pmc=2190592|vauthors=Moir RD, Yoona M, Khuona S, Goldman RD}}</ref>。ラミンの構造体は[[クロマチン]]と相互作用しており、これらの構造を破壊するとタンパク質をコードする遺伝子の[[転写 (生物学)|転写]]が阻害される<ref name="Spann">{{cite journal|year=2002|title=Alteration of nuclear lamin organization inhibits RNA polymerase II–dependent transcription|journal=Journal of Cell Biology|volume=156|issue=4|pages=603–608|doi=10.1083/jcb.200112047|pmid=11854306|pmc=2174089|authors=Spann TP, Goldman AE, Wang C, Huang S, Goldman RD.}}</ref>。 |
|||
他の中間径フィラメントの構成要素と同様に、ラミンの[[モノマー|単量体]]は[[Αヘリックス|α-ヘリカル]]ドメインを持っており、2分子の単量体が互いに巻きついて[[コイルドコイル]]と呼ばれる[[二量体]]構造を形成する。そして、2つの二量体が逆平行の配置で並んで結合し、プロトフィラメント (protofilament) と呼ばれる[[四量体]]が形成される。さらに8つのプロトフィラメントが並んでねじられ、ロープ状のフィラメントが形成される。これらのフィラメントが動的に重合・脱重合を行い、その競合によってフィラメントの長さが変化する<ref name="MBoC" />。 |
|||
フィラメント重合に欠陥が生じるラミン遺伝子の変異は、{{仮リンク|ラミノパシー|en|Laminopathy}}として知られる一群の稀な[[遺伝子疾患]]の原因となる。ラミノパシーで最も有名なものは[[ハッチンソン・ギルフォード・プロジェリア症候群|プロジェリア]]として知られる疾患ファミリーであり、患者には早期の[[老化]]が引き起こされる。老化の[[表現型]]を生じさせる[[生化学]]的変化の正確なメカニズムは、まだよく理解されていない<ref name="Mounkes">{{cite journal|year=2004|title=Aging and nuclear organization: lamins and progeria|journal=Current Opinion in Cell Biology|volume=16|issue=3|pages=322–327|doi=10.1016/j.ceb.2004.03.009|pmid=15145358|vauthors=Mounkes LC, Stewart CL}}</ref>。 |
|||
=== 染色体 === |
|||
{{Main|染色体}} |
|||
[[Image:MouseChromosomeTerritoriesBMC Cell Biol6-44Fig2e.jpg|thumb|200px|DNAが青く染色された、マウスの線維芽細胞の核。[[蛍光 in situ ハイブリダイゼーション|FISH]]法によって2番染色体(赤)と9番染色体(緑)の染色体テリトリーが染色されている。]] |
|||
細胞核には、複数の直鎖状のDNA分子の形で細胞の遺伝物質の大部分が含まれており (少数の遺伝子は[[ミトコンドリア]]と、植物では[[葉緑体]]にも存在している)、DNA分子は[[染色体]]と呼ばれる構造に組織化される。ヒトの各細胞は大雑把に見積もって約 2 m のDNAを含んでいる。[[細胞周期]]のほとんどの期間、これらは[[クロマチン]]として知られるDNA-タンパク質複合体に組織されている。[[細胞分裂]]の間クロマチンは、[[核型]]の図で馴染み深い、染色体を形成しているのが観察される。 |
|||
クロマチンには2つのタイプが存在する。[[ユークロマチン]]はDNAが比較的コンパクトに納まっていない形態で、高頻度で発現している遺伝子を含んでいる<ref name="Ehrenhofer">{{cite journal|author=Ehrenhofer-Murray A|year=2004|title=Chromatin dynamics at DNA replication, transcription and repair|journal=Eur J Biochem|volume=271|issue=12|pages=2335–2349|doi=10.1111/j.1432-1033.2004.04162.x|pmid=15182349}}</ref>。他のタイプである[[ヘテロクロマチン]]はよりコンパクトな形態で、低頻度で転写されるDNAが含まれる。ヘテロクロマチンはさらに、特定の細胞種または特定の発生ステージでのみヘテロクロマチンとして組織化される条件的ヘテロクロマチン (facultative heterochromatin) と、[[テロメア]]や[[セントロメア]]のような染色体の構造的要素からなる構成的ヘテロクロマチン (constitutive heterochromatin) とに分類される<ref name="Grigoryev">{{cite journal|year=2006|title=The end adjusts the means: heterochromatin remodelling during terminal cell differentiation|journal=Chromosome Res|volume=14|issue=1|pages=53–69|doi=10.1007/s10577-005-1021-6|pmid=16506096|vauthors=Grigoryev S, Bulynko Y, Popova E}}</ref>。{{仮リンク|間期|en|Interphase}}を通じて、クロマチンは染色体テリトリー (chromosome territory) と呼ばれる個別のパッチ状の組織となっている<ref name="Schardin">{{cite journal|last=Schardin|first=Margit|last2=Cremer|first2=T|last3=Hager|first3=HD|last4=Lang|first4=M|date=December 1985|title=Specific staining of human chromosomes in Chinese hamster x man hybrid cell lines demonstrates interphase chromosome territories|url=http://www.springerlink.com/content/lv101t8w17306071/|journal=Human Genetics|volume=71|issue=4|pages=281–287|publisher=Springer Berlin / Heidelberg|doi=10.1007/BF00388452|pmid=2416668|authorlink=}}</ref><ref name="Lamond">{{cite journal|last=Lamond|first=Angus I.|date=24 April 1998|title=Structure and Function in the Nucleus|journal=Science|volume=280|issue=5363|pages=547–553|doi=10.1126/science.280.5363.547|pmid=9554838|author2=William C. Earnshaw}}</ref>。一般的に染色体のユークロマチン領域に見つかる活性型の遺伝子は、染色体テリトリーの境界に位置する傾向がある<ref name="Kurz">{{cite journal|last=Kurz|first=A|last2=Lampel|first2=S|last3=Nickolenko|first3=JE|last4=Bradl|first4=J|last5=Benner|first5=A|last6=Zirbel|first6=RM|last7=Cremer|first7=T|last8=Lichter|first8=P|year=1996|title=Active and inactive genes localize preferentially in the periphery of chromosome territories|url=http://intl.jcb.org/cgi/content/abstract/135/5/1195|journal=The Journal of Cell Biology|volume=135|issue=5|pages=1195–1205|publisher=The Rockefeller University Press|doi=10.1083/jcb.135.5.1195|pmid=8947544|pmc=2121085|deadurl=yes|archiveurl=https://web.archive.org/web/20070929104104/http://intl.jcb.org/cgi/content/abstract/135/5/1195|archivedate=29 September 2007|df=}}</ref>。 |
|||
特定のタイプのクロマチン組織、特に[[ヌクレオソーム]]に対する抗体は、[[全身性エリテマトーデス]]のような多くの[[自己免疫疾患]]と関連している<ref name="Rothfield">{{cite journal|year=1967|title=The Relation of Immunoglobulin Class, Pattern of Antinuclear Antibody, and Complement-Fixing Antibodies to DNA in Sera from Patients with Systemic Lupus Erythematosus|journal=J Clin Invest|volume=46|issue=11|pages=1785–1794|doi=10.1172/JCI105669|pmid=4168731|pmc=292929|author1=NF Rothfield|author2=BD Stollar}}</ref>。これらは[[抗核抗体]]として知られており、[[多発性硬化症]]の患者でも、その病態とは関連しないものの、一般的な免疫不全の一部として高頻度で観察される<ref name="Barned">{{cite journal|year=1995|title=Frequency of anti-nuclear antibodies in multiple sclerosis|journal=Neurology|volume=45|issue=2|pages=384–385|doi=10.1212/WNL.45.2.384|pmid=7854544|author1=S Barned|author2=AD Goodman|author3=DH Mattson}}</ref>。 |
|||
=== 核小体 === |
|||
{{Main|核小体}} |
|||
[[Image:Micrograph of a cell nucleus.png|thumb|left|200px|細胞核の[[電子顕微鏡]]像。[[核小体]]が暗く染色されている。]] |
|||
[[File:Blausen 0212 CellNucleus.png|thumb|核の3Dレンダリング。核小体 Nucleolus の位置が示されている。]] |
|||
[[核小体]]は、濃密に染色される構造体として核内に存在している。核小体は膜に囲まれておらず、サブオルガネラ (suborganelle) と呼ばれることもある。[[リボソームRNA]] (rRNA) をコードするDNA ([[リボソームDNA|rDNA]]) のタンデムリピートの周囲に形成される。これらの領域は{{仮リンク|核小体形成域|en|Nucleolus organizer region}} (nucleolus organizer region) と呼ばれる。核小体の主な役割はrRNAの合成と[[リボソーム]]の組み立てである。核小体の構造的凝集はその活性に依存している。核小体でのリボソームの組み立てが核小体構成要素の一時的な結合をもたらし、それによってさらにリボソームの組み立てが促進され、さらに結合が行われる。このモデルは、rDNAの不活性化によって核小体構造が混合するという観察によって支持されている<ref name="Hernandez-Verdun">{{cite journal|last=Hernandez-Verdun|first=Daniele|year=2006|title=Nucleolus: from structure to dynamics|url=https://hal.archives-ouvertes.fr/hal-00015455|journal=Histochem. Cell. Biol|volume=125|issue=1–2|pages=127–137|doi=10.1007/s00418-005-0046-4|pmid=16328431}}</ref>。 |
|||
リボソームの組み立ての最初のステップでは、[[RNAポリメラーゼ|RNAポリメラーゼI]]と呼ばれるタンパク質がrDNAを転写し、大きなpre-rRNA前駆体が形成される。そして、5.8S、18S、28S rRNAのサブユニットへ切断される<ref name="Lamond-Sleeman">{{cite journal|last=Lamond|first=Angus I.|date=October 2003|title=Nuclear substructure and dynamics|journal=Current Biology|volume=13|issue=21|pages=R825–828|accessdate=|doi=10.1016/j.cub.2003.10.012|pmid=14588256|author2=Judith E. Sleeman}}</ref>。転写と転写後プロセシング、そしてrRNAの組み立ては、[[核小体低分子RNA]] (snoRNA) の助けによって行われる。そのいくつかは、リボソームの機能に関連する遺伝子をコードする[[伝令RNA|mRNA]]から[[Pre-mRNA スプライシング|スプライシング]]された[[イントロン]]に由来する。組み立てられたリボソームのサブユニットは[[核膜孔]]を通過する最も大きな構造である<ref name="Lodish" />。 |
|||
[[電子顕微鏡]]による観察では、核小体は3つの判別可能な領域から構成されていることが観察される。最も内側の fibrillar center (FC)、それを取り囲む濃密な dense fibrillar component (DFC)、外側の境界部の granular component (GC) である。rDNAの転写はFCまたはFC-DFC境界で起こり、そのため、細胞でrRNAの転写が増加すると、より多くのFCが検出されるようになる。rRNAの切断と修飾の大部分はDFCで行われ、リボソームサブユニットへのタンパク質の組み込みを伴う後半のステップはGCで行われる<ref name="Lamond-Sleeman" />。 |
|||
=== 他の核内構造体 === |
|||
{| class="wikitable" style="float:right; font-size:100%; margin-left:15px;" |
|||
|- bgcolor="#efefef" |
|||
|+ '''核内構造体のサイズ''' |
|||
|- bgcolor="#efefef" |
|||
! style="width: 120px;" abbr="name" |'''構造の名称''' |
|||
! style="width: 130px;" abbr="diameter" |'''構造の直径''' |
|||
|'''出典''' |
|||
|- |
|||
| カハール体 || 0.2–2.0 µm || <ref name="Cioce">{{cite journal |vauthors=Cioce M, Lamond A | title = Cajal bodies: a long history of discovery | journal = Annu Rev Cell Dev Biol | volume = 21 | issue = | pages = 105–131 | year = 2005| pmid = 16212489 | doi = 10.1146/annurev.cellbio.20.010403.103738 }}</ref> |
|||
|- |
|||
|クラストソーム |
|||
|0.2–0.5 µm |
|||
|<ref name=":0">{{Cite journal|last=Lafarga|first=Miguel|date=1 August 2002|title=Clastosome: A Subtype of Nuclear Body Enriched in 19S and 20S Proteasomes, Ubiquitin, and Protein Substrates of Proteasome|url=http://www.molbiolcell.org/content/13/8/2771|journal=Molecular Biology of the Cell|volume=13|issue=8|pages=2771–2782|doi=10.1091/mbc.e02-03-0122|pmid=12181345|pmc=117941|via=|citeseerx=10.1.1.321.6138}}</ref> |
|||
|- |
|||
| PIKA || 5 µm || <ref name="Pollard">{{cite book |
|||
| last = Pollard |
|||
| first = Thomas D. |
|||
|author2=William C. Earnshaw |
|||
| title = Cell Biology |
|||
| publisher = Saunders |
|||
| year = 2004 |
|||
| location = Philadelphia |
|||
| isbn = 0-7216-3360-9}}</ref> |
|||
|- |
|||
| PML体 || 0.2–1.0 µm || <ref name="Dundr">{{cite journal |
|||
| last = Dundr |
|||
| first = Miroslav |
|||
|author2=Tom Misteli |
|||
| title = Functional architecture in the cell nucleus |
|||
| journal = Biochem. J. |
|||
| issue = Pt 2 |
|||
| pages = 297–310 |
|||
| year = 2001 |
|||
| pmid = 11368755 |
|||
| volume=356 |
|||
| pmc=1221839 |
|||
| doi=10.1042/0264-6021:3560297}}</ref> |
|||
|- |
|||
| パラスペックル || 0.5–1.0 µm || <ref>{{cite journal |
|||
| last1 = Bond |
|||
| first1 = Charles S. |
|||
| last2 = Fox |
|||
| first2 = Archa H. |
|||
| title = Paraspeckles: nuclear bodies built on long noncoding RNA |
|||
| journal = J. Cell Biol. |
|||
| year = 2009 |
|||
| volume = 186 |
|||
| issue = 5 |
|||
| pages = 637–644 |
|||
| doi = 10.1083/jcb.200906113}}</ref> |
|||
|- |
|||
| 核スペックル || 20–25 nm || <ref name="Pollard" /> |
|||
|} |
|||
核小体以外にも、核には膜で区切られていない構造体が多数含まれている。[[カハール体]] (Cajal body)、GEMs (Gemini of coiled bodies)、PIKA (polymorphic interphase karyosomal association)、PML体 (promyelocytic leukaemia body)、{{仮リンク|パラスペックル|en|Paraspeckle}} (paraspeckle)、核スペックル (speckle, splicing speckle) などの構造体が知られている。これらの構造体の機能はあまり解明されていないが、[[核質]]が一様な混合物ではなく、むしろ組織化された機能的なサブドメインを含むものであることを示している<ref name="Dundr" />。 |
|||
他の核内構造体は、疾患の異常なプロセスの一部として出現する。例えば、{{仮リンク|ネマリンミオパチー|en|Nemaline myopathy}}のいくつかの症例では、核内に小さな桿状の構造体の存在が報告されている。これは典型的には[[アクチン]]の変異によるものであり、桿状構造は変異体アクチンやの細胞骨格タンパク質から構成されている<ref name="Goebel">{{cite journal|last=Goebel|first=H.H.|date=January 1997|title=Nemaline myopathy with intranuclear rods—intranuclear rod myopathy|url=|journal=Neuromuscular Disorders|volume=7|issue=1|pages=13–19|doi=10.1016/S0960-8966(96)00404-X|pmid=9132135|author2=I Warlow}}</ref>。 |
|||
==== カハール体とGem ==== |
|||
{{Main|カハール体}}典型的な核には、[[カハール体]] (カハール小体、カハールボディ、Cajal body) またはコイル体 (coiled body) と呼ばれる1個から10個のコンパクトな構造が存在し、その直径は生物種や細胞種によって異なるが 0.2 µm から 2.0 µm 程度である<ref name="Cioce" />。[[電子顕微鏡]]下での観察では、糸が絡まった球のような形状をしており<ref name="Pollard" />、濃密な中心部 (foci) にはタンパク質{{仮リンク|コイリン|en|Coilin}}が分布している<ref name="MateraFrey">{{cite journal|year=1998|title=Coiled Bodies and Gems: Janus or Gemini?|journal=American Journal of Human Genetics|volume=63|issue=2|pages=317–321|doi=10.1086/301992|pmid=9683623|pmc=1377332|vauthors=Matera AG, Frey MA}}</ref>。カハール体はRNAのプロセシングに関する多数の異なる役割に関与しており、特に、[[核小体低分子RNA]] (snoRNA) や{{仮リンク|核内低分子RNA|en|Small nuclear RNA}} (snRNA) の成熟や、[[ヒストン]]のmRNAの修飾などに関与している<ref name="Cioce" />。 |
|||
カハール体に類似した構造として、Gem (Gem小体、Gems、Gemini of coiled bodies、Gemini of Cajal bodies) がある。その名前は[[ふたご座]] (Gemini) に由来し、カハール体との緊密な関係を表している。Gemはカハール体と似た大きさと形状であり、実際、顕微鏡下で視覚的に区別することはできない<ref name="MateraFrey" />。カハール体とは異なり、Gemは{{仮リンク|核内低分子リボ核タンパク質|en|snRNP}}(snRNP) を含まないが、snRNPの生合成に関連した機能を持つ{{仮リンク|SMN|en|Survival of motor neuron}}タンパク質 (survival of motor neuron) を含んでいる<ref name="Matera">{{cite journal|last=Matera|first=A. Gregory|year=1998|title=Of Coiled Bodies, Gems, and Salmon|journal=[[Journal of Cellular Biochemistry]]|volume=70|issue=2|pages=181–192|accessdate=|doi=10.1002/(sici)1097-4644(19980801)70:2<181::aid-jcb4>3.0.co;2-k|pmid=9671224}}</ref>。 電子顕微鏡による[[微細構造]]の解析によって、Gemとカハール体との差異はコイリンにあることが示された。すなわち、カハール体はSMNとコイリンを含んでおり、GemはSMNを含むがコイリンを含まない<ref name="Navascues">{{cite journal|last1=Navascues|first1=J|last2=Berciano|first2=MT|last3=Tucker|first3=KE|last4=Lafarga|first4=M|last5=Matera|first5=AG|date=June 2004|title=Targeting SMN to Cajal bodies and nuclear gems during neuritogenesis.|journal=Chromosoma|volume=112|issue=8|pages=398–409|doi=10.1007/s00412-004-0285-5|pmid=15164213|pmc=1592132}}</ref>。 |
|||
==== PIKAとPTFドメイン ==== |
|||
PIKA (polymorphic interphase karyosomal association) またはRAFAドメインは、1991年の顕微鏡研究で初めて記述された。その機能は未だ明らかではないが、DNA複製、転写、そしてRNAのプロセシングには関与していないと考えられている<ref name="Saunders">{{cite journal|year=1991|title=Compartmentalization within the nucleus: discovery of a novel subnuclear region.|journal=[[Journal of Cellular Biology]]|volume=115|issue=4|pages=919–931|doi=10.1083/jcb.115.4.919|pmid=1955462|pmc=2289954|vauthors=Saunders WS, Cooke CA, Earnshaw WC}}</ref>。snRNAの転写を促進する[[転写因子]]PTFの濃密な局在によって定義される別のドメインとしばしば相互作用していることが判明している<ref name="Pombo">{{cite journal|year=1998|title=Regional and temporal specialization in the nucleus: a transcriptionally active nuclear domain rich in PTF, Oct1 and PIKA antigens associates with specific chromosomes early in the cell cycle|journal=The EMBO Journal|volume=17|issue=6|pages=1768–1778|doi=10.1093/emboj/17.6.1768|pmid=9501098|pmc=1170524|vauthors=Pombo A, Cuello P, Schul W, Yoon J, Roeder R, Cook P, Murphy S}}</ref>。 |
|||
==== PML体 ==== |
|||
PML体 (PML小体、PMLボディ、promyelocytic leukaemia body) は核質中に分散して存在する球形の構造体で、大きさは約 0.1–1.0 µm である。他の名称が多く付けられており、nuclear domain 10 (ND10)、Kremer body、PML oncogenic domain などとも呼ばれる。PML体の名称は、主要な構成要素である{{仮リンク|前骨髄性白血病タンパク質|en|Promyelocytic leukemia protein|label=PML}}タンパク質 (promyelocytic leukaemia protein) に由来する。核内でカハール体や cleavage body と関連して存在しているのがしばしば観察される<ref name="Dundr"/>。PML体は、核内のはっきりしない超構造である{{仮リンク|核マトリックス|en|Nuclear matrix}}に属しており、DNA複製、転写、エピジェネティックなサイレンシングなど、多くの核の機能のアンカーとなって調節を行っていると提唱されている<ref name="Lallemand2010">{{Cite journal|last1=Lallemand-Breitenbach|first1=V.|last2=De The|first2=H.|year=2010|title=PML Nuclear Bodies|journal=Cold Spring Harbor Perspectives in Biology|volume=2|issue=5|pages=a000661|doi=10.1101/cshperspect.a000661|pmid=20452955|pmc=2857171}}</ref>。PMLタンパク質はこのドメインを組織する主要な因子であり、リクルートされるタンパク質の数は増え続けているが、報告されている機能に唯一共通するものは[[SUMO化]]である。しかし、PML遺伝子が欠失し核内構造体が形成されないマウスも発生は正常であるため、PML体はほとんどの基礎的な生物学的機能には必要ないことが示されている<ref name="Lallemand2010"/>。 |
|||
==== 核スペックル ==== |
|||
核スペックル (スペックル、スプライシングスペックル、speckle) は、[[Pre-mRNA スプライシング|pre-mRNAスプライシング因子]]に富む核内構造体で、哺乳類細胞の核質のクロマチン間領域 (interchromatin region) に位置している。蛍光顕微鏡のレベルでは不定形の点状構造で大きさや形も様々であるが、電子顕微鏡では{{仮リンク|クロマチン間顆粒|en|Interchromatin granule}} (interchromatin granule) のクラスターとして観察される。核スペックルは動的な構造で、タンパク質やRNA-タンパク質複合体の構成要素は絶えずスペックル間や、転写の活性部位を含む、核の他の領域を循環している。核スペックルの構成要素、構造、挙動についての研究からは、核の機能的区画化と、遺伝子発現装置、スプライシング{{仮リンク|核内低分子リボ核タンパク質|en|snRNP|label=snRNP}}、他のpre-mRNAスプライシングに必要なタンパク質の組織化に関与しているというモデルが立てられている<ref name=":4">{{cite journal|date=August 2003|title=Nuclear speckles: a model for nuclear organelles|url=|journal=Nature Reviews Molecular Cell Biology|volume=4|issue=8|pages=605–12|doi=10.1038/nrm1172|pmid=12923522|vauthors=Lamond AI, Spector DL}}</ref><ref name=":5">{{cite journal|date=September 2008|title=Differential dynamics of splicing factor SC35 during the cell cycle|url=http://www.ias.ac.in/jbiosci/sep2008/345.pdf|journal=J. Biosci.|volume=33|issue=3|pages=345–54|format=PDF|doi=10.1007/s12038-008-0054-3|pmid=19005234|vauthors=Tripathi K, Parnaik VK|deadurl=no|archiveurl=https://web.archive.org/web/20111115235056/http://www.ias.ac.in/jbiosci/sep2008/345.pdf|archivedate=15 November 2011|df=}}</ref><ref name=":6">{{Cite journal|last1=Tripathi|first1=K.|last2=Parnaik|first2=V. K.|year=2008|title=Differential dynamics of splicing factor SC35 during the cell cycle|journal=Journal of Biosciences|volume=33|issue=3|pages=345–354|doi=10.1007/s12038-008-0054-3|pmid=19005234}}</ref><ref name=":7">{{cite journal|date=August 2003|title=Nuclear speckles: a model for nuclear organelles|journal=Nature Reviews Molecular Cell Biology|volume=4|issue=8|pages=605–12|doi=10.1038/nrm1172|pmid=12923522|vauthors=Lamond AI, Spector DL}}</ref>。細胞が必要とするものの変化によって、これらの構造体の構成要素や位置も、mRNAの転写や特定のタンパク質の[[リン酸化]]による調節を通じて変化する<ref name="Handwerger">{{cite journal|last=Handwerger|first=Korie E.|date=January 2006|title=Subnuclear organelles: new insights into form and function|journal=Trends in Cell Biology|volume=16|issue=1|pages=19–26|doi=10.1016/j.tcb.2005.11.005|pmid=16325406|author2=Joseph G. Gall}}</ref>。核スペックルは上に挙げた名称の他にも、splicing factor compartment (SF compartment)、interchromatin granule cluster (IGC)、B snurposomes などとして知られる<ref name=":8">{{cite web|url=https://www.uniprot.org/locations/SL-0186|title=Cellular component Nucleus speckle|accessdate=30 August 2013|publisher=UniProt: UniProtKB}}</ref>。B snurposome は[[両生類]]の[[卵母細胞]]の核や、[[キイロショウジョウバエ]]の[[胚]]で観察されている。両生類の核の電子顕微鏡像からは、B snurposome は単独で存在するか、[[カハール体]]に付着しているように見える<ref name=":9">{{Cite journal|last=Gall|first=Joseph G.|date=December 1999|title=Assembly of the Nuclear Transcription and Processing Machinery: Cajal Bodies (Coiled Bodies) and Transcriptosomes|journal=Molecular Biology of the Cell|volume=10|issue=12|pages=4385–4402|doi=10.1091/mbc.10.12.4385|issn=1059-1524|pmid=10588665|pmc=25765|author2=Bellini, Michel|author3=Wu, Zheng'an|author4=Murphy, Christine}}</ref>。IGC はスプライシング因子の貯蔵部位として機能している<ref name="Matera2007_NatureMolCellBio">{{Cite journal|last=Matera|first=A. Gregory|date=March 2007|title=Non-coding RNAs: lessons from the small nuclear and small nucleolar RNAs|url=http://www.nature.com/nrm/journal/v8/n3/full/nrm2124.html|journal=Nature Reviews Molecular Cell Biology|volume=8|issue=3|pages=209–220|accessdate=9 August 2013|doi=10.1038/nrm2124|issn=1471-0072|pmid=17318225|author2=Rebecca M. Terns|author3=Michael P. Terns|deadurl=no|archiveurl=https://web.archive.org/web/20110926040835/http://www.nature.com/nrm/journal/v8/n3/full/nrm2124.html|archivedate=26 September 2011|df=}}</ref>。 |
|||
==== パラスペックル ==== |
|||
{{Main|en:Paraspeckle}} |
|||
Foxらによって2002年に発見された{{仮リンク|パラスペックル|en|Paraspeckle}} (paraspeckle) は、核のクロマチン間領域の不定形の区画である<ref name="para1">{{cite journal|last1=Fox|first1=Archa|last2=Lam|first2=YW|last3=Leung|first3=AK|last4=Lyon|first4=CE|last5=Andersen|first5=J|last6=Mann|first6=M|last7=Lamond|first7=AI|year=2002|title=Paraspeckles: A Novel Nuclear Domain|journal=Current Biology|volume=12|issue=1|pages=13–25|doi=10.1016/S0960-9822(01)00632-7|pmid=11790299}}</ref>。最初に報告されたのは[[HeLa細胞]]においてであり、その核には一般的に10個から30個存在するとされた<ref name="para2">{{cite web|url=http://npd.hgu.mrc.ac.uk/compartments/paraspeckles.html|title=Nuclear Compartments: Paraspeckles|accessdate=6 March 2007|last=Fox|first=Archa|year=2004|publisher=Nuclear Protein Database|author2=Wendy Bickmore|archive-url=http://webarchive.nationalarchives.gov.uk/20080910110920/http://npd.hgu.mrc.ac.uk/compartments/paraspeckles.html|dead-url=yes|archive-date=10 September 2008}}</ref>。現在では、全ての[[初代培養]]細胞、形質転換細胞株、組織切片に存在することが知られている<ref name="para3">{{cite journal|author=Fox, A.|year=2005|title=P54nrb Forms a Heterodimer with PSP1 That Localizes to Paraspeckles in an RNA-dependent Manner|url=http://www.molbiolcell.org/cgi/reprint/16/11/5304|journal=Molecular Biology of the Cell|volume=16|issue=11|pages=5304–5315|doi=10.1091/mbc.E05-06-0587|pmid=16148043|pmc=1266428|display-authors=etal}}</ref>。その名称は核での分布に由来するもので、"para"は"parallel"の略、"speckle"は常に近接して存在する核スペックルを指している<ref name="para2"/>。 |
|||
パラスペックルは動的な構造で、細胞の代謝活性の変化に反応して変化する。[[転写 (生物学)|転写]]に依存的で<ref name="para1" />、[[RNAポリメラーゼ|RNAポリメラーゼII]]による転写がないときにはパラスペックルは消失し、全ての関連するタンパク質の構成要素 (PSP1、p54nrb、PSP2、CFI(m)68、PSF) は[[核小体]]で三日月型のキャップ構造 (perinucleolar cap) を形成する。この現象は[[細胞周期]]中でも確認されている。パラスペックルは{{仮リンク|間期|en|Interphase}}を通じて存在し、[[有糸分裂]]中も[[終期 (細胞分裂)|終期]]を除いて存在する。2つの[[娘細胞]]の核が形成される終期にはRNAポリメラーゼIIによる転写が行われないため、タンパク質構成要素は代わりに perinucleolar cap を形成する<ref name="para3" />。 |
|||
==== Perichromatin fibril ==== |
|||
Perichromatin fibril (クロマチン周囲の線維状の構造物) は、電子顕微鏡下でのみ観察可能である。転写が活発なクロマチンに隣接して位置し、pre-mRNAのプロセシングが活発に行われている場所であるという仮説が立てられている<ref name="Matera2007_NatureMolCellBio" />。 |
|||
==== クラストソーム ==== |
|||
クラストソーム (clastosome) は小さな構造体で (0.2–0.5 µm)、構造体周縁部のカプセルのために厚いリング状に観察される<ref name=":0" />。その名称はギリシャ語の ''klastos'' (壊れた) と ''soma'' (体) に由来する<ref name=":0" />。クラストソームは典型的には通常の細胞に存在せず、検出することは難しい。核内部のタンパク質分解活性が高いときに形成され、活性が低下するか、細胞が[[プロテアソーム]]阻害剤によって処理されると分解される<ref name=":0" /><ref name=":10">{{Cite journal|last=Kong|first=Xiao-Ni|last2=Yan|first2=He-Xin|last3=Chen|first3=Lei|last4=Dong|first4=Li-Wei|last5=Yang|first5=Wen|last6=Liu|first6=Qiong|last7=Yu|first7=Le-Xing|last8=Huang|first8=Dan-Dan|last9=Liu|first9=Shu-Qin|date=29 October 2007|title=LPS-induced down-regulation of signal regulatory protein α contributes to innate immune activation in macrophages|journal=The Journal of Experimental Medicine|volume=204|issue=11|pages=2719–2731|doi=10.1084/jem.20062611|issn=0022-1007|pmid=17954568|pmc=2118489}}</ref>。クラストソームが細胞にわずかしか存在しないということは、それがプロテアソームの機能に必須なわけではないことを示している<ref name=":1">{{Cite journal|last=Carmo-Fonseca|first=Maria|last2=Berciano|first2=Maria T.|last3=Lafarga|first3=Miguel|date=September 2010|title=Orphan Nuclear Bodies|journal=Cold Spring Harbor Perspectives in Biology|volume=2|issue=9|pages=a000703|doi=10.1101/cshperspect.a000703|issn=1943-0264|pmid=20610547|pmc=2926751}}</ref>。[[浸透圧]]ストレスも、クラストソームの形成を引き起こすことが示されている<ref name=":11">{{Cite journal|last=Sampuda|first=Katherine M.|last2=Riley|first2=Mason|last3=Boyd|first3=Lynn|date=19 April 2017|title=Stress induced nuclear granules form in response to accumulation of misfolded proteins in Caenorhabditis elegans|journal=BMC Cell Biology|volume=18|issue=1|pages=18|doi=10.1186/s12860-017-0136-x|issn=1471-2121|pmid=28424053|pmc=5395811}}</ref>。この核内構造体は、プロテアソームの触媒サブユニットと調節サブユニット、そしてその基質を含んでおり、タンパク質分解部位であることが示唆される<ref name=":1" />。 |
|||
== 機能 == |
|||
核は、[[細胞質]]での[[翻訳 (生物学)|翻訳]]部位から隔離された、[[遺伝子]]の[[転写 (生物学)|転写]]のための場所を提供し、[[原核生物]]にはないレベルでの[[遺伝子発現の調節|遺伝子調節]]を可能にしている。核の主要な機能は[[遺伝子発現]]の制御と[[細胞周期]]中の[[DNA複製]]の媒介である。[[核膜]]によって完全に包まれたその内部には、細胞の遺伝物質の大部分が含まれている。この物質は[[デオキシリボ核酸|DNA]]分子で構成されており、さまざまな[[タンパク質]]ととともに[[染色体]]を形成している。 |
|||
=== 細胞の区画化 === |
|||
核膜によって、核はその内容物を制御し、細胞質部分から隔離されている。このことは、核膜の両側でのプロセスの制御に重要である。細胞質でのプロセスの制限の必要がある場合、ほとんどの場合主要な関与因子は核へ除去され、そこで[[転写因子]]と相互作用し関連する酵素の生産がダウンレギュレーションされる。この調節メカニズムは、エネルギー産生のために[[グルコース]]を分解する経路である、[[解糖系]]でも行われている。[[ヘキソキナーゼ]]は解糖系の最初のステップを担う酵素であり、グルコースから[[グルコース-6-リン酸]]を形成する。グルコース-6-リン酸から合成される分子である[[フルクトース-6-リン酸]]が高濃度で存在すると、調節タンパク質によってヘキソキナーゼは核へ除去され<ref name="Lehninger">{{cite book|last=Lehninger|first=Albert L.|title=Lehninger principles of biochemistry|edition=3rd|year=2000|publisher=Worth Publishers|isbn=1-57259-931-6|location=New York|author2=Nelson, David L.|author3=Cox, Michael M.}}</ref>、そこで核のタンパク質と転写抑制複合体を形成して解糖系に関与する遺伝子の発現を低下させる<ref name="Moreno">{{cite journal|year=2005|title=Glucose sensing through the Hxk2-dependent signalling pathway.|journal=Biochem Soc Trans|volume=33|issue=1|pages=265–268|doi=10.1042/BST0330265|pmid=15667322|vauthors=Moreno F, Ahuatzi D, Riera A, Palomino CA, Herrero P}}</ref>。 |
|||
遺伝子発現を調節するいくつかの転写因子はDNAから分離され、他のシグナル伝達経路によって活性化されない限りそれらが物理的にDNAにアクセスすることがないようになっている。これによって、不適切な遺伝子発現が防がれている。例えば、ほとんどの炎症反応に関与する[[NF-κB]]によって制御される遺伝子の場合、シグナリング分子[[TNF-α]]によるシグナル伝達経路が開始され転写が誘導される。TNF-αが[[細胞膜]]の[[受容体]]に結合するとシグナリングタンパク質は膜へリクルートされ、最終的にNF-κBが活性化される。NF-κBの{{仮リンク|核局在化シグナル|en|Nuclear localization sequence}}によって[[核膜孔]]を通って核へ輸送され、標的遺伝子の転写が促進される<ref name="MBoC" />。 |
|||
また、区画化によって、[[Pre-mRNA スプライシング|スプライシング]]されていないmRNAの翻訳が防がれている<ref name="Gorlich">{{cite journal|last=Görlich|first=Dirk|year=1999|title=Transport between the cell nucleus and the cytoplasm|journal=Annu. Rev. Cell Dev. Biol.|volume=15|issue=1|pages=607–660|doi=10.1146/annurev.cellbio.15.1.607|pmid=10611974|author2=Ulrike Kutay}}</ref>。真核生物のmRNAは[[イントロン]]を含んでおり、機能的なタンパク質への翻訳にはイントロンの除去が必要である。スプライシングは、リボソームがmRNAにアクセスする前に核内で行われる。核がなければ、リボソームは転写されたばかりの (プロセシングされていない) mRNAを翻訳してしまい、欠陥があるか機能しないタンパク質が合成されてしまうと考えられる。 |
|||
=== 遺伝子発現 === |
|||
{{Main|遺伝子発現}} |
|||
[[File:Transcription label en.jpg|thumb|200px|left|[[リボソームRNA]]をコードする遺伝子の転写が進行し、[[一次転写産物]]が合成されている様子。"Begin"はRNAの合成が開始されるDNAの5'末端を、"End"は一次転写産物の合成がほぼ完了する3'末端を示している。]] |
|||
[[遺伝子発現]]はまず転写を伴い、DNAがRNAを合成するための鋳型として用いられる。タンパク質をコードする遺伝子の場合、このプロセスで合成されるRNAはmRNAであり、タンパク質を合成するには、その後リボソームによってmRNAが翻訳される必要がある。リボソームは核の外部に位置しているため、合成されたmRNAは核外へ輸送されなければならない<ref name=":12">{{cite book|last=Nierhaus|first=Knud H.|title=Protein Synthesis and Ribosome Structure: Translating the Genome|year=2004|publisher=Wiley-VCH|isbn=3-527-30638-2|author2=Daniel N. Wilson}}</ref>。 |
|||
核は転写が行われる部位であり、転写に直接関与したり転写過程の調節に関与したりするさまざまな種類のタンパク質が含まれている。これらには、二本鎖DNAをほどいてアクセスを促進する[[ヘリカーゼ]]、DNAの[[プロモーター]]領域に結合してRNA分子を合成する[[RNAポリメラーゼ]]、[[DNA超らせん|DNAのスーパーコイル構造]]を変化させてDNAの巻き戻しなどを助ける[[DNAトポイソメラーゼ|トポイソメラーゼ]]、発現を調節するさまざまな種類の転写因子などが含まれる<ref name=":13">{{cite book|last=Nicolini|first=Claudio A.|title=Genome Structure and Function: From Chromosomes Characterization to Genes Technology|year=1997|publisher=Springer|isbn=0-7923-4565-7}}</ref>。 |
|||
=== pre-mRNAのプロセシング === |
|||
{{Main|en:Post-transcriptional modification}} |
|||
新しく合成されたmRNA分子は、[[一次転写産物]]またはpre-mRNAとして知られている。それらは、細胞質へ輸送される前に核内で{{仮リンク|転写後修飾|en|Post-transcriptional modification}}を受けなければならず、これらの修飾を受けずに細胞質へ移動したmRNAは、タンパク質への翻訳よりも分解が行われる。行われる修飾は、[[5'キャップ|5'キャッピング]]、[[ポリアデニル化|3'ポリアデニル化]]、そして[[Pre-mRNA スプライシング|RNAスプライシング]]である。核内では、pre-mRNAは {{仮リンク|hnRNP|en|Heterogeneous ribonucleoprotein particle}} (heterogeneous nuclear ribonucleoprotein) として知られる複合体中の様々なタンパク質と相互作用している。5'キャップの付加は転写と同時に起こり、転写後修飾の最初のステップである。3'のポリ(A)テールは、転写が完了した後に付加される。 |
|||
RNAスプライシングは[[スプライソソーム]]と呼ばれる複合体によって行われ、[[イントロン]]、もしくはタンパク質をコードしていない領域がpre-mRNAから除去され、残った[[エクソン]]が1本の連続的なRNA分子として再形成される。このプロセスは通常、5'キャッピングと3'ポリアデニル化の後に起こるが、多数のエクソンからなる転写産物の場合は転写が完了する前に開始される<ref name="Lodish" />。[[抗体]]をコードするものをはじめとして、多くのpre-mRNAが複数通りにスプライシングされ、異なるタンパク質配列をコードする成熟RNAが作り出される。このプロセスは[[選択的スプライシング|オルタナティブスプライシング]]として知られ、限られた量のDNAから多様なタンパク質を作り出すことが可能となっている。{{Clear}} |
|||
== ダイナミクスと調節 == |
|||
=== 核輸送 === |
|||
{{Main|en:Nuclear transport}} |
|||
[[Image:RanGTPcycle.png|360px|right|thumb|RNAやタンパク質のような巨大分子は、{{仮リンク|Ran (タンパク質)|en|Ran (protein)|label=Ran}}-GTP核輸送サイクルと呼ばれるプロセスによって、[[核膜]]を越えた[[能動輸送]]が行われる。]] |
|||
巨大分子の核への出入りは、核膜孔複合体によって緊密に制御されている。低分子は調節を受けずに核へ入ることができるが<ref name="Watson">{{cite book|last=Watson|first=JD|title=Molecular Biology of the Gene|edition=5th|year=2004|publisher=Peason Benjamin Cummings; CSHL Press.|isbn=0-8053-9603-9|chapter=Ch9–10|author2=Baker TA|author3=Bell SP|author4=Gann A|author5=Levine M|author6=Losick R.}}</ref>、RNAやタンパク質のような高分子は、核へ入るには[[インポーチン]]、核から出るには[[エクスポーチン]]と呼ばれる{{仮リンク|カリオフェリン|en|Karyopherin}}との相互作用を必要とする。細胞質から核へ移行するべき「積み荷」タンパク質には、{{仮リンク|核局在化シグナル|en|Nuclear localization sequence}}と呼ばれる短いアミノ酸配列があり、そこへインポーチンが結合する。一方、核から細胞質へ輸送されるべきものには[[核外搬出シグナル]]があり、エクスポーチンが結合する。インポーチンとエクスポーチンによる輸送は、[[グアノシン三リン酸|GTP]]を[[加水分解]]してエネルギーを放出する酵素、[[GTPアーゼ]]によって調節されている。核輸送における主要なGTPアーゼは{{仮リンク|Ran (タンパク質)|en|Ran (protein)|label=Ran}}であり、核に位置するか細胞質に位置するかに応じて、GTPか[[グアノシン二リン酸|GDP]]のどちらかを結合する。インポーチンはRan-GTPによって積み荷を解離するが、エクスポーチンは積み荷と結合するためにRan-GTPを必要とする<ref name="Pemberton" />。 |
|||
核内輸送は細胞質でのインポーチンの積み荷への結合に依存し、核膜孔を通って核へ移動する、核内では、Ran-GTPがインポーチンから積み荷を降ろすために働き、インポーチンは核を出て再利用される。核外輸送も同様であり、エクスポーチンはRan-GTPに促進される形で核内の積み荷と結合し、核膜孔を通って外へ出て、細胞質で積み荷を降ろす。 |
|||
転写後修飾が完了した後の、成熟したmRNAや[[転移RNA|tRNA]]の細胞質への移動のためには、特別なタンパク質が存在する。mRNAやtRNAはタンパク質の翻訳で中心的な役割を果たすため、この品質管理メカニズムは重要である。不完全なイントロンの除去や誤ったアミノ酸の組み込みによって誤ったタンパク質が発現されてしまうと、細胞にはネガティブな結果が生じる。そのため、細胞質に到着した修飾が不完全なRNAは、翻訳よりも分解が行われる<ref name="Lodish" />。 |
|||
=== 組み立てと解体 === |
|||
[[File:Mitosis-fluorescent.jpg|thumb|left|230px|[[蛍光色素]]で染色された、[[細胞分裂]]の{{仮リンク|中期 (細胞分裂)|en|Metaphase|label=中期}}の[[イモリ]]の[[肺]]の細胞。緑色に染色された[[紡錘体]]へ、青色に染色された2組の[[染色体]]が付着している。1本を除きすべての染色体がすでに赤道面 (metaphase plate) に位置している。]] |
|||
[[細胞分裂]]のプロセス、または[[アポトーシス]]の結果 ([[プログラム細胞死]]のプロセス) として、核は分解されたり破壊されたりする。これらのイベント中に、核の構造的要素 ([[核膜]]や{{仮リンク|核ラミナ|en|Nuclear lamina}}) は分解される。ほとんどの細胞で、核膜の解体は細胞分裂の[[前期 (細胞分裂)|前期]]の終わりに起こる。しかし、核の解体は細胞分裂の普遍的な特徴ではなく、すべての細胞で起こるのではない。いくつかの[[単細胞生物|単細胞]]の真核生物 ([[酵母]]など) ではいわゆる "closed mitosis" が起こり、核膜は保持されたままである。closed mitosis では、娘染色体は核の両極に移動し、その後2つに分割される。一方、高等真核生物の細胞では、通常 "open mitosis" が起こり、核膜の崩壊で特徴づけられる。娘染色体は[[紡錘体]]の両極に移動し、新たな核がその周辺で再集合する。 |
|||
細胞周期の特定の時点で、細胞は2つへ分裂する。このプロセスが可能となるためには、新しい娘細胞のそれぞれが遺伝子の完全なセットを持っていなければならず、染色体を複製するだけでなく、それぞれを別々のセットへと分離することが必要とされる。これは、複製された染色体 ([[姉妹染色分体]]) が、[[微小管]]を介して異なる[[中心体]]と結合されているようにすることで行われる。その後、姉妹染色分体は細胞の別々の位置へと引き離される。多くの細胞では、中心体は核の外部、細胞質に位置しており、核膜が存在していると微小管が染色分体へ結合することができない<ref name="Lippincott-Schwartz">{{cite journal|last=Lippincott-Schwartz|first=Jennifer|date=7 March 2002|title=Cell biology: Ripping up the nuclear envelope|journal=Nature|volume=416|issue=6876|pages=31–32|doi=10.1038/416031a|pmid=11882878}}</ref>。そのため、細胞周期の初期の段階、前期に始まり{{仮リンク|前中期 (細胞分裂)|en|Prometaphase|label=前中期}}の頃までに、核膜は分解される<ref name="RGoldman" />。同様に、CDC2のような[[プロテインキナーゼ]]による[[ラミン]]の[[リン酸化]]で調節されるプロセスで、同じ時期に核ラミナも分解される<ref name="Boulikas">{{cite journal|author=Boulikas T|year=1995|title=Phosphorylation of transcription factors and control of the cell cycle|journal=Crit Rev Eukaryot Gene Expr|volume=5|issue=1|pages=1–77|pmid=7549180}}</ref>。細胞周期の終了へ向けて、核膜は再形成され、ほぼ同じ時期に核ラミナもラミンの脱リン酸化によって再集合する<ref name="Boulikas" />。 |
|||
一方、[[渦鞭毛藻]]では、核膜は保持されたままであり、中心体は細胞質に位置している。微小管の centromeric region は核膜に取り込まれ、染色体と接触する (closed mitosis with extranuclear spindle)。他の多くの[[原生生物]] ([[繊毛虫]]や[[胞子虫]]など) や[[菌類]]は、中心体が核内にあるため、細胞分裂中も核膜は解体されない。 |
|||
[[アポトーシス]]は、細胞の構造要素が破壊される制御されたプロセスであり、細胞死が誘導される。アポトーシスに関連した変化は、直接的に核やその内容物に影響を与え、クロマチンは濃縮され、核膜や核ラミナは解体される。ラミンのネットワークの破壊は、[[カスパーゼ]]と呼ばれるアポトーシスを進行させる特別な[[プロテアーゼ]]によって制御され、ラミンが切断されることで核の構造的完全性が破壊される。アポトーシスの初期活性のアッセイにおいて、ラミンの切断はカスパーゼ活性の実験的指標として用いられることもある<ref name="RGoldman" />。カスパーゼによって切断されない変異型ラミンを発現する細胞は、アポトーシスに関連した核の変化が見られず、ラミンがアポトーシスによる核の分解を開始する役割を担っていることが示唆される<ref name="RGoldman" />。ラミンの重合の阻害は、アポトーシスの誘導因子となる<ref name="Steen">{{cite journal|year=2001|title=Mistargeting of B-type lamins at the end of mitosis: implications on cell survival and regulation of lamins A/C expression|journal=J Cell Biol|volume=153|issue=3|pages=621–626|doi=10.1083/jcb.153.3.621|pmid=11331311|pmc=2190567|vauthors=Steen R, Collas P}}</ref>。 |
|||
核膜は、[[DNAウイルス]]や[[RNAウイルス]]が核へ進入するのを防ぐ障壁として機能している。いくつかのウイルスは、自身の複製と組み立てのために核内のタンパク質にアクセスする必要がある。[[ヘルペスウイルス]]のようなDNAウイルスは、核内で複製と組み立てを行い、核の内膜からの出芽によって外部へ出る。このプロセスは、内膜の核側のラミナの分解を伴っている<ref name="RGoldman" />。 |
|||
=== 疾患に関連したダイナミクス === |
|||
かつては、一般的に[[免疫グロブリン]]、特に[[自己抗体]]は核内へ進入することはないと考えられていた。現在では、病的状態 ([[全身性エリテマトーデス]]など) においては[[免疫グロブリンG|IgG]]が核に進入するという一連のエビデンスが存在する<ref name=":14">Böhm I. IgG deposits can be detected in cell nuclei of patients with both lupus erythematosus and malignancy. ''Clin Rheumatol'' 2007;26(11) 1877–1882</ref>。 |
|||
== 核が特徴的な細胞の例 == |
== 核が特徴的な細胞の例 == |
||
真核生物のほとんどの細胞種は通常、核を1つだけ持っているが、いくつかには核が存在せず、他のものは複数の核を持っている。哺乳類の[[赤血球]]の成熟のように正常な発生の結果であることも、細胞分裂時の欠陥から生じている場合もある。 |
|||
=== 多核体 === |
|||
多核体(たかくたい)は、合胞体(ごうほうたい)、シンシチウム(syncytium)、coenocyte、apocyte、polykaryocyteとも呼ばれ、1個の細胞に核がたくさんある細胞のことで、核が1個ある通常の細胞が細胞融合して形成されたものや、[[細胞質分裂]]を行わずに[[核分裂]]のみが進行した細胞。 |
|||
=== 多核細胞 === |
|||
; [[骨格筋]]の[[筋細胞]] |
|||
: 筋肉の長軸方向に伸びる非常に大型の細胞で、1個の細胞を筋線維とも呼ぶ。この細胞は、筋肉の分化過程で多数の筋芽細胞が細胞融合してできる。長い筋肉の端から端まで強い力を出すために、細胞内に規則正しく配列した[[筋原線維]]([[アクチン]]と[[ミオシン]])によって発生した張力を効率的に筋肉全体の力とするために役立っていると考えられている。 |
|||
多核細胞は複数の核を持つ細胞である。原生生物の[[アカンタリア]]のほとんどの種<ref name="Zettler">{{cite journal|last=Zettler|first=LA|year=1997|date=|title=Phylogenetic relationships between the Acantharea and the Polycystinea: A molecular perspective on Haeckel's Radiolaria|url=|journal=Proc Natl Acad Sci USA|volume=94|issue=21|pages=11411–11416|doi=10.1073/pnas.94.21.11411|pmid=9326623|pmc=23483|author2=Sogin ML|author3=Caron DA}}</ref>と[[菌根]]菌のいくつかの種<ref name="Horton">{{cite journal|last=Horton|first=TR|year=2006|title=The number of nuclei in basidiospores of 63 species of ectomycorrhizal Homobasidiomycetes|journal=Mycologia|volume=98|issue=2|pages=233–238|doi=10.3852/mycologia.98.2.233|pmid=16894968}}</ref>は、通常多核である。他の例としては、[[ジアルジア]]属の腸管寄生体があり、細胞当たり2つの核を持つ<ref name=":15">{{cite journal|author=Adam RD|date=December 1991|title=The biology of Giardia spp|url=http://mmbr.asm.org/cgi/pmidlookup?view=long&pmid=1779932|journal=Microbiol. Rev.|volume=55|issue=4|pages=706–32|pmid=1779932|pmc=372844}}</ref>。ヒトでは、[[骨格筋]]の筋細胞や[[破骨細胞]]などが多核である。また、giant multinucleated cell として知られる、[[単球]]と[[マクロファージ]]が融合した細胞が[[炎症]]に伴って生じることがあり<ref name="McInnes">{{cite journal|last=McInnes|first=A|year=1988|date=|title=Interleukin 4 induces cultured monocytes/macrophages to form giant multinucleated cells|journal=J Exp Med|volume=167|issue=2|pages=598–611|doi=10.1084/jem.167.2.598|pmid=3258008|pmc=2188835|author2=Rennick DM}}</ref>、[[腫瘍]]形成とも関係している可能性がある<ref name="Goldring">{{cite journal|last=Goldring|first=SR|year=1987|title=Human giant cell tumors of bone identification and characterization of cell types|journal=J Clin Invest|volume=79|issue=2|pages=483–491|doi=10.1172/JCI112838|pmid=3027126|pmc=424109|author2=Roelke MS|author3=Petrison KK|author4=Bhan AK}}</ref>。 |
|||
; [[胎盤]]の絨毛膜絨毛の合胞体栄養膜細胞 |
|||
多くの[[渦鞭毛藻]]も2つの核を持つことが知られている<ref name="Imanian2012">{{cite journal|last1=Imanian|first1=B|last2=Pombert|first2=JF|last3=Dorrell|first3=RG|last4=Burki|first4=F|last5=Keeling|first5=PJ|year=2012|title=Tertiary endosymbiosis in two dinotoms has generated little change in the mitochondrial genomes of their dinoflagellate hosts and diatom endosymbionts|journal=PLOS ONE|volume=7|issue=8|page=e43763|doi=10.1371/journal.pone.0043763|pmid=22916303|pmc=3423374}}</ref>。他の多核細胞とは異なり、2つの核はDNAの系統が異なる。1つは渦鞭毛藻のもので、もう1つは共生した[[珪藻]]のものである。珪藻由来の[[ミトコンドリア]]と[[色素体]]も機能的なままである。 |
|||
; 骨格筋の筋細胞 |
|||
: 筋肉の長軸方向に伸びる非常に大型の細胞で、1個の細胞を筋線維とも呼ぶ。この細胞は、筋肉の分化過程で多数の筋芽細胞が細胞融合してできる。長い筋肉の端から端まで強い力を出すために、細胞内に規則正しく配列した[[筋原線維]]([[アクチン]]と[[ミオシン]])によって発生した張力を効率的に筋肉全体の力とするために役立っていると考えられている<ref name="Lodish" />。 |
|||
;[[胎盤]]の絨毛膜絨毛の合胞体栄養膜細胞 |
|||
: 合胞体栄養膜細胞(ごうほうたいえいようまくさいぼう、syncytiotrophoblast)は、[[胎盤]]にあって、胎児の血液と母体の血液とが混ざらないような仕組み「胎盤関門」を構成している。胎児の血管が通る絨毛膜絨毛の外側をすっぽりと被い、その外側の母体血との間で物質が自由に移動できないようになっている。細胞性栄養膜が[[細胞融合]]して形成される。 |
: 合胞体栄養膜細胞(ごうほうたいえいようまくさいぼう、syncytiotrophoblast)は、[[胎盤]]にあって、胎児の血液と母体の血液とが混ざらないような仕組み「胎盤関門」を構成している。胎児の血管が通る絨毛膜絨毛の外側をすっぽりと被い、その外側の母体血との間で物質が自由に移動できないようになっている。細胞性栄養膜が[[細胞融合]]して形成される。 |
||
; |
;[[骨髄造血細胞]]の[[巨核球]] |
||
: 巨核球(きょかくきゅう、Megakaryocyte)[[血小板]]のもとになる細胞で[[骨髄]]中に存在し周りの細胞よりひときわ大きい。 |
: 巨核球(きょかくきゅう、Megakaryocyte)[[血小板]]のもとになる細胞で[[骨髄]]中に存在し周りの細胞よりひときわ大きい。 |
||
; 骨中の |
; 骨中の破骨細胞 |
||
: 骨を溶かし、再構築にかかわる。 |
: 骨を溶かし、再構築にかかわる。 |
||
=== |
=== 無核細胞 === |
||
; [[赤血球]] |
|||
[[Image:redbloodcells.jpg|thumb|230px|right|ヒトの赤血球は、他の哺乳類と同様、核を失う。これは細胞の分化の正常な過程である。]] |
|||
: 赤血球は成熟に際し、酸素を運搬するという役割に特化するためにすべての細胞小器官を吐き出す。核もその例外ではなく、それゆえ ''[[in vivo]]'' でも3ヶ月程度の寿命しか持たず、老化した際は異物として異化される。 |
|||
<!-- |
|||
=== 分葉核をもつ細胞 === |
|||
;[[顆粒白血球]]: |
|||
;巨核球: |
|||
=== 核が2つある細胞 === |
|||
--> |
|||
無核細胞は核を持っておらず、そのため、分裂して娘細胞を生み出すことはできない。最もよく知られた無核細胞は哺乳類の赤血球である。また、[[被子植物]]の{{仮リンク|師管要素|en|Sieve tube element}}も核を持たない。無核細胞は細胞分裂の欠陥からも生じることがあり、一方の娘細胞は無核細胞に、他方は2つの核を持つ細胞となる。 |
|||
{{Commonscat|Cell nucleus}} |
|||
; 赤血球 |
|||
: 赤血球は成熟に際し、酸素を運搬するという役割に特化するためにすべての細胞小器官を吐き出す。核もその例外ではなく、それゆえ ''[[in vivo]]'' でも3ヶ月程度の寿命しか持たず、老化した際は異物として異化される。骨髄での{{仮リンク|赤血球生成|en|Erythropoiesis}}において、核は[[赤芽球]]から[[網赤血球]]への[[細胞分化|分化]]の過程で排出される<ref name="Skutelsky">{{cite journal|last=Skutelsky|first=E.|date=June 1970|title=Comparative study of nuclear expulsion from the late erythroblast and cytokinesis|journal=J Cell Biol|volume=60|issue=60(3)|pages=625–635|doi=10.1016/0014-4827(70)90536-7|pmid=5422968|author2=Danon D.}}</ref>。[[変異原]]の存在下では、未成熟な小核赤血球 (micornucleated erythrocyte) の血流への放出が誘導される<ref name="Torous">{{cite journal|last=Torous|first=DK|year=2000|date=|title=Enumeration of micronucleated reticulocytes in rat peripheral blood: a flow cytometric study|url=|journal=Mutat Res|volume=465|issue=465(1–2)|pages=91–99|doi=10.1016/S1383-5718(99)00216-8|pmid=10708974|author2=Dertinger SD|author3=Hall NE|author4=Tometsko CR.}}</ref><ref name="Hutter">{{cite journal|last=Hutter|first=KJ|year=1982|title=Rapid detection of mutagen induced micronucleated erythrocytes by flow cytometry|url=|journal=Histochemistry|volume=75|issue=3|pages=353–362|doi=10.1007/bf00496738|pmid=7141888|author2=Stohr M.}}</ref>。 |
|||
== 進化 == |
|||
核は真核生物の細胞を定義づける主要な特徴であるので、核の進化的起源は多くの思索の対象となってきた。核の存在を説明するために4つの主要な仮説が提唱されているが、どれもいまだ広範な支持を得るには至っていない<ref name="Pennisi">{{cite journal|author=Pennisi E.|year=2004|title=Evolutionary biology. The birth of the nucleus|journal=Science|volume=305|issue=5685|pages=766–768|doi=10.1126/science.305.5685.766|pmid=15297641}}</ref>。 |
|||
最初のモデルは「栄養共生モデル」(syntrophic model) として知られるもので、[[古細菌]]と[[細菌]]の[[共生]]関係が核を持つ真核生物細胞を作り出したと提唱する。古細菌[[ドメイン (分類学)|ドメイン]]・細菌ドメインの生物は核を持たない<ref name=":16">C.Michael Hogan. 2010. [http://www.eoearth.org/article/Archaea?topic=49496 ''Archaea''. eds. E.Monosson & C.Cleveland, Encyclopedia of Earth. National Council for Science and the Environment, Washington DC.] {{webarchive|url=https://web.archive.org/web/20110511133400/http://www.eoearth.org/article/Archaea?topic=49496|date=11 May 2011}}</ref>。現代の[[メタン菌]]に似た古代の古細菌が、現代の[[粘液細菌]]に似た細菌に侵入して生息したことに起源を持ち、最終的に初期の核が形成されたという仮説が立てられている。この理論は、真核生物の[[ミトコンドリア]]と[[葉緑体]]の起源について広く受け入れられている理論 ([[細胞内共生説]]) と類似したもので、その理論ではミトコンドリアと葉緑体は原始的な真核生物と[[好気性生物|好気性細菌]]との[[内生生物|内部共生]]関係から発展したと考えられている<ref name="Margulis">{{cite book|author=Margulis, Lynn|title=Symbiosis in Cell Evolution|year=1981|publisher=W. H. Freeman and Company|isbn=0-7167-1256-3|pages=206–227|location=San Francisco}}</ref>。核が古細菌起源であることは、古細菌と真核生物が[[ヒストン]]を含む、ある種のタンパク質について似た遺伝子を持つことから支持される。粘液細菌が運動性であり、多細胞の複合体を形成することができ、真核生物と似た[[キナーゼ]]と[[Gタンパク質]]を持つことから、真核細胞が細菌起源であることが支持される<ref name="Lopez-Garcia">{{cite journal|year=2006|title=Selective forces for the origin of the eukaryotic nucleus|journal=BioEssays|volume=28|issue=5|pages=525–533|doi=10.1002/bies.20413|pmid=16615090|vauthors=Lopez-Garcia P, Moreira D}}</ref>。 |
|||
2番目のモデルでは、原始的な真核生物は細菌から、内部共生段階を経ることなく進化したと提唱される。このモデルは現代の[[プランクトミケス門]]の細菌の存在に基づいており、それらには原始的な孔を持つ核構造と他の区画化された膜構造が存在する<ref name="Fuerst">{{cite journal|author=Fuerst JA.|year=2005|title=Intracellular compartmentation in planctomycetes|journal=Annu Rev Microbiol|volume=59|issue=|pages=299–328|doi=10.1146/annurev.micro.59.030804.121258|pmid=15910279}}</ref>。同様のモデルでは、chronocyte と呼ばれる真核生物に似た細胞が最初に進化し、古細菌と細菌を[[食作用]]で取り込んで核と真核細胞が生み出されたという主張がなされている<ref name="Hartman">{{cite journal|year=2002|title=The origin of the eukaryotic cell: a genomic investigation|journal=Proc Natl Acad Sci U S A|volume=99|issue=3|pages=1420–1425|doi=10.1073/pnas.032658599|pmid=11805300|pmc=122206|vauthors=Hartman H, Fedorov A}}</ref>。 |
|||
最も議論の的となっているモデルは「[[細胞核ウイルス起源説]]」として知られ、膜結合性の核や他の真核生物の特徴は[[原核生物]]への[[ウイルス]]の感染によって生じたと仮定する。これは、直鎖状のDNA、mRNAのキャッピングといった、真核生物とウイルスの間の類似性に基づいている。このモデルの1つのバージョンでは、核は食作用と共に進化し、初期の細胞の「捕食者」が形成されたと示唆されている<ref name="Bell">{{cite journal|author=Bell PJ|date=September 2001|title=Viral eukaryogenesis: was the ancestor of the nucleus a complex DNA virus?|url=|journal=J. Mol. Evol.|volume=53|issue=3|pages=251–6|doi=10.1007/s002390010215|pmid=11523012}}</ref>。他のバージョンでは、真核生物は初期の古細菌への[[ポックスウイルス科|ポックスウイルス]]の感染によって生じたと提唱しており、これは現代のポックスウイルスと真核生物との[[DNAポリメラーゼ]]の類似性に基づいている<ref name="Takemura">{{cite journal|author=Takemura M|year=2001|title=Poxviruses and the origin of the eukaryotic nucleus|url=|journal=J Mol Evol|volume=52|issue=5|pages=419–425|doi=10.1007/s002390010171|pmid=11443345}}</ref><ref name="Villareal">{{cite journal|year=2000|title=A hypothesis for DNA viruses as the origin of eukaryotic replication proteins|journal=J Virol|volume=74|issue=15|pages=7079–7084|doi=10.1128/JVI.74.15.7079-7084.2000|pmid=10888648|pmc=112226|vauthors=Villarreal L, DeFilippis V}}</ref>。また、{{仮リンク|有性生殖の進化|en|Evolution of sexual reproduction}}という未解決の問題もこの仮説と関連している可能性があると示唆されている<ref name="Bell2">{{cite journal|author=Bell PJ|date=November 2006|title=Sex and the eukaryotic cell cycle is consistent with a viral ancestry for the eukaryotic nucleus|url=|journal=J. Theor. Biol.|volume=243|issue=1|pages=54–63|doi=10.1016/j.jtbi.2006.05.015|pmid=16846615}}</ref>。 |
|||
より近年に提唱された exomembrane hypothesis では、核は単一の祖先細胞に起源を持つとされ、祖先細胞は2つ目の細胞外膜を進化させ、内側の膜が元の細胞を包み込んで核膜となり、リボソームサブユニットのような内部で合成される細胞の構成要素の通り道として複雑な孔構造が進化したと示唆されている<ref name="deRoos">{{cite journal|author=de Roos AD|year=2006|title=The origin of the eukaryotic cell based on conservation of existing interfaces|journal=Artif Life|volume=12|issue=4|pages=513–523.|doi=10.1162/artl.2006.12.4.513|pmid=16953783}}</ref>。 |
|||
== 出典 == |
|||
{{Reflist|2}} |
|||
== 参考文献 == |
|||
{{Library resources box |
|||
|onlinebooks=yes |
|||
|by=no |
|||
|lcheading= Cell nuclei |
|||
}} |
|||
* {{cite journal |
|||
| last = Goldman |
|||
| first = Robert D. |
|||
| title = Nuclear lamins: building blocks of nuclear architecture |
|||
| journal = Genes Dev. |
|||
| issue = 5 |
|||
| pages = 533–547 |
|||
| year = 2002 |
|||
| doi = 10.1101/gad.960502 |
|||
| volume = 16 |
|||
| pmid = 11877373 |
|||
| last2 = Gruenbaum |
|||
| first2 = Y |
|||
| last3 = Moir |
|||
| first3 = RD |
|||
| last4 = Shumaker |
|||
| first4 = DK |
|||
| last5 = Spann |
|||
| first5 = TP |
|||
}} |
|||
:核のラミンについての総説。その構造とさまざまな機能について説明している。 |
|||
* {{cite journal | last = Görlich | first = Dirk | title = Transport between the cell nucleus and the cytoplasm | journal = Annu. Rev. Cell Dev. Biol. | volume = 15| issue = | pages = 607–660 | year = 1999 | pmid =10611974 | doi = 10.1146/annurev.cellbio.15.1.607 | last2 = Kutay | first2 = U }} |
|||
:核輸送についての総説。メカニズムの原理とさまざまな輸送経路について説明している。 |
|||
* {{cite journal | last = Lamond | first = Angus I. | title = Structure and Function in the Nucleus | journal = Science | volume = 280 | pages = 547–553 | date = 24 April 1998 | pmid =9554838 | doi = 10.1126/science.280.5363.547 | last2 = Earnshaw | first2 = WC | issue = 5363| url = http://azolla.fc.ul.pt/aulas/BiologiaCelular/docs/nucleo.pdf}} |
|||
:核についての総説。染色体の構造、核小体や他の核内構造体について記述している。 |
|||
* {{cite journal | author = Pennisi E.| title = Evolutionary biology. The birth of the nucleus | doi = 10.1126/science.305.5685.766| journal = Science | volume = 305 | issue =5685 | pages = 766–768 | year =2004 | pmid = 15297641}} |
|||
:核の進化についての総説。さまざまな理論について説明している。 |
|||
* {{cite book |
|||
| last = Pollard |
|||
| first = Thomas D. |
|||
|author2=William C. Earnshaw |
|||
| title = Cell Biology |
|||
| publisher = Saunders |
|||
| year = 2004 |
|||
| location = Philadelphia |
|||
| isbn = 0-7216-3360-9}} |
|||
:細胞生物学に焦点を絞った大学レベルの教科書。核の構造と機能、核輸送、核内ドメインについての情報が含まれる。 |
|||
== 外部リンク == |
|||
{{Commons category|Cell nucleus}} |
|||
* [http://www.mechanobio.info/topics/cellular-organization/go-0005634 MBInfo – The Nucleus] |
|||
* [http://www.cellnucleus.com/education_main.htm cellnucleus.com] Website covering structure and function of the nucleus from the Department of Oncology at the University of Alberta. |
|||
* http://npd.hgu.mrc.ac.uk/user/?page=compartment The Nuclear Protein Database] Information on nuclear components. |
|||
* [https://web.archive.org/web/20061112023405/http://cellimages.ascb.org/cdm4/browse.php?CISOROOT=%2Fp4041coll6 The Nucleus Collection] in the [http://cellimages.ascb.org/ Image & Video Library] of [http://www.ascb.org/ The American Society for Cell Biology] contains peer-reviewed still images and video clips that illustrate the nucleus. |
|||
* [https://web.archive.org/web/20061117175431/http://cellimages.ascb.org/u/?%2Fp4041coll11%2C62 Nuclear Envelope and Nuclear Import Section] from [https://web.archive.org/web/20070306232601/http://cellimages.ascb.org/cdm4/browse.php?CISOROOT=%2Fp4041coll11 ''Landmark Papers in Cell Biology],'' Joseph G. Gall, J. Richard McIntosh, eds., contains digitized commentaries and links to seminal research papers on the nucleus. Published online in the [http://cellimages.ascb.org/ Image & Video Library] of [http://www.ascb.org/ The American Society for Cell Biology] |
|||
* [https://web.archive.org/web/20070102032704/http://www.antibodypatterns.com/cytoplasmic.php Cytoplasmic patterns generated by human antibodies] |
|||
{{細胞小器官}} |
{{細胞小器官}} |
||
{{Biosci-stub}} |
{{Biosci-stub}} |
||
{{Authority control}} |
|||
{{DEFAULTSORT:さいほうかく}} |
{{DEFAULTSORT:さいほうかく}} |
||
2019年1月23日 (水) 03:06時点における版


細胞核(さいぼうかく、英: cell nucleus)とは、真核生物の細胞を構成する細胞小器官のひとつ。細胞の遺伝情報の保存と伝達を行い、ほぼすべての細胞に存在する。通常は単に核ということが多い。
細胞核は細胞の遺伝物質の大部分を含んでおり、複数の長い直鎖状のDNA分子がさまざまな種類のタンパク質 (ヒストンなど) と複合体を形成することで、染色体が形成されている。これらの染色体の内部の遺伝子が核ゲノムを構成しており、細胞の機能を促進するよう構造化されている。核は遺伝子の完全性を維持し、遺伝子発現の調節により細胞の活動を制御する。すなわち、核は細胞のコントロールセンターである。核を作り上げている主要な構造は核膜と核マトリックスである。核膜は核全体を包む2層の脂質二重膜で、その内容物を細胞質から分離している。核マトリックス (核ラミナもこれに含まれる) は核内部のネットワーク構造で、細胞を支える細胞骨格のように、核構造の機械的支持を行っている。
巨大な分子は核膜を透過できないので、核膜を越える輸送の調節には核膜孔が必要とされる。孔は二重膜を貫通しており、輸送タンパク質による能動輸送を必要とする巨大分子が通過するためのチャネルとなっている一方、低分子やイオンは自由に移動する。タンパク質やRNAなどの巨大分子の孔を通っての移動は、遺伝子発現と染色体の維持の両方のプロセスに必要とされる。核の内部には膜結合性の小区画は存在しないが、その内容物が一様であるわけではなく、特定のタンパク質、RNA分子、染色体の特定の部分から構成される、多数の核内構造体が存在する。最もよく知られているのは核小体で、主にリボソームの組み立てに関与している。リボソームは核小体で合成された後、細胞質へ輸送されてmRNAの翻訳を行う。
歴史


核は最初に発見された細胞小器官である。現存する最古の描画はおそらく、初期の顕微鏡学者であったアントニ・ファン・レーウェンフック (1632–1723) によるものである。彼はサケの赤血球細胞の中に "lumen" を観察した[1]。哺乳類とは異なり、他の脊椎動物の赤血球は核を持っている。
また、核はオーストリアの植物画家フランツ・バウアーによって1802年[2]または1804年[3]に記述された。イギリスの植物学者ロバート・ブラウン(Robert Brown、1773年12月21日 - 1858年6月10日)により1831年に再発見され、ロンドン・リンネ協会で発表された。ブラウンは顕微鏡下でランの研究をしている際、花の外層の細胞に不透明な領域を発見し、それを"areola"または"nucleus"と名付けた[4]。
ブラウンはその領域の機能については示唆しなかったが、1838年にマティアス・ヤーコプ・シュライデンは、核が細胞を生成する役割を持つと提唱し、"cytoblast"という名称を導入した。彼は、新しい細胞が"cytoblast"の周辺に集まっているのを観察したと信じていた。フランツ・ユリウス・フェルディナント・マイエンはこの見方の強固な反対者で、細胞が分裂によって増殖することをすでに記述しており、多くの細胞は核を持たないと信じていた。"cytoblast"か何かによって細胞が「新たに」生じるという考えは、「全ての細胞は細胞から生じる」("Omnis cellula e cellula") という新たなパラダイムを決定的に広めた、ロベルト・レーマク (1852) とルドルフ・ルートヴィヒ・カール・フィルヒョウ (1855) の業績とも矛盾していた。核の機能は依然不明なままであった[5]。
1877年から1878年の間に、オスカー・ヘルトヴィヒはウニの卵の孵化に関するいくつかの研究を発表し、精子の核が卵母細胞に進入し、その核と融合することを示した。これは、個体が1個の有核細胞から発生することを初めて示唆したものであった。またこれは、種の系統発生は胚の発生中に完全に反復され、原始的な粘液体 ("Urschleim") の構造化されていない塊 ("monerula") から最初の有核細胞が発生する、としていたエルンスト・ヘッケルの理論と矛盾するものであった。しかし、ヘルトヴィヒは両生類や軟体動物など、他の動物群を用いて自身の観察を確証した。エドゥアルト・シュトラスブルガーは、1884年に植物でも同じ結果を得た。ここから、遺伝における重要な役割を核へ割り当てる道が開かれた。1873年にアウグスト・ヴァイスマンは、遺伝に関しては母系と父系の生殖細胞が等価であると予想した。核の遺伝情報の保持機能は、有糸分裂が発見され、メンデルの法則が20世紀の初めに再発見されるまで明らかにされなかった。その後、遺伝の染色体説が発展した[5]。
構造
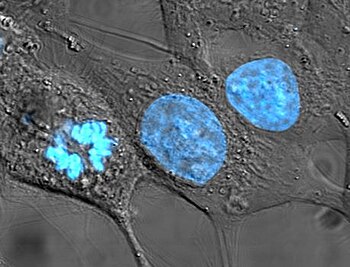
通常、核は細胞に1つある(例外は後述)。核は動物細胞で最大の細胞小器官である[6]。哺乳類の細胞では、核の直径は約 6 µm であり、細胞の総体積の約10%を占める[7]。核の内部の粘性の液体は核質と呼ばれ、その組成は核外の細胞質基質と類似している[8]。外観は、濃密で球形または不定形の細胞小器官である。ある種の白血球細胞、特に顆粒球では、核には切れ込み (lobation) が入っており、二裂、三裂、または多数に分裂した形で存在する。
また、核内には1つ以上の核小体がある。細胞の他の部分(細胞質)とは、核膜と呼ばれる2層の脂質二重膜によって隔てられており、核と細胞質間で物質輸送が行われるときには、核膜に空いた多くの穴(核膜孔)を通って行われる場合が多い。核内には遺伝情報であるDNAのほか、核タンパク質、RNA(リボ核酸)が含まれており、DNAの遺伝情報は核でRNAに転写される。細胞分裂時には、核内のDNAは凝集し、染色体と呼ばれる棒状の構造をとり、細胞分裂後の2つの細胞に分かれて移動する。このとき、核の表面は二重の核膜で包まれる。その後、それぞれの細胞では、再び核が形成され、染色体が消失、DNAが核内に広がる。
核内には、糸状に連なったDNA分子が結合蛋白質と複合体を構成しながら散らばっており、クロマチン(chromatin)あるいは染色質と呼ばれる。染色質の名前は、ヘマトキシリン染色などの染色を施した細胞を光学顕微鏡で観察すると、核内が濃く染色されることに由来する。クロマチンは大きく2種類に分けられる。
- ユークロマチン(euchromatin)、あるいは真正染色質 - RNA転写活性が高く、DNAがよく広がり、多種の蛋白質と共存する部位
- ヘテロクロマチン(heterochromatin)、あるいは異質染色質 - 遺伝子発現が不活性化され、DNAと結合蛋白質の複合体は凝集されたままの状態になっている部位
核膜と核膜孔
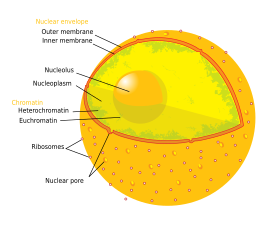

核膜は、内膜と外膜の2層の脂質二重膜によって構成される。内膜と外膜は互いに平行で 10–50 nm 離れている。核膜は核を完全に包んで細胞質から遺伝物質を分離するとともに、高分子が核質と細胞質の間を自由に拡散することを防ぐ障壁の役割を果たしている[9]。外膜は粗面小胞体の膜と連続しており、粗面小胞体膜と同様にリボソームが点在している[9]。内膜と外膜の間の領域は perinuclear space と呼ばれ、粗面小胞体内腔と連続している。
核膜孔は核膜を通過するチャネルである。複数のタンパク質から構成されており、それらはヌクレオポリンと総称されている。核膜孔はおよそ 125 MDa で、約50 (酵母) から 数百 (脊椎動物) のタンパク質で構成されている[6]。孔の直径は約 100 nm であるが、孔の中心部には調節システムが位置しているため、分子が自由に拡散する間隙は約 9 nm の幅しかない。このサイズ選択性のため、水溶性の低分子は通過できる一方、核酸やタンパク質などの巨大な分子は不適切な出入りが防がれており、核内外への輸送は能動的になされる必要がある。典型的な哺乳類細胞の核膜には約3000から4000の核膜孔があり[10]、内膜と外膜が融合する地点のそれぞれに8回対称のリング状の構造が存在している[11]。そのリングから核質側へは核バスケット (nuclear basket) と呼ばれる構造が突出しており、細胞質側へは一連のフィラメントが伸びている。両方の構造が核輸送タンパク質の結合に関与している[6]。
ほとんどのタンパク質、リボソームのサブユニット、そしていくつかのDNAは、カリオフェリンとして知られる輸送因子ファミリーによって、核膜孔複合体を通って輸送される。核内への移動を媒介するカリオフェリンはインポーチン、核外への移動を媒介するものはエクスポーチンと呼ばれる。ほとんどのカリオフェリンはその積み荷 (cargo) と直接相互作用するが、いくつかのものはアダプタータンパク質を利用する[12]。コルチゾールやアルドステロンのようなステロイドホルモンや、細胞間シグナル伝達に関与する他の脂溶性低分子は細胞膜を通過して細胞質へ拡散するが、そこで核内受容体に結合し核へと輸送される。核内受容体はリガンドが結合時には転写因子として機能し、リガンドがないときには、その多くが遺伝子発現を抑制するヒストン脱アセチル化酵素として機能する[6]。
核ラミナ
動物細胞では、2種類の中間径フィラメントのネットワークによって核は機械的に支持されている。核ラミナは核膜の内側にメッシュ状に組織されたネットワークを形成しており、細胞質側は比較的組織されていない。両方のシステムが核膜の機械的支持や、染色体や核膜孔のアンカー部位として機能している[7]。
核ラミナの大部分はラミンタンパク質で構成されている。他の全てのタンパク質と同様、ラミンは細胞質で合成される。その後、核の内部へ輸送され、そこで重合して既存の核ラミナのネットワークに組み込まれる[13][14]。核ラミナは核膜内側のエメリン、細胞質側のネスプリンなどを介して細胞骨格と連結されている[15]。ラミンは核質の内部にも見つかり、核質ヴェール (nucleoplasmic veil) として知られる、蛍光顕微鏡で観察可能な別の構造を形成している[16]。このヴェールの機能は不明だが、核小体からは排除されており、細胞周期の間期に存在する[17]。ラミンの構造体はクロマチンと相互作用しており、これらの構造を破壊するとタンパク質をコードする遺伝子の転写が阻害される[18]。
他の中間径フィラメントの構成要素と同様に、ラミンの単量体はα-ヘリカルドメインを持っており、2分子の単量体が互いに巻きついてコイルドコイルと呼ばれる二量体構造を形成する。そして、2つの二量体が逆平行の配置で並んで結合し、プロトフィラメント (protofilament) と呼ばれる四量体が形成される。さらに8つのプロトフィラメントが並んでねじられ、ロープ状のフィラメントが形成される。これらのフィラメントが動的に重合・脱重合を行い、その競合によってフィラメントの長さが変化する[7]。
フィラメント重合に欠陥が生じるラミン遺伝子の変異は、ラミノパシーとして知られる一群の稀な遺伝子疾患の原因となる。ラミノパシーで最も有名なものはプロジェリアとして知られる疾患ファミリーであり、患者には早期の老化が引き起こされる。老化の表現型を生じさせる生化学的変化の正確なメカニズムは、まだよく理解されていない[19]。
染色体

細胞核には、複数の直鎖状のDNA分子の形で細胞の遺伝物質の大部分が含まれており (少数の遺伝子はミトコンドリアと、植物では葉緑体にも存在している)、DNA分子は染色体と呼ばれる構造に組織化される。ヒトの各細胞は大雑把に見積もって約 2 m のDNAを含んでいる。細胞周期のほとんどの期間、これらはクロマチンとして知られるDNA-タンパク質複合体に組織されている。細胞分裂の間クロマチンは、核型の図で馴染み深い、染色体を形成しているのが観察される。
クロマチンには2つのタイプが存在する。ユークロマチンはDNAが比較的コンパクトに納まっていない形態で、高頻度で発現している遺伝子を含んでいる[20]。他のタイプであるヘテロクロマチンはよりコンパクトな形態で、低頻度で転写されるDNAが含まれる。ヘテロクロマチンはさらに、特定の細胞種または特定の発生ステージでのみヘテロクロマチンとして組織化される条件的ヘテロクロマチン (facultative heterochromatin) と、テロメアやセントロメアのような染色体の構造的要素からなる構成的ヘテロクロマチン (constitutive heterochromatin) とに分類される[21]。間期を通じて、クロマチンは染色体テリトリー (chromosome territory) と呼ばれる個別のパッチ状の組織となっている[22][23]。一般的に染色体のユークロマチン領域に見つかる活性型の遺伝子は、染色体テリトリーの境界に位置する傾向がある[24]。
特定のタイプのクロマチン組織、特にヌクレオソームに対する抗体は、全身性エリテマトーデスのような多くの自己免疫疾患と関連している[25]。これらは抗核抗体として知られており、多発性硬化症の患者でも、その病態とは関連しないものの、一般的な免疫不全の一部として高頻度で観察される[26]。
核小体


核小体は、濃密に染色される構造体として核内に存在している。核小体は膜に囲まれておらず、サブオルガネラ (suborganelle) と呼ばれることもある。リボソームRNA (rRNA) をコードするDNA (rDNA) のタンデムリピートの周囲に形成される。これらの領域は核小体形成域 (nucleolus organizer region) と呼ばれる。核小体の主な役割はrRNAの合成とリボソームの組み立てである。核小体の構造的凝集はその活性に依存している。核小体でのリボソームの組み立てが核小体構成要素の一時的な結合をもたらし、それによってさらにリボソームの組み立てが促進され、さらに結合が行われる。このモデルは、rDNAの不活性化によって核小体構造が混合するという観察によって支持されている[27]。
リボソームの組み立ての最初のステップでは、RNAポリメラーゼIと呼ばれるタンパク質がrDNAを転写し、大きなpre-rRNA前駆体が形成される。そして、5.8S、18S、28S rRNAのサブユニットへ切断される[28]。転写と転写後プロセシング、そしてrRNAの組み立ては、核小体低分子RNA (snoRNA) の助けによって行われる。そのいくつかは、リボソームの機能に関連する遺伝子をコードするmRNAからスプライシングされたイントロンに由来する。組み立てられたリボソームのサブユニットは核膜孔を通過する最も大きな構造である[6]。
電子顕微鏡による観察では、核小体は3つの判別可能な領域から構成されていることが観察される。最も内側の fibrillar center (FC)、それを取り囲む濃密な dense fibrillar component (DFC)、外側の境界部の granular component (GC) である。rDNAの転写はFCまたはFC-DFC境界で起こり、そのため、細胞でrRNAの転写が増加すると、より多くのFCが検出されるようになる。rRNAの切断と修飾の大部分はDFCで行われ、リボソームサブユニットへのタンパク質の組み込みを伴う後半のステップはGCで行われる[28]。
他の核内構造体
| 構造の名称 | 構造の直径 | 出典 |
|---|---|---|
| カハール体 | 0.2–2.0 µm | [29] |
| クラストソーム | 0.2–0.5 µm | [30] |
| PIKA | 5 µm | [31] |
| PML体 | 0.2–1.0 µm | [32] |
| パラスペックル | 0.5–1.0 µm | [33] |
| 核スペックル | 20–25 nm | [31] |
核小体以外にも、核には膜で区切られていない構造体が多数含まれている。カハール体 (Cajal body)、GEMs (Gemini of coiled bodies)、PIKA (polymorphic interphase karyosomal association)、PML体 (promyelocytic leukaemia body)、パラスペックル (paraspeckle)、核スペックル (speckle, splicing speckle) などの構造体が知られている。これらの構造体の機能はあまり解明されていないが、核質が一様な混合物ではなく、むしろ組織化された機能的なサブドメインを含むものであることを示している[32]。
他の核内構造体は、疾患の異常なプロセスの一部として出現する。例えば、ネマリンミオパチーのいくつかの症例では、核内に小さな桿状の構造体の存在が報告されている。これは典型的にはアクチンの変異によるものであり、桿状構造は変異体アクチンやの細胞骨格タンパク質から構成されている[34]。
カハール体とGem
典型的な核には、カハール体 (カハール小体、カハールボディ、Cajal body) またはコイル体 (coiled body) と呼ばれる1個から10個のコンパクトな構造が存在し、その直径は生物種や細胞種によって異なるが 0.2 µm から 2.0 µm 程度である[29]。電子顕微鏡下での観察では、糸が絡まった球のような形状をしており[31]、濃密な中心部 (foci) にはタンパク質コイリンが分布している[35]。カハール体はRNAのプロセシングに関する多数の異なる役割に関与しており、特に、核小体低分子RNA (snoRNA) や核内低分子RNA (snRNA) の成熟や、ヒストンのmRNAの修飾などに関与している[29]。
カハール体に類似した構造として、Gem (Gem小体、Gems、Gemini of coiled bodies、Gemini of Cajal bodies) がある。その名前はふたご座 (Gemini) に由来し、カハール体との緊密な関係を表している。Gemはカハール体と似た大きさと形状であり、実際、顕微鏡下で視覚的に区別することはできない[35]。カハール体とは異なり、Gemは核内低分子リボ核タンパク質(snRNP) を含まないが、snRNPの生合成に関連した機能を持つSMNタンパク質 (survival of motor neuron) を含んでいる[36]。 電子顕微鏡による微細構造の解析によって、Gemとカハール体との差異はコイリンにあることが示された。すなわち、カハール体はSMNとコイリンを含んでおり、GemはSMNを含むがコイリンを含まない[37]。
PIKAとPTFドメイン
PIKA (polymorphic interphase karyosomal association) またはRAFAドメインは、1991年の顕微鏡研究で初めて記述された。その機能は未だ明らかではないが、DNA複製、転写、そしてRNAのプロセシングには関与していないと考えられている[38]。snRNAの転写を促進する転写因子PTFの濃密な局在によって定義される別のドメインとしばしば相互作用していることが判明している[39]。
PML体
PML体 (PML小体、PMLボディ、promyelocytic leukaemia body) は核質中に分散して存在する球形の構造体で、大きさは約 0.1–1.0 µm である。他の名称が多く付けられており、nuclear domain 10 (ND10)、Kremer body、PML oncogenic domain などとも呼ばれる。PML体の名称は、主要な構成要素であるPMLタンパク質 (promyelocytic leukaemia protein) に由来する。核内でカハール体や cleavage body と関連して存在しているのがしばしば観察される[32]。PML体は、核内のはっきりしない超構造である核マトリックスに属しており、DNA複製、転写、エピジェネティックなサイレンシングなど、多くの核の機能のアンカーとなって調節を行っていると提唱されている[40]。PMLタンパク質はこのドメインを組織する主要な因子であり、リクルートされるタンパク質の数は増え続けているが、報告されている機能に唯一共通するものはSUMO化である。しかし、PML遺伝子が欠失し核内構造体が形成されないマウスも発生は正常であるため、PML体はほとんどの基礎的な生物学的機能には必要ないことが示されている[40]。
核スペックル
核スペックル (スペックル、スプライシングスペックル、speckle) は、pre-mRNAスプライシング因子に富む核内構造体で、哺乳類細胞の核質のクロマチン間領域 (interchromatin region) に位置している。蛍光顕微鏡のレベルでは不定形の点状構造で大きさや形も様々であるが、電子顕微鏡ではクロマチン間顆粒 (interchromatin granule) のクラスターとして観察される。核スペックルは動的な構造で、タンパク質やRNA-タンパク質複合体の構成要素は絶えずスペックル間や、転写の活性部位を含む、核の他の領域を循環している。核スペックルの構成要素、構造、挙動についての研究からは、核の機能的区画化と、遺伝子発現装置、スプライシングsnRNP、他のpre-mRNAスプライシングに必要なタンパク質の組織化に関与しているというモデルが立てられている[41][42][43][44]。細胞が必要とするものの変化によって、これらの構造体の構成要素や位置も、mRNAの転写や特定のタンパク質のリン酸化による調節を通じて変化する[45]。核スペックルは上に挙げた名称の他にも、splicing factor compartment (SF compartment)、interchromatin granule cluster (IGC)、B snurposomes などとして知られる[46]。B snurposome は両生類の卵母細胞の核や、キイロショウジョウバエの胚で観察されている。両生類の核の電子顕微鏡像からは、B snurposome は単独で存在するか、カハール体に付着しているように見える[47]。IGC はスプライシング因子の貯蔵部位として機能している[48]。
パラスペックル
Foxらによって2002年に発見されたパラスペックル (paraspeckle) は、核のクロマチン間領域の不定形の区画である[49]。最初に報告されたのはHeLa細胞においてであり、その核には一般的に10個から30個存在するとされた[50]。現在では、全ての初代培養細胞、形質転換細胞株、組織切片に存在することが知られている[51]。その名称は核での分布に由来するもので、"para"は"parallel"の略、"speckle"は常に近接して存在する核スペックルを指している[50]。
パラスペックルは動的な構造で、細胞の代謝活性の変化に反応して変化する。転写に依存的で[49]、RNAポリメラーゼIIによる転写がないときにはパラスペックルは消失し、全ての関連するタンパク質の構成要素 (PSP1、p54nrb、PSP2、CFI(m)68、PSF) は核小体で三日月型のキャップ構造 (perinucleolar cap) を形成する。この現象は細胞周期中でも確認されている。パラスペックルは間期を通じて存在し、有糸分裂中も終期を除いて存在する。2つの娘細胞の核が形成される終期にはRNAポリメラーゼIIによる転写が行われないため、タンパク質構成要素は代わりに perinucleolar cap を形成する[51]。
Perichromatin fibril
Perichromatin fibril (クロマチン周囲の線維状の構造物) は、電子顕微鏡下でのみ観察可能である。転写が活発なクロマチンに隣接して位置し、pre-mRNAのプロセシングが活発に行われている場所であるという仮説が立てられている[48]。
クラストソーム
クラストソーム (clastosome) は小さな構造体で (0.2–0.5 µm)、構造体周縁部のカプセルのために厚いリング状に観察される[30]。その名称はギリシャ語の klastos (壊れた) と soma (体) に由来する[30]。クラストソームは典型的には通常の細胞に存在せず、検出することは難しい。核内部のタンパク質分解活性が高いときに形成され、活性が低下するか、細胞がプロテアソーム阻害剤によって処理されると分解される[30][52]。クラストソームが細胞にわずかしか存在しないということは、それがプロテアソームの機能に必須なわけではないことを示している[53]。浸透圧ストレスも、クラストソームの形成を引き起こすことが示されている[54]。この核内構造体は、プロテアソームの触媒サブユニットと調節サブユニット、そしてその基質を含んでおり、タンパク質分解部位であることが示唆される[53]。
機能
核は、細胞質での翻訳部位から隔離された、遺伝子の転写のための場所を提供し、原核生物にはないレベルでの遺伝子調節を可能にしている。核の主要な機能は遺伝子発現の制御と細胞周期中のDNA複製の媒介である。核膜によって完全に包まれたその内部には、細胞の遺伝物質の大部分が含まれている。この物質はDNA分子で構成されており、さまざまなタンパク質ととともに染色体を形成している。
細胞の区画化
核膜によって、核はその内容物を制御し、細胞質部分から隔離されている。このことは、核膜の両側でのプロセスの制御に重要である。細胞質でのプロセスの制限の必要がある場合、ほとんどの場合主要な関与因子は核へ除去され、そこで転写因子と相互作用し関連する酵素の生産がダウンレギュレーションされる。この調節メカニズムは、エネルギー産生のためにグルコースを分解する経路である、解糖系でも行われている。ヘキソキナーゼは解糖系の最初のステップを担う酵素であり、グルコースからグルコース-6-リン酸を形成する。グルコース-6-リン酸から合成される分子であるフルクトース-6-リン酸が高濃度で存在すると、調節タンパク質によってヘキソキナーゼは核へ除去され[55]、そこで核のタンパク質と転写抑制複合体を形成して解糖系に関与する遺伝子の発現を低下させる[56]。
遺伝子発現を調節するいくつかの転写因子はDNAから分離され、他のシグナル伝達経路によって活性化されない限りそれらが物理的にDNAにアクセスすることがないようになっている。これによって、不適切な遺伝子発現が防がれている。例えば、ほとんどの炎症反応に関与するNF-κBによって制御される遺伝子の場合、シグナリング分子TNF-αによるシグナル伝達経路が開始され転写が誘導される。TNF-αが細胞膜の受容体に結合するとシグナリングタンパク質は膜へリクルートされ、最終的にNF-κBが活性化される。NF-κBの核局在化シグナルによって核膜孔を通って核へ輸送され、標的遺伝子の転写が促進される[7]。
また、区画化によって、スプライシングされていないmRNAの翻訳が防がれている[57]。真核生物のmRNAはイントロンを含んでおり、機能的なタンパク質への翻訳にはイントロンの除去が必要である。スプライシングは、リボソームがmRNAにアクセスする前に核内で行われる。核がなければ、リボソームは転写されたばかりの (プロセシングされていない) mRNAを翻訳してしまい、欠陥があるか機能しないタンパク質が合成されてしまうと考えられる。
遺伝子発現

遺伝子発現はまず転写を伴い、DNAがRNAを合成するための鋳型として用いられる。タンパク質をコードする遺伝子の場合、このプロセスで合成されるRNAはmRNAであり、タンパク質を合成するには、その後リボソームによってmRNAが翻訳される必要がある。リボソームは核の外部に位置しているため、合成されたmRNAは核外へ輸送されなければならない[58]。
核は転写が行われる部位であり、転写に直接関与したり転写過程の調節に関与したりするさまざまな種類のタンパク質が含まれている。これらには、二本鎖DNAをほどいてアクセスを促進するヘリカーゼ、DNAのプロモーター領域に結合してRNA分子を合成するRNAポリメラーゼ、DNAのスーパーコイル構造を変化させてDNAの巻き戻しなどを助けるトポイソメラーゼ、発現を調節するさまざまな種類の転写因子などが含まれる[59]。
pre-mRNAのプロセシング
新しく合成されたmRNA分子は、一次転写産物またはpre-mRNAとして知られている。それらは、細胞質へ輸送される前に核内で転写後修飾を受けなければならず、これらの修飾を受けずに細胞質へ移動したmRNAは、タンパク質への翻訳よりも分解が行われる。行われる修飾は、5'キャッピング、3'ポリアデニル化、そしてRNAスプライシングである。核内では、pre-mRNAは hnRNP (heterogeneous nuclear ribonucleoprotein) として知られる複合体中の様々なタンパク質と相互作用している。5'キャップの付加は転写と同時に起こり、転写後修飾の最初のステップである。3'のポリ(A)テールは、転写が完了した後に付加される。
RNAスプライシングはスプライソソームと呼ばれる複合体によって行われ、イントロン、もしくはタンパク質をコードしていない領域がpre-mRNAから除去され、残ったエクソンが1本の連続的なRNA分子として再形成される。このプロセスは通常、5'キャッピングと3'ポリアデニル化の後に起こるが、多数のエクソンからなる転写産物の場合は転写が完了する前に開始される[6]。抗体をコードするものをはじめとして、多くのpre-mRNAが複数通りにスプライシングされ、異なるタンパク質配列をコードする成熟RNAが作り出される。このプロセスはオルタナティブスプライシングとして知られ、限られた量のDNAから多様なタンパク質を作り出すことが可能となっている。
ダイナミクスと調節
核輸送

巨大分子の核への出入りは、核膜孔複合体によって緊密に制御されている。低分子は調節を受けずに核へ入ることができるが[60]、RNAやタンパク質のような高分子は、核へ入るにはインポーチン、核から出るにはエクスポーチンと呼ばれるカリオフェリンとの相互作用を必要とする。細胞質から核へ移行するべき「積み荷」タンパク質には、核局在化シグナルと呼ばれる短いアミノ酸配列があり、そこへインポーチンが結合する。一方、核から細胞質へ輸送されるべきものには核外搬出シグナルがあり、エクスポーチンが結合する。インポーチンとエクスポーチンによる輸送は、GTPを加水分解してエネルギーを放出する酵素、GTPアーゼによって調節されている。核輸送における主要なGTPアーゼはRanであり、核に位置するか細胞質に位置するかに応じて、GTPかGDPのどちらかを結合する。インポーチンはRan-GTPによって積み荷を解離するが、エクスポーチンは積み荷と結合するためにRan-GTPを必要とする[12]。
核内輸送は細胞質でのインポーチンの積み荷への結合に依存し、核膜孔を通って核へ移動する、核内では、Ran-GTPがインポーチンから積み荷を降ろすために働き、インポーチンは核を出て再利用される。核外輸送も同様であり、エクスポーチンはRan-GTPに促進される形で核内の積み荷と結合し、核膜孔を通って外へ出て、細胞質で積み荷を降ろす。
転写後修飾が完了した後の、成熟したmRNAやtRNAの細胞質への移動のためには、特別なタンパク質が存在する。mRNAやtRNAはタンパク質の翻訳で中心的な役割を果たすため、この品質管理メカニズムは重要である。不完全なイントロンの除去や誤ったアミノ酸の組み込みによって誤ったタンパク質が発現されてしまうと、細胞にはネガティブな結果が生じる。そのため、細胞質に到着した修飾が不完全なRNAは、翻訳よりも分解が行われる[6]。
組み立てと解体

細胞分裂のプロセス、またはアポトーシスの結果 (プログラム細胞死のプロセス) として、核は分解されたり破壊されたりする。これらのイベント中に、核の構造的要素 (核膜や核ラミナ) は分解される。ほとんどの細胞で、核膜の解体は細胞分裂の前期の終わりに起こる。しかし、核の解体は細胞分裂の普遍的な特徴ではなく、すべての細胞で起こるのではない。いくつかの単細胞の真核生物 (酵母など) ではいわゆる "closed mitosis" が起こり、核膜は保持されたままである。closed mitosis では、娘染色体は核の両極に移動し、その後2つに分割される。一方、高等真核生物の細胞では、通常 "open mitosis" が起こり、核膜の崩壊で特徴づけられる。娘染色体は紡錘体の両極に移動し、新たな核がその周辺で再集合する。
細胞周期の特定の時点で、細胞は2つへ分裂する。このプロセスが可能となるためには、新しい娘細胞のそれぞれが遺伝子の完全なセットを持っていなければならず、染色体を複製するだけでなく、それぞれを別々のセットへと分離することが必要とされる。これは、複製された染色体 (姉妹染色分体) が、微小管を介して異なる中心体と結合されているようにすることで行われる。その後、姉妹染色分体は細胞の別々の位置へと引き離される。多くの細胞では、中心体は核の外部、細胞質に位置しており、核膜が存在していると微小管が染色分体へ結合することができない[61]。そのため、細胞周期の初期の段階、前期に始まり前中期の頃までに、核膜は分解される[16]。同様に、CDC2のようなプロテインキナーゼによるラミンのリン酸化で調節されるプロセスで、同じ時期に核ラミナも分解される[62]。細胞周期の終了へ向けて、核膜は再形成され、ほぼ同じ時期に核ラミナもラミンの脱リン酸化によって再集合する[62]。
一方、渦鞭毛藻では、核膜は保持されたままであり、中心体は細胞質に位置している。微小管の centromeric region は核膜に取り込まれ、染色体と接触する (closed mitosis with extranuclear spindle)。他の多くの原生生物 (繊毛虫や胞子虫など) や菌類は、中心体が核内にあるため、細胞分裂中も核膜は解体されない。
アポトーシスは、細胞の構造要素が破壊される制御されたプロセスであり、細胞死が誘導される。アポトーシスに関連した変化は、直接的に核やその内容物に影響を与え、クロマチンは濃縮され、核膜や核ラミナは解体される。ラミンのネットワークの破壊は、カスパーゼと呼ばれるアポトーシスを進行させる特別なプロテアーゼによって制御され、ラミンが切断されることで核の構造的完全性が破壊される。アポトーシスの初期活性のアッセイにおいて、ラミンの切断はカスパーゼ活性の実験的指標として用いられることもある[16]。カスパーゼによって切断されない変異型ラミンを発現する細胞は、アポトーシスに関連した核の変化が見られず、ラミンがアポトーシスによる核の分解を開始する役割を担っていることが示唆される[16]。ラミンの重合の阻害は、アポトーシスの誘導因子となる[63]。
核膜は、DNAウイルスやRNAウイルスが核へ進入するのを防ぐ障壁として機能している。いくつかのウイルスは、自身の複製と組み立てのために核内のタンパク質にアクセスする必要がある。ヘルペスウイルスのようなDNAウイルスは、核内で複製と組み立てを行い、核の内膜からの出芽によって外部へ出る。このプロセスは、内膜の核側のラミナの分解を伴っている[16]。
疾患に関連したダイナミクス
かつては、一般的に免疫グロブリン、特に自己抗体は核内へ進入することはないと考えられていた。現在では、病的状態 (全身性エリテマトーデスなど) においてはIgGが核に進入するという一連のエビデンスが存在する[64]。
核が特徴的な細胞の例
真核生物のほとんどの細胞種は通常、核を1つだけ持っているが、いくつかには核が存在せず、他のものは複数の核を持っている。哺乳類の赤血球の成熟のように正常な発生の結果であることも、細胞分裂時の欠陥から生じている場合もある。
多核細胞
多核細胞は複数の核を持つ細胞である。原生生物のアカンタリアのほとんどの種[65]と菌根菌のいくつかの種[66]は、通常多核である。他の例としては、ジアルジア属の腸管寄生体があり、細胞当たり2つの核を持つ[67]。ヒトでは、骨格筋の筋細胞や破骨細胞などが多核である。また、giant multinucleated cell として知られる、単球とマクロファージが融合した細胞が炎症に伴って生じることがあり[68]、腫瘍形成とも関係している可能性がある[69]。
多くの渦鞭毛藻も2つの核を持つことが知られている[70]。他の多核細胞とは異なり、2つの核はDNAの系統が異なる。1つは渦鞭毛藻のもので、もう1つは共生した珪藻のものである。珪藻由来のミトコンドリアと色素体も機能的なままである。
- 骨格筋の筋細胞
- 筋肉の長軸方向に伸びる非常に大型の細胞で、1個の細胞を筋線維とも呼ぶ。この細胞は、筋肉の分化過程で多数の筋芽細胞が細胞融合してできる。長い筋肉の端から端まで強い力を出すために、細胞内に規則正しく配列した筋原線維(アクチンとミオシン)によって発生した張力を効率的に筋肉全体の力とするために役立っていると考えられている[6]。
- 胎盤の絨毛膜絨毛の合胞体栄養膜細胞
- 合胞体栄養膜細胞(ごうほうたいえいようまくさいぼう、syncytiotrophoblast)は、胎盤にあって、胎児の血液と母体の血液とが混ざらないような仕組み「胎盤関門」を構成している。胎児の血管が通る絨毛膜絨毛の外側をすっぽりと被い、その外側の母体血との間で物質が自由に移動できないようになっている。細胞性栄養膜が細胞融合して形成される。
- 骨髄造血細胞の巨核球
- 巨核球(きょかくきゅう、Megakaryocyte)血小板のもとになる細胞で骨髄中に存在し周りの細胞よりひときわ大きい。
- 骨中の破骨細胞
- 骨を溶かし、再構築にかかわる。
無核細胞

無核細胞は核を持っておらず、そのため、分裂して娘細胞を生み出すことはできない。最もよく知られた無核細胞は哺乳類の赤血球である。また、被子植物の師管要素も核を持たない。無核細胞は細胞分裂の欠陥からも生じることがあり、一方の娘細胞は無核細胞に、他方は2つの核を持つ細胞となる。
- 赤血球
- 赤血球は成熟に際し、酸素を運搬するという役割に特化するためにすべての細胞小器官を吐き出す。核もその例外ではなく、それゆえ in vivo でも3ヶ月程度の寿命しか持たず、老化した際は異物として異化される。骨髄での赤血球生成において、核は赤芽球から網赤血球への分化の過程で排出される[71]。変異原の存在下では、未成熟な小核赤血球 (micornucleated erythrocyte) の血流への放出が誘導される[72][73]。
進化
核は真核生物の細胞を定義づける主要な特徴であるので、核の進化的起源は多くの思索の対象となってきた。核の存在を説明するために4つの主要な仮説が提唱されているが、どれもいまだ広範な支持を得るには至っていない[74]。
最初のモデルは「栄養共生モデル」(syntrophic model) として知られるもので、古細菌と細菌の共生関係が核を持つ真核生物細胞を作り出したと提唱する。古細菌ドメイン・細菌ドメインの生物は核を持たない[75]。現代のメタン菌に似た古代の古細菌が、現代の粘液細菌に似た細菌に侵入して生息したことに起源を持ち、最終的に初期の核が形成されたという仮説が立てられている。この理論は、真核生物のミトコンドリアと葉緑体の起源について広く受け入れられている理論 (細胞内共生説) と類似したもので、その理論ではミトコンドリアと葉緑体は原始的な真核生物と好気性細菌との内部共生関係から発展したと考えられている[76]。核が古細菌起源であることは、古細菌と真核生物がヒストンを含む、ある種のタンパク質について似た遺伝子を持つことから支持される。粘液細菌が運動性であり、多細胞の複合体を形成することができ、真核生物と似たキナーゼとGタンパク質を持つことから、真核細胞が細菌起源であることが支持される[77]。
2番目のモデルでは、原始的な真核生物は細菌から、内部共生段階を経ることなく進化したと提唱される。このモデルは現代のプランクトミケス門の細菌の存在に基づいており、それらには原始的な孔を持つ核構造と他の区画化された膜構造が存在する[78]。同様のモデルでは、chronocyte と呼ばれる真核生物に似た細胞が最初に進化し、古細菌と細菌を食作用で取り込んで核と真核細胞が生み出されたという主張がなされている[79]。
最も議論の的となっているモデルは「細胞核ウイルス起源説」として知られ、膜結合性の核や他の真核生物の特徴は原核生物へのウイルスの感染によって生じたと仮定する。これは、直鎖状のDNA、mRNAのキャッピングといった、真核生物とウイルスの間の類似性に基づいている。このモデルの1つのバージョンでは、核は食作用と共に進化し、初期の細胞の「捕食者」が形成されたと示唆されている[80]。他のバージョンでは、真核生物は初期の古細菌へのポックスウイルスの感染によって生じたと提唱しており、これは現代のポックスウイルスと真核生物とのDNAポリメラーゼの類似性に基づいている[81][82]。また、有性生殖の進化という未解決の問題もこの仮説と関連している可能性があると示唆されている[83]。
より近年に提唱された exomembrane hypothesis では、核は単一の祖先細胞に起源を持つとされ、祖先細胞は2つ目の細胞外膜を進化させ、内側の膜が元の細胞を包み込んで核膜となり、リボソームサブユニットのような内部で合成される細胞の構成要素の通り道として複雑な孔構造が進化したと示唆されている[84]。
出典
- ^ Leeuwenhoek, A. van: Opera Omnia, seu Arcana Naturae ope exactissimorum Microscopiorum detecta, experimentis variis comprobata, Epistolis ad varios illustres viros. J. Arnold et Delphis, A. Beman, Lugdinum Batavorum 1719–1730. Cited after: Dieter Gerlach, Geschichte der Mikroskopie. Verlag Harri Deutsch, Frankfurt am Main, Germany, 2009. ISBN 978-3-8171-1781-9.
- ^ Pederson, Thoru (2011-05-01). “The nucleus introduced”. Cold Spring Harbor Perspectives in Biology 3 (5). doi:10.1101/cshperspect.a000521. ISSN 1943-0264. PMC PMC3101846. PMID 20660024.
- ^ Harris, H (1999). The Birth of the Cell. New Haven: Yale University Press. ISBN 0-300-07384-4
- ^ Brown, Robert (1866). “On the Organs and Mode of Fecundation of Orchidex and Asclepiadea”. Miscellaneous Botanical Works I: 511–514.
- ^ a b Cremer, Thomas (1985). Von der Zellenlehre zur Chromosomentheorie. Berlin, Heidelberg, New York, Tokyo: Springer Verlag. ISBN 3-540-13987-7 Online Version here
- ^ a b c d e f g h Lodish, H; Berk A; Matsudaira P; Kaiser CA; Krieger M; Scott MP; Zipursky SL; Darnell J. (2004). Molecular Cell Biology (5th ed.). New York: WH Freeman. ISBN 0-7167-2672-6
- ^ a b c d Bruce Alberts; Alexander Johnson; Julian Lewis et al., eds (2002). Molecular Biology of the Cell, Chapter 4, pages 191–234 (4th ed.). Garland Science
- ^ Clegg JS (February 1984). “Properties and metabolism of the aqueous cytoplasm and its boundaries”. Am. J. Physiol. 246 (2 Pt 2): R133–51. PMID 6364846.
- ^ a b “Nuclear envelope permeability”. Nature 254 (5496): 109–114. (1975). doi:10.1038/254109a0. PMID 1117994.
- ^ Rodney Rhoades; Richard Pflanzer, eds (1996). “Ch3”. Human Physiology (3rd ed.). Saunders College Publishing
- ^ “Yeast nucleoporins involved in passive nuclear envelope permeability”. J Cell Biol 149 (5): 1027–1038. (2000). doi:10.1083/jcb.149.5.1027. PMC 2174828. PMID 10831607.
- ^ a b “Mechanisms of receptor-mediated nuclear import and nuclear export”. Traffic 6 (3): 187–198. (2005). doi:10.1111/j.1600-0854.2005.00270.x. PMID 15702987.
- ^ “Nuclear lamins: their structure, assembly, and interactions”. J Struct Biol 122 (1–2): 42–66. (1998). doi:10.1006/jsbi.1998.3987. PMID 9724605.
- ^ “Pathway of incorporation of microinjected lamin A into the nuclear envelope”. J Cell Biol 119 (4): 725–735. (1992). doi:10.1083/jcb.119.4.725. PMC 2289687. PMID 1429833.
- ^ Wehnert, Manfred S.; Nguyen, Thuy Duong; Meinke, Peter (2011-12-01). “The LINC complex and human disease” (英語). Biochemical Society Transactions 39 (6): 1693–1697. doi:10.1042/BST20110658. ISSN 1470-8752. PMID 22103509.
- ^ a b c d e “Nuclear lamins: building blocks of nuclear architecture”. Genes Dev 16 (5): 533–547. (2002). doi:10.1101/gad.960502. PMID 11877373.
- ^ “Nuclear Lamins A and B1: Different Pathways of Assembly during Nuclear Envelope Formation in Living Cells”. Journal of Cell Biology 151 (6): 1155–1168. (2000). doi:10.1083/jcb.151.6.1155. PMC 2190592. PMID 11121432.
- ^ Spann TP, Goldman AE, Wang C, Huang S, Goldman RD. (2002). “Alteration of nuclear lamin organization inhibits RNA polymerase II–dependent transcription”. Journal of Cell Biology 156 (4): 603–608. doi:10.1083/jcb.200112047. PMC 2174089. PMID 11854306.
- ^ “Aging and nuclear organization: lamins and progeria”. Current Opinion in Cell Biology 16 (3): 322–327. (2004). doi:10.1016/j.ceb.2004.03.009. PMID 15145358.
- ^ Ehrenhofer-Murray A (2004). “Chromatin dynamics at DNA replication, transcription and repair”. Eur J Biochem 271 (12): 2335–2349. doi:10.1111/j.1432-1033.2004.04162.x. PMID 15182349.
- ^ “The end adjusts the means: heterochromatin remodelling during terminal cell differentiation”. Chromosome Res 14 (1): 53–69. (2006). doi:10.1007/s10577-005-1021-6. PMID 16506096.
- ^ Schardin, Margit; Cremer, T; Hager, HD; Lang, M (December 1985). “Specific staining of human chromosomes in Chinese hamster x man hybrid cell lines demonstrates interphase chromosome territories”. Human Genetics (Springer Berlin / Heidelberg) 71 (4): 281–287. doi:10.1007/BF00388452. PMID 2416668.
- ^ Lamond, Angus I.; William C. Earnshaw (24 April 1998). “Structure and Function in the Nucleus”. Science 280 (5363): 547–553. doi:10.1126/science.280.5363.547. PMID 9554838.
- ^ Kurz, A; Lampel, S; Nickolenko, JE; Bradl, J; Benner, A; Zirbel, RM; Cremer, T; Lichter, P (1996). “Active and inactive genes localize preferentially in the periphery of chromosome territories”. The Journal of Cell Biology (The Rockefeller University Press) 135 (5): 1195–1205. doi:10.1083/jcb.135.5.1195. PMC 2121085. PMID 8947544. オリジナルの29 September 2007時点におけるアーカイブ。.
- ^ NF Rothfield; BD Stollar (1967). “The Relation of Immunoglobulin Class, Pattern of Antinuclear Antibody, and Complement-Fixing Antibodies to DNA in Sera from Patients with Systemic Lupus Erythematosus”. J Clin Invest 46 (11): 1785–1794. doi:10.1172/JCI105669. PMC 292929. PMID 4168731.
- ^ S Barned; AD Goodman; DH Mattson (1995). “Frequency of anti-nuclear antibodies in multiple sclerosis”. Neurology 45 (2): 384–385. doi:10.1212/WNL.45.2.384. PMID 7854544.
- ^ Hernandez-Verdun, Daniele (2006). “Nucleolus: from structure to dynamics”. Histochem. Cell. Biol 125 (1–2): 127–137. doi:10.1007/s00418-005-0046-4. PMID 16328431.
- ^ a b Lamond, Angus I.; Judith E. Sleeman (October 2003). “Nuclear substructure and dynamics”. Current Biology 13 (21): R825–828. doi:10.1016/j.cub.2003.10.012. PMID 14588256.
- ^ a b c “Cajal bodies: a long history of discovery”. Annu Rev Cell Dev Biol 21: 105–131. (2005). doi:10.1146/annurev.cellbio.20.010403.103738. PMID 16212489.
- ^ a b c d Lafarga, Miguel (1 August 2002). “Clastosome: A Subtype of Nuclear Body Enriched in 19S and 20S Proteasomes, Ubiquitin, and Protein Substrates of Proteasome”. Molecular Biology of the Cell 13 (8): 2771–2782. doi:10.1091/mbc.e02-03-0122. PMC 117941. PMID 12181345.
- ^ a b c Pollard, Thomas D.; William C. Earnshaw (2004). Cell Biology. Philadelphia: Saunders. ISBN 0-7216-3360-9
- ^ a b c Dundr, Miroslav; Tom Misteli (2001). “Functional architecture in the cell nucleus”. Biochem. J. 356 (Pt 2): 297–310. doi:10.1042/0264-6021:3560297. PMC 1221839. PMID 11368755.
- ^ Bond, Charles S.; Fox, Archa H. (2009). “Paraspeckles: nuclear bodies built on long noncoding RNA”. J. Cell Biol. 186 (5): 637–644. doi:10.1083/jcb.200906113.
- ^ Goebel, H.H.; I Warlow (January 1997). “Nemaline myopathy with intranuclear rods—intranuclear rod myopathy”. Neuromuscular Disorders 7 (1): 13–19. doi:10.1016/S0960-8966(96)00404-X. PMID 9132135.
- ^ a b “Coiled Bodies and Gems: Janus or Gemini?”. American Journal of Human Genetics 63 (2): 317–321. (1998). doi:10.1086/301992. PMC 1377332. PMID 9683623.
- ^ Matera, A. Gregory (1998). “Of Coiled Bodies, Gems, and Salmon”. Journal of Cellular Biochemistry 70 (2): 181–192. doi:10.1002/(sici)1097-4644(19980801)70:2<181::aid-jcb4>3.0.co;2-k. PMID 9671224.
- ^ “Compartmentalization within the nucleus: discovery of a novel subnuclear region.”. Journal of Cellular Biology 115 (4): 919–931. (1991). doi:10.1083/jcb.115.4.919. PMC 2289954. PMID 1955462.
- ^ “Regional and temporal specialization in the nucleus: a transcriptionally active nuclear domain rich in PTF, Oct1 and PIKA antigens associates with specific chromosomes early in the cell cycle”. The EMBO Journal 17 (6): 1768–1778. (1998). doi:10.1093/emboj/17.6.1768. PMC 1170524. PMID 9501098.
- ^ a b Lallemand-Breitenbach, V.; De The, H. (2010). “PML Nuclear Bodies”. Cold Spring Harbor Perspectives in Biology 2 (5): a000661. doi:10.1101/cshperspect.a000661. PMC 2857171. PMID 20452955.
- ^ “Nuclear speckles: a model for nuclear organelles”. Nature Reviews Molecular Cell Biology 4 (8): 605–12. (August 2003). doi:10.1038/nrm1172. PMID 12923522.
- ^ “Differential dynamics of splicing factor SC35 during the cell cycle” (PDF). J. Biosci. 33 (3): 345–54. (September 2008). doi:10.1007/s12038-008-0054-3. PMID 19005234. オリジナルの15 November 2011時点におけるアーカイブ。.
- ^ Tripathi, K.; Parnaik, V. K. (2008). “Differential dynamics of splicing factor SC35 during the cell cycle”. Journal of Biosciences 33 (3): 345–354. doi:10.1007/s12038-008-0054-3. PMID 19005234.
- ^ “Nuclear speckles: a model for nuclear organelles”. Nature Reviews Molecular Cell Biology 4 (8): 605–12. (August 2003). doi:10.1038/nrm1172. PMID 12923522.
- ^ Handwerger, Korie E.; Joseph G. Gall (January 2006). “Subnuclear organelles: new insights into form and function”. Trends in Cell Biology 16 (1): 19–26. doi:10.1016/j.tcb.2005.11.005. PMID 16325406.
- ^ “Cellular component Nucleus speckle”. UniProt: UniProtKB. 30 August 2013閲覧。
- ^ Gall, Joseph G.; Bellini, Michel; Wu, Zheng'an; Murphy, Christine (December 1999). “Assembly of the Nuclear Transcription and Processing Machinery: Cajal Bodies (Coiled Bodies) and Transcriptosomes”. Molecular Biology of the Cell 10 (12): 4385–4402. doi:10.1091/mbc.10.12.4385. ISSN 1059-1524. PMC 25765. PMID 10588665.
- ^ a b Matera, A. Gregory; Rebecca M. Terns; Michael P. Terns (March 2007). “Non-coding RNAs: lessons from the small nuclear and small nucleolar RNAs”. Nature Reviews Molecular Cell Biology 8 (3): 209–220. doi:10.1038/nrm2124. ISSN 1471-0072. PMID 17318225. オリジナルの26 September 2011時点におけるアーカイブ。 9 August 2013閲覧。.
- ^ a b Fox, Archa; Lam, YW; Leung, AK; Lyon, CE; Andersen, J; Mann, M; Lamond, AI (2002). “Paraspeckles: A Novel Nuclear Domain”. Current Biology 12 (1): 13–25. doi:10.1016/S0960-9822(01)00632-7. PMID 11790299.
- ^ a b Fox, Archa (2004年). “Nuclear Compartments: Paraspeckles”. Nuclear Protein Database. 10 September 2008時点のオリジナルよりアーカイブ。6 March 2007閲覧。
- ^ a b Fox, A. (2005). “P54nrb Forms a Heterodimer with PSP1 That Localizes to Paraspeckles in an RNA-dependent Manner”. Molecular Biology of the Cell 16 (11): 5304–5315. doi:10.1091/mbc.E05-06-0587. PMC 1266428. PMID 16148043.
- ^ Kong, Xiao-Ni; Yan, He-Xin; Chen, Lei; Dong, Li-Wei; Yang, Wen; Liu, Qiong; Yu, Le-Xing; Huang, Dan-Dan et al. (29 October 2007). “LPS-induced down-regulation of signal regulatory protein α contributes to innate immune activation in macrophages”. The Journal of Experimental Medicine 204 (11): 2719–2731. doi:10.1084/jem.20062611. ISSN 0022-1007. PMC 2118489. PMID 17954568.
- ^ a b Carmo-Fonseca, Maria; Berciano, Maria T.; Lafarga, Miguel (September 2010). “Orphan Nuclear Bodies”. Cold Spring Harbor Perspectives in Biology 2 (9): a000703. doi:10.1101/cshperspect.a000703. ISSN 1943-0264. PMC 2926751. PMID 20610547.
- ^ Sampuda, Katherine M.; Riley, Mason; Boyd, Lynn (19 April 2017). “Stress induced nuclear granules form in response to accumulation of misfolded proteins in Caenorhabditis elegans”. BMC Cell Biology 18 (1): 18. doi:10.1186/s12860-017-0136-x. ISSN 1471-2121. PMC 5395811. PMID 28424053.
- ^ Lehninger, Albert L.; Nelson, David L.; Cox, Michael M. (2000). Lehninger principles of biochemistry (3rd ed.). New York: Worth Publishers. ISBN 1-57259-931-6
- ^ “Glucose sensing through the Hxk2-dependent signalling pathway.”. Biochem Soc Trans 33 (1): 265–268. (2005). doi:10.1042/BST0330265. PMID 15667322.
- ^ Görlich, Dirk; Ulrike Kutay (1999). “Transport between the cell nucleus and the cytoplasm”. Annu. Rev. Cell Dev. Biol. 15 (1): 607–660. doi:10.1146/annurev.cellbio.15.1.607. PMID 10611974.
- ^ Nierhaus, Knud H.; Daniel N. Wilson (2004). Protein Synthesis and Ribosome Structure: Translating the Genome. Wiley-VCH. ISBN 3-527-30638-2
- ^ Nicolini, Claudio A. (1997). Genome Structure and Function: From Chromosomes Characterization to Genes Technology. Springer. ISBN 0-7923-4565-7
- ^ Watson, JD; Baker TA; Bell SP; Gann A; Levine M; Losick R. (2004). “Ch9–10”. Molecular Biology of the Gene (5th ed.). Peason Benjamin Cummings; CSHL Press.. ISBN 0-8053-9603-9
- ^ Lippincott-Schwartz, Jennifer (7 March 2002). “Cell biology: Ripping up the nuclear envelope”. Nature 416 (6876): 31–32. doi:10.1038/416031a. PMID 11882878.
- ^ a b Boulikas T (1995). “Phosphorylation of transcription factors and control of the cell cycle”. Crit Rev Eukaryot Gene Expr 5 (1): 1–77. PMID 7549180.
- ^ “Mistargeting of B-type lamins at the end of mitosis: implications on cell survival and regulation of lamins A/C expression”. J Cell Biol 153 (3): 621–626. (2001). doi:10.1083/jcb.153.3.621. PMC 2190567. PMID 11331311.
- ^ Böhm I. IgG deposits can be detected in cell nuclei of patients with both lupus erythematosus and malignancy. Clin Rheumatol 2007;26(11) 1877–1882
- ^ Zettler, LA; Sogin ML; Caron DA (1997). “Phylogenetic relationships between the Acantharea and the Polycystinea: A molecular perspective on Haeckel's Radiolaria”. Proc Natl Acad Sci USA 94 (21): 11411–11416. doi:10.1073/pnas.94.21.11411. PMC 23483. PMID 9326623.
- ^ Horton, TR (2006). “The number of nuclei in basidiospores of 63 species of ectomycorrhizal Homobasidiomycetes”. Mycologia 98 (2): 233–238. doi:10.3852/mycologia.98.2.233. PMID 16894968.
- ^ Adam RD (December 1991). “The biology of Giardia spp”. Microbiol. Rev. 55 (4): 706–32. PMC 372844. PMID 1779932.
- ^ McInnes, A; Rennick DM (1988). “Interleukin 4 induces cultured monocytes/macrophages to form giant multinucleated cells”. J Exp Med 167 (2): 598–611. doi:10.1084/jem.167.2.598. PMC 2188835. PMID 3258008.
- ^ Goldring, SR; Roelke MS; Petrison KK; Bhan AK (1987). “Human giant cell tumors of bone identification and characterization of cell types”. J Clin Invest 79 (2): 483–491. doi:10.1172/JCI112838. PMC 424109. PMID 3027126.
- ^ Imanian, B; Pombert, JF; Dorrell, RG; Burki, F; Keeling, PJ (2012). “Tertiary endosymbiosis in two dinotoms has generated little change in the mitochondrial genomes of their dinoflagellate hosts and diatom endosymbionts”. PLOS ONE 7 (8): e43763. doi:10.1371/journal.pone.0043763. PMC 3423374. PMID 22916303.
- ^ Skutelsky, E.; Danon D. (June 1970). “Comparative study of nuclear expulsion from the late erythroblast and cytokinesis”. J Cell Biol 60 (60(3)): 625–635. doi:10.1016/0014-4827(70)90536-7. PMID 5422968.
- ^ Torous, DK; Dertinger SD; Hall NE; Tometsko CR. (2000). “Enumeration of micronucleated reticulocytes in rat peripheral blood: a flow cytometric study”. Mutat Res 465 (465(1–2)): 91–99. doi:10.1016/S1383-5718(99)00216-8. PMID 10708974.
- ^ Hutter, KJ; Stohr M. (1982). “Rapid detection of mutagen induced micronucleated erythrocytes by flow cytometry”. Histochemistry 75 (3): 353–362. doi:10.1007/bf00496738. PMID 7141888.
- ^ Pennisi E. (2004). “Evolutionary biology. The birth of the nucleus”. Science 305 (5685): 766–768. doi:10.1126/science.305.5685.766. PMID 15297641.
- ^ C.Michael Hogan. 2010. Archaea. eds. E.Monosson & C.Cleveland, Encyclopedia of Earth. National Council for Science and the Environment, Washington DC. Archived 11 May 2011 at the Wayback Machine.
- ^ Margulis, Lynn (1981). Symbiosis in Cell Evolution. San Francisco: W. H. Freeman and Company. pp. 206–227. ISBN 0-7167-1256-3
- ^ “Selective forces for the origin of the eukaryotic nucleus”. BioEssays 28 (5): 525–533. (2006). doi:10.1002/bies.20413. PMID 16615090.
- ^ Fuerst JA. (2005). “Intracellular compartmentation in planctomycetes”. Annu Rev Microbiol 59: 299–328. doi:10.1146/annurev.micro.59.030804.121258. PMID 15910279.
- ^ “The origin of the eukaryotic cell: a genomic investigation”. Proc Natl Acad Sci U S A 99 (3): 1420–1425. (2002). doi:10.1073/pnas.032658599. PMC 122206. PMID 11805300.
- ^ Bell PJ (September 2001). “Viral eukaryogenesis: was the ancestor of the nucleus a complex DNA virus?”. J. Mol. Evol. 53 (3): 251–6. doi:10.1007/s002390010215. PMID 11523012.
- ^ Takemura M (2001). “Poxviruses and the origin of the eukaryotic nucleus”. J Mol Evol 52 (5): 419–425. doi:10.1007/s002390010171. PMID 11443345.
- ^ “A hypothesis for DNA viruses as the origin of eukaryotic replication proteins”. J Virol 74 (15): 7079–7084. (2000). doi:10.1128/JVI.74.15.7079-7084.2000. PMC 112226. PMID 10888648.
- ^ Bell PJ (November 2006). “Sex and the eukaryotic cell cycle is consistent with a viral ancestry for the eukaryotic nucleus”. J. Theor. Biol. 243 (1): 54–63. doi:10.1016/j.jtbi.2006.05.015. PMID 16846615.
- ^ de Roos AD (2006). “The origin of the eukaryotic cell based on conservation of existing interfaces”. Artif Life 12 (4): 513–523.. doi:10.1162/artl.2006.12.4.513. PMID 16953783.
参考文献
| 細胞核に関する 図書館収蔵著作物 |
- Goldman, Robert D.; Gruenbaum, Y; Moir, RD; Shumaker, DK; Spann, TP (2002). “Nuclear lamins: building blocks of nuclear architecture”. Genes Dev. 16 (5): 533–547. doi:10.1101/gad.960502. PMID 11877373.
- 核のラミンについての総説。その構造とさまざまな機能について説明している。
- Görlich, Dirk; Kutay, U (1999). “Transport between the cell nucleus and the cytoplasm”. Annu. Rev. Cell Dev. Biol. 15: 607–660. doi:10.1146/annurev.cellbio.15.1.607. PMID 10611974.
- 核輸送についての総説。メカニズムの原理とさまざまな輸送経路について説明している。
- Lamond, Angus I.; Earnshaw, WC (24 April 1998). “Structure and Function in the Nucleus”. Science 280 (5363): 547–553. doi:10.1126/science.280.5363.547. PMID 9554838.
- 核についての総説。染色体の構造、核小体や他の核内構造体について記述している。
- Pennisi E. (2004). “Evolutionary biology. The birth of the nucleus”. Science 305 (5685): 766–768. doi:10.1126/science.305.5685.766. PMID 15297641.
- 核の進化についての総説。さまざまな理論について説明している。
- Pollard, Thomas D.; William C. Earnshaw (2004). Cell Biology. Philadelphia: Saunders. ISBN 0-7216-3360-9
- 細胞生物学に焦点を絞った大学レベルの教科書。核の構造と機能、核輸送、核内ドメインについての情報が含まれる。
外部リンク
- MBInfo – The Nucleus
- cellnucleus.com Website covering structure and function of the nucleus from the Department of Oncology at the University of Alberta.
- http://npd.hgu.mrc.ac.uk/user/?page=compartment The Nuclear Protein Database] Information on nuclear components.
- The Nucleus Collection in the Image & Video Library of The American Society for Cell Biology contains peer-reviewed still images and video clips that illustrate the nucleus.
- Nuclear Envelope and Nuclear Import Section from Landmark Papers in Cell Biology, Joseph G. Gall, J. Richard McIntosh, eds., contains digitized commentaries and links to seminal research papers on the nucleus. Published online in the Image & Video Library of The American Society for Cell Biology
- Cytoplasmic patterns generated by human antibodies
