椎名エステル化反応
椎名エステル化反応(しいなエステルかはんのう、英: Shiina esterification)とは有機化学における化学反応のひとつで、芳香族カルボン酸無水物を脱水縮合剤に用いたエステルの合成法である。1994年にルイス酸触媒を用いる手法が[1][2]、2002年に求核性触媒を用いる手法が椎名勇によって報告された[3][4]。
機構
[編集]芳香族カルボン酸無水物と触媒の存在下、脂肪族カルボン酸にアルコールを加えると、下図の過程を経て対応するエステルが得られる。酸性条件での椎名エステル化ではルイス酸触媒が用いられ、塩基性条件での椎名エステル化では求核性触媒が用いられる。

酸性条件の反応では、まず、芳香族カルボン酸無水物にルイス酸触媒が作用し、活性化された芳香族カルボン酸無水物に脂肪族カルボン酸が反応することで混合酸無水物(Mixed Anhydride, MA)が一旦生成する。引き続き、MAに含まれる脂肪族カルボン酸部位が活性化を受け、片方のカルボニル炭素にアルコールが選択的に求核攻撃する。同時に、MAから生じた芳香族カルボン酸残基が脱プロトン化剤として働くことで脂肪族カルボン酸のエステルが生成する。反応の収支としては、芳香族カルボン酸無水物が原料から水分子1個分の原子を奪い、自らは2分子の芳香族カルボン酸となって反応が終結する。ルイス酸触媒は反応の最後に再生するので原料よりも少ない量で足りる。
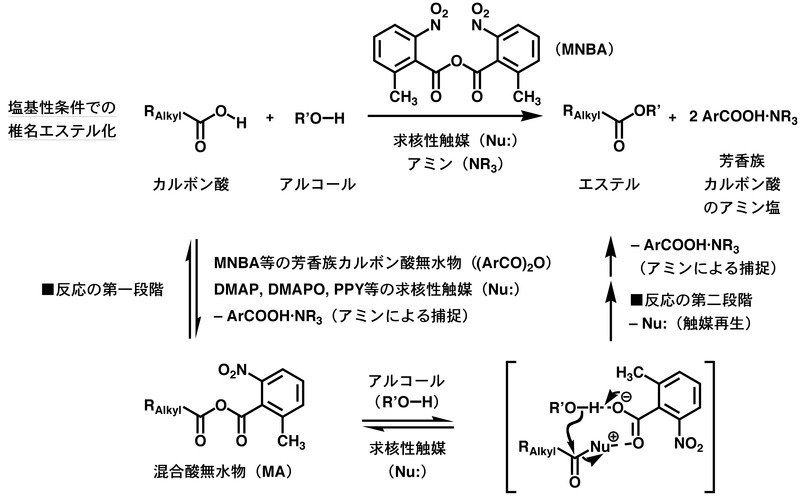
塩基性条件の反応では、2-メチル-6-ニトロ安息香酸無水物(MNBA)が脱水縮合剤として多用される[5]。MNBAを用いるエステル化の場合、まず、求核性触媒がMNBAに作用することで活性アシルカルボキシラートを与える。これに対して脂肪族カルボン酸が反応することで、酸性条件の反応と同様にMAが一旦生成する。続いて、求核性触媒がMAに含まれる脂肪族カルボン酸部位に選択的に作用することで活性アシルカルボキシラートを再度与える。カルボニル基にアルコールが求核攻撃し、同時に、2-メチル-6-ニトロ安息香酸のカルボキシラートアニオンが脱プロトン化剤として働くことで脂肪族カルボン酸のエステルが生成する。反応の収支としては、MNBAが原料から水分子1個分の原子を奪い、自らは2分子の2-メチル-6-ニトロ安息香酸のアミン塩となって反応が終結する。求核性触媒は反応の最後に再生するので原料よりも少ない量で足りる。
補足
[編集]椎名エステル化反応の過程は、最後のアルコールの求核攻撃以外はすべて可逆反応で構成されている。したがって、系内には芳香族カルボン酸無水物と混合酸無水物(MA)が共存する。さらに、MAが不均化して生じる脂肪族カルボン酸無水物も系内に同時に存在するがこれらは分離することなくそのまま混合物として使用される。三者の混合物がルイス酸触媒あるいは求核性触媒によって活性化されてアルコールと反応するので、目的とする脂肪族カルボン酸エステルのみならず、副生物である芳香族カルボン酸エステルが得られる可能性もある。
酸性条件の反応では、芳香族カルボン酸無水物として4-トリフルオロメチル安息香酸無水物(TFBA)、塩基性条件の反応では、芳香族カルボン酸無水物として2-メチル-6-ニトロ安息香酸無水物(MNBA)を用いることで副生物である芳香族カルボン酸エステルはほとんど得られなくなる。(化学選択性は200:1以上。)
椎名エステル化反応はカルボン酸とアルコールの分子間反応のみならず、ヒドロキシカルボン酸の分子内反応にも使われる(椎名ラクトン化反応)。分子間反応、分子内反応ともに様々な天然物や薬理活性化合物の人工合成に利用されている[6][7]。カルボン酸とアミンの反応ではアミドやペプチドも得られる[8]。
酸性条件の反応では、金属トリフラートなどのルイス酸触媒が高活性であり、塩基性条件の反応では、N,N-ジメチル-4-アミノピリジン(DMAP)、N,N-ジメチル-4-アミノピリジン N-オキシド(DMAPO)および4-ピロリジノピリジン(PPY)などが用いられる。
塩基性条件の椎名エステル化では、キラルな求核性触媒を併用することで不斉合成が実現されている。まず、キラルな求核性触媒の存在下、ラセミ脂肪族カルボン酸に適切なカルボン酸無水物を作用させることで対応するMAを発生させ、これにアキラルアルコールを反応させることでラセミカルボン酸の速度論的光学分割が行える[9]。この方法では光学活性なカルボン酸ならびに光学活性なカルボン酸エステルが得られる。また、反応剤の組合せを入れ替えてラセミアルコールの速度論的光学分割を実施することも可能である。すなわち、アキラル脂肪族カルボン酸と適切なカルボン酸無水物との反応によりMA を発生させ、これにラセミアルコールを作用させることで光学活性なアルコールならびに光学活性なカルボン酸エステルが得られる[10]。
脚注
[編集]- ^ Shiina, I.; Miyoshi, S.; Miyashita, M.; Mukaiyama, T. (1994). “A Useful Method for the Preparation of Carboxylic Esters from Free Carboxylic Acids and Alcohols”. Chem. Lett. 23 (3): 515. doi:10.1246/cl.1994.515.
- ^ Shiina, I. (2004). “An Effective Method for the Synthesis of Carboxylic Esters and Lactones Using Substituted Benzoic Anhydrides with Lewis Acid Catalysts”. Tetrahedron 60 (7): 1587. doi:10.1016/j.tet.2003.12.013.
- ^ Shiina, I.; Ibuka, R.; Kubota, M. (2002). “A New Condensation Reaction for the Synthesis of Carboxylic Esters from Nearly Equimolar Amounts of Carboxylic Acids and Alcohols Using 2-Methyl-6-nitrobenzoic Anhydride”. Chem. Lett. 31 (3): 286. doi:10.1246/cl.2002.286.
- ^ Shiina, I.; Kubota, M.; Oshiumi, H.; Hashizume, M. (2004). “An Effective Use of Benzoic Anhydride and Its Derivatives for the Synthesis of Carboxylic Esters and Lactones: A Powerful and Convenient Mixed Anhydride Method Promoted by Basic Catalysts”. J. Org. Chem. 69 (6): 1822. doi:10.1021/jo030367x.
- ^ Shiina, I.; Umezaki, Y.; Kuroda, N.; Iizumi, T.; Nagai, S.; Katoh, T. (2012). “MNBA-Mediated β-Lactone Formation: Mechanistic Studies and Application for the Asymmetric Total Synthesis of Tetrahydrolipstatin”. J. Org. Chem. 77 (11): 4885. doi:10.1021/jo300139r.
- ^ Shiina, I. (2007). “Total Synthesis of Natural 8- and 9-Membered Lactones: Recent Advancements in Medium-Sized Ring Formation”. Chem. Rev. 107 (1): 239. doi:10.1021/cr050045o.
- ^ Shiina, I. (2014). “An Adventurous Synthetic Journey with MNBA from Its Reaction Chemistry to the Total Synthesis of Natural Products”. Bull. Chem. Soc. Jpn. 87 (2): 196. doi:10.1246/bcsj.20130216.
- ^ Shiina, I.; Ushiyama, H.; Yamada, Y.; Kawakita, Y.; Nakata, K. (2008). “4-(Dimethylamino)pyridine N-oxide (DMAPO): an Effective Nucleophilic Catalyst in the Peptide Coupling Reaction with 2-Methyl-6-nitrobenzoic Anhydride”. Chem. Asian J. 3 (2): 454. doi:10.1002/asia.200700305.
- ^ Shiina, I.; Nakata, K.; Ono, K.; Onda, Y.; Itagaki, M. (2010). “Kinetic Resolution of Racemic α-Arylalkanoic Acids with Achiral Alcohols via the Asymmetric Esterification Using Carboxylic Anhydrides and Acyl-Transfer Catalysts”. J. Am. Chem. Soc. 132 (33): 11629. doi:10.1021/ja103490h.
- ^ Shiina, I.; Nakata, K.; Ono, K.; Sugimoto, M.; Sekiguchi, A. (2010). “Kinetic Resolution of the Racemic 2-Hydroxyalkanoates Using the Enantioselective Mixed-Anhydride Method with Pivalic Anhydride and a Chiral Acyl-Transfer Catalyst”. Chem. Eur. J. 16 (1): 167. doi:10.1002/chem.200902257.
関連項目
[編集]外部リンク
[編集]- Shiina, I.; Hashizume, M.; Yamai, Y.; Oshiumi, H.; Shimazaki, T.; Takasuna, Y.; Ibuka, R. (2005). “Enantioselective Total Synthesis of Octalactin A Using Asymmetric Aldol Reactions and a Rapid Lactonization To Form a Medium-Sized Ring”. Chem. Eur. J. 11 (22): 6601. doi:10.1002/chem.200500417.
- Schweitzer, D.; Kane, J. J.; Strand, D.; McHenry, P.; Tenniswood, M.; Helquist, P. (2007). “Total Synthesis of Iejimalide B. An Application of the Shiina Macrolactonization”. Org. Lett. 9 (22): 4619. doi:10.1021/ol702129w.
- Das, S.; Paul, D.; Goswami, R. K. (2016). “Stereoselective Total Synthesis of Bioactive Marine Natural Product Biselyngbyolide B”. Org. Lett. 18: 1908. doi:10.1021/acs.orglett.6b00713.
- M. W. Chojnacka, R. A. Batey (2018). “Total Synthesis of (+)-Prunustatin A: Utility of Organotrifluoroborate-Mediated Prenylation and Shiina MNBA Esterification and Macrolactonization To Avoid a Competing Thorpe–Ingold Effect Accelerated Transesterification”. Org. Lett. 20: 5671. doi:10.1021/acs.orglett.8b02396.
- Xu, S.; Held, I.; Kempf, B.; Mayr, H.; Steglich, W.; Zipse, H. (2005). “The DMAP-Catalyzed Acetylation of Alcohols—A Mechanistic Study (DMAP = 4-(Dimethylamino)pyridine)”. Chem. Eur. J. 11 (16): 4751. doi:10.1002/chem.200500398.
