塩化ロジウム(III)
| 塩化ロジウム(III) | |
|---|---|

| |
塩化ロジウム(III) | |
| 識別情報 | |
| CAS登録番号 | 10049-07-7(無水物), 13569-65-8(三水和物) |
| 特性 | |
| 化学式 | RhCl3 |
| モル質量 | 209.2636 g/mol(無水物) 263.3094 g/mol(三水和物) |
| 外観 | 褐赤色粉末(無水物) 暗赤色固体(三水和物) |
| 密度 | 5.38 g/cm³(無水物) |
| 融点 |
450 ℃(分解) |
| 沸点 |
717 ℃ |
| 構造 | |
| 結晶構造 | 三方晶系[1]又は単斜晶系(無水物) |
| 熱化学 | |
| 標準生成熱 ΔfH |
−299.2 kJ mol−1(無水物)[2] |
| 危険性 | |
| EU分類 | 有害 (Xn) |
| EU Index | Not listed |
| Rフレーズ | R22, R36/37/38 |
| Sフレーズ | S26, S37/39 |
| 引火点 | 不燃性 |
| 関連する物質 | |
| その他の陽イオン | 塩化イリジウム(IV) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
塩化ロジウム(III)(えんかロジウム さん、Rhodium chloride)は、代表的なロジウムの塩化物であり、通常三水和物を単に塩化ロジウムと呼ぶことが多い。三水和物は各種ロジウム(III)錯体の合成出発物質として用いられる。
無水塩化ロジウム RhCl3 は塩化アルミニウム型の無限構造を持つ異なる化合物である。
製法
[編集]無水物
[編集]粉末ロジウムを塩素ガス中で400℃で加熱反応させる。
塩化ロジウム三水和物を塩化水素中で360℃で加熱分解すると水に不溶性の無水物が得られる。一方塩化水素中の180℃の加熱では水溶性の無水物が得られる[3]。
三水和物
[編集]粉末ロジウムと塩化カリウムの混合物を550〜575℃で塩素ガスと反応させてヘキサクロロロジウム酸(III)カリウムを得る。この水溶液に水酸化カリウム水溶液を加え水酸化ロジウム(III)を沈殿させる。水酸化ロジウム(III)を濃塩酸に溶解し、濃縮すると三水和物が析出する。
性質
[編集]無水物
[編集]褐赤色粉末で、高温で合成したものは水に不溶性である。結晶は三方晶系ないし単斜晶系で、三方晶系ものの格子定数は三方晶系として単位格子をとればa = 4.898Å、c = 6.81Å、菱面体としてとればa = 3.617Å、α = 84°48′である[1]。
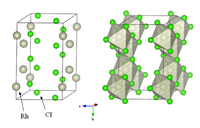
三水和物
[編集]塩化ロジウムの三水和物 RhCl3•3H2O は水に可溶な暗赤色固体で、徐々に潮解する性質がある。濃塩酸から再結晶できる。ウィルキンソン触媒など、有機合成で用いられる触媒の原料となる。
結晶を溶解したばかりの新鮮な水溶液は硝酸銀を加えても塩化銀の沈殿を生成せず、塩化物イオンはロジウムに配位結合していると予想される[4]。
脚注
[編集]- ^ a b 『化学大辞典』 共立出版、1993年
- ^ D.D. Wagman, W.H. Evans, V.B. Parker, R.H. Schumm, I. Halow, S.M. Bailey, K.L. Churney, R.I. Nuttal, K.L. Churney and R.I. Nuttal, The NBS tables of chemical thermodynamics properties, J. Phys. Chem. Ref. Data 11 Suppl. 2 (1982).
- ^ 日本化学会編 『新実験化学講座 無機化合物の合成II』 丸善、1977年
- ^ F.A. コットン, G. ウィルキンソン著, 中原 勝儼訳 『コットン・ウィルキンソン無機化学』 培風館、1987年


![{\displaystyle {\ce {[RhCl3(H2O)3] -> {RhCl3}+ 3H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9500021fe6a4d301940adcd27ebacfb364b1cc69)
![{\displaystyle {\ce {{2Rh}+ {3Cl2}+ 6KCl -> 2 K3[RhCl6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0a917a71a9bda02c057d764cd67cd12dd9b7b111)
![{\displaystyle {\ce {{[RhCl6]^{-}}+3OH^{-}->{Rh(OH)3}+6Cl^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6ca284e71a535811a50d35a8689cb5d70e0dbdb0)
![{\displaystyle {\ce {{Rh(OH)3}+ 3HCl -> \ [RhCl3(H2O)3]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9236dd883b1fb4072687c34baba16ee8d63a830f)