利用者:加藤勝憲/IgA腎症(充実のための翻訳)
| IgA nephropathy | |
|---|---|
| 別称 | IgA nephritis, Berger's disease |
 | |
| Immunoglobulin A dimer | |
| 概要 | |
| 診療科 |
Nephrology Rheumatology |
| 分類および外部参照情報 | |
IgA腎症(IgA じんしょう)は、ベルジェ病([bɛərˈʒeɪ])(およびその変異型)、または合咽性糸球体腎炎としても知られ、腎臓(または腎症)と免疫系の疾患である。侵攻性IgA腎症(より稀な病型)は肝臓、皮膚、心臓など他の主要臓器を攻撃することがある。
IgA腎症は、世界的に最も一般的な糸球体腎炎であり、世界的な発生率は、成人において年間10万人あたり2.5人である[1]。侵攻性ベルガー病は米国希少疾病団体(National Organization for Rare Disorders、NORD)の希少疾患リストに掲載されている[2]。一次性IgA腎症は、糸球体へのIgA抗体の沈着を特徴とする。糸球体へのIgA沈着に関連する疾患は他にもあり、最も一般的なものはIgA血管炎(以前はヘノッホ-シェーンライン紫斑病[HSP]として知られていた)であり、IgA腎症の全身型と考えられている[3]。
HSPは、IgA腎症よりも予後が良好である。非侵襲性IgA腎症では、従来か20年の間に25〜30%の症例で慢性腎不全に緩徐に進行する。
兆候と症状
[編集]非攻撃型(症例の40~50%)の典型的な症状は断続的な血尿であり、これは通常、非特異的な上気道感染から1~2日以内に始まる(したがって咽頭炎)。侵攻性、非侵攻性IgA腎症ともに、鼡径部痛が起こることがある。肉眼的血尿は数日後に消失するが、顕微鏡的血尿は持続する。しかし、侵攻性IgA腎症では、顕微鏡的血尿よりも肉眼的血尿が持続することの方が一般的である。腎機能は通常、非攻撃性IgA腎症では正常であるが、まれに急性腎不全を起こすことがある(下記参照)。この症状は若年成人に多い。
より少ない割合(20~30%)、通常は高齢者層で、顕微鏡的血尿と蛋白尿(2g/日未満)を認める。これらの患者は無症状であり、尿検査によってのみ発見される。そのため、尿検査が義務付けられている状況(例えば、日本の学童)では、この疾患はより一般的に診断される。
ごくまれに(各5%)、以下のような既往歴がある:
- 腎炎症候群Nephritic syndrome
- 急性腎不全(血尿の合併症として発症し、通常は回復するか、急性進行性糸球体腎炎により慢性腎不全に至ることが多い)
- 慢性腎不全(以前には症状がなく、貧血、高血圧、その他の腎不全症状を呈する。)
肝不全、癌、セリアック病、全身性エリテマトーデス、関節リウマチ、心不全、反応性関節炎、強直性脊椎炎、HIVなど、様々な全身疾患が侵攻性IgA腎症と関連している。IgA腎症と診断され、関連疾患が検索されると、そのような重篤な全身疾患が見つかることがある。時には、ヘノッホ・シェーンライン紫斑病の症状が同時にみられることもある。いくつかのヒト白血球型抗原(Human Leukocyte Antigen、HLA)対立遺伝子が補体表現型とともに遺伝的因子として疑われている。非攻撃性IgA腎症は、上記の全身疾患のいずれかと関連することもあるが、これはまれである。
形態
[編集]組織学的には、IgA腎症はメサンギウムの拡大、局所および分節性の炎症を示す。びまん性のメサンギウム増殖や半月体形成性糸球体腎炎がみられることもある。免疫蛍光検査では、IgAのメサンギウム沈着とC3、プロペルジン、および少量の他の免疫グロブリン(IgGまたはIgM)が認められる。古典的補体経路の初期成分(C1qまたはC4)は通常認められない。電子顕微鏡では、メサンギウムの電子密度の高い沈着が確認され、ごく一部の症例では、隣接する毛細血管壁の内皮下領域にまで及ぶことがある。
病態生理学
[編集]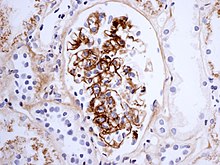
この疾患の名称は、腎糸球体の一領域である糸球体内メサンギウム細胞を免疫蛍光法によって観察すると[4]、免疫グロブリンA(immunoglobulin A、IgA)が顆粒状に沈着していることに由来する。光学顕微鏡によるメサンギウムの観察では高細胞性で、細胞外マトリックス蛋白の沈着が増加していることが確認できる[4]。ヘノッホ・シェーンライン紫斑病の腎症状に関しては、IgA腎症と組織学的スペクトルは同じであるが、糸球体壊死やクレセントなどの重篤な病変の頻度が高いことが判明している。これに対応して、HSP腎炎では、IgA腎症と比較して糸球体のフィブリン染色の頻度が高いが、それ以外の免疫蛍光プロファイルは類似している[5]。
IgAの蓄積についての明確な説明はない。IgAの外因性抗原は腎臓では同定されていないが、この抗原が疾患が顕在化する前に除去されている可能性はある。また、IgAそのものが抗原である可能性も提唱されている。
IgA 沈着の機序に関する最近の理論
[編集]最近提唱された理論では、IgA1分子の異常に焦点が当てられている。IgA1は、2つの免疫グロブリンサブクラスのうちの1つ(もう1つはIgD)で、プロリンに富んだヒンジ領域にある多くのセリン残基とスレオニン残基でO-グリコシル化されている。IgAの異常なグリコシル化は、組織、特に糸球体メサンギウムにおけるIgA分子の重合につながるようである[6]。同様のメカニズムが、主に小児が罹患し、IgA腎炎とほとんど区別できない腎病変を特徴とする血管炎であるヘノッホ-シェーンライン紫斑病の根底にあると主張されている。しかしながら、IgA1の脱ガラクトシル化は、IgA腎症患者では(全身性ではなく)腸管抗原曝露にのみ反応して起こり、健常人ではより少ない程度しか起こらないことが、ヒトを対象とした研究によって明らかにされている[7]。このことは、IgA1の脱ガラクトシル化が、IgA腎症の最終的な原因ではなく、根本的な現象(粘膜抗原処理の異常)の結果であることを強く示唆している。免疫グロブリン複合体が形成され糸球体に蓄積されるためには、IgA1のヒンジ領域におけるガラクトース欠損のo-糖鎖と、IgA1に対する抗体の合成および結合の両方が必要であることが、有力な証拠から示唆されている[8]。
腎移植後にIgA腎症が再発することから、この疾患は腎臓そのものというよりもむしろ免疫系の問題によって引き起こされると推測できる。驚くべきことに、腎臓に蓄積するIgA1は、ほとんどの上気道感染症の発生部位である粘膜関連リンパ組織(MALT)からではなく、骨髄から発生するようである。このことも、外的要因による直接的な干渉ではなく、免疫病理を示唆している[9][10]。
Natural history
[編集]IgA腎症は一般に、尿検査での異常所見によって症状を伴わずに発見されるため、スクリーニングの方針によって、調査対象集団にかなりのばらつきが生じる可能性がある。同様に、腎生検を実施する地域の方針も重要な役割を果たす。もし、単に血尿のある患者を観察する方針であれば、一般的に予後が良好なグループは除外される。対照的に、そのような患者をすべて生検するのであれば、顕微鏡的血尿と孤立性メサンギウムIgAを有するグループが含まれ、その特定のシリーズの予後を改善することになる。
しかしながら、IgA腎症は当初良性疾患と考えられていたが、特に患者が侵攻型である場合、良性疾患ではないことが示されている。多くの報告では、IgA腎症は治癒または腎障害に向かって緩徐に進展するとされているが、より侵攻的な経過をたどり、広範なクレセントを伴って急性腎不全を呈することもある。一般的に、慢性腎不全への移行は他の糸球体腎炎と比較して緩徐であり、30年以上の期間を要する(他の糸球体腎炎では5〜15年)。これは、明らかな血尿のために診断が早まったことを反映しているのかもしれない。
成人では、侵攻性IgA腎症の完全寛解はめったに起こらない。しかし、約5%の症例では、非攻撃性IgA腎症でも寛解する可能性が高い(これは症例の約7.4%と推定される)。特に侵攻性IgA腎症では再発の可能性が高い。しかし、この疾患の進化を考えると、このような患者の長期(10~20年)の転帰はまだ確立されていない。
全体として、侵攻性IgA腎症の10年生存率は現在25%、非侵攻性IgA腎症では73%である。
診断
[編集]単独血尿[11]の成人患者の場合、出血源を特定するために、腎臓の超音波検査や膀胱鏡検査が最初に行われるのが普通である。これらの検査は、血尿の他の2つの一般的な泌尿器科的原因である腎結石や膀胱がんを除外する。小児や若年成人では、既往歴や呼吸器感染症との関連からIgA腎症が疑われる。診断の確定には腎生検が必要である。生検標本ではメサンギウムの増殖がみられ、免疫蛍光法および電子顕微鏡でIgAの沈着が認められる。しかし、単独顕微鏡的血尿(すなわち、蛋白尿を伴わず、腎機能が正常)の患者は、予後が良好であるため、通常は生検されない。尿検査では、通常、赤血球尿円柱として赤血球が認められる。通常1日2グラム未満の蛋白尿がみられることもある。単独血尿の他の腎臓の原因としては、基底膜が薄い疾患やアルポート症候群があり、後者は聴覚障害や眼の問題を伴う遺伝性疾患である。
診断を助けるために行われる他の血液検査には、C反応性蛋白(CRP)または赤血球沈降速度(ESR)、補体値、抗核抗体(ANA)、乳酸脱水素酵素(LDH)がある。タンパク質電気泳動と免疫グロブリンレベルは、全患者の50%でIgAの増加を示すことがある。
治療
[編集]IgA腎症の理想的な治療法は、糸球体からIgAを除去し、それ以上のIgAの沈着を防ぐことである。しかし、この目標はまだ遠い先の話である。IgA腎症の治療中に考慮しなければならない注意点がいくつかある。IgA腎症は、良性の再発性血尿から、慢性腎不全や他の主要臓器の障害へと急速に進行するものまで、経過が非常に多様である。したがって、どの患者を治療するかは、予後因子と進行リスクに基づき決定すべきである。また、IgA腎症は、シクロスポリン、アザチオプリン、ミコフェノール酸モフェチル、シクロホスファミド、イソトレチノイン、ステロイドの使用にもかかわらず、移植で再発する。現在までに行われた数少ない対照無作為化試験の対象患者数が限られているため、不確実性が残っている。これらの研究では、IgA腎症患者の不均一性、試験治療プロトコルの多様性、追跡期間の長さに関して、統計的に有意な根拠はほとんど得られていない。
扁桃摘出術
[編集]扁桃炎がエピソード性血尿の誘発因子である場合、扁桃摘出術はその頻度を減少させると主張されている[12][13][14][15]。しかし、進行性腎不全の発生率を減少させることはできない[16]。粘膜抗原チャレンジを減少させるために用いられる食事性グルテン制限も、腎機能を維持することは示されていない。フェニトインの投与も試みられているが、効果はない[17]。
IgA腎症患者の一部では、微小変化群しか認められず、臨床的にはネフローゼ症候群であるが、ステロイドに微妙な反応を示し、多かれ少なかれ軽微な変化しか認めない。それ以外の患者では、ステロイドが有効であるという証拠はない。高用量のステロイドを短期間投与しても効果がないことが証明されている。しかし、侵攻性のIgA腎症患者では、他の薬物療法に加えてステロイドを6ヵ月間投与することで、蛋白尿が減少し、腎機能が維持される可能性がある[18]。この研究では、10年間の患者追跡データがあり、ステロイド療法の有益性が示された;ステロイド投与群で末期腎不全(透析が必要なほど腎機能が低下する)に至る可能性が低かった。重要なことは、アンジオテンシン変換酵素阻害薬が両群で同等に使用されたことである。
シクロホスファミド(エンドキサンおよびサイトキサンとして販売されている)とイソトレチノインは、しばしば抗血小板剤/抗凝固剤とともに、進行性IgA腎症患者に一般的に使用されてきた。しかし、これらの薬剤の副作用プロファイルは、長期にわたる悪性腫瘍や不妊症のリスクを含むため、若年成人に使用するには好ましくない選択であった。しかし、クレアチニンクリアランス(GFR)が低下している患者の中から慎重に選ばれた高リスク集団における最近のある研究では、ステロイドとシクロホスファミドの併用療法を最初の3ヵ月間行い、その後アザチオプリンを最低2年間投与することで、腎機能が有意に維持されることが示された[19] 。ミコフェノール酸モフェチル、シクロスポリン、ミゾリビンなどの他の薬剤も試みられているが、結果はさまざまである。
メイヨー・クリニックの研究では、オメガ3脂肪酸の長期投与によって腎不全への進行がわずかに抑制されることが示されたが、腎機能悪化のリスクが高い患者のサブセットでは蛋白尿は減少しなかった[20]。しかし、これらの結果は、他の研究グループやその後の2つのメタアナリシスでは再現されていない[21][22]。 しかし、魚油療法には免疫抑制療法のような欠点はない。また、不快な味と腹部の不快感を除けば、比較的安全に摂取することができる。
腎不全を進行させやすい事象はIgA腎症に特有なものではなく、同様の事象を軽減するための非特異的な対策も同様に有用である。低タンパク食や血圧の最適コントロールなどがその例である。血圧が望ましいレベルにコントロールされている限り、降圧薬の選択は自由である。しかし、アンジオテンシン変換酵素阻害薬とアンジオテンシンII受容体拮抗薬は、抗タンパク尿作用があるため好まれる。また、不快な味と腹部の不快感を除けば、摂取しても比較的安全である。
2021年12月、ブデソニド(タルペヨ)は、急速な疾患進行のリスクがある原発性IgA腎症の成人における蛋白尿の減少を目的として、米国で医療用として承認された[23]。
予後
[編集]男性性、蛋白尿(特に2g/日以上)、高血圧、喫煙、高脂血症、高齢、家族性疾患、クレアチニン濃度の上昇は予後不良のマーカーである。フランク血尿については、予後不良を報告した1つのグループを除き、ほとんどの研究が予後良好を示しており、おそらく早期診断に関係しているものと思われる。蛋白尿と高血圧は、このグループの最も強力な予後因子である[24]。
Male sex, proteinuria (especially > 2 g/day), hypertension, smoking, hyperlipidemia, older age, familial disease and elevated creatinine concentrations are markers of a poor outcome. Frank hematuria has shown discordant results with most studies showing a better prognosis, perhaps related to the early diagnosis, except for one group which reported a poorer prognosis. Proteinuria and hypertension are the most powerful prognostic factors in this group.
腎生検では、間質性瘢痕のような予後不良と関連する他の特徴も認められる。ACE遺伝子多型は、最近、DD遺伝子型が腎不全への進行とより一般的に関連していることに影響を及ぼすことが示されている。
There are certain other features on kidney biopsy such as interstitial scarring which are associated with a poor prognosis. ACE gene polymorphism has been recently shown to have an impact with the DD genotype associated more commonly with progression to kidney failure.
IgA腎症の病勢進行は、リスク予測ツールによって腎生検時に予測することができる。[19]
Disease progression in IgA腎症 can be predicted at the time of kidney biopsy by a risk-prediction tool. [25]
疫学
[編集]男性の罹患率は女性の3倍である。IgA腎症の有病率には、世界中で顕著な地域差がある。極東および東南アジアでは最も一般的な糸球体疾患であり、全糸球体疾患患者のほぼ半数を占める。しかし、ヨーロッパ人では約25%、北米人では約10%に過ぎず、アフリカ系アメリカ人の有病率は約2%と非常に低い。この分析における交絡因子は、スクリーニングおよび調査手段としての腎生検の既存の政策である。日本では学童が定期的に尿検査を受け(シンガポールでは軍隊の新兵が受ける)、疑わしい異常があれば腎生検を受ける。IgA腎症の発生率が高い理由の一端は、これらの国々で観察されるIgA腎症にあるのかもしれない。
Men are affected three times as often as women. There is also marked geographic variation in the prevalence of IgA nephropathy throughout the world. It is the most common glomerular disease in the Far East and Southeast Asia, accounting for almost half of all the patients with glomerular disease.However, it accounts for only about 25% of the proportion in Europeans and about 10% among North Americans, with African–Americans having a very low prevalence of about 2%. A confounding factor in this analysis is the existing policy of screening and use of kidney biopsy as an investigative tool. School children in Japan undergo routine urinalysis (as do army recruits in Singapore) and any suspicious abnormality is pursued with a kidney biopsy, which might partly explain the high observed incidence of IgA nephropathy in those countries.
Genetics
[編集]様々な関連性が報告されているが、単一の感受性遺伝子を指し示す一貫したパターンは今のところ確認されていない。C4ヌル対立遺伝子、B因子Bf対立遺伝子、MHC抗原、IgAアイソタイプなどとの関連が報告されている。ACE遺伝子多型(D対立遺伝子)は、他の慢性腎不全の原因との関連と同様に、腎不全の進行と関連している。しかしながら、IgA腎症の症例の90%以上は散発性であり、ケンタッキー州とイタリアからいくつかの大規模な血統が報告されている(Online Mendelian Inheritance in Man (OMIM): 161950)。
Though various associations have been described, no consistent pattern pointing to a single susceptible gene has been identified to date. Associations described include those with C4 null allele, factor B Bf alleles, MHC antigens and IgA isotypes. ACE gene polymorphism (D allele) is associated with progression of kidney failure, similar to its association with other causes of chronic kidney failure. However, more than 90% of cases of IgA nephropathy are sporadic, with a few large pedigrees described from Kentucky and Italy (Online 'Mendelian Inheritance in Man' (OMIM) 161950).

長老のウィリアム・ヘバーデンは、1801年に腹痛、血尿、血便、下肢紫斑を伴う5歳の小児においてこの疾患を初めて報告した[26]。1837年には、ヨハン・ルーカス・シェーンラインが小児の関節痛と尿沈渣を伴う紫斑病症候群を報告した。シェーンラインの弟子であるエドゥアルト・ハインリッヒ・ヘノッホは、さらに腹痛と腎病変をこの症候群に関連づけた。
1968年、フランスの先駆的な腎臓内科医であるジャン・ベルジェは、共著者である電子顕微鏡医のニコル・ヒングレ(Nicole Hinglais)とともに、この形態の糸球体腎炎におけるIgA沈着を初めて記述したため、ベルジェ病と呼ばれることもある。
脚注・参考文献
[編集]- ^ Kiryluk, Krzysztof; Li, Yifu; Sanna-Cherchi, Simone; Rohanizadegan, Mersedeh; Suzuki, Hitoshi; Eitner, Frank; Snyder, Holly J.; Choi, Murim et al. (21 June 2012). “Geographic Differences in Genetic Susceptibility to IgA Nephropathy: GWAS Replication Study and Geospatial Risk Analysis”. PLOS Genetics 8 (6): e1002765. doi:10.1371/journal.pgen.1002765. PMC 3380840. PMID 22737082.
- ^ D'Amico, G (1987). “The commonest glomerulonephritis in the world: IgA nephropathy”. Q J Med 64 (245): 709–27. PMID 3329736.
- ^ C, Davin J (2001). “What is the difference between IgA nephropathy and Henoch-Schönlein purpura nephritis?”. Kidney International 59 (3): 823–34. doi:10.1046/j.1523-1755.2001.059003823.x. PMID 11231337.
- ^ a b “IgA腎症とは 図_組織障害の進行”. 国立成育医療研究センター. 2024年6月12日閲覧。
- ^ Magistroni, Riccardo (2015). “New developments in the genetics, pathogenesis, and therapy of IgA nephropathy”. Kidney International 88 (5): 974–89. doi:10.1038/ki.2015.252. PMC 4653078. PMID 26376134.
- ^ “Glycans in the immune system and The Altered Glycan Theory of Autoimmunity”. J Autoimmun 57 (6): 1–13. (2015). doi:10.1016/j.jaut.2014.12.002. PMC 4340844. PMID 25578468.
- ^ “O-glycosylation of serum IgA1 antibodies against mucosal and systemic antigens in IgA nephropathy.”. J Am Soc Nephrol 17 (12): 3520–28. (2006). doi:10.1681/ASN.2006060658. PMID 17093066.
- ^ Suzuki, Hitoshi; Kiryluk, Krzysztof; Novak, Jan; Moldoveanu, Zina; Herr, Andrew; Renfrow, Matthew; Wyatt, Robert; Scolari, Francesco et al. (October 1, 2011). “The Pathophysiology of IgA Nephropathy”. Journal of the American Society of Nephrology 22 (10): 1795–1803. doi:10.1681/ASN.2011050464. PMC 3892742. PMID 21949093.
- ^ “IgA Nephropathy”. The Lecturio Medical Concept Library. 27 July 2021閲覧。
- ^ “IgA Nephropathy”. National Kidney Foundation (24 December 2015). 27 July 2021閲覧。
- ^ 長澤俊彦 (1985). “最近の話題 無症候性血尿 -第82回 日本内科学会講演会(1985年)-”. 日内会誌 74 (9): 37 - 40.
- ^ Hotta, Osamu; Ieiri, Norio; Nagai, Masaaki; Tanaka, Ayaki; Harabuchi, Yasuaki (2022-01). “Role of Palatine Tonsil and Epipharyngeal Lymphoid Tissue in the Development of Glomerular Active Lesions (Glomerular vasculitis) in Immunoglobulin A Nephropathy” (英語). International Journal of Molecular Sciences 23 (2): 727. doi:10.3390/ijms23020727. ISSN 1422-0067.
- ^ “IgA腎症/扁摘パルス療法”. hosp.juntendo.ac.jp. 順天堂大学医学部附属順天堂医院腎・高血圧内科. 2024年6月12日閲覧。
- ^ “扁桃腺摘出術+ステロイドパルス療法|東京女子医科大学病院 腎臓内科”. www.twmu.ac.jp. 2024年6月12日閲覧。
- ^ “IgA腎症根治治療ネットワーク 扁摘パルス療法”. www.iga.gr.jp. 2024年6月13日閲覧。
- ^ “Relationship between tonsils and IgA nephropathy as well as indications of tonsillectomy”. Kidney Int. 65 (4): 1135–44. (2004). doi:10.1111/j.1523-1755.2004.00486.x. PMID 15086452.
- ^ “Controlled trial of phenytoin therapy in IgA nephropathy”. Clin. Nephrol. 13 (5): 215–18. (1980). PMID 6994960.
- ^ “Steroid therapy during the early stage of progressive IgA nephropathy. A 10-year follow-up study”. Nephron 72 (2): 237–42. (1996). doi:10.1159/000188848. PMID 8684533.
- ^ “Controlled prospective trial of prednisolone and cytotoxics in progressive IgA nephropathy”. J. Am. Soc. Nephrol. 13 (1): 142–48. (2002). doi:10.1681/ASN.V131142. PMID 11752031.
- ^ “A controlled trial of fish oil in IgA nephropathy. Mayo Nephrology Collaborative Group”. N. Engl. J. Med. 331 (18): 1194–99. (1994). doi:10.1056/NEJM199411033311804. PMID 7935657.
- ^ “An "evidence-based" survey of therapeutic options for IgA nephropathy: assessment and criticism”. Am. J. Kidney Dis. 41 (6): 1129–39. (2003). doi:10.1016/S0272-6386(03)00344-5. PMID 12776264.
- ^ Dillon JJ (1997). “Fish oil therapy for IgA nephropathy: efficacy and interstudy variability”. J. Am. Soc. Nephrol. 8 (11): 1739–44. doi:10.1681/ASN.V8111739. PMID 9355077.
- ^ “FDA approves first drug to decrease urine protein in IgA nephropathy, a rare kidney disease”. U.S. Food and Drug Administration (FDA) (17 December 2021). 18 December 2021閲覧。
 この記事には現在パブリックドメインとなった次の出版物からの記述が含まれています。
この記事には現在パブリックドメインとなった次の出版物からの記述が含まれています。
- ^ “Predicting progression in IgA nephropathy”. Am. J. Kidney Dis. 38 (4): 728–35. (2001). doi:10.1053/ajkd.2001.27689. PMID 11576875.
- ^ Barbour, Sean J.; Coppo, Rosanna; Zhang, Hong; Liu, Zhi-Hong; Suzuki, Yusuke; Matsuzaki, Keiichi; Katafuchi, Ritsuko; Er, Lee et al. (2019-07-01). “Evaluating a New International Risk-Prediction Tool in IgA Nephropathy”. JAMA Internal Medicine 179 (7): 942. doi:10.1001/jamainternmed.2019.0600. ISSN 2168-6106. PMC 6583088.
- ^ “Les depots intercapillaires d'IgA-IgG”. J Urol Nephrol 74: 694–95. (1968).
外部リンク
[編集]- IGA Nephropathy on National Institute of Diabetes and Digestive and Kidney Diseases
[[Category:自己免疫疾患]] [[Category:腎泌尿器疾患]] [[Category:未査読の翻訳があるページ]]
