三塩化ヒ素
| 三塩化ヒ素 | |
|---|---|
| |
別称 Arsenic(III) chloride, Arsenous trichloride, Butter of arsenic, de Valagin's solution | |
| 識別情報 | |
| CAS登録番号 | 7784-34-1 |
| PubChem | 24570 |
| ChemSpider | 22974 |
| RTECS番号 | CG1750000 |
| |
| |
| 特性 | |
| 化学式 | AsCl3 |
| モル質量 | 181.28 g/mol |
| 外観 | 無色液体 |
| 密度 | 2.163 g/cm3 |
| 融点 |
-16.2 °C, 257 K, 3 °F |
| 沸点 |
130.2 °C, 403 K, 266 °F |
| 水への溶解度 | 分解 |
| 溶解度 | アルコール、エーテル、塩酸、臭化水素酸に可溶 |
| 屈折率 (nD) | 1.6006 |
| 粘度 | 9.77 x 10-6 Pa s |
| 危険性 | |
| EU分類 | 非常に高い毒性 (T+) 環境に対する危険性 (N) |
| NFPA 704 | |
| Rフレーズ | R23/25, R50/53 |
| Sフレーズ | (S1/2), S20/21, S28, S45, S60, S61 |
| 半数致死量 LD50 | 48 mg/kg |
| 関連する物質 | |
| その他の陰イオン | 三酸化二ヒ素 |
| その他の陽イオン | 塩化アンチモン |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
三塩化ヒ素(Arsenic trichloride)は、AsCl3という化学式を持つ無機化合物である。毒性を持つ油状の物質で無色であるが、不純物を含むものは黄色を呈する。有機ヒ素化合物を製造する際の中間体となる[1]。
構造
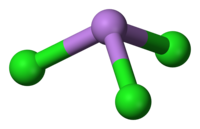
[編集]三塩化ヒ素は、C3v対称性を持つピラミッド状の分子である。As-Cl結合は2.161Åの長さで、Cl-As-Clの角は98°25'±30である[2][3]。三塩化ヒ素は、ν1(A1) 416、ν2(A1) 192、ν3 393、ν4(E) 152 cm-1の4つの通常振動モードを持つ[4]。三塩化ヒ素はほぼ共有結合であり、そのため融点は低い。
合成
[編集]三塩化ヒ素は、三酸化二ヒ素を塩化水素で処理し、その後蒸留することによって製造される。
また、ヒ素を80〜85℃で塩素化することによっても得られるが、この方法には、ヒ素元素が必要である[1]。
酸化ヒ素と一塩化硫黄の反応によっても得られる。この方法は単純な器具しか必要とせず、また効率よく進む[5]。
反応
[編集]三塩化ヒ素は三塩化リンよりも感湿性が弱いが、それでも湿気を含んだ空気中では気化する[6]。
三酸化二ヒ素で処理することで、無機ポリマーのAsOClを形成する。塩素源の下では、三塩化ヒ素は [AsCl4]-を含む塩を形成する。臭化カリウムやヨウ化カリウムと反応させると、それぞれ三臭化ヒ素や三ヨウ化ヒ素が得られる。有機ヒ素化合物の合成に有益で、三塩化ヒ素からトリフェニルアルシンが合成される[7]。
安全性
[編集]ヒ素化合物は非常に毒性が高いが、三塩化ヒ素はその揮発性や溶解性のために、特に毒性が高い。
出典
[編集]- ^ a b Sabina C. Grund, Kunibert Hanusch, Hans Uwe Wolf "Arsenic and Arsenic Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, VCH-Wiley, 2008, Weinheim.doi:10.1002/14356007.a03_113.pub2
- ^ P. Kisliuk; C. H. Townes. "The Microwave Spectra and Molecular Structure of Phosphorus and Arsenic Trichloride". J. Chem. Physics 1950, 18.
- ^ Jean Galy; Renee Enjalbertl Pierre Lecante; Andrzej Burian "AsCl3: From the crystalline to the liquid state. XRD (176< T (K) < 250) and WAXS (295K) studies" Inorg. Chem 2002, volume 41, pp. 693-698.doi:10.1021/ic0102788
- ^ Klapoetke, Thomas M. "The vibrational spectrum of arsenic trichloride" Main Group Metal Chemistry 1997, volume 20, pp. 81-83.
- ^ R. C. Smith, "Manufacture of Arsenic trichloride" The Journal of Industrial and Engineering Chemistry 1919, volume 11, pp. 109-110. doi:10.1021/ie50110a009
- ^ Holleman, A. F.; Wiberg, E. Inorganic Chemistry Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ Shriner, R. L.; Wolf, C. N. (1963). "Tetraphenylarsonium Chloride Hydrochloride". Organic Syntheses (英語).; Collective Volume, vol. 4, p. 910. Describes the preparation of As(C6H5)3.






