ボーアの原子模型
ボーアの原子模型(ボーアのげんしもけい、英: Bohr's model)とは、ラザフォードの原子模型[注 1]における矛盾を解消するために考案された原子模型である。この模型は、水素原子に関する実験結果を見事に説明し、量子力学の先駆け(前期量子論)となった。
その後のシュレーディンガーによる波動関数の導入とボルンによる確率解釈によって、この模型の「電子が軌道運動をする」という解釈は誤りであることがわかった。
概要
[編集]電磁気学によると、電荷を帯びた粒子が円運動をしたとき、円運動の周期の逆数に等しい振動数の電磁波を放出してエネルギーを失ってしまう。そのため、正の電荷を帯びた原子核の周りを負の電荷を持った電子が同心円状の軌道を周回しているという太陽系型原子模型や土星型原子模型では、電子はエネルギーを失って原子核に引き寄せられてしまい、現実に原子が安定的に存在することと矛盾する。一方で、分光学における原子の発光スペクトルの研究により、原子の発する光は特定の複数の振動数のみに限られ、各振動数の間には一定の法則(リッツの結合法則)が成り立つことが知られていた。
それらの疑問点を説明するため、1913年にコペンハーゲン大学のニールス・ボーアは「原子および分子の構成について」という3部作の論文の第1論文[1]の中で、次のような仮説に基づく、新たな原子模型を提示した。
- 電子は特定の離散的なエネルギー状態(エネルギー準位)に属し、対応する軌道を運動する。この状態を定常状態という。定常状態では、電子は電磁波を放出することなく、古典力学にしたがって運動することができる。
- エネルギー準位と対応する軌道は、量子条件が満たされるもののみが選択される。
- 電子はある定常状態から別の定常状態へ、瞬間的に移行することがある。これを状態の遷移という。そのときに放射(吸収)される光の振動数は振動数条件を満たす。
ボーアの示した模型は、なぜ円運動する電子がエネルギーを失わないか、という点を説明するものではないが、ボーアの量子条件という大胆な仮説によりそれを一旦棚上げして、スペクトルの法則性に合致した説明を与えるものであった。
量子条件と振動数条件
[編集]量子条件
[編集]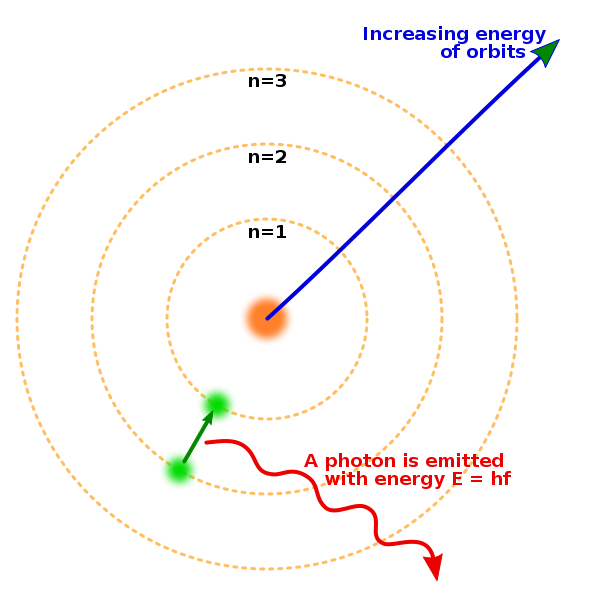
原子内の電子は、原子核との間にはたらくクーロン力を向心力とする等速円運動を行うが、電子は次の条件を満たす円軌道のみをとることができ、この条件を満たす円軌道上では電子は電磁波を放出せず、円運動を行うことができると仮定する。
ここで、me は電子の質量、v は電子の速さ、h はプランク定数であり、自然数 n を量子数という。この条件は量子条件といい、この条件を満たす状態を定常状態、定常状態における電子のエネルギーをエネルギー準位という。
上述の条件は、角運動量が の自然数倍のみの値をとることを意味しており、角運動量の量子化を表している。
振動数条件
[編集]また、1個の電子が量子数nの定常状態から量子数n'の定常状態に移るとき、そのエネルギー準位の差のエネルギーを、1個の光子として吸収または放出する。すなわち、量子数nにおけるエネルギー準位および量子数n'におけるエネルギー準位をそれぞれ 、とすると
ここで、は光子の振動数であり
のときは光子を吸収し、
のときは光子を放出する。これを振動数条件という。
量子条件の解釈
[編集]この量子条件に、1924年にルイ・ド・ブロイによって提唱されたド・ブロイ波の式を導入することによって、量子条件のもつ意味がより明瞭になる。ド・ブロイ波の理論では粒子に波動としての性質をみとめ、その波長は粒子の運動量 p を用いて
と表される。これを量子条件に導入すると
すなわち、電子軌道(ここでは、円軌道であると仮定されている)の一周の長さは、電子における物質波の波長の整数倍となる。ボーアの量子条件は、電子が波としてふるまっていること(粒子と波動の二重性)を示唆している。
水素原子の輝線スペクトル
[編集]ボーアの原子模型は水素原子の輝線スペクトルに関する実験結果を説明することができる。
水素原子は陽子と電子で構成される2体系であるが、陽子の質量は電子に比較して圧倒的に大きいため、陽子は原点に固定されているものとして取り扱う。 水素原子中において、電子はクーロンポテンシャル
の下で運動する。定常状態にある電子は、仮定により、古典力学に従って楕円軌道をとる。 定常状態における系のエネルギーを E とすれば、軌道長半径と軌道周期は
で表される。 電子の軌道が円軌道であるとき、電子の周回速度は
となる。
ボーアの量子条件より、量子数 n に対して
であり、対応するエネルギー準位が
と求められる。 この式から判るように、量子数 n が大きいほどエネルギー準位は高い。
ここで量子数 n から n' への定常状態の遷移を考える。n > n' とすると、エネルギー準位の高い状態から低い状態への遷移であり、このときに放出される光の周波数は、振動数条件より
である。放出される光の波長で表せば
となり、バルマー系列などの水素原子の輝線スペクトルの関係式と同じ形の式が得られる。 比例係数は
である。 物理定数から計算されるこの比例係数の値は、水素原子のスペクトルの観測から得られたリュードベリ定数と見事に一致し、ボーアの模型の正しさが実証された。
原子模型
[編集]既に見たようにボーアの原子模型において、量子数 n に対応して電子のエネルギーが離散化される。量子数 n = 1 に対応する定常状態が最もエネルギーが低く安定した状態であり、この状態を基底状態と呼ぶ。基底状態よりエネルギーの高い量子数 n ≥ 2 に対応する定常状態を励起状態と呼ぶ。基底状態から励起状態へ移ることを励起という。
また、量子数 n に対応する電子の軌道半径は
となる。ボーアの原子模型においてはエネルギーだけでなく軌道半径も離散化され、基底状態で最も軌道半径が小さく、高いエネルギー準位へ励起されるに従って軌道半径は大きくなる。基底状態における軌道半径は特にボーア半径と呼ばれ
である。
軌道周期と周回速度はそれぞれ
となる。
イオン化エネルギー
[編集]量子数 n → ∞ の極限を考えると
である。電子の軌道半径が無限大の状態とは、電子が束縛を逃れた状態であり、すなわちイオン化された状態である。水素原子の第一イオン化エネルギーは基底状態から量子数 n → ∞ の状態への遷移エネルギーであり
となる。
水素以外の原子の軌道
[編集]水素のほかにも原子番号 Z の原子についてボーアの原子模型を用いると、クーロンポテンシャルを
と置き換えることに相当する。 これによって原子中の電子のエネルギーは Z2 倍に軌道半径は Z−1 倍になる。
このように原子の種類によって、特有の電子軌道のパターンができる[2]。
脚注
[編集]注釈
[編集]出典
[編集]- ^ Bohr (1913a)
- ^ Backman & Seeds (2010, p. 114)
参考文献
[編集]- Bohr, N. (April 5, 1913). “On the Constitution of Atoms and Molecules [原子および分子の構造について]”. Phil. Mag.. Series 6 26 (151): 1-25. doi:10.1080/14786441308634955. ISSN 1478-6435. LCCN 2003-249007. OCLC 476300855.
- Bohr, N. (July 1913). “On the Constitution of Atoms and Molecules, Part II, Systems Containing Only a Single Nucleus” (PDF). Phil. Mag.. Series 6 26: 476-502. ISSN 1478-6435. LCCN 2003-249007. OCLC 476300855.
- Bohr, N. (November 1913). “On the Constitution of Atoms and Molecules, Part III, Systems containing several nuclei”. Phil. Mag.. Series 6 26: 857-875. ISSN 1478-6435. LCCN 2003-249007. OCLC 476300855.
- 広重, 徹『物理学史II』培風館〈新物理学シリーズ〉、1968年3月。ASIN 4563024066。ISBN 4563024066。 NCID BN00957321。OCLC 673599647。全国書誌番号:68001733。
- Backman, Dana E、Seeds, Michael A 著、中村 理・松浦 美香子・高木 俊暢・小野寺 仁人 訳『最新天文百科 宇宙・惑星・生命をつなぐサイエンス』有本 信雄 監訳、丸善、2010年10月23日。ASIN 4621082787。ISBN 978-4-621-08278-2。 NCID BB03649795。OCLC 743346560。全国書誌番号:21838611。
- 近角 聡信・三浦 登(編) 編『教科書マスターから受験対策まで 理解しやすい物理』(物理基礎収録版)文英堂、2013年3月2日。ASIN 4578242188。ISBN 978-4-578-24218-5。 NCID BB14747275。OCLC 828854819。全国書誌番号:22208864。
































