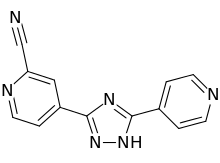
トピロキソスタット
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | トピロリック, ウリアデック |
| 法的規制 |
|
| 薬物動態データ | |
| 血漿タンパク結合 | 97.5-98.8% |
| 代謝 | グルクロン酸抱合 |
| 半減期 | 5〜7時間 |
| 排泄 | 肝排泄26.1%・腎排泄76.8% |
| データベースID | |
| CAS番号 | 577778-58-6 |
| ATCコード | None |
| PubChem | CID: 5288320 |
| ChemSpider | 4450517 |
| 化学的データ | |
| 化学式 | C13H8N6 |
| 分子量 | 248.24 g/mol |
| |
| |
トピロキソスタット(Topiroxostat)は痛風および高尿酸血症の治療薬である[1]。商品名ウリアデック;三和化学研究所、トピロリック;富士薬品製造販売。日本で開発され、2013年6月に承認を取得した[2][3]。
2016年6月から、トピロリックで富士薬品とファイザーの共同販促(コ・プロモーション活動)が開始された[4]。
トピロキソスタットはフェブキソスタットと同様に、キサンチン酸化還元酵素(XOR)を阻害して尿酸の生成を抑制し、血中尿酸値を低下させる[5]。XORの阻害は競合的である[6]。
適応症
[編集]副作用
[編集]国内の治験での副作用発現率は35.4%であり、主な副作用は、痛風関節炎(10.0%)、ALT(GPT)増加(7.5%)、β-N-アセチル-D-グルコサミニダーゼ増加(7.0%)、α1-ミクログロブリン増加(5.9%)、AST(GOT)増加(5.1%)等であった[7][8]。
重大な副作用として添付文書に記載されているものは、肝機能障害(2.9%)と多形紅斑(0.5%未満)である。そのほか、5%以上に発現する副作用として、ALT(GPT)増加、AST(GOT)増加、痛風関節炎[注 1]、β-NアセチルDグルコサミニダーゼ増加、α1ミクログロブリン増加 がある。
用法・用量
[編集]1回20mgより開始し、1日2回朝夕に経口投与する。その後は血中尿酸値を確認しながら必要に応じて徐々に増量する。維持量は通常1回60mgを1日2回とし、患者の状態に応じて適宜増減するが、最大投与量は1回80mgを1日2回とする。
増量する際には、1回20mgを1日2回から開始し、投与開始から2週間以降に1回40mgを1日2回、投与開始から6週間以降に1回60mgを1日2回投与が目安となる。腎機能障害患者に対しても用量調節の必要がなく、常用量で使用できるが、重度の腎機能障害のある患者は、使用経験がなく安全性が確立していないため慎重投与である[7][8]。
作用機序
[編集]トピロキソスタットはプリン骨格を有さない選択的キサンチン酸化還元酵素(XOR)阻害剤である。
尿酸は、ヒトにおいてプリン体の代謝経路の最終産物として、XORの作用によりヒポキサンチンからキサンチンを経て産生されるが、トピロキソスタットはXORに対し競合的な阻害作用を示し、内因性の尿酸の生成を抑制する[5]。なお、XORに対するKi値は5.1 (nmol/L)である[8]。また、他のプリン・ピリミジン代謝酵素には阻害作用を示さず、XORに対して選択的である[6]。
また、糖尿病モデルマウス(db/dbマウス)において、肝臓、腎臓、血漿でのトピロキソスタットのXOR活性阻害作用が検討され、肝臓、腎臓に比べて血漿でのXOR活性阻害作用が強いことが示された[9]。
なお、トピロキソスタットにはXOR阻害作用があるため、XORによっても代謝されるアザチオプリンやメルカプトプリンとの併用は禁忌とされている[8]。
研究事例
[編集]高尿酸血症患者は慢性腎臓病(CKD)を合併していることが多く、CKDを合併する高尿酸血症患者へのXOR阻害薬の投与が検討されている。薬物動態に関する研究として、腎機能軽度低下者、腎機能中等度低下者および腎機能正常者でトピロキソスタット80mgを単回経口投与したときの血中濃度を比較しているが、腎機能低下者と腎機能正常者の間に、薬物動態パラメータ(Cmax、Tmax、半減期、AUC)の差はみられなかった[10]。
腎機能検査値への影響をみた研究としては、中等度腎機能障害(CKDステージ3)を合併した高尿酸血症患者におけるプラセボ対照の比較試験において、トピロキソスタット投与終了時には、血清尿酸値の改善とともに、CKDの重症度評価の指標である尿アルブミン/クレアチニン比の改善もみられたことが示されている[11]。
注釈
[編集]- ^ 痛風発作中に血中尿酸値を急激に変動させると関節炎が悪化することがある。
出典
[編集]- ^ New Drugs FY2013. Pharmaceuticals and Medical Devices Agency, Japan.
- ^ “痛風・高尿酸血症治療剤「ウリアデック錠」製造販売承認取得のお知らせ”. 三和化学研究所 (2013年6月28日). 2015年2月26日閲覧。
- ^ “痛風・高尿酸血症治療剤 「トピロリック錠」製造販売承認取得のお知らせ”. 富士薬品 (2013年6月28日). 2015年2月26日閲覧。
- ^ “高尿酸血症治療剤「トピロリック®錠」コ・プロモーション開始のお知らせ”. ファイザー (2016年6月1日). 2017年1月30日閲覧。
- ^ a b Hosoya, Tatsuo; Ohno, Iwao; Nomura, Shinsuke; Hisatome, Ichiro; Uchida, Shunya; Fujimori, Shin; Yamamoto, Tetsuya; Hara, Shigeko (2014). “Effects of topiroxostat on the serum urate levels and urinary albumin excretion in hyperuricemic stage 3 chronic kidney disease patients with or without gout”. Clinical and Experimental Nephrology. doi:10.1007/s10157-014-0935-8.
- ^ a b “新規XO阻害薬のXO阻害作用・血清尿酸値低下作用強く,副作用は同等”. メディカルトリビューン (2015年2月25日). 2015年2月26日閲覧。
- ^ a b “ウリアデック錠20mg/ウリアデック錠40mg/ウリアデック錠60mg 添付文書” (2014年9月). 2015年2月26日閲覧。
- ^ a b c d “トピロリック錠20mg/トピロリック錠40mg/トピロリック錠60mg 添付文書” (2016年6月). 2016年6月27日閲覧。
- ^ Nakamura T et al: Eur J Pharmacol. 780: 224, 2016
- ^ Nakazawa T et al: Jpn Pharmacol Ther. 43(5): 639, 2015
- ^ Hosoya T et al: Clin Exp Nephrol. 18(6): 876, 2014
