チアントレン
表示
| チアントレン | |
|---|---|
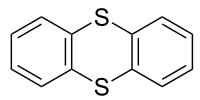
| |

| |
Thianthrene | |
別称 Thianthren; 9,10-Dithiaanthracene; Di-o-phenylene disulfide | |
| 識別情報 | |
| CAS登録番号 | 92-85-3 |
| PubChem | 7109 |
| ChemSpider | 6842 |
| EC番号 | 202-197-0 |
| ChEMBL | CHEMBL488176 |
| |
| 特性[1] | |
| 化学式 | C12H8S2 |
| モル質量 | 216.32 g mol−1 |
| 融点 |
151-155 °C, 424-428 K, 304-311 °F |
| 沸点 |
364-366 °C, 637-639 K, 687-691 °F |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
チアントレン(Thianthrene)は、硫黄を含む複素環式化合物である。ジチインと呼ばれる複素環式化合物の誘導体である。容易に酸化されることで知られる。
構造と合成
[編集]他の1,4-ジチインと同様に、しかしその酸素アナログであるジベンゾジオキシンとは異なり、チアントレンの形は平面状ではない。2つのベンゾ基の間は128°の角度で曲がっている[2][3][4]。
チアントレンは、塩化アルミニウムの存在下でベンゼンを二塩化二硫黄で処理することにより生成する[5]。
歴史
[編集]チアントレンはジョン・ステンハウスによって、ベンゼンスルホン酸ナトリウムを乾留することで初めて得られた[6]。チアントレンは硫酸により酸化され、赤色のラジカルカチオンを形成する[7]。チアントレンイオンは電子スピン共鳴により特徴付けられている。4つの異なる論文で、チアントレン塩の結晶構造が述べられている[8]。
出典
[編集]- ^ Thianthrene at Sigma-Aldrich
- ^ Hosoya, S. (1963). “Molecular shapes of thianthrene and related heterocyclic compounds”. Acta Crystallographica 16 (4): 310–312. doi:10.1107/S0365110X63000797.
- ^ Gallaher, K. L.; Bauer, S. H. (1975). “Structure and inversion potential of thianthren”. Journal of the Chemical Society, Faraday Transactions 2 71: 1173–1182. doi:10.1039/F29757101173.
- ^ Aroney, M. J.; Le Fèvre, R. J. W.; Saxby, J. D. (1965). “92. Molecular polarisability. The apparent conformations of thianthren and of three of its oxides as solutes in benzene”. Journal of the Chemical Society (Resumed): 571–575. doi:10.1039/JR9650000571.
- ^ US patent 3997560, "Process for the manufacture of thianthrene", issued 1976-12-14.
- ^ Stenhouse, J. (1869). “Ueber die Producte der trockenen Destillation der sulfobenzolsauren Salze”. Annalen der Chemie und Pharmacie 149 (2): 247–255. doi:10.1002/jlac.18691490216.
- ^ W. Dilthey: Versammlungsberichte Bonner Chemische Gesellschaft, Angewandte Chemie, Volume 42, Issue 24, pp. 668–670, 15. June 1929; doi:10.1002/ange.19290422405.
- ^ Shine, Henry J. (July 1998). “EPR and the History of the Thianthrene Cation Radical”. Foundations of modern EPR. ISBN 978-981-02-3295-5
