エタン
| エタン | |
|---|---|
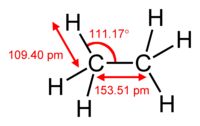 回転分光法によるエタンの分子構造
| |

| |

|

|
別称
| |
| 識別情報 | |
| CAS登録番号 | 74-84-0 |
| PubChem | 6324 |
| ChemSpider | 6084 |
| UNII | L99N5N533T |
| EC番号 | 200-814-8 |
| 国連/北米番号 | 1035 |
| MeSH | Ethane |
| ChEBI | |
| ChEMBL | CHEMBL135626 |
| RTECS番号 | KH3800000 |
| バイルシュタイン | 1730716 |
| Gmelin参照 | 212 |
| |
| 特性 | |
| 化学式 | C2H6 |
| モル質量 | 30.07 g mol−1 |
| 外観 | 無色の気体 |
| 匂い | 無臭 |
| 密度 |
544.0 kg/m3 (液体 -88,5 °C) |
| 融点 |
−182.8 °C |
| 沸点 |
−88.5 °C |
| 水への溶解度 | 56.8 mg L−1[4] |
| 蒸気圧 | 3.8453 MPa (at 21.1 °C) |
| kH | 19 nmol Pa−1 kg−1 |
| 酸解離定数 pKa | 50 |
| 塩基解離定数 pKb | −36 |
| 磁化率 | -37.37·10−6 cm3/mol |
| 熱化学 | |
| 標準生成熱 ΔfH |
−84 kJ mol−1 |
| 標準燃焼熱 ΔcH |
−1561.0 〜 −1560.4 kJ mol−1 |
| 標準定圧モル比熱, Cp |
52.14± 0.39 J K−1 mol−1 at 298 K[5] |
| 危険性 | |
| 安全データシート(外部リンク) | inchem.org |
| GHSピクトグラム | 
|
| GHSシグナルワード | DANGER |
| Hフレーズ | H220, H280 |
| Pフレーズ | P210, P410+403 |
| NFPA 704 | |
| 引火点 | −135 °C (−211 °F; 138 K) |
| 発火点 | 472 °C (882 °F; 745 K) |
| 爆発限界 | 2.9 - 13 % |
| 関連する物質 | |
| 関連するアルカン | |
| 関連物質 | |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
エタン(英: ethane)は、アルカン群に属する炭素数が2の有機化合物である。分子式は C2H6、構造式は CH3-CH3 で、メタンに次ぎ2番目に簡単なアルカンであり、異性体は存在しない。水に溶けにくく、有機溶媒に溶けやすいという性質を持つ。可燃性の気体であり、日本では高圧ガス保安法の可燃性気体に指定されている。
歴史
[編集]1834年、マイケル・ファラデーによって酢酸カリウム水溶液の電気分解により合成されたのが最初である。しかしこの当時はメタンが合成されたものと考えられていた。1847年から49年にかけ、ヘルマン・コルベとエドワード・フランクランドがファラデーの手法を用いて、また有機ラジカル理論を用いてプロピオニトリルとヨウ化エチルとを金属カリウムで還元することでエタンを合成した。しかしこの時も生成物がエタンだとは考えられていなかった。この間違いは1864年にCarl Schorlemmerによって発見され、エタンの存在が明らかとなった。
エタンという名前はエーテル(ジエチルエーテル)が起源である。
化学的性質
[編集]一般的なアルカンの性質を持つ。すなわち、酸化剤・還元剤や酸・塩基とはほとんど反応しないが、光の照射による置換反応や燃焼などの反応を起こす。詳細はアルカンの項を参照。
燃焼
[編集]エタンを完全燃焼させたときの燃焼熱は1561 kJ/molであり、完全燃焼により二酸化炭素と水を発生する。
燃焼は複雑に連続したラジカル反応により起こる。計算化学で反応速度論について計算すると、数百種類の反応経路が考えられるという結果が出た。その中でも重要な連続反応として、エチルラジカルと酸素との結合、それに続く過酸化物の生成、その分解によるエトキシラジカルとヒドロキシルラジカルの生成が挙げられる。
酸素が不足した際には不完全燃焼が起こり、一酸化炭素やホルムアルデヒドが生成する。このような炭素1つを含む物質を生成するためには、エタンのC-C結合を切る必要がある。これにはエトキシラジカルが分解し、メチルラジカルとホルムアルデヒドを生成するという経路が挙げられる。これらの生成物は更なる酸化により別の化合物へと変化することとなる。
不完全燃焼では他にアセトアルデヒド、メタン、メタノール、エタノールなどが少量生成する。600–900℃の高温では、エチレンが主な生成物となる。
同じような反応がエタンからエチレンを製造する際のクラッキング法として利用されている。
製造
[編集]工業的製法については一般的なアルカンと同様、石油を分留することで得られる。詳細はアルカンの項を参照。
エタンは天然ガス中でメタンの次に多く含まれる成分である。1960年代の始めには、天然ガスから得られたエタンはメタンと分離されることなく使われていたが、この頃は燃料として燃やされる用途が主であった。しかしそれ以降、エタンは重要な石油化学原料となり、天然ガス中から分離される最も重要な成分の一つとなっている。またエタンは石油ガス中からも、製油の際の副生成物として得られる。
エタンとメタンを分離する際には、極低温にした液体を分留するという手法が用いられる。様々な冷却法が存在するが、混合物を急激に膨張させることで温度を下げるという手法が最も効率的であり、天然ガスから90%以上の割合でエタンを得ることができる。この時は冷却ガスをタービンに通すことで膨張させる。このときの温度は約−100℃である。このときガス状のメタンは液体のエタンから取り除かれ、液体となっている他のアルカン類は分留により分離される。
研究室レベルでは、コルベ電解により得られる。具体的には酢酸塩水溶液を電気分解する。アノードでは酢酸が酸化されて二酸化炭素とメチルラジカルを生成する。このメチルラジカル同士が反応してエタンが生成する。
似たような方法として、無水酢酸を過酸化物で酸化しても得ることができる。
利用
[編集]化学工業でエタンが最もよく使われるものとしては、蒸気クラッキングによるエチレンの生成である。アルカンの薄い蒸気を900℃以上の高温に晒すと、分子量の大きいアルカンは分子量が小さいアルカンになり、飽和アルカンがアルケンになる。この反応を利用すると、エタンは選択的にエチレンを生成することができる。そして分子量の大きい炭化水素はプロピレンやブタジエン、芳香族炭化水素などの様々な不飽和炭化水素を生成する。
他にも、エタンは様々な化学物質の原材料として利用される。
エタンの酸化的塩素化によりクロロエチレンを生成する方法は、エチレンの塩素化に比べて本質的に経済的な手法であるように見える。この反応の様々な場面に特許が取られているが、低い反応選択性と腐食性反応であること(塩酸を含む反応溶液を500℃以上に熱するなど)から実際に利用されることはあまりない。現在では、ドイツでINEOS社がエタンからクロロエチレンを生産している。
同じように、サウジアラビアのSABIC社がエタンの酸化により酢酸を生産するプラントをヤンブに建設することを発表した。この酢酸生産手法はサウジアラビア近辺から低価格のエタンを得られるという前提に立ったものであり、世界的に見るとメタノールのカルボニル化反応による生産が経済的に有利であることに変わりはない。
エタンは極低温の冷却材としても用いられる。実験室などの小スケールでは、電子顕微鏡を用いる際に液化エタンが水を多く含む試料のガラス化に使われることがある。
安全性
[編集]室温では可燃性であり、空気と3%-12.5%の体積比で混合した混合ガスは爆発性である。その上分子量も空気の平均分子量である28.8に近いため、ガス漏れした場合簡単に拡散して混合ガスを形成しやすい。
脚注
[編集]- ^ International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. p. 133. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4. "The saturated unbranched acyclic hydrocarbons C2H6, C3H8, and C4H10 have the retained names ethane, propane, and butane, respectively."
- ^ IUPAC 2014, p. 4. "Similarly, the retained names 'ethane', 'propane', and 'butane' were never replaced by systematic names 'dicarbane', 'tricarbane', and 'tetracarbane' as recommended for analogues of silane, 'disilane'; phosphane, 'triphosphane'; and sulfane, 'tetrasulfane'."
- ^ “Ethane – Compound Summary”. PubChem Compound. US: National Center for Biotechnology Information (16 September 2004). 7 December 2011閲覧。
- ^ Lide, D. R., ed. (2005), CRC Handbook of Chemistry and Physics (86th ed.), Boca Raton (FL): CRC Press, p. 8.88, ISBN 0-8493-0486-5
- ^ “Ethane”. webbook.nist.gov. 2024年5月16日閲覧。
参考文献
[編集]- Michael Faraday (1834). Experimental researches in electricity: Seventh series. Philosophical Transactions, 124:77–122.
- Hermann Kolbe, Edward Frankland (1849). On the products of the action of potassium on cyanide of ethyl. Journal of the Chemical Society, 1:60–74.
- Edward Frankland (1850). On the isolation of the organic radicals. Journal of the Chemical Society, 2:263–296.
- Hermann Kolbe (1850). Researches on the electrolysis of organic compounds. Journal of the Chemical Society, 2:157–184.
- Carl Schorlemmer (1864). Annalen der Chimie, 132:234.
- Michael J. Mumma et al. (1996). Detection of Abundant Ethane and Methane, Along with Carbon Monoxide and Water, in Comet C/1996 B2 Hyakutake: Evidence for Interstellar Origin. Science, 272:1310–1314.









