シデロホア
シデロホア(英: Siderophore、ギリシア語: σίδεροφόρος「鉄運搬体」から)は、微生物やいわゆるストラテジーII植物(イネ科植物)が分泌する鉄キレート剤である[1][2][3][4][5][6]。知られている中で、Fe3+に対して最も高い親和性を持つ水溶性化合物群の1つである。
概要
[編集]鉄はすべての生物において必須の栄養素である。代謝やDNA合成に必須であるためである。この元素は地球の地殻において最も豊富なものの一つであるが、土壌や海洋といった多くの環境での生物学的利用能は限定的である。これは、水中でのFe3+イオンの溶解度が低いためによる。この三価イオンの形態は、酸素存在下を含む非酸性の水中で優勢である。また、酸化鉄や水酸化鉄といった一般的な鉱物相-土壌の赤色や黄色を形成している-として自然界に蓄積されている。しかし、生物は三価鉄を容易に利用することはできない[7][8]。微生物やイネ科植物は、鉄を利用するためにシデロホアを分泌する。この化合物は、鉱物相からFe3+ 錯体を取り出し、能動輸送により鉄を栄養素として吸収することを可能にする。多くのシデロホアは非リボソームペプチドであり[3][9]、いくつかは独立して生合成される[10]。シデロホアはいくつかの病原微生物にとっても重要である[3][4][6]。宿主の哺乳類体内で鉄はヘモグロビン、トランスフェリン、ラクトフェリン、フェリチンと結合している。細菌体内の鉄分濃度は10−24 mol L−1程度に維持される必要があるため[11]、細菌は外部から鉄を獲得する機構を具えている。例えば、炭疽症の原因菌Bacillus anthracisは2種類のシデロホア、バチリバクチンとペトロバクチンを分泌し、鉄タンパク質から二価鉄を吸収している。バチリバクチンは免疫タンパク質シデロカリンとの結合性を示す[12]。一方、ペトロバクチンは免疫系に捕捉される実験結果は確認されておらず、また、マウスにおいて病毒性に重要であることが明らかとなっている[13]。
シデロホアの中でも、エンテロバクチンが最もFe3+との結合性が強いとされる[11]。鉄に対する高いキレート作用のため、シデロホアは、鉄中毒やサラセミアといった人体内の鉄濃度異常に対する治療への利用が研究されている。いわゆる、キレーション療法のための治療薬として期待されている。すでに、シデロホアの一つであるデフェロキサミンBが実用化されている[14]。いくつかの病原微生物はシデロホアではなく、ヘムと結合するヘムホアを産生する。また、これらの鉄結合性物質を外部へと分泌せず、細胞膜上で鉄イオンまたはヘムタンパク質と結合する受容体を持つものも存在する[15]。これらとは別に、真核生物は鉄獲得の機構を持つ。すなわち、環境中のpHを低下させる、あるいは、不溶性の三価鉄を二価鉄に還元させる。
構造
[編集]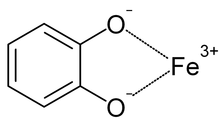
シデロホアは通常、6座配位子の正八面体の安定した化合物である。最も強力なシデロホアは、分子一つ当たり3つの2座配位子を有しており、6座配位子錯体を形成する。このとき、別々の配位子で鉄分子を一つだけキレートしているときよりもエントロピー変化は小さい[16]。シデロホアの包括的なリストは作成されている[3]。シデロホアが反応する鉄はFe3+であり、Fe2+に対する親和性は低い。微生物は一般的に、シデロホアと結合しているFe3+をFe2+に還元することでシデロホアから鉄分を放出させている[9]。
シデロホアはその配位子により分類されている。多数派のグループにはカテコール(フェノラート)、ヒドロキサム酸、各種カルボン酸(例えば、クエン酸誘導体)が含まれる。クエン酸はシデロホアとして働くことができる[17]。シデロホアには多くの種類が存在するが、これは微生物間の生存競争にかけて生じた進化圧の結果である。すなわち、各種微生物にとって自身のシデロホアが他の種の輸送体に横取りされることを避け、かつ、病原微生物の場合は宿主の免疫系により不活性化されることを防がなければならない[3][6]。
種類
[編集]微生物や菌類のシデロホアを以下に示す。
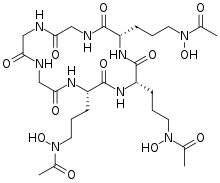
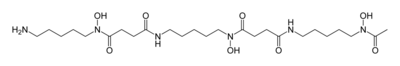
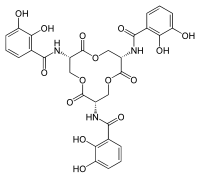



ヒドロキサム酸型シデロホア
| シデロホア | 保有微生物 |
|---|---|
| フェリクローム | Ustilago sphaerogena |
| デフェロキサミンB
(デフェロキサミン) |
Streptomyces pilosus
Streptomyces coelicolor |
| デフェロキサミンE | Streptomyces coelicolor |
| フサリニンC | Fusarium roseum |
| オルニバクチン | Burkholderia cepacia |
| ロドトルル酸 | Rhodotorula pilimanae |
カテコール型シデロホア
| シデロホア | 保有微生物 |
|---|---|
| エンテロバクチン | Escherichia coli |
| バチリバクチン | Bacillus subtilis |
| ビブリオバクチン | Vibrio cholerae |
混合配位子型
| シデロホア | 保有微生物 |
|---|---|
| アゾトバクチン | Azotobacter vinelandii |
| ピオベルジン | Pseudomonas aeruginosa |
| エルシニアバクチン | Yersinia pestis |
生物学的な役割
[編集]微生物
[編集]シデロホア産生の微生物は普通、鉄を十分に摂取しているとき、シデロホアの利用(シデロホアの合成と、細胞外に分泌したものの吸収)に関わる遺伝子の発現を抑制している。鉄摂取の十分さは細胞内濃度で認識している。抑制方法はFe2+-依存性リプレッサーであり、細胞内鉄イオン濃度が十分に高いとき、リプレッサーが当該遺伝子の上流に結合してその発現を阻害している。
環境中の鉄が欠乏すると細胞内の鉄イオン濃度が低くなり、Fe2+がリプレッサーから分離し、リプレッサーはDNAから遊離する。こうして、抑制されていた遺伝子は発現するようになり、鉄の獲得能力は底上げされる。
グラム陰性および、ゲノムDNAにアデニンとチミンが豊富なグラム陽性細菌において、通常、リプレッサーはFur (ferric uptake regulator) リプレッサーである。一方、ゲノムDNAにグアニンとシトシンが豊富なグラム陽性細菌(放線菌門など)の場合は、DtxR (diphtheria toxin repressor) である。DtxRの名称は、Corynebacterium diphtheriaeにおいて制御する遺伝子が人体に危険なジフテリア毒素であるためである[9]。
植物
[編集]
一般的に土壌中の鉄濃度は植物成長の要求量以上であるが、石灰質土壌の場合にはその高いpHにより鉄が不溶性の水酸化鉄となり、植物の鉄不足が現れる。石灰質土壌は世界中の耕作地の30%である。鉄不足の条件下で、イネ科植物はデオキシムギネ酸などの植物シデロホア(ファイトシデロホア)を分泌する[18]。ファイトシデロホアの構造は微生物シデロホアとは異なり、3つのα-アミノカルボン酸ユニットと、中心と結合した2つのα-アミノカルボン酸をもつ。後者の二座は三価鉄への高い選択性に寄与する。環境中へと分泌された後、鉄を捕捉したファイトシデロホア(鉄-ファイトシデロホア錯体)は細胞内へと輸送される。この輸送は細胞膜上でのプロトンとの共輸送により行われる[19]。このとき、錯体中の三価鉄は二価鉄に還元され、ファイトシデロホアへの親和性を失う。そして、二価鉄に対する親和力が強いニコチアナミンに捕捉され、根の細胞外から出ないようにされる[20]。ニコチアナミンはまた師部を通じた植物体内全体への鉄イオンの運搬に関わると考えられている。
铜绿假单胞菌中的吡咯菌素和铁载体产生
[編集]在最近的一项研究中[21],研究人员探索了铜绿假单胞菌中一种名为吡咯菌素(PVD)的铁载体的产生。[22]这项研究专注于通过系统性方法对PVD生物合成(一种毒力因子)进行构建、建模和动态模拟。这种方法认为PVD合成的代谢途径受到菌群感应(QS)现象的调控,这是一种细胞通信系统,允许细菌根据其种群密度协调其行为。
研究表明,随着细菌生长的增加,QS信号分子的细胞外浓度也会增加,从而模拟了铜绿假单胞菌PAO1的自然行为。为了进行这项研究,研究人员基于iMO1056模型、铜绿假单胞菌PAO1菌株的基因组注释以及PVD合成的代谢途径,构建了铜绿假单胞菌的代谢网络模型。这个模型包括了PVD的合成、运输反应、交换以及QS信号分子。
最终的模型,被称为CCBM1146[23],显示了QS现象如何直接影响铜绿假单胞菌向PVD生物合成的代谢,这取决于QS信号强度的变化。这项工作是首次以硅报告的一种整合模型,包括QS基因调控网络和铜绿假单胞菌的代谢网络,为如何通过菌群感应现象影响铜绿假单胞菌中吡咯菌素和铁载体的产生提供了详细的视角。
脚注
[編集]- ^ J. B. Neilands (1952). “A Crystalline Organo-iron Pigment from a Rust Fungus (Ustilago sphaerogena)”. Journal of the American Chemical Society 74 (19): 4846-4847. doi:10.1021/ja01139a033.
- ^ J. B. Neilands (1995). “Siderophores: Structure and Function of Microbial Iron Transport Compounds”. Journal of Biological Chemistry 270 (45): 26723-26726. doi:10.1074/jbc.270.45.26723.
- ^ a b c d e R. C. Hider and X. Kong (2010). “Chemistry and biology of siderophores”. Natural product reports 27 (5): 637-657. doi:10.1039/B906679A.
- ^ a b Jorge H. Crosa1, Alexandra R. Mey2, Shelley M. Payne, ed (2004). Iron Transport in Bacteria. ワシントンDC: American Society for Microbiology. doi:10.1128/9781555816544. ISBN 9781555816544
- ^ Cornelis, P. and Andrews, S. C., ed (2010). Iron Uptake and Homeostasis in Microorganisms. UK: Caister Academic Press. ISBN 9781904455653
- ^ a b c Marvin J. Miller, Siderophores (microbial iron chelators) and siderophore-drug conjugates (new methods for microbially selective drug delivery). University of Notre Dame, 4/21/2008
- ^ Stephan M. Kraemer, Alison Butler, Paul Borer, Javiera Cervini-Silva (2005). “Siderophores and the Dissolution of Iron-Bearing Minerals in Marine Systems”. Reviews in mineralogy and geochemistry 59 (1): 53-84. doi:10.2138/rmg.2005.59.4.
- ^ Paul M. Borer, Barbara Sulzberger, Petra Reichard, Stephan M. Kraemer (15 January 2005). “Effect of siderophores on the light-induced dissolution of colloidal iron(III) (hydr)oxides”. Marine Chemistry 93 (2-4): 179-193. doi:10.1016/j.marchem.2004.08.006.
- ^ a b c Marcus Miethke and Mohamed A. Marahiel (1 September 2007). “Siderophore-Based Iron Acquisition and Pathogen Control”. Microbiology and molecular biology reviews 71 (3): 413-451. doi:10.1128/MMBR.00012-07. PMC 2168645. PMID 17804665.
- ^ Gregory L. Challis Dr. (2005). “A Widely Distributed Bacterial Pathway for Siderophore Biosynthesis Independent of Nonribosomal Peptide Synthetases”. Chembiochem 6 (4): 601-611. doi:10.1002/cbic.200400283. PMID 15719346.
- ^ a b Kenneth N. Raymond, Emily A. Dertz, & Sanggoo S. Kim (2003). “Enterobactin: An archetype for microbial iron transport”. Proceedings of the National Academy of Sciences 100 (7): 3584-3588. doi:10.1073/pnas.0630018100. PMC 152965. PMID 12655062.
- ^ Rebecca J. Abergel, Melissa K. Wilson, Jean E. L. Arceneaux, Trisha M. Hoette, Roland K. Strong, B. Rowe Byers, and Kenneth N. Raymond (2006). “Anthrax pathogen evades the mammalian immune system through stealth siderophore production”. Proceedings of the National Academy of Sciences 103 (49): 18499-18503. doi:10.1073/pnas.0607055103. PMC 1693691. PMID 17132740.
- ^ Stephen Cendrowski,William MacArthur, Philip Hanna (Jan 2004). “Bacillus anthracis requires siderophore biosynthesis for growth in macrophages and mouse virulence”. Molecular microbiology 51 (2): 407-417. doi:10.1046/j.1365-2958.2003.03861.x. PMID 14756782.
- ^ Tao Zhou Yongmin Ma, Xiaole Kong and Robert C. Hider (2002). “Design of iron chelators with therapeutic application”. Dalton transactions 41 (21): 6371-6389. doi:10.1039/C2DT12159J.
- ^ Karla D.KrewulakHans J.Vogel (2008). “Structural biology of bacterial iron uptake”. Biochimica et Biophysica Acta (BBA) - Biomembranes 1778 (9): 1781-1804. doi:10.1016/j.bbamem.2007.07.026. PMID 17916327.
- ^ Roosenberg, I. I., Lin, Y. M., Lu, Y., & Miller, M. J. (2000). “Studies and Syntheses of Siderophores, Microbial Iron Chelators, and Analogs as Potential Drug Delivery Agents”. Current medicinal chemistry 7 (2): 159-197. doi:10.2174/0929867003375353. PMID 10637361.
- ^ Prof. Dr. H.-J. Rehm & Dr. G. Reed (7 May 2008). “5. Microbial Siderophores”. In David Clark, Nanette Pazdernik. Biotechnology 2nd Edition. doi:10.1002/9783527620999.ch5g. ISBN 9780123850164
- ^ Y. Sugiura & K. Nomoto (1984). “Phytosiderophores structures and properties of mugineic acids and their metal complexes”. Siderophores from Microorganisms and Plants: 107-135. doi:10.1007/BFb0111313.
- ^ Astrid Sigel & Helmut Sigel (1998). “Metal Ions in Biological Systems, Volume 35: Iron Transport and Storage Microorganisms, Plants, and Animals”. Metal-Based Drugs 5 (5): 262. doi:10.1155/MBD.1998.262a. PMC 2365134.
- ^ Elsbeth L. Walker & Erin L. Connolly (2008). “Time to pump iron: iron-deficiency-signaling mechanisms of higher plants”. Current Opinion in Plant Biology 11 (5): 530-535. doi:10.1016/j.pbi.2008.06.013. PMID 18722804.
- ^ Clavijo-Buriticá, Diana Carolina; Arévalo-Ferro, Catalina; González Barrios, Andrés Fernando (2023-05-16). “A Holistic Approach from Systems Biology Reveals the Direct Influence of the Quorum-Sensing Phenomenon on Pseudomonas aeruginosa Metabolism to Pyoverdine Biosynthesis” (英語). Metabolites 13 (5): 659. doi:10.3390/metabo13050659. ISSN 2218-1989. PMC 10224149. PMID 37233700.
- ^ Buriticá, Clavijo; Carolina, Diana (2022-11-21) (英語). Quorum-Sensing Model for the Pyoverdine Expression in P. aeruginosa.. 1. doi:10.17632/2xzzkmnpfx.1.
- ^ Buriticá, Clavijo; Carolina, Diana (2022-11-21) (英語). P. aeruginosa Genome-scale Metabolic Network - CCBM1146. 1. doi:10.17632/y9htx3fcjm.1.
