塩化ホスホリル
| 塩化ホスホリル | |
|---|---|

| |

| |
塩化ホスホリル | |
別称 オキシ塩化リン 三塩化酸化燐 | |
| 識別情報 | |
| CAS登録番号 | 10025-87-3 |
| EC番号 | 233-046-7 |
| 国連/北米番号 | 1810 |
| RTECS番号 | TH4897000 |
| 特性 | |
| 化学式 | POCl3 |
| モル質量 | 153.33 g/mol |
| 外観 | 無色液体 |
| 密度 | 1.645 g/cm3, 液体 |
| 融点 |
1.25 ℃ (274.4 K) |
| 沸点 |
105.8 ℃ (379.0 K) |
| 水への溶解度 | 水と反応 |
| 構造 | |
| 分子の形 | 四面体形 |
| 双極子モーメント | 2.54 D |
| 危険性 | |
| 安全データシート(外部リンク) | ICSC 0190 |
| EU分類 | 猛毒 (T+) 有害 (Xn) 腐食性 (C) |
| EU Index | 015-009-00-5 |
| NFPA 704 | |
| Rフレーズ | R14, R22, R26, R35, R48/23 |
| Sフレーズ | (S1/2), S7/8, S26, S36/37/39, S45 |
| 関連する物質 | |
| 関連物質 | 塩化チオホスホリル 臭化ホスホリル 三塩化リン 五塩化リン |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
塩化ホスホリル(えんかホスホリル、phosphoryl chloride)は三塩化リンに酸素原子を付加した化合物である。オキシ塩化リン (phosphorus oxychloride)、リン酸トリクロリド (phosphoric trichloride) とも呼ばれる。分子式は POCl3 である。湿気を含んだ空気で加水分解されてリン酸と塩化水素の煙を生じる。三塩化リンと酸素、あるいは五塩化リンから工業的に大規模に生産されており、リン酸トリクレジルのようなリン酸エステルを作るのに用いられる。毒物及び劇物取締法により毒物に指定されている[1]
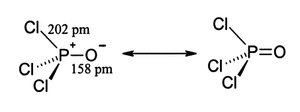
構造
[編集]リン酸エステルなどの類縁体と同様、四面体構造をとる。3つの P-Cl 結合と1つの非常に強い P=O 結合を持ち、P=O 結合の結合解離エネルギーは 533.5 kJ/mol と見積もられている。結合強度と電気陰性度に基づき、ショーメーカー・スチーブンソン則 (Schomaker-Stevenson rule) は POF3 よりも二重結合の寄与が非常に大きいことを示している。この P=O 結合はケトンなどのカルボニル基におけるπ結合とは異なる。P-O 間の相互作用の適切な記述法については長らく論争が続いている。古い教科書では、リン原子上のd軌道の関与を用いた記述、すなわちいくつかのd軌道が酸素原子に向かって広がり、酸素のp軌道と重なっている、という記述がよく見られる。より新しい教科書では、
P-Cl σ* 軌道に O 原子の孤立電子対が供与されて P-O π 結合が生じるという記述が好んで用いられ、d軌道に関しては考慮されない。

化学的性質
[編集]水やアルコールと反応してリン酸やリン酸エステルを与える。
アルコールと反応させる場合、生成物であるアルキルリン酸エステルは HCl に対して不安定なので、ピリジンやアミンなど HCl と反応してこれを取り除ける試薬を共存させる。塩化ホスホリルを塩化マグネシウムなどのルイス酸存在下に過剰のフェノールと加熱すると、トリアリールリン酸エステルが生成する。
ルイス塩基としても働き、四塩化チタンなど、様々なルイス酸と反応して付加物を形成する。
塩化アルミニウムとの付加物は非常に安定なので、フリーデル・クラフツ反応を行った後の混合物から完全に塩化アルミニウムを取り除くことができる。また、塩化アルミニウムの存在下、臭化水素と反応して POBr3 を与える。
合成法
[編集]三塩化リンと酸素の20–50 ℃における反応によって得られる。空気を用いると反応効率が悪い。
もう1つは五塩化リンと五酸化二リンの反応によるものである。これらの化合物は共に固体なので混合しにくい。そこで、液体である三塩化リンを原料兼溶媒として使う。五酸化二リンとの混合物を塩素化し、五塩化リンを系中で発生させ、反応を行う。三塩化リンが消費されると、生成物である塩化ホスホリルが溶媒となる。
五塩化リンを水と反応させても塩化ホスホリルが生成するが、この反応は上記のものより制御するのが難しい。
用途
[編集]最も重要な用途はリン酸トリフェニルやリン酸トリクレジルといったリン酸トリアリールエステルの製造である。これらのエステル類は難燃剤やポリ塩化ビニルの可塑剤として長年用いられている。一方、リン酸トリブチル(TBP)などのアルキルエステルは核燃料再処理において液-液抽出溶媒として使われる。
実験室においては脱水試薬として広く用いられる。例としてアミドのニトリルへの変換が挙げられる。ビシュラー・ナピエラルスキー反応 (Bischler-Napieralski reaction) ではアミド前駆体の閉環によってジヒドロイソキノリン誘導体を合成する。
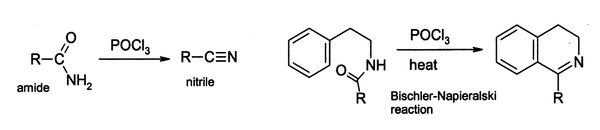
上記の反応は塩化イミドイル中間体を経由すると考えられている。十分に安定な場合は、塩化イミドイルが最終生成物となる。例えば、ピリドンやピリミドンはピリジンやピリミジンの塩化物誘導体へと変換でき、これらは製薬工業における重要な中間体である。同様にして、バルビツール酸は塩化ホスホリルと140 ℃で反応させることにより、2,4,6-トリクロロピリミジンに変換される。

また、これと関連する反応として、塩化ホスホリルを用いて活性化された芳香環をアシル化し、芳香族アルデヒドや芳香族ケトンを得る反応(ビルスマイヤー・ハック反応)がある。この反応には DMF や N-フェニル-N-メチルホルムアミドといったホルムアミド誘導体が最もよく使われる。これらはイミニウム塩を生成したあと、簡単に加水分解されてアルデヒドを与える。例えばアントラセンとの反応では 9-アントラアルデヒドを与える。

脚注
[編集]参考文献
[編集]- Earnshaw, A.; Greenwood, N. Chemistry of the Elements; Butterworth-Heinemann: Oxford, 1997; 2nd ed. ISBN 0-7506-3365-4
- Handbook of Chemistry and Physics; CRC Press: Ann Arbor, Michigan, 1990; 71st ed.
- March, J. Advanced Organic Chemistry; Wiley: New York, 1992; 4th ed., p. 723. ISBN 0-471-58148-8
- The Merck Index; Merck & Co: Rahway, New Jersey, 1960; 7th ed.
- Toy, A. D. F. The Chemistry of Phosphorus; Pergamon Press: Oxford, UK, 1973.
- Wade, L. G., Jr. Organic Chemistry; Prentice Hall: Upper Saddle River, New Jersey, 2005; 6th ed., p. 477. ISBN 0-13-169957-1
- Walker, B. J. Organophosphorus Chemistry; Penguin: Harmondsworth, UK, 1972; pp. 101-116.
- Elderfield, R. C. Heterocyclic Compounds; Wiley: New York, 1957; Vol. 6, pp. 265-266. トリクロロピリミジンの合成については: Gabriel, S.; Colman J. "Zur Darstellung des 2.4.6-Trichlor-pyrimidins." Chem. Ber. 1904, 37, 3657-3658.
- 9-Anthraldehyde; 2-Ethoxy-1-naphthaldehyde. Organic Syntheses, Coll. Vol. 3, p. 98 (1955); Vol. 20, p. 11 (1940). アントラセンのホルミル化(英語)







