クエン酸
| クエン酸 | |
|---|---|
| |

| |
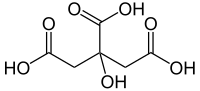
2-hydroxypropane-1,2,3-tricarboxylic acid | |
別称 3-カルボキシ-3-ヒドロキシペンタン二酸 | |
| 識別情報 | |
| CAS登録番号 | 77-92-9 |
| PubChem | 311 |
| ChemSpider | 305 |
| UNII | XF417D3PSL |
| E番号 | E330 (酸化防止剤およびpH調整剤) |
| KEGG | D00037 |
| ChEMBL | CHEMBL1261 |
| |
| |
| 特性 | |
| 化学式 | C6H8O7 |
| モル質量 | 192.124 g/mol (無水物) 210.14 g/mol (一水和物) |
| 示性式 | C(OH)(CH2COOH)2COOH |
| 外観 | 白色結晶 |
| 密度 | 1.665 g/cm3 |
| 融点 |
153 °C, 426 K, 307 °F |
| 沸点 |
175 °C, 448 K, 347 °F (分解) |
| 水への溶解度 | 73 g/100 ml (20 °C) |
| THF, エタノール, メタノールへの溶解度 | 無水物: THF 1.80 M エタノール 1.6 M メタノール 3.08 M[1] 一水和物: THF 1.52 M エタノール 1.78 M メタノール 2.27 M[2] |
| 酸解離定数 pKa | pKa1 = 3.09 pKa2 = 4.75 pKa3 = 6.41 [3] |
| 危険性 | |
| 主な危険性 | 皮膚と目を刺激 |
| 関連する物質 | |
| 関連物質 | クエン酸ナトリウム クエン酸カルシウム |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
クエン酸(クエンさん、枸櫞酸、英: citric acid)は、柑橘類などに含まれる有機化合物で、ヒドロキシ酸のひとつである。爽やかな酸味を持つことから食品添加物として多用される。
枸櫞(くえん)とは漢名でマルブシュカン(シトロン)を指す。レモンをはじめ柑橘類に多く含まれていることからこの名がついた。柑橘類の酸味はクエン酸の味に因るものが多い。また、梅干しにも多量に含まれている。
性質
[編集]分子量は192.125。CAS登録番号は[77-92-9](無水物)、[5949-29-1](一水和物)。カルボキシ基を3個有する弱酸。
水溶液は弱酸性(pKa = 2.87)を呈する。常温で無色あるいは白色の固体であり、無水物と一水和物の結晶がある。両者とも揮発性は無く無臭である。潮解性をしめすため保存には注意を必要とする[4]。一水和物は加熱すると100 °Cで融解し、130 °Cに保つと融点153 °Cの無水物となる。175 °C以上では分子内脱水によりアコニット酸となる。金属イオンとキレート錯体を作ることが知られている。
生体内物質
[編集]クエン酸は、生体内ではクエン酸回路の構成成分であり、オキサロ酢酸とアセチルCoAとの反応によって生成する。また、クエン酸は、クエン酸回路でアコニット酸ヒドラターゼ(EC 4.2.1.3)によってcis-アコニット酸を経て異性化されイソクエン酸となる。またクエン酸は解糖系のホスホフルクトキナーゼ活性を阻害し、解糖系からクエン酸回路への流入を調節する因子の1つでもある[5]。
製法
[編集]工業的にはデンプンあるいは糖をコウジカビの一種Aspergillus niger(クロコウジカビ) で発酵させて作られている。1919年に製薬企業のファイザーが、初めてクエン酸の工業生産に成功した。
存在
[編集]レモンジュース、トマトピューレ、ルビー種のグレープフルーツジュースやオレンジジュース、食酢などに多い。
利用
[編集]ヒトの摂取
[編集]
主にクエン酸回路によるエネルギー生産を謳い、各種サプリメントの成分として多用されている。しかし、5 km走での実験から、運動成績を有意に向上させることが報告されたが、その後否定されている[6][7]。このほか、高強度運動や600 m走でも運動成績には影響がないことが示されている[8][9]。
他にも、クエン酸回路において間接的に筋肉内の乳酸を分解する点からかつては運動後の疲労軽減効果作用も言及されていたものの、乳酸疲労物質説は今日では否定されており[10]、売り文句としてはあまり有為ではない。
ただし、クエン酸自体は疲労物質の一つとされるカルシウム[11]ともキレート錯体を構成するため、このカルシウムとの結合が乳酸分解におけるアシドーシス低下とのトレードオフにおいて汎的に有位であるならば、疲労軽減に若干は効果が認められることとなる。
同様に、鉄を中心としたミネラルイオンともキレート錯体を構成して吸収性を高めることから、運動成績向上機能ではなく、栄養機能的側面から見れば、運動後におけるクエン酸の摂取は、決して無駄とは言いがたい。また、運動後はブドウ糖を単体でとるよりも、クエン酸を加えた方が、グリコーゲンを多く貯蔵できるとの説も存在する[12]。
日本薬局方収載品であり、ドラッグストアでも第三類医薬品として市販されている。クエン酸の塩は血液凝固因子の一つであるカルシウムイオンとキレート結合するので、成分献血や血液凝固機能検査のサンプル採取などにおいて抗凝固薬としても利用される。
クエン酸ナトリウム・クエン酸カリウム合剤(商品名ウラリット配合錠)は、体液成分のアニオン性電解質の増大にともない利尿作用を励起し尿酸の排泄を促進することから、痛風に代表される高尿酸血症の治療薬として処方されるとともに尿路結石や代謝性アシドーシスの治療にも使用される[注 1]。オルニチン同様、肝機能低下による疲労臭に対する低減効果も流布されているが、真偽を別とし、この場合はまず肝機能低下の原因を、専門医の診断のもと特定したうえで適切に摂取すべきである。
食品添加物でもあり、清涼飲料水や炭酸水を始め、各種の加工食品に添加される。
洗浄
[編集]炭酸カルシウムを容易に溶かしてしまうことから、便器の尿石・浴室・電気ポット・加湿器内部に溜まった水垢の洗浄に用いられている。
肥料
[編集]肥料の成分がクエン酸の2%水溶液に溶解する性質を「く溶性」という言葉で表すが、これは植物の根が分泌する根酸には溶けにくいがもう少し強い酸には溶けることを意味し、徐々に溶け出してゆっくり吸収されることを示す。
クエン酸塩
[編集]アルカリ金属塩の正塩はいずれも水に可溶、アルコールに難溶で水溶液は弱アルカリ性を示す。重金属塩は水に不溶なものが多いが、クエン酸イオンが過剰にあると複数配位することで水溶性となるものもある。
- クエン酸ナトリウム
- 二水和物が安定で、化学式 · の塩。水溶液は弱アルカリ性を示す。抗血液凝固剤や写真材料として利用される。家庭でクエン酸と炭酸水素ナトリウムを用いて自作の炭酸水を作った際には、その副産物として発生する[注 2]。
- クエン酸カリウム
- 一水和物が安定で、化学式 · の塩。水溶液は弱アルカリ性を示す。利尿剤として利用された。
- クエン酸銅(II)
- 化学式 の塩。トラコーマまたは濾胞性結膜炎の軟膏に使用されたことがある。
- クエン酸鉄(III)アンモニウム
- 水酸化鉄(III) をクエン酸に溶かしアンモニアを加えて調製する。調製法により錯塩の構成が異なり、赤褐色の塩と緑色の塩が得られる。鉄欠乏性貧血の鉄剤として利用されたり、青写真や写真材料として利用されている。
安全性
[編集]クエン酸は弱酸ではあるが、純粋なクエン酸に曝されると悪影響を受ける可能性がある。吸入されると、咳、息切れ、喉の痛みを引き起こす可能性がある。過剰摂取は、腹痛や喉の痛みを引き起こす可能性がある。皮膚や目が濃縮液に曝されると、赤みや痛みを引き起こす可能性がある。長期間または繰り返し摂取すると、歯のエナメル質が侵食される可能性がある。
洗剤用として販売されている製品は食品や医薬品としての製造認可を受けた工場で製造したものではないため、これらを経口摂取することは衛生・食品安全の見地からまったく望ましくない[13]。食用・飲用を目的とする場合、食品添加物規格を満たした製品を用いるべきである。
脚注
[編集]注釈
[編集]- ^ ウラリットの臨床成績によると、酸性尿の改善効果により、痛風に93.3%(180/193)、無症候性高尿酸血症に98.1%(51/52)、高尿酸血症を伴う高血圧症に91.2%(31/34)、高尿酸血症を伴う腎障害に87.5%(21/24)、Lesch-Nyhan症候群に100.0%(5/5)、小児急性白血病に100.0%(7/7)、尿酸結石ほかに95.8%(92/96)、アシドーシスの改善効果により、ファンコニー症候群に90.5%(19/21)、ロウ症候群に92.9%(13/14)、糖原病に100.0%(12/12)、シスチン症に100.0%(4/4)、腎尿細管性アシドーシスに88.6%(39/44)、高クロール血症性アシドーシス(尿路形成術など手術後)に66.7%(10/15)、その他のアシドーシス(アルギニノコハク酸尿症、腎障害に伴うアシドーシスほか)に100.0%(16/16)の有効な改善効果が認められた。
有効性の機序としては、主としてクエン酸の代謝産物の重炭酸塩(HCO3−)が、生体において塩基として作用することに基づくと考えられる。(参考:医療用医薬品 : ウラリット) - ^ 化学式は、
出典
[編集]- ^ Solubility of citric acid anhydrous in non-aqueous solvents
- ^ Solubility of citric acid monohydrate in non-aqueous solvents
- ^ Dawson, R. M. C., et al., Data for Biochemical Research, Oxford, Clarendon Press, 1959.
- ^ “クエン酸 | 株式会社日東物産商事”. nittobussan-corp.co.jp. 2024年9月10日閲覧。
- ^ Stryer, Lubert; Berg, Jeremy; Tymoczko, John (2003). “Section 16.2: The Glycolytic Pathway Is Tightly Controlled”. Biochemistry (5. ed., international ed., 3. printing ed.). New York: Freeman. ISBN 978-0716746843
- ^ Oöpik, V.; Saaremets, I.; Medijainen, L.; Karelson, K.; Janson, T.; Timpmann, S. (2003). "Effects of sodium citrate ingestion before exercise on endurance performance in well trained college runners." Br. J. Sports Med. 37: 485–489. PMID 14665584.
- ^ Oopik, V.; Saaremets, I.; Timpmann, S.; Medijainen, L.; Karelson, K. (2004). "Effects of acute ingestion of sodium citrate on metabolism and 5-km running performance: a field study." Can. J. Appl. Physiol. 29: 691–703. PMID 15630143.
- ^ Hausswirth, C.; Bigard, A. X.; Lepers, R.; Berthelot, M.; Guezennec, C. Y. (1995). "Sodium citrate ingestion and muscle performance in acute hypobaric hypoxia." Eur. J. Appl. Physiol. Occup. Physiol. 71(4): 362–368. PMID 8549581.
- ^ van Someren, K.; Fulcher, K.; McCarthy, J.; Moore, J.; Horgan, G.; Langford, R. (1998). "An investigation into the effects of sodium citrate ingestion on high-intensity exercise performance." Int. J. Sport Nutr. 8(4): 356–363. PMID 9841956.
- ^ Nielsen, O. B.; de Paoli, F.; Overgaard, K. J. Physiol. 2001, 536, 161-166., doi:10.1111/j.1469-7793.2001.t01-1-00161.x
- ^ 八田秀雄、「新たな乳酸の見方」『学術の動向』、Vol.11 (2006) No.10 p.47-50, doi:10.5363/tits.11.10_47
- ^ 『競技力向上のスポーツ栄養学』 トレーニング科学研究会/編 朝倉書店 2001年 ISBN 978-4254690194
- ^ https://kensa.coop-kobe.net/qa/other/post-318.html
関連項目
[編集]外部リンク
[編集]- クエン酸 - 素材情報データベース<有効性情報>(国立健康・栄養研究所)
- くえん酸一水和物 (試薬) JISK8283:2006
















