SIGLEC
Siglec(シアル酸結合免疫グロブリン-タイプレクチン)はシアル酸と結合する細胞表面タンパク質である。主に免疫細胞との表面に見られるI型レクチンの一種である。哺乳類では14種が見つかっており、細胞表面受容体-リガンド相互作用に基づき多様な機能を発揮する。
歴史
[編集]はじめにSiglecの候補として見出されたのはマクロファージ表面のSialoadhesin(Siglec-1/CD169)レクチン様接着タンパク質である[1]。同時期にAjit Varkiらは、CD22(接着や活性化に関わる B細胞 表面タンパク)がシアル酸を認識する直接的な証拠を示した。その後、Crocker らによるSialoadhesinのクローニングにより、CD22(Siglec-2)、CD33(Siglec-3)および ミエリン関連糖タンパク質(MAG/Siglec-4)との相同性が示されたことから、"Sialoadhesin"ファミリーが提唱された。その後、Varkiが"Siglec"という名称を提唱し、I型 レクチンの一種であることを示した。以降、この名称がこれら分子に関わる研究者のほぼすべてにより採用されている。CD33と非常に類似した構造の複数のSiglec(Siglec5-12)がヒトで見つかっており、"CD33関連Siglecs"と呼ばれている[2]。Sialoadhesin、CD22、MAGおよびSiglec-15を含む一部のSiglecはマウスおよびヒトで完全に保存されており、Siglec-8、Siglec-9はマウス、およびラットにおいて ホモログ を持つ(Siglec-FおよびSiglec-E)ヒトがマウスよりも多様なSiglecを持つため、ナンバリングはヒトタンパクに基づく[3]。
機能
[編集]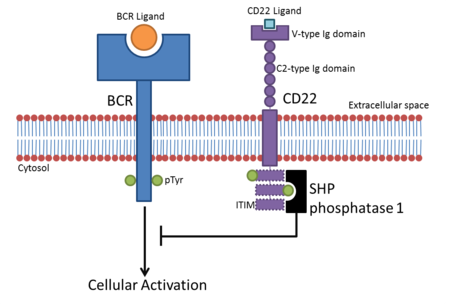
Siglecの主たる機能はシアル酸を含む糖鎖との結合である。これらの受容体-糖鎖相互作用は細胞接着、シグナリングなどに使われる。Siglecの機能は細胞での発現により制限される。例えば、MAGは希突起膠細胞、およびシュワン細胞にのみ見られる一方、Sialoadhesinはマクロファージにのみ存在する。
多くのSiglecは短く、細胞表面から離れた分子に対しては機能しない。これにより、哺乳類細胞はシアル酸を含む糖鎖に覆われているにもかかわらず、他の細胞に接着することは防がれている。つまり、Siglecの多くは同じ細胞上のリガンド(cis-リガンド)としか結合せず、同一細胞上の糖鎖が周囲に集合する。一つの例外はSialoadhesinであり、16個のC2-Igドメインを持ち、他の細胞上のリガンド(trans-リガンド)と結合する。その他、MAGもtrans-リガンドと相互作用することが示されている。
シグナリング
[編集]多くのSiglecは免疫受容抑制性チロシンモチーフ(Immunoreceptor Tyrosine-based Inhibition Motif: ITIM)を細胞内領域に持ち、これによって免疫細胞の活性化を抑制する。リガンドと結合するとSiglecはSrc相同性領域2(SH2)ドメイン含有フォスファターゼ(SHP)等の抑制性タンパクをITIM領域に動員する[4]。リガンド結合後、ITIMに含まれるチロシンがリン酸化され、SHPのようなSH2ドメイン含有タンパクの結合領域として機能する。これにより細胞質タンパクが脱リン酸化され、活性化経路が阻害される。
ヒト-霊長類 Siglec
[編集]| 名称 | 発現細胞 |
シアル酸結合得意性 |
C2-Ig ドメイン数 | ITIM / 活性化部位 |
|---|---|---|---|---|
| Siglec-1 (Sialoadhesin) | マクロファージ | α2,3>α2,6 | 16 | なし |
| Siglec-2 (CD22) | B細胞 | α2,6 | 6 | ITIM |
| Siglec-3 (CD33) | 骨髄系細胞、単球 | α2,6>α2,3[5] | 1 | ITIM |
| Siglec-4 (MAG) | ミエリン | α2,3>α2,6 | 4 | なし |
| Siglec-5 | 好中球、単球 | α2,3 | 3 | ITIM |
| Siglec-6 | 栄養芽細胞 | α2,6 | 2 | ITIM |
| Siglec-7 | NK 細胞 | α2,8>α2,6>α2,3 | 2 | ITIM |
| Siglec-8 | 好酸球 | α2,3>α2,6 | 2 | ITIM |
| Siglec-9 | 単球、好中球、樹状細胞 | α2,3=α2,6 (prefers sulfated residues) | 2 | ITIM |
| Siglec-10 | B細胞 | α2,3=α2,6 | 4 | ITIM |
| Siglec-11 | B細胞 | α2,8 | 4 | ITIM |
| Siglec-12[6] | マクロファージ | なし |
2 | ITIM |
| Siglec-13[7] | 単球(チンパンジー) | |||
| Siglec-14 | 不明 | α2,6 | 2 | アルギニン |
| Siglec-15 | 不明 | α2,6[8] | 1 | リシン |
| Siglec-16[9] | 組織マクロファージ | |||
| Siglec-17 | NK 細胞 |
参照文献
[編集]- ^ Crocker P (1986). “Properties and distribution of a lectin-like hemagglutinin differentially expressed by murine stromal tissue macrophages”. J Exp Med 164 (6): 1862–75. doi:10.1084/jem.164.6.1862. PMC 2188478. PMID 3783087.
- ^ Crocker P (2001). “Siglecs in the immune system”. Immunology 103 (2): 137–45. doi:10.1046/j.0019-2805.2001.01241.x. PMC 1783234. PMID 11412300.
- ^ Varki A (2006). “Siglecs-the major subfamily of I-type lectins”. Glycobiology 16: 1R-27R. doi:10.1093/glycob/cwj008. PMID 16014749.
- ^ Avril T (2004). “The Membrane-Proximal Immunoreceptor Tyrosine-Based Inhibitory Motif is critical for the Inhibitory Signaling Mediated by Siglecs-7 and -9, CD33-Related Siglecs Expressed on Human Monocytes and NK Cells”. The Journal of Immunology 173: 6841–6849. doi:10.4049/jimmunol.173.11.6841. PMID 15557178.
- ^ Razi N (1999). “Cryptic sialic acid binding lectins on human blood leukocytes can be unmasked by sialidase treatment or cellular activation”. Glycobiology 9: 1225–1234. doi:10.1093/glycob/9.11.1225. PMID 10536038.
- ^ Mitra N (2011). “SIGLEC12, a Human-specific Segragating (Pseudo)gene, Encodes a Signaling Molecule Expressed in Prostate Carcinomas”. J. Biol. Chem. 286: 23003–23011. doi:10.1074/jbc.M111.244152. PMC 3123068. PMID 21555517.
- ^ Wang X (Jun 19, 2012). “Specific inactivation of two immunomodulatory SIGLEC genes during human evolution”. Proc Natl Acad Sci U S A. 109 (25): 9935–40. doi:10.1073/pnas.1119459109.
- ^ Angata T (2007). “Siglec-15: an immune system Siglec conserved throughout vertebrate evolution”. Glycobiology 17: 838–846. doi:10.1093/glycob/cwm049. PMID 17483134.
- ^ Cao H1, Lakner U, de Bono B, Traherne JA, Trowsdale J, Barrow AD. (Aug 2008). “SIGLEC16 encodes a DAP12-associated receptor expressed in macrophages that evolved from its inhibitory counterpart SIGLEC11 and has functional and non-functional alleles in humans”. Eur J Immunol. 38 (8): 2303–15. doi:10.1002/eji.200738078.
