選択的エストロゲン受容体修飾薬
| 選択的エストロゲン受容体修飾薬 | |
|---|---|
| 薬物クラス | |
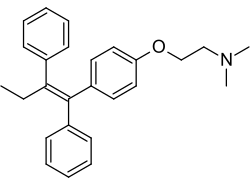 | |
| クラス識別子 | |
| 別名 | SERM; Estrogen receptor agonist/antagonist; ERAA |
| 適応 | Breast cancer, infertility, osteoporosis, vaginal atrophy, dyspareunia, contraception, male hypogonadism, gynecomastia, breast pain, others |
| ATCコード | G03XC |
| 生物学的ターゲット | エストロゲン受容体 |
| In Wikidata | |
選択的エストロゲン受容体修飾薬(Selective estrogen receptor modulator;SERM)[1]は、エストロゲン受容体作動薬/遮断薬(ERAA)[2]としても知られ、エストロゲン受容体(ER)に作用する薬剤の一種である[3]。これらの物質が純粋なER作動薬および遮断薬(即ち、完全作動薬および完全遮断薬)と異なる特徴は、その作用の強さが組織ごとにさまざまに異なるため、多種多様な組織でエストロゲン様作用を選択的に刺激または阻害する可能性があるということである。
臨床使用
[編集]SERMは、不妊症治療における排卵障害の治療、閉経後の骨粗鬆症の治療および予防、乳癌の治療およびリスク低減[4]、更年期障害の治療など、さまざまなエストロゲン関連疾患に使用される。また、エストロゲン欠乏症や更年期障害に伴う血管運動症状の治療を目的として、共役型エストロゲンとの併用も行われている[5]。SERMは、さまざまな組織での作用パターンに応じて使用される。
タモキシフェンは、ER陽性の転移性乳癌に対する第一選択のホルモン治療薬である。また、乳癌高リスクの女性のリスク低減や、腋窩リンパ節転移陰性およびリンパ節転移陽性の非浸潤性乳管癌のアジュバント治療にも使用される[5][6]。また、タモキシフェン治療は、閉経後の女性の骨密度や血中脂質の治療にも有用である。副作用としては、熱感紅潮があり、より深刻なのは、子宮内膜癌の相対リスクが、年齢をマッチさせた女性と比較して2 - 3倍高いことである[6][4]。
塩素化タモキシフェン誘導体であるトレミフェンは、前臨床試験において、タモキシフェンで見られたものよりも肝臓でのDNA付加体が少なく、肝癌の回避を目的に開発された。本剤は、ER/PR陽性のステージ4または再発転移性乳癌の女性患者の内分泌療法として使用され[7]、乳癌のアジュバント治療および転移性乳癌の治療において、タモキシフェンと比較して同等の有効性を示している[6]。
ラロキシフェンは、閉経後の骨粗鬆症の予防・治療、および骨粗鬆症を有する乳癌リスクの高い閉経後女性の癌予防に使用される[5]。前臨床および臨床報告によると、骨粗鬆症の治療において、エストロゲンよりもかなり効果が低いことが示唆されている。また、子宮内膜の状態も良好で、子宮内でタモキシフェンと同様の作用を示すことはないが、静脈血栓塞栓症や熱感紅潮のような血管運動性症状などの副作用が認められている[4]。
オスペミフェンはトレミフェン代謝物の類縁物質である。タモキシフェンとは異なり、トレミフェンはラットの肝発癌物質ではないため、オスペミフェンもタモキシフェンよりも安全なSERMと言えると思われる[4]。更年期障害に伴う外陰部・膣の萎縮症状である中等度から重度の性交疼痛の治療に使用される。乳癌に関する臨床データはないが、in vitro およびin vivo のデータでは、オスペミフェンが乳房組織において化学的予防作用を有する可能性が示唆されている[6]。
バゼドキシフェンは、骨折のリスクが高い閉経後女性の骨粗鬆症治療薬として使用される。比較的安全で忍容性が高いことが示されている。乳房や子宮内膜への刺激を示さず、最初の2年間はわずかな増加でも静脈血栓塞栓症が改善され、長期的には他のSERMと同様の効果が得られる。ラロキシフェンに対するバゼドキシフェンの利点は、内皮の一酸化窒素合成酵素活性を高め、血管運動症状に対する17β-エストラジオールの効果に拮抗しないことである[5]。
最初の組織選択性エストロゲン複合体薬(TSEC)は、結合型エストロゲンとSERMであるバゼドキシフェンを配合し、それぞれの作用を融合させた初めての製品である。更年期障害に伴う中等度から重度の血管運動症状の治療、閉経後の骨粗鬆症の予防、閉経後の非子宮摘出女性におけるエストロゲン欠乏症の治療に用いられる。本剤は、エストロゲンによる子宮内膜への刺激を伴わずに、血管運動症状の緩和というエストロゲンの利点を享受することができる[5][6]。
| 名称 | 効能・効果 | 発売 | 注記 |
|---|---|---|---|
| アノルドリン | 緊急避妊 | 1970s | 中国のみ。ミフェプリストンと併用 |
| バゼドキシフェン | 骨粗鬆症予防 | 2013 | 結合型エストロゲンと併用 |
| ブロパレストロール | 皮膚科;乳癌治療 | 1970s | 販売中止 |
| クロミフェン | 女性不妊症 | 1967 | |
| シクロフェニル | 女性不妊症;更年期障害 | 1970 | ほとんど販売中止 |
| ラソフォキシフェン | 骨粗鬆症予防/治療;膣萎縮 | 2009 | リトアニアおよびポルトガルのみ |
| オルメロキシフェン | ホルモン避妊薬 | 1991 | インドのみ |
| オスペミフェン | 膣萎縮による性交疼痛症 | 2013 | |
| ラロキシフェン | 骨粗鬆症予防/治療;乳癌予防 | 1997 | |
| タモキシフェン | 乳癌治療 | 1978 | |
| トレミフェン | 乳癌治療 | 1997 |
薬理
[編集]SERMは、ERの競合的部分作動薬である[8]。内因性エストロゲンの活性に対する感度は組織により異なるため、SERMは、SERMの固有活性(IA)の割合だけでなく、問題となる特定の組織に応じて、エストロゲン作用または抗エストロゲン作用をもたらす[9]。IAが高く、エストロゲン作用が主となるSERMの例としては、クロロトリアニセンがあり、IAが低く、抗エストロゲン作用が主となるSERMの例としては、エタモキシトリフェトールがある。クロミフェンやタモキシフェンのようなSERMは、そのIAやエストロゲン作用と抗エストロゲン作用のバランスにおいて、比較的中間的な存在である。ラロキシフェンはタモキシフェンよりも抗エストロゲン作用が強いSERMである。どちらも骨ではエストロゲン作用を示すが、子宮ではタモキシフェンがエストロゲン作用を示すのに対し、ラロキシフェンは抗エストロゲン作用を示す[9]。
| 名称 | 乳腺 | 骨 | 肝臓 | 子宮 | 膣 | 脳 | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| 脂質 | 凝固 | SHBG | IGF-1 | 熱感紅潮 | 性腺刺激ホルモン | |||||
| エストラジオール | + | + | + | + | + | + | + | + | + | + |
| 理想的SERM | – | + | + | ± | ± | ± | – | + | + | ± |
| バゼドキシフェン | – | + | + | + | + | ? | – | ± | – | ? |
| クロミフェン | – | + | + | ? | + | + | – | ? | – | ± |
| ラソフォキシフェン | – | + | + | + | ? | ? | ± | ± | – | ? |
| オスペミフェン | – | + | + | + | + | + | ± | ± | – | ± |
| ラロキシフェン | – | + | + | + | + | + | ± | – | – | ± |
| タモキシフェン | – | + | + | + | + | + | + | – | – | ± |
| トレミフェン | – | + | + | + | + | + | + | – | – | ± |
| 効果: + = 作動、 ± = 混合・中性、 – = 遮断 注釈:SERMは一般的に、閉経前の女性だけでなく、性腺機能低下症や性腺機能亢進症の男性でも性腺刺激ホルモン濃度を増加させる (抗エストロゲン作用) が、閉経後の女性では性腺刺激ホルモン濃度を減少させる (エストロゲン作用)。 出典:[10][11][12][13][14][15][16][17][18][19][20][21][22][23][24][25] | ||||||||||
結合部位
[編集]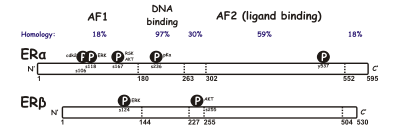
SERMは、核内受容体ファミリーに属する、細胞内のリガンド依存性転写活性化因子であるエストロゲン受容体(ER)に作用する[26]。ERには、ERαとERβという2つの異なるサブタイプが存在している。ERαは、エストロゲンのシグナルが転写レベルで伝達される主要な媒体と考えられており、女性の生殖管や乳腺で優勢なERであるのに対し、ERβは主に血管内皮細胞、骨、男性の前立腺組織に存在する[27]。ERαとERβの濃度は、組織ごとに発生、加齢、疾患などの状況で異なることが知られている[28]。ERαとERβの間では、サイズ(約600アミノ酸と約530アミノ酸)や構造など、多くの特徴が類似している。ERαとERβは、DNA結合ドメインでは約97%、リガンド結合ドメインでは約56%のアミノ酸配列の同一性がある[26][28]。リガンド結合ドメインの主な違いは、ERαではLeu-384とMet-421が、ERβではそれぞれMet-336とIle-373に置き換えられていることで決まる[29]。また、ERαとERβでは、N末端の違いが大きい[30]。
DNA結合ドメインは、2つのサブドメインから構成されている。1つはDNAの認識に関わる近位ボックス、もう1つはDNA依存的なDNA結合ドメインの二量化を担う遠位ボックスである。近位ボックスの配列はERαとERβで同一であり、このことは2つのサブグループ間の特異性と親和性が類似していることを示している。DNA結合ドメインの球状タンパク質は8つのシステインを含み、2つの亜鉛イオンの四面体の配位を可能にする。この配位により、ERとエストロゲン応答要素との結合が可能となる[27]。リガンド結合ドメインは、11本のヘリックスからなる球状の3層構造で、天然または合成のリガンドを入れるポケットがある[27][26]。結合親和性に影響を与える因子は、主にフェノール部位の存在、分子の大きさと形状、二重結合、疎水性である[31]。
リガンド結合ドメイン内の活性化機能2(AF-2)ヘリックス12が、結合したリガンドによってどのような位置関係になるかによって、そのリガンドが作動作用を持つか、遮断作用を持つかが決まる。作動薬が結合した受容体では、ヘリックス12はヘリックス3と5に隣接して配置される。また、ヘリックス3、5、12は、LXXLL(Lはロイシンまたはイソロイシン、Xは任意のアミノ酸を表す)という正規の配列を持つ補助活性化因子に含まれるNRボックスモチーフの結合面を形成している。アポ状態(リガンド非結合)の受容体や遮断薬リガンドと結合した受容体は、ヘリックス12をLXXLLの結合面から遠ざけ、補助抑制因子であるNCoR1やSMRTに存在するより長いロイシンリッチモチーフであるLXXXIXXX(I/L)と優先的に結合するようになる。さらに、いくつかの補酵素は、末端、DNA結合部位、または他の結合部位を介してERに結合する。このように、ある化合物は、補助活性化因子が多く存在する組織ではER作動薬となり、補助抑制因子が多く存在する組織ではER遮断薬となることがある[26]。
作用機序
[編集]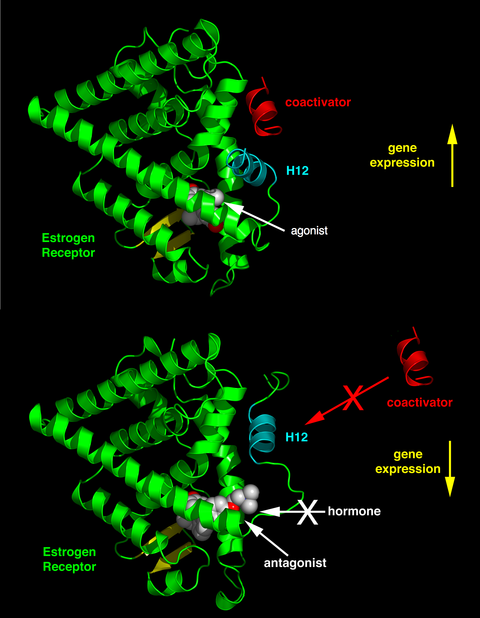
エストロゲン関連化合物には、次のような活性の広がりがある。
- 完全作動薬:天然の内因性ホルモンであるエストラジオールなど(すべての組織で作動薬)
- 混合作動薬/遮断薬(SERM):タモキシフェンなど(ある組織では作動薬、ある組織では遮断薬)
- 完全遮断薬:フルベストラントなど(すべての組織で遮断薬)
SERMは、肝臓、骨、心臓血管系などの組織でエストロゲン作用を刺激することが知られているが、乳房や子宮などの刺激が望ましくない場所ではエストロゲン作用を阻害することが知られている[34]。この作動作用または遮断作用は、受容体のさまざまな構造変化を引き起こし、その結果、エストロゲンの標的遺伝子を活性化または抑制する[3][34][4][35]。SERMは、細胞内に拡散して受容体と相互作用し、そこでERαやERβのサブユニットと結合することで、受容体の二量体化や構造変化を引き起こす。これにより、SERMはエストロゲン応答要素との相互作用が容易になり、エストロゲン誘導遺伝子の活性化に繋がり、エストロゲン効果を仲介することになる[34]。
SERMのユニークな特徴は、その組織・細胞選択的な活性である。SERMの活性は、主に特定の種類の組織や細胞におけるER標的遺伝子への補助抑制因子や補助活性化因子の選択的な漸増によって決定されることを裏付ける証拠が増えている[4][35][36]。SERMは、補助活性化因子タンパク質の安定性に影響を与え、また、リン酸化などの翻訳後修飾によって補助活性化因子活性を調節することができる。HER2、PKC、PI3Kなどの複数の成長シグナル伝達経路は、抗エストロゲン治療に反応して下向き調節される。ステロイド受容体補助活性化因子3(SRC-3)は、活性化されたキナーゼによってリン酸化され、補助活性化因子活性も増強され、細胞の成長に影響を与え、最終的には薬剤耐性の原因となる[36]。
標的部位におけるERαとERβの比率は、SERMの活性を決定するもう一つの要素だと思われる。細胞増殖の亢進は、高ERα:ERβ比とよく相関し、細胞増殖の抑制は、ERαよりもERβが優勢であることと相関する。腫瘍性乳房組織と正常乳房組織におけるERの比率は、SERMによる化学的予防を考えるうえで重要であろう[3][34][4][35]。
ERαとERβの違いを見ると、活性化機能1(AF-1)とAF-2が重要である。これらは共に、遺伝子の転写を制御する他の共調節タンパク質との相互作用に重要な役割を果たしている[34][4]。AF-1は、ERのアミノ末端に位置し、ERαとERβでは20%しか相同性がない。一方、AF-2は、ERαとERβで非常によく似ており、1つのアミノ酸だけが異なっている[4]。これまでの研究で、ERαとERβのAF-1領域を入れ替えることで、転写活性に特異的な違いがあることが判っている。一般に、SERMは、エストロゲン受容体要素によって、ERαを介して人工的な遺伝子を部分的に活性化することができるが、ERβを介して活性化することはできない[34][4][35]。しかし、ラロキシフェンと活性型タモキシフェンは、ERαとERβの両方でAF-1で制御されるレポーター遺伝子を刺激することができる[4]。
ERには2つのサブタイプがあることが発見されたため、特定の受容体をオン・オフすることができるさまざまな受容体特異的リガンドが合成されるようになった[4]。しかし、得られた複合体の外形は、SERMに対する標的組織での反応を変化させる触媒となるものである[3][34][4][35]。
エストロゲン薬や抗エストロゲン薬のX線結晶構造解析により、リガンドがどのようにして受容体複合体を他のタンパク質と相互作用するように変形させるかが明らかになった。ERのリガンド結合ドメインは、エストロゲン薬や抗エストロゲン薬の複合体の形状に基づいて、リガンドがどのように補助活性化因子の結合を促進したり阻止したりするかを示している。ERに結合する幅広いリガンドは、特定の標的部位で完全なエストロゲン作用から抗エストロゲン作用までを示す多彩なER複合体を作り出せる[3][4][35]。ERにリガンドが結合すると、主にカルボキシ末端領域のAF-2にあるリガンド結合ポケットが構造的に再配置される。ERにリガンドが結合すると、補酵素や受容体の薬理作用を調節する疎水性ポケットが形成される。リガンド結合ドメインが正しく折り畳まれることは、転写の活性化や、ERが多くの補助活性化因子と相互作用するために必要である[4]。
補助活性化因子は、複合体の中で部位を繋ぐだけのタンパク質パートナーではない。補助活性化因子は、複合体の活性を修飾するという積極的な役割を果たしている。補助活性化因子の翻訳後の修飾は、細胞表面の成長因子受容体によって開始される複数のキナーゼ経路を介して、ステロイドホルモン作用の動的モデルをもたらす。多数のタンパク質再構成因子の誘導の下、特定の遺伝子プロモーター部位でリン酸化されたERと相互作用できる多タンパク質補助活性化因子複合体を形成するために、コア補助活性化因子はまず、特定の補補助活性化因子[訳語疑問点]セットを導入しなければならない。コア補助活性化因子を複合体の一部に含むタンパク質は、隣接するタンパク質をメチル化またはアセチル化する個々の酵素活性を持つ。ERの基質や補酵素Aは、反応を何度も繰り返すことでポリユビキチン化されるか、あるいは連結タンパク質によってさらに活性化されるか、26Sプロテアソームによって分解されるかのいずれかになる[4]。
結果的に、ERや補酵素の構造やリン酸化状態に応じた効果的な遺伝子転写を行うためには、転写複合体がプロテアソームによって瞬時に破壊された後に、転写集合体の再構成力が動的かつ周期的に変化することが必要である[4]。
構造上の特徴
[編集]構造活性相関
[編集]
SERMの骨格構造は、17β-エストラジオールに類似している。その骨格には1 - 3個の原子を挟んで2つの芳香環が結合している。芳香環を繋ぐ連結部位には4位置換フェニル基がもう一つ結合しており、エストロゲン受容体(ER)に結合した時に結合部位から突き出して、ヘリックス12が受容体開口部に近付けず、通常、補助活性化因子タンパク質が結合してER作動薬活性を引き起こすべき空間をブロックする。SERMの骨格部分には多くのバリエーションがあるが、側鎖にはあまり柔軟性がない[7]。SERMは骨格構造で分類される。
第1世代:トリフェニルエチレン類
[編集]
最初のSERMはスチルベンの類縁物質であるトリフェニルエチレン誘導体である。スチルベン骨格(非ステロイド系エストロゲンであるジエチルスチルベストロールに類似)は17β-エストラジオールのエストラトリエン骨格[注 1]を模倣でき、トリフェニルエチレン誘導体ではステロイド骨格の11位から側鎖が伸びているように見える[7]。ステロイド骨格3位に該当する部分のフェノール系水酸基の水素結合能が、ERとの結合に重要な役割を果たす[37]。

最初の医薬品であるクロミフェン(2-[4-(2-chloro-1,2-diphenylethenyl)phenoxy]-N,N-diethylethanamine)[38]は、2つのフェニル基に挟まれたエチレン基が1箇所塩素置換されており、それが後に開発されたタモキシフェンと同等の親和性をもたらしている。クロミフェンはエストロゲン薬であるシス型(Z 型)と抗エストロゲン薬であるトランス型(E 型)の混合物である[37]。この場合のシス型・トランス型は非置換フェニル基の位置関係で見ると解り易い[38][注 2]。クロミフェンの2つの幾何異性体の薬理学的特性は異なり、トランス型はタモキシフェンに近く、シス型は17β-エストラジオールに近い[7]。シス型はトランス型の10倍強力であるが、トランス型の方が上皮細胞の増殖誘導能力が強いので、混合体のクロミフェンは低用量で拮抗薬として、高用量で作動薬として作用する[38]。拮抗薬型異性体(E 型)は子宮と乳腺組織で抗エストロゲン作用を示すが、作動薬型異性体(Z 型)は骨のERと結合してエストロゲン様作用を発揮する[39]。

タモキシフェン((Z)-2-[4-(1,2-diphenylbut-1-enyl)phenoxy]-N,N-dimethyl-ethanamine)は、ホルモン応答性乳癌(ERおよび/またプロゲステロン受容体が陽性の乳癌)のすべてのステージの治療に用いられる。米国では、乳癌リスクの高い女性の予防にも使われる[40]。タモキシフェンは2つのフェニル基がトランス型に配置している(シス型の混入のない)抗エストロゲン薬であり、全身のエストロゲン標的組織で異なる作用を示す。タモキシフェンは、乳房では選択的に抗エストロゲン作用を示すが、骨や子宮内膜癌ではエストロゲン様作用を示す[39]。タモキシフェンは、ミクロソームのシトクロムP450(CYP)酵素により肝臓で第I相代謝を受ける。タモキシフェンの主な代謝物は、N-デスメチルタモキシフェンと4-ヒドロキシタモキシフェンである。
4-ヒドロキシタモキシフェンER会合体の結晶構造を見ると[41]、リガンド結合ドメイン内のERのアミノ酸と相互作用している[42]。フェノール基と水分子が、受容体(ERα;Glu 353/Arg 394)のグルタミン酸とアルギニンとの親和性が高く結合するので、17β-エストラジオールのA環に似たフェノール環を持つ4-ヒドロキシタモキシフェンは、フェノールを持たないタモキシフェンの100倍以上の結合親和性を持つ。そのOH基を無くしたり、位置を変えたりすると、結合親和性は低下する[7][37]。
タモキシフェンとERとの結合にはトリフェニルエチレン基と側鎖が必要である一方で、4-ヒドロキシタモキシフェンとERとの結合にはフェニルプロペン基と側鎖は重要ではないと見られる。側鎖の塩基性と長さは、タモキシフェンのERへの結合親和性に重要な役割を果たしていないと思われ、タモキシフェンのβ環[注 3]も同様であるが、タモキシフェンのスチルベン部分はERへの結合に必要である。4-ヒドロキシタモキシフェンのER結合には水酸基が特に重要であり、タモキシフェンのエチル側鎖はERのリガンド結合ドメインからはみ出している[42]。タモキシフェンの使用者の中に、子宮癌、熱感紅潮、血栓塞栓症の発生率が高くなった患者はほとんどいない。この薬はラットに肝癌を引き起こす可能性がある。これは、タモキシフェンのスチルベン骨格から延びるエチル基がアリル位酸化され、DNAのアルキル化や鎖切断を引き起こすことが原因と考えられる。この問題は後にトレミフェンで修正されている[7]。タモキシフェンでは、ERのアミノ酸であるAsp-351とSERMの抗エストロゲン性側鎖[注 4]との関係から、ラロキシフェンよりも標的特異性が低くなる。タモキシフェンの側鎖はAsp-351を中和できないので、この部位はERの近位端のAF-1にアロステリックに影響を与える。この問題は、第二世代の薬剤であるラロキシフェンで修正される[39]。

トレミフェン(2-(p-[(Z)-4-chloro-1,2-diphenyl-1-butenyl]phenoxy)-N,N-dimethylethylamine)は、非ステロイド性トリフェニルエチレン系抗エストロゲン薬であるタモキシフェンの塩素化誘導体であり[7]、エチレン側鎖にクロロ置換基を持ち、タモキシフェンと同様の結合親和性を有する[37]。トレミフェンの構造と活性の関係はタモキシフェンと似ているが、DNAのアルキル化に関しては大幅に改善されている。付加された塩素原子の存在は、活性化されたアリル代謝物から形成される陽イオンの安定性を低下させ、アルキル化の可能性を減少させる。実際、トレミフェンはネズミの肝細胞でDNA付加体形成を示さなかった。トレミフェンは、卵巣摘出ラットモデルにおいて骨量減少を防ぎ、臨床的にも骨吸収マーカーにタモキシフェン同様の影響を与える[7]。トレミフェンは、タモキシフェンと同様にミクロソームのシトクロムP450酵素による第I相代謝を受けるが、主にCYP3A4アイソフォームによって代謝される。トレミフェンは、N-脱メチル化および脱アミノ化-水酸化によって、2つの主要代謝物であるN-デスメチルトレミフェンとデアミノヒドロキシトレミフェン(オスペミフェン)を生成する。N-デスメチルトレミフェンはトレミフェンと同等の効果を持つ一方、4-ヒドロキシトレミフェンはトレミフェンよりもERへの結合親和性が高い[41]。4-ヒドロキシトレミフェンは、4-ヒドロキシタモキシフェンと同様に振る舞う[43]。
第2世代:ベンゾチオフェン類
[編集]
ラロキシフェン([6-hydroxy-2-(4-hydroxyphenyl)-benzothiophen-3-yl]-[4-[2-(1-piperidyl)ethoxy]phenyl]-methanone)は、第二世代のベンゾチオフェン系SERM薬に属する。ERへの高い親和性を持ち、強力な抗エストロゲン活性とエストラジオールとは異なる組織特異的な作用を有する[34]。Raloxifeneは、骨や循環器系ではER作動薬として作用するが、乳房組織や子宮内膜ではER遮断薬として作用する。タモキシフェンやトレミフェンのバイオアベイラビリティが約100%であるのに対し、ラロキシフェンは腸内でグルクロン酸抱合により多くが代謝されるため、生物学的利用能は2%と低い[41]。
トリフェニルエチレン系のタモキシフェンに対するラロキシフェンの利点は、子宮への影響が少ないことである。子宮への影響を最小限に抑えるためには、抗エストロゲン作用のある4-ピペリジノエトキシフェニル側鎖だけでなく、柔軟なヒンジ基も重要である。側鎖は柔軟性があるため、コアに対して直交するように配置することができ[7]、ラロキシフェン側鎖のアミンがERαのリガンド結合ドメインのアミノ酸Asp-351に対してタモキシフェンよりも0.1nm近くなっている[39][44]。
ラロキシフェンの疎水性側鎖と受容体の疎水性残基との密接な関係が、SERM-ER複合体の外部表面の形状と電荷の両方を変化させるうえで重要な役割を果たすことが、ラロキシフェン誘導体で確認された。ラロキシフェンとAsp-351の相互作用距離を0.27nmから0.35 - 0.5nmに増加させると、ラロキシフェン-ERα複合体のエストロゲン様作用が増大する。ラロキシフェンのピペリジン環をシクロヘキサンで置換すると、リガンドは抗エストロゲン作用を失い、完全な作動薬となる。SERMの抗エストロゲン性側鎖とアミノ酸Asp-351の相互作用は、AF-2を機能停止するための重要な第一段階である。これは、ヘリックス12をリガンド結合ポケットから遠ざけ、それによって、補助活性化因子がSERM-ER複合体に結合するのを防ぐものである[39][44]。
第3世代
[編集]
第3世代SERMは子宮刺激作用がない、熱感紅潮が増加しない、効力が向上している、あるいはこれらのポジティブな特徴が組み合わさっている[7]。
最初のジヒドロナフタレン系SERMであるナフォキシジンは乳癌治療薬の臨床候補であったが、重篤な光毒性などの副作用があったため、ラソフォキシフェン((5R,6S)-6-phenyl-5-[4-(2-pyrrolidin-1-yl-ethoxy)-phenyl]-5,6,7,8-tetrahydro-naphthalen-2-ol)に改良された。ナフォキシジンは、タモキシフェンのように3つのフェニルがすべて同一平面上に拘束されている。しかし、水素添加によりナフォキシジンの二重結合が減少し、2つのフェニルがシス配向となった。アミンを持つ側鎖は、ラロキシフェンや他の子宮低刺激性SERMのように、軸方向の立体配座を取り、このグループをコアの平面に対して直交するように配置することができる。

ラソフォキシフェンは、骨粗鬆症の予防とコレステロールの低下が報告されている最も強力なSERMの一つである。ラソフォキシフェン経口投与時の優れた効力は、フェノール基の腸内グルクロン酸抱合が抑制されていることに起因している[7]。ラロキシフェンとは異なり、ラソフォキシフェンは腸壁でのグルクロン酸抱合に対する抵抗性を予測する分子的特徴モデルの要件を満たしている。構造上の要件とは、縮合した二環式芳香族の平面に近いところに立体的に嵩張る部分を持つ非平面的な幾何構造である[45]。ERとラソフォキシフェンの間の相互作用は、SERM-ER認識の一般的な特徴と一致している。ラソフォキシフェンの大きな柔軟性のある側鎖はピロリジン末端で終わり、末端はタンパク質の表面に向かって伸びていきAF-2ヘリックスの位置に直接干渉している。ラソフォキシフェンとAsp-351の間には塩橋が形成されている。この領域での電荷の中和が、ラソフォキシフェンの抗エストロゲン作用を説明しているのかも知れない[27]。

インドール骨格はSERMのコアユニットとして機能しており、インドールにベンジルオキシエチルでアミンを結合させると、結果として前臨床では子宮活性がない一方でラットの骨を温存し、低用量で十分な効果が得られる化合物となった。バゼドキシフェン(1-{4-[2-(Hexahydro-1H-azepin-1-yl)ethoxy]benzyl}-2-(4-hydroxyphenyl)-3-methyl-1H-indol-5-ol)は、そのような化合物の一つである。コア結合領域は、2-フェニル-3-メチルインドールと側鎖の作用領域のアゼピン環から構成されている。グルクロン酸抱合で代謝され、絶対的な生物学的利用能は6.2%で、ラロキシフェンの3倍である。本薬は、骨および脂質代謝に作用するが、乳房および子宮内膜には作用しない[46]。忍容性は良好で、熱感紅潮の発生率、子宮肥大、乳房圧迫感の増加は見られない[7]。

オスペミフェン(Z-2-(4-(4-chloro-1,2-diphenyl-but-1-enyl)phenoxy)ethanol)は、トリフェニルエチレンであり、トレミフェンの代謝物として知られている。タモキシフェンやトレミフェンと構造的に高い類似性を有する。オスペミフェンは、タモキシフェンのように2-(ジメチルアミノ)エトキシ基を持たない。構造活性相関研究では、タモキシフェンの2-(ジメチルアミノ)エトキシ基を除去することにより、子宮での作動薬活性が有意に低下するが、骨や心血管系に対する活性は低下しないことが示された。前臨床試験および臨床試験の結果から、オスペミフェンの忍容性は高く、重大な副作用は認められなかった。オスペミフェンが他のSERMと比較して優れている点は、熱感紅潮に対するニュートラルな作用と、膣に対するER作動薬作用で膣乾燥症の症状を改善することである[47]。
結合様式
[編集]
SERMは、ERに結合する際に4つの特徴的な様式を持つことが知られている。それらの特徴の一つは、(1)リガンドとERαのArg-394とGlu-353との間の強い水素結合であり、これは「Aリングポケット」に並んでおり、リガンドがERの結合ポケットに留まるのを助ける。これは、17β-エストラジオールが「Dリングポケット」のHis-524と水素結合しているのとは異なる[28]。リガンド結合ポケットへの結合の他の特徴は、(2)17β-エストラジオールのA環およびB環に相当する縮合芳香環(場合により複素環)からなるほぼ平面的な「コア」構造、(3)17β-エストラジオールのB環に相当するビアリール構造からの嵩高い側鎖、(4)C環およびD環に相当し、通常は芳香族である第2の側基がリガンド結合ポケットの残余の容積を埋めること、である[45]。
ERの2つのサブタイプ間の小さな違いは、ER修飾薬の開発目標となっていたが、2つのサブタイプ間の相同性は高く、開発は非常に難しい。リガンド結合ドメインのアミノ酸は2箇所異なり、ERαではLeu-384とMet-421、ERβではMet-336とIle-373であるが、両者の疎水性および占有体積はほぼ等しい。しかし、アミノ酸残基の形状や回転障壁には違いがあり、ERαとERβでは結合空洞のα面とβ面が区別される。これにより、Met-336の下側に面するリガンド置換基はERαに優先的に結合し、Met-336の上側に面するリガンド置換基はERβに結合し易くなる。もう一つの違いは、ERαでのVal-392が、ERβではMet-344に置換されていることである。ERβの結合ポケットの容積は、ERαのそれよりも若干小さく、形状も少し異なる。多くのERβ選択性リガンドは、ERβの結合空洞がERαのそれよりもわずかに狭いため、大部分が平面的な配置になっているが、これだけでは選択性は控えめである。強い選択性を得るためには、ERαとERβの間のアミノ酸の違いに非常に近い位置にリガンド置換基を置くことで、他方のサブタイプの受容体に対して強い反発力を生じさせる必要がある。加えて、リガンドの構造は剛直でなければならない。反発的な相互作用がないと、リガンドの立体配座が変化して、別の結合様式が生まれる可能性があるからである[28]。
第1世代:トリフェニルエチレン類
[編集]タモキシフェンは、肝臓のシトクロムP450によって4-ヒドロキシタモキシフェンに変換され[27]、ERβよりもERαサブタイプに選択的な遮断薬となる[48]。4-ヒドロキシタモキシフェンは、17β-エストラジオールを認識するのと同じ結合ポケット内でERに結合する。4-ヒドロキシタモキシフェンの受容体認識は、4-ヒドロキシタモキシフェンの2つの構造的特徴、すなわちフェノールA環と嵩高い側鎖によって制御されているようである。フェノールA環は、ERのArg-394、Glu-354の側鎖と、構造的に保存されている水に水素結合を形成する。嵩高い側鎖は、結合腔から突出しており、ヘリックス12をリガンド結合ポケットから移動させ、補助活性化因子結合ポケットの一部を覆っている。ERと4-ヒドロキシタモキシフェンの複合体形成により、補助活性化因子タンパク質が接近不能となる。これにより、DNA合成が減少し、エストロゲン活性が阻害される[27]。クロミフェンとトレミフェンは、タモキシフェンと同様の結合親和性を示す[37]。従って、この2つの薬剤は、ERβよりもERαサブタイプに対してより選択的な遮断薬である[48]。
第2世代:ベンゾチオフェン類
[編集]
ラロキシフェンは、4-ヒドロキシタモキシフェンと同様に、フェノール性の「A環」のヒドロキシル基で、Arg-394およびGlu-353との水素結合を介してERαに結合する。これらの結合に加えて、ラロキシフェンは、「D環」に2つ目の水酸基が存在するため、His-524の側基を介してERに2つ目の水素結合を形成する。この水素結合は、17β-エストラジオールとHis-524の間のものとも異なり、His-524のイミダゾール環が回転して、ラロキシフェンと17β-エストラジオールの酸素の位置の違いを打ち消すようになっている。4-ヒドロキシタモキシフェンと同様に、ラロキシフェンの嵩高い側鎖がヘリックス12を変位させる[27]。
第3世代
[編集]ラソフォキシフェンとERαの相互作用は、ほぼ平面的な幾何学的配置(テトラヒドロナフタレン炭素環)、Arg-394とGlu-353との水素結合、リガンド結合ポケットのC環とD環の容積を満たすラソフォキシフェンのフェニル側鎖など、SERM-ERα間の相互作用として典型的なものである。ラソフォキシフェンはヘリックス12を変位させ、LXXLLモチーフを持つ補助活性化因子タンパク質の結合を阻止する。これはラソフォキシフェンが、通常はLeu-540の側鎖が満たす空間を占め、ヘリックス11[要追加記述]の残基(His-524、Leu-525)の立体配置を変化させることで達成される。さらに、ラソフォキシフェンは、薬剤のエチルピロリジン基によって、ヘリックス12の位置を直接妨害する[27]。
In vitro の研究では、バゼドキシフェンは、ERαとERβの両方に同様に高親和性に結合することで、17β-エストラジオールを競合的に阻害することが示されている[49]。バゼドキシフェンの主な結合ドメインは、2-フェニル-3-メチルインドールと側鎖影響領域のヘキサメチレンアミン環で構成されている[46]。
オスペミフェンは、トレミフェンの酸化的脱アミノ化代謝物で、トレミフェンやタモキシフェンと同様にERに結合する。3つの代謝物である4-ヒドロキシオスペミフェン、4'-ヒドロキシオスペミフェン、4-ヒドロキシ-側鎖カルボン酸オスペミフェンのERαおよびERβに対する競合結合親和性は、少なくとも親化合物と同程度に高い[50]。
歴史
[編集]
SERMの発見は,新しい避妊薬の開発を目的としたものであった。クロミフェンとタモキシフェンは、ラットでは妊娠を妨げたが、ヒトでは逆であった。クロミフェンは不妊症の女性に排卵を誘発することに成功し、1967年2月1日に米国で妊娠を希望する女性の排卵障害の治療薬として承認された[5]。しかし、毒性の問題から、クロミフェンの長期使用は認められず、乳癌の治療や予防など、他の用途への開発は進められなかった[6]。
1977年12月にタモキシフェンが避妊薬としてではなく、乳癌の治療と予防を目的としたホルモン治療薬として承認されるまでには、さらに10年の歳月を要した[6]。1987年、SERMであるタモキシフェンとラロキシフェンが、乳房組織での遮断作用から抗エストロゲン薬と考えられていたが、卵巣摘出ラットの骨量減少を防ぐエストロゲン作用を示すことが発見され、エストロゲン受容体や核内受容体全般の機能についての理解に大きな影響を与えた[7]。SERMという言葉は、組織に応じてエストロゲンの作動薬、部分作動薬、遮断薬の活性を組み合わせて持つこれらの化合物を表すために導入された[5]。トレミフェンはタモキシフェンと互換であることが判っており、1996年に閉経後女性の乳癌治療に使用が承認された[51]。
ラロキシフェンは当初、実験室でタモキシフェンと比較して効果が劣っていたため[34]乳癌治療薬としては失敗したが、骨に対するエストロゲン作用により再発見され、1997年に承認された[6]。骨粗鬆症の予防および治療薬として承認され、骨粗鬆症と乳癌の両方を予防できる初の臨床用SERMであった[7]。オスペミフェンは、2013年2月26日に「中等度から重度の性交疼痛症(更年期障害による外陰部および膣の萎縮症状)」の治療薬として承認された。結合型エストロゲンとSERMであるバゼドキシフェンの併用療法は、2013年10月3日に「更年期障害に伴う血管運動症状」の効能・効果で承認された。また、バゼドキシフェンは、閉経後の骨粗鬆症の予防にも使用されている[6]。骨に効果があり、ラロキシフェンよりも生物学的利用能が高い強力なSERMを探していたところ、ラソフォキシフェンが発見された[27]。ラソフォキシフェンは2009年に承認されたが、承認後3年間は販売されなかったため、販売承認は失効している[52]。欧州ではバゼドキシフェンが「骨折リスクの高い閉経後女性の骨粗鬆症」を適応症とし、インドではオルメロキシフェンが「機能不全性子宮出血」と「避妊」を適応症としている[6]。
関連項目
[編集]- エストロゲン除去療法
- List of selective estrogen receptor modulators(米国)
- 選択的アンドロゲン受容体修飾薬
- 選択的プロゲステロン受容体修飾薬
- 選択的受容体修飾薬
- Timeline of cancer treatment development(米国)
注釈
[編集]- ^ この場合、A環が芳香化したステロイド骨格を指す。
- ^ 厳密には、CIP順位則に従い原子番号の大きな置換基から順番を付けるので、クロミフェンの場合はクロロ基とアミノエトキシフェニル基の位置関係で定まる。
- ^ アミノエトキシフェニル基を意味する。
- ^ アミノ基を含む側鎖のこと。
参考資料
[編集]- ^ “Ospemifene: less venous thrombosis than other selective estrogen receptor modulators in postmenopausal women with vulvo vaginal atrophy”. Menopause 27 (8): 846–847. (August 2020). doi:10.1097/GME.0000000000001600. PMID 32576803.
- ^ “ERAAs for menopause treatment: Welcome the 'designer estrogens'”. Cleve Clin J Med 84 (6): 463–470. (June 2017). doi:10.3949/ccjm.84a.15140. PMID 28628428.
- ^ a b c d e “Selective estrogen-receptor modulators -- mechanisms of action and application to clinical practice”. The New England Journal of Medicine 348 (7): 618–29. (Feb 2003). doi:10.1056/NEJMra022219. PMID 12584371.
- ^ a b c d e f g h i j k l m n o p q “The discovery and development of selective estrogen receptor modulators (SERMs) for clinical practice”. Current Clinical Pharmacology 8 (2): 135–55. (May 2013). doi:10.2174/1574884711308020006. PMC 3624793. PMID 23062036.
- ^ a b c d e f g “Selective estrogen receptor modulators and the combination therapy conjugated estrogens/bazedoxifene: A review of effects on the breast”. Post Reproductive Health 21 (3): 112–21. (Sep 2015). doi:10.1177/2053369115599090. PMID 26289836.
- ^ a b c d e f g h i j “Selective estrogen receptor modulators (SERMs): a review of clinical data”. Maturitas 80 (1): 52–7. (Jan 2015). doi:10.1016/j.maturitas.2014.10.010. PMID 25466304.
- ^ a b c d e f g h i j k l m n “SERMs: evolutionary chemistry, revolutionary biology”. Current Pharmaceutical Design 8 (23): 2089–111. (2002). doi:10.2174/1381612023393404. PMID 12171520.
- ^ Cameron, John L.; Cameron, Andrew M (20 November 2013). Current Surgical Therapy. Elsevier Health Sciences. pp. 582–. ISBN 978-0-323-22511-3
- ^ a b Huang, Xianhai; Aslanian, Robert G. (19 April 2012). Case Studies in Modern Drug Discovery and Development. John Wiley & Sons. pp. 392–394. ISBN 978-1-118-21967-6
- ^ Nath, A.; Sitruk-Ware, R. (2009). “Pharmacology and clinical applications of selective estrogen receptor modulators”. Climacteric 12 (3): 188–205. doi:10.1080/13697130802657896. ISSN 1369-7137.
- ^ “SERMs: current status and future trends”. Crit. Rev. Oncol. Hematol. 43 (1): 63–76. (July 2002). doi:10.1016/S1040-8428(02)00022-7. PMID 12098608.
- ^ “Selective estrogen receptor modulators: tissue specificity and clinical utility”. Clin Interv Aging 9: 1437–52. (2014). doi:10.2147/CIA.S66690. PMC 4154886. PMID 25210448.
- ^ “Selective estrogen receptor modulators (SERMs): a review of clinical data”. Maturitas 80 (1): 52–7. (January 2015). doi:10.1016/j.maturitas.2014.10.010. PMID 25466304.
- ^ “Selective estrogen receptor modulators in clinical practice: a safety overview”. Expert Opin Drug Saf 14 (6): 921–34. (June 2015). doi:10.1517/14740338.2015.1014799. PMID 25936229.
- ^ Barbara L. Hoffman; John O. Schorge; Karen D. Bradshaw; Lisa M. Halvorson; Joseph I. Schaffer; Marlene M. Corton (22 April 2016). Williams Gynecology (Third ed.). McGraw-Hill Education. p. 364. ISBN 978-0-07-184909-8
- ^ “Estrogens and selective estrogen receptor modulators in acromegaly”. Endocrine 54 (2): 306–314. (November 2016). doi:10.1007/s12020-016-1118-z. PMID 27704479.
- ^ “Clinical uses of antiestrogens”. Obstet Gynecol Surv 51 (1): 45–59. (January 1996). PMID 8657397.
- ^ Bryant, Henry U. (2008). “Chapter 41 – The Pharmacology of Selective Estrogen Receptor Modulators”. Principles of Bone Biology. pp. 887–919. doi:10.1016/B978-0-12-373884-4.00058-6
- ^ “The effect of selective estrogen receptor modulator administration on the hypothalamic-pituitary-testicular axis in men with idiopathic oligozoospermia”. Fertil. Steril. 91 (4 Suppl): 1427–30. (April 2009). doi:10.1016/j.fertnstert.2008.06.002. PMID 18692782.
- ^ “The effect of selective estrogen receptor modulators on parameters of the hypothalamic-pituitary-gonadal axis”. Ann. N. Y. Acad. Sci. 949: 251–8. (December 2001). doi:10.1111/j.1749-6632.2001.tb04029.x. PMID 11795360.
- ^ “The future of the new selective estrogen receptor modulators”. Menopause Int 13 (1): 27–34. (March 2007). doi:10.1258/175404507780456791. PMID 17448265.
- ^ “Pharmacokinetics, pharmacodynamics and clinical efficacy of ospemifene for the treatment of dyspareunia and genitourinary syndrome of menopause”. Expert Opin Drug Metab Toxicol 12 (10): 1233–46. (October 2016). doi:10.1080/17425255.2016.1218847. PMID 27476551.
- ^ “Effects of Toremifene, a Selective Estrogen Receptor Modulator, on Spontaneous and Stimulated GH Secretion, IGF-I, and IGF-Binding Proteins in Healthy Elderly Subjects”. J Endocr Soc 2 (2): 154–165. (February 2018). doi:10.1210/js.2017-00457. PMC 5789038. PMID 29383334.
- ^ “A double-blind, randomized, ascending, multiple-dose study of bazedoxifene in healthy postmenopausal women”. Clin Pharmacol Drug Dev 3 (4): 262–9. (July 2014). doi:10.1002/cpdd.102. PMID 27128831.
- ^ Trost, Landon W.; Khera, Mohit (2014). “Alternative Treatment Modalities for the Hypogonadal Patient”. Current Urology Reports 15 (7). doi:10.1007/s11934-014-0417-2. ISSN 1527-2737.
- ^ a b c d “Panning for SNuRMs: using cofactor profiling for the rational discovery of selective nuclear receptor modulators”. Drug Discovery Today 12 (19–20): 860–9. (Oct 2007). doi:10.1016/j.drudis.2007.07.025. PMID 17933688.
- ^ a b c d e f g h i “Structure-based approach for the discovery of novel selective estrogen receptor modulators”. Current Medicinal Chemistry 18 (8): 1188–94. (2011). doi:10.2174/092986711795029645. PMID 21291367.
- ^ a b c d “Development of subtype-selective oestrogen receptor-based therapeutics”. Nature Reviews. Drug Discovery 10 (10): 778–92. (Oct 2011). doi:10.1038/nrd3551. PMID 21921919.
- ^ “Reflections on the discovery and significance of estrogen receptor beta”. Endocrine Reviews 26 (3): 465–78. (May 2005). doi:10.1210/er.2004-0027. PMID 15857973.
- ^ “Molecular mechanisms of selective estrogen receptor modulator (SERM) action”. The Journal of Pharmacology and Experimental Therapeutics 295 (2): 431–7. (Nov 2000). PMID 11046073.
- ^ “Discovery of estrogen receptor modulators: a review of virtual screening and SAR efforts”. Expert Opinion on Drug Discovery 5 (1): 21–31. (Jan 2010). doi:10.1517/17460440903490395. PMID 22823969.
- ^ “Molecular basis of agonism and antagonism in the oestrogen receptor”. Nature 389 (6652): 753–8. (1997). doi:10.1038/39645. PMID 9338790.
- ^ “The structural basis of estrogen receptor/coactivator recognition and the antagonism of this interaction by tamoxifen”. Cell 95 (7): 927–37. (1998). doi:10.1016/S0092-8674(00)81717-1. PMID 9875847.
- ^ a b c d e f g h i “Medicinal chemistry and emerging strategies applied to the development of selective estrogen receptor modulators (SERMs)”. Current Medicinal Chemistry 14 (11): 1249–61. (2007). doi:10.2174/092986707780598023. PMID 17504144.
- ^ a b c d e f “Selective estrogen receptor modulators (SERMs): mechanisms of anticarcinogenesis and drug resistance”. Mutation Research 591 (1–2): 247–63. (Dec 2005). doi:10.1016/j.mrfmmm.2005.02.028. PMID 16083919.
- ^ a b “Nuclear receptor modulation--role of coregulators in selective estrogen receptor modulator (SERM) actions”. Steroids 90: 39–43. (Nov 2014). doi:10.1016/j.steroids.2014.06.008. PMC 4192004. PMID 24945111.
- ^ a b c d e “Structure-activity relationships for a large diverse set of natural, synthetic, and environmental estrogens”. Chemical Research in Toxicology 14 (3): 280–94. (Mar 2001). doi:10.1021/tx000208y. PMID 11258977.
- ^ a b c “The agonistic-antagonistic properties of clomiphene: a review”. Pharmacology & Therapeutics 15 (3): 467–519. (1981). doi:10.1016/0163-7258(81)90055-3. PMID 7048350.
- ^ a b c d e “The estrogen receptor: a model for molecular medicine”. Clinical Cancer Research 9 (6): 1980–9. (Jun 2003). PMID 12796359.
- ^ “Tamoxifen: important considerations of a multi-functional compound with organ-specific properties”. Cancer Treatment Reviews 33 (2): 91–100. (Apr 2007). doi:10.1016/j.ctrv.2006.09.008. PMID 17178195.]
- ^ a b c “Pharmacokinetics of selective estrogen receptor modulators”. Clinical Pharmacokinetics 42 (4): 361–72. (2012-09-30). doi:10.2165/00003088-200342040-00004. PMID 12648026.
- ^ a b “Multiple targeting by the antitumor drug tamoxifen: a structure-activity study”. Current Medicinal Chemistry. Anti-Cancer Agents 4 (6): 491–508. (Nov 2004). doi:10.2174/1568011043352696. PMID 15579015.
- ^ “New Highly Stereoselective Synthesis of (Z)-4-Hydroxytamoxifen and (Z)-4-Hydroxytoremifene via McMurry Reaction”. The Journal of Organic Chemistry 61 (11): 3890–3893. (May 1996). doi:10.1021/jo952279l. PMID 11667248.
- ^ a b “Antiestrogens and selective estrogen receptor modulators as multifunctional medicines. 2. Clinical considerations and new agents”. Journal of Medicinal Chemistry 46 (7): 1081–111. (Mar 2003). doi:10.1021/jm020450x. PMID 12646017.
- ^ a b “The 2.0 A crystal structure of the ERalpha ligand-binding domain complexed with lasofoxifene”. Protein Science 16 (5): 897–905. (May 2007). doi:10.1110/ps.062729207. PMC 2206632. PMID 17456742.
- ^ a b “Bazedoxifene: a new selective estrogen receptor modulator for the treatment of postmenopausal osteoporosis”. Expert Opinion on Pharmacotherapy 10 (8): 1377–85. (Jun 2009). doi:10.1517/14656560902980228. PMID 19445558.
- ^ “Ospemifene use in postmenopausal women”. Expert Opinion on Investigational Drugs 18 (6): 839–49. (Jun 2009). doi:10.1517/13543780902953715. PMID 19466874.
- ^ a b “Toremifene--a promising therapy for the prevention of prostate cancer and complications of androgen deprivation therapy”. Expert Opinion on Investigational Drugs 15 (3): 293–305. (Mar 2006). doi:10.1517/13543784.15.3.293. PMID 16503765.
- ^ Palacios, Santiago (2006). “Endometrial Effects of SERMs”. Selective estrogen receptor modulators a new brand of multitarget drugs (1st ed.). Berlin: Springer. pp. 282–3. doi:10.1007/3-540-34742-9_11. ISBN 978-3-540-24227-7
- ^ “Senshio (ospemifene)”. The European Medicines Agency (EMA). 2015年11月2日閲覧。
- ^ “Fareston”. European Medicines Agency (EMA). 2015年11月2日閲覧。
- ^ “Fablyn”. The European Medicines Agency (EMA). 2015年11月2日閲覧。
