G2/M期DNA損傷チェックポイント

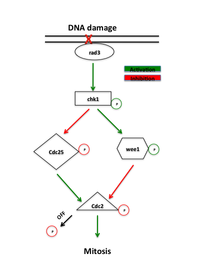
G2/M期DNA損傷チェックポイント(G2/MきDNAそんしょうチェックポイント、G2/Mチェックポイント、英: G2/M DNA damage checkpoint, G2/M checkpoint)は真核生物における細胞周期の重要なチェックポイントであり、損傷した、もしくは不完全な複製が行われたDNAが十分に修復されるまで、有糸分裂の開始(G2期からM期への移行)が起こらないよう保証する機構である。G2/Mチェックポイントに欠陥を有する細胞において、DNA修復の完了を待たずにM期が開始された場合には、細胞分裂後にアポトーシスもしくは細胞死が引き起こされる[1]。このチェックポイントは生化学的現象としてはM期サイクリン-CDK複合体の活性化であり、この複合体は紡錘体の組み立てを促進するタンパク質をリン酸化して有糸分裂中期への移行をもたらす[2]。
サイクリンB/CDK1の活性
[編集]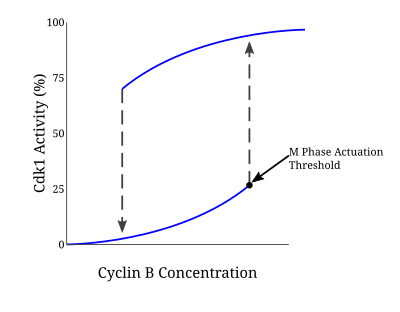
細胞周期はサイクリン依存性キナーゼ(CDK)と呼ばれるタンパク質によって駆動され、CDKにはさまざまなチェックポイントでサイクリンと呼ばれる調節タンパク質と結合する。細胞周期のさまざまな地点において、特定のサイクリン-CDK複合体の活性化や不活性化が生じる。
サイクリンB/CDK1の活性はG2/Mチェックポイントに特異的である。細胞が有糸分裂の開始に備える段階になると、サイクリンBが蓄積してサイクリン依存性キナーゼCDK1(酵母ではCdc2)の活性が増加する。Cdc2の活性は対応する活性化因子や阻害因子のリン酸化/脱リン酸化によってさらに調節されている。サイクリンB/Cdc2はホスファターゼCdc25を活性化し、その結果サイクリンB/Cdc2の阻害因子であるWee1とMyt1が不活化される。Cdc25は複合体の活性部位からリン酸基を除去することで活性化を行うが、Wee1はチロシン残基(具体的にはTyr15)をリン酸化することで複合体を不活性化する[3]。
このCdc25を介した活性化ループは、オーロラAキナーゼとBoraとの協調的相互作用によって間接的に増幅される。G2期の間、Boraは蓄積してオーロラAと活性化複合体を形成する。その後、この複合体はPlk1の活性化を調節する。Plk1はWee1をリン酸化することでSCF複合体を介した分解の標的とするとともに、リン酸化によってCdc25を活性化し、こうした複合的作用によってCdc2を活性化する。Cdc2、Cdc25、Plk1、そしてサイクリンBの蓄積の複合的作用によってサイクリンB/Cdc2複合体は活性化され、有糸分裂の開始が促進される[4]。
有糸分裂の開始は「全か無か」(all-or-none)型の応答である必要があるため、このポジティブフィードバックループに関与する多くのタンパク質はサイクリンB/Cdc2複合体の活性化を駆動する作用を果たす。こうした調節ループの説明にはNovak–Tysonモデルが用いられ、ヒステリシスによる有糸分裂への不可逆的な移行が予測された[5]。そしてアフリカツメガエル卵抽出液での実験により、こうしたモデルが有糸分裂開始の基礎となっていることが実際に確認された。サイクリン濃度が一定の最低活性化閾値に達すると、Cdc2の活性化は急速に進行する。この状態は活性が不活性化閾値(活性化閾値とは異なる値である)を下回るまで維持され、閾値を下回るとWee1とMyt1によるチロシンリン酸化によって急激に不活性化が進行する。DNA複製が完了していない場合、Cdc2の活性化閾値を上回るのに必要なサイクリン濃度はさらに上昇する。こうしたサイクリンB/Cdc2の双安定性とヒステリシスは、G2/Mチェックポイントの高度な調節を保証している[6]。
DNA損傷応答経路
[編集]上述したように、G2期にDNA損傷部位に局在するタンパク質は一連のシグナル伝達カスケードを開始し、サイクリンB/Cdc2の活性を介して有糸分裂の開始を制御する。サイクリンB/Cdc2活性に対する負の調節は有糸分裂の開始の遅れをもたらすが、この調節はS期以降に蓄積したDNA損傷の修復に重要であり、細胞分裂を継続するために必要である。
G2/Mチェックポイントで機能するタンパク質はもともと、酵母で放射線照射(radiation)に対する感受性の増大を示す変異体のスクリーニングから同定され、こうした変異体は"rad"変異体と命名された[1]。これらの変異体では電離放射線照射や化学物質によるDNA損傷の修復が効率的に行われず、この経路に必要不可欠なタンパク質に変異が生じていることが明らかにされた。このチェックポイント経路の序盤のシグナル伝達に関与するタンパク質は、酵母ではRad3、脊椎動物ではATRと呼ばれるPI3K関連キナーゼファミリーのメンバーであり、このタンパク質はDNA損傷部位に局在すると考えられている[7]。Rad3はRad26をリン酸化し、Rad26はチェックポイントの開始に必要である一方で、その維持には必要ではない。またRad3は、Rad1、Rad9、Hus1、Rad17など、その他のいくつかのタンパク質もリン酸化し、これらのタンパク質が存在しない場合にはチェックポイントは消失する[1]。Rad9、Hus1、Rad17は、DNA複製時にDNAポリメラーゼのプロセシビティを高めるクランプの形成に関与するタンパク質と類似していると考えられている[8]。同じくRad17は、DNAへのクランプのローディングに関与するタンパク質と類似している。このことは、Rad3によるリン酸化はこれらのタンパク質のDNA損傷部位へのリクルートを引き起こし、そこでこれらのタンパク質はDNA修復に関わるDNAポリメラーゼの活性を媒介しているというモデルを支持している[1]。
Rad3の主要なエフェクターとなるキナーゼはChk1であり、このキナーゼはDNA損傷試薬に応答したG2/M期での停止に必要である[9]。Chk1はM期サイクリンを不活性な状態に維持するキナーゼであり、S期から有糸分裂までの間にRad3によってリン酸化されることから、G2期での停止に特異的役割を有することが示唆されている[10]。Chk1の過剰発現はDNA損傷に非依存的な細胞周期停止を引き起こす[11]。さらに、Chk1の過剰発現はrad変異体の放射線感受性をレスキューする。これはChk1が有糸分裂の開始を遅らせることでDNA修復を可能にしているためであると思われる[7]。
DNA損傷の存在によってATM経路もしくはATR経路が活性化され、それぞれChk2とChk1が活性化される。これらのキナーゼはCdc25とWee1の上流で作用し、サイクリンB/Cdc2複合体を調節する。Chk1とChk2はCdc25をリン酸化し、Cdc25の脱リン酸化活性を阻害するとともにユビキチン化による分解の標的とする[11][12]。また、これらの経路はp53も刺激する。p53はCDK阻害因子p21や14-3-3タンパク質の機能を調節し、p21はCDK活性を阻害し14-3-3はCdc25を細胞質に隔離する[13]。また、Chk1と14-3-3は同様にWee1を正に調節することも示唆されている。Chk1によるWee1の高リン酸化は14-3-3の結合を引き起こし、Wee1を核内にとどめることでCdc2に対するリン酸化活性を高める[14]。このように、Wee1とCdc25へのリン酸化はどちらもCdc2の活性化を阻害する[12]。
ATM/ATR経路は、Wee1の安定性に寄与するPlkへの負の調節も引き起こす。Wee1とMyt1の安定化は、G2期での停止を保証し、DNA修復を可能にしている[13][15]。
チェックポイントには複数の経路が関与しているため、Cdc25は細胞周期の遅れを引き起こす唯一の機構ではない。未複製のDNAや損傷DNAに応答して生じる、Chk1によるWee1に対する正の調節やCdc25に対する負の調節は、細胞周期G2期で強力に停止させる[1][11][13][15]。Wee1量の増加とCdc25量の減少は、有糸分裂の駆動に必要なヒステリシスループのサイクリンB濃度閾値を高める役割を果たす。
チェックポイントの維持
[編集]Rad3はChk1の活性化とG2期での停止の開始に必要であるが、DNA修復が十分に行われるようG2期での停止を維持するためには他のタンパク質が必要であると考えられている。こうしたタンパク質の1つがRad18であり、Chk1がリン酸化されて活性化されている場合でもG2期での停止に必要である。このように、Chk1はチェックポイントの開始に、そしてRad18はチェックポイントの維持に必要である[16]。また、Rad18はDNA修復に他の役割、具体的には染色体構造の維持に機能している。Rad18が存在しない場合、G2期での停止が他の手段で延長された場合でもDNAは修復されない。
こうしたG2期での停止の維持は、p53やp21によってさらに保たれている。p53もしくはp21が存在しない場合、放射線照射された細胞でも有糸分裂が開始されることが示されている[17]。p21もしくは14-3-3が存在しない場合にはサイクリンB/Cdc2複合体を十分に阻害することができないため、G2/Mチェックポイントにはp53とp21による調節が必要である[12]。p53の変異はチェックポイントに重大な欠陥をもたらすため、がん治療においても重要な意味を持っている。
チェックポイントの不活化
[編集]Wee1とCdc25の双方が不活性化された場合には、G2/Mチェックポイントは消失する。Wee1の不在もしくは標的残基であるTyr15が除去された場合にはCdc2活性の負の調節が取り除かれ、細胞は修復の完了を待たずに有糸分裂へ移行し、G2/Mチェックポイントは消失する[18]。Cdc25が存在しない場合には細胞はG2期で停止し、G2/Mチェックポイントは活性化されることから、Wee1の活性化とCdc25の不活性化がチェックポイントの重要な調節段階となっていることが示唆される[11]。またChk1の不活性化によって、DNA損傷の修復に関係なく、チェックポイントを乗り越えて有糸分裂への移行が促進される。一方で、活性化をもたらすリン酸化を除去するホスファターゼや活性化タンパク質のユビキチン化分解、独立した経路で有糸分裂を促進するチェックポイントアンタゴニストの作用機構など、チェックポイントの終結の正確な機構に関してはまだほとんど理解されていない[10]。
がん
[編集]がんでは、CDK、サイクリン、p53など多くの細胞周期調節因子の発現に異常がみられる。より具体的には、これらは中心体に局在してG2/M期の移行に関与していることが示唆されており、これらのタンパク質を操作してがんの放射線療法や化学療法に対する感受性を高める研究が進められている[13]。Chk1はDNA損傷に応答して機能するため、がんの薬剤標的として重要な意味を持っている。現在、G2/M期の移行の調節によって細胞毒性を発揮する化学療法薬の研究が行われており、G2/Mチェックポイントの阻害とチェックポイントでの停止の双方のアプローチが行われている[19]。多くの治療法は、チェックポイントを不活性化することで過剰なDNA損傷を抱えたまま強制的に有糸分裂を開始させ、細胞死を誘導することに焦点を当てている[12]。
出典
[編集]- ^ a b c d e Cuddihy, Andrew R.; O'Connell, Matthew J. (2003). “Cell-cycle responses to DNA damage in G2”. International Review of Cytology 222: 99–140. doi:10.1016/s0074-7696(02)22013-6. ISBN 9780123646262. ISSN 0074-7696. PMID 12503848.
- ^ Morgan, David Owen, 1958- (2007). The cell cycle : principles of control. London: New Science Press. ISBN 978-0-19-920610-0. OCLC 70173205
- ^ Gould, K. L.; Nurse, P. (1989). “Tyrosine phosphorylation of the fission yeast cdc2+ protein kinase regulates entry into mitosis”. Nature 342 (6245): 39–45. Bibcode: 1989Natur.342...39G. doi:10.1038/342039a0. PMID 2682257.
- ^ Seki, A.; Coppinger, J. A.; Jang, C.-Y.; Yates, J. R.; Fang, G. (20 June 2008). “Bora and the Kinase Aurora A Cooperatively Activate the Kinase Plk1 and Control Mitotic Entry”. Science 320 (5883): 1655–1658. Bibcode: 2008Sci...320.1655S. doi:10.1126/science.1157425. PMC 2834883. PMID 18566290.
- ^ Novak, B.; Tyson, J. J. (1993). “Numerical analysis of a comprehensive model of M-phase control in Xenopus oocyte extracts and intact embryos”. Journal of Cell Science 106 (4): 1153–1168. doi:10.1242/jcs.106.4.1153. PMID 8126097.
- ^ Sha, Wei (September 2002). “Hysteresis drives cell-cycle transitions in Xenopus laevis egg extracts”. Proceedings of the National Academy of Sciences 100 (3): 975–980. Bibcode: 2003PNAS..100..975S. doi:10.1073/pnas.0235349100. PMC 298711. PMID 12509509.
- ^ a b Al-Khodairy, F.; Carr, A. M. (1992). “DNA repair mutants defining G2 checkpoint pathways in Schizosaccharomyces pombe”. The EMBO Journal 11 (4): 1343–1350. doi:10.1002/j.1460-2075.1992.tb05179.x. PMC 556583. PMID 1563350.
- ^ Thelen, M. P.; Venclovas, C.; Fidelis, K. (1999). “A sliding clamp model for the Rad1 family of cell cycle checkpoint proteins”. Cell 96 (6): 769–770. doi:10.1016/s0092-8674(00)80587-5. PMID 10102265.
- ^ Walworth, N.; Davey, S.; Beach, D. (1993). “Fission yeast chkl protein kinase links the rad checkpoint pathway to cdc2”. Nature 363 (6427): 368–371. Bibcode: 1993Natur.363..368W. doi:10.1038/363368a0. PMID 8497322.
- ^ a b Calonge, T. M.; O'Connell, M. J. (2007). “Turning off the G2 DNA damage checkpoint”. DNA Repair (Amst) 7 (2): 136–140. doi:10.1016/j.dnarep.2007.07.017. PMC 2233850. PMID 17851138.
- ^ a b c d Raleigh, J. M.; O'Connell, M. J. (2000). “The G(2) DNA damage checkpoint targets both Wee1 and Cdc25”. Journal of Cell Science 113 (10): 1727–1736. doi:10.1242/jcs.113.10.1727. PMID 10769204.
- ^ a b c d Morgan, David (2007). The Cell Cycle Principles of Control. New Science Press. pp. 227–245
- ^ a b c d Wang, Y.; Ji, P.; Liu, J.; Broaddus, R. R.; Xue, F.; Zhang, W. (2009). “Centrosome-associated regulators of the G2/M checkpoint as targets for cancer therapy”. Molecular Cancer 8 (1): 8. doi:10.1186/1476-4598-8-8. PMC 2657106. PMID 19216791.
- ^ Lee, J.; Kumagai, A.; Dunphy, W. G. (2001). “Positive regulation of Wee1 by Chk1 and 14-3-3 proteins”. Molecular Biology of the Cell 12 (3): 551–563. doi:10.1091/mbc.12.3.551. PMC 30963. PMID 11251070.
- ^ a b Harper, J. W.; Elledge, S. J. (December 2007). “The DNA Damage Response: Ten Years After”. Molecular Cell 28 (5): 739–745. doi:10.1016/j.molcel.2007.11.015. PMID 18082599.
- ^ Verkade, H. M.; Bugg, S. J.; Lindsay, H. D.; Carr, A. M.; O'Connell, M. J. (1999). “Rad18 is required for DNA repair and checkpoint responses in fission yeast”. Molecular Biology of the Cell 10 (9): 2905–2918. doi:10.1091/mbc.10.9.2905. PMC 25529. PMID 10473635.
- ^ Bunz, F.; Dutriaux, A.; Lengauer, C.; Waldman, T.; Zhou, S.; Brown, J. P.; Sedivy, J. M.; Kinzler, K. W. et al. (1998). “Requirement for p53 and p21 to Sustain G2 Arrest After DNA Damage”. Science 282 (5393): 1497–1501. doi:10.1126/science.282.5393.1497. PMID 9822382.
- ^ Lundgren, K.; Walworth, N.; Booher, R.; Dembski, M.; Kirschner, M.; Beach, D. (1991). “Mik1 and wee1 cooperate in the inhibitory tyrosine phosphorylation of cdc2”. Cell 64 (6): 1111–1122. doi:10.1016/0092-8674(91)90266-2. PMID 1706223.
- ^ DiPaola, Robert S. (2002-11). “To arrest or not to G(2)-M Cell-cycle arrest : commentary re: A. K. Tyagi et al., Silibinin strongly synergizes human prostate carcinoma DU145 cells to doxorubicin-induced growth inhibition, G(2)-M arrest, and apoptosis. Clin. cancer res., 8: 3512-3519, 2002”. Clinical Cancer Research: An Official Journal of the American Association for Cancer Research 8 (11): 3311–3314. ISSN 1078-0432. PMID 12429616.
