シナプス
細胞生物学において、シナプス(synapse)は、神経細胞間あるいは筋繊維(筋線維)、神経細胞と他種細胞間に形成される、シグナル伝達などの神経活動に関わる接合部位とその構造である。化学シナプス(小胞シナプス)と電気シナプス(無小胞シナプス)、および両者が混在する混合シナプスに分類される。シグナルを伝える方の細胞をシナプス前細胞、伝えられる方の細胞をシナプス後細胞という。

化学シナプス
[編集]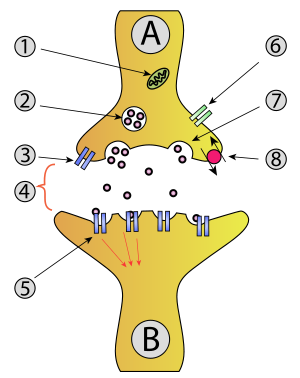
化学シナプスとは、細胞間に神経伝達物質が放出され、それが受容体に結合することによって細胞間の情報伝達が行われるシナプスのことを指す。化学シナプスは電気シナプスより広範に見られ、一般にシナプスとだけ言われるときはこちらを指すことが多い。
構造と機序
[編集]化学シナプスの基本的構造は、神経細胞の軸索の先端が他の細胞(神経細胞の樹状突起や筋線維)と20nm程度の隙間(シナプス間隙)を空けて、シナプス接着分子によって細胞接着している状態である。シナプス間隙は模式図では強調されて大きな隙間をあけて描かれることが多いが、実際にはかなりべったりと接合している。
情報伝達は一方向に行われ、興奮がシナプスに達するとシナプス小胞が細胞膜に融合しシナプス間隙に神経伝達物質が放出される。そして拡散した神経伝達物質がシナプス後細胞に存在する受容体に結合することで刺激が伝達されて行く。
化学シナプスにおける典型的な情報伝達機序は以下のように進む。
- 前シナプス細胞の軸索を活動電位が伝わり、末端にある膨らみであるシナプス小頭に到達する。
- 活動電位によりシナプス小頭の膜上に位置する電位依存性カルシウムイオンチャネルが開く。
- するとカルシウムイオンがシナプス内に流入し、シナプス小胞が細胞膜に接して神経伝達物質が細胞外に開口放出される。
- 神経伝達物質はシナプス間隙を拡散し、後シナプス細胞の細胞膜上に分布する神経伝達物質受容体に結合する。
- 後シナプス細胞のイオンチャネルが開き、細胞膜内外の電位差が変化する。
分類
[編集]化学シナプスは、興奮性シナプス、抑制性シナプス(シナプス後抑制性とも呼ばれる)、シナプス前抑制性の3つに分けられる。
- 興奮性シナプスは信号を受け取ると、興奮性シナプス後電位(EPSP; Excitatory PostSynaptic Potential)という信号を発生させる。EPSPは神経細胞の分極状態が崩れる電位となるため、脱分極と呼ばれる。
- 抑制性シナプスは信号を受け取ると、抑制性シナプス後電位(IPSP; Inhibitory PostSynaptic Potential)という信号を発生させる。IPSPは神経細胞の分極状態が強化される電位となるため、過分極と呼ばれる。
- シナプス前抑制性は、興奮性シナプスが起こす興奮性シナプス後電位(EPSP)を減少させる働きを持つ。
可塑性
[編集]シナプスの活動状態などによってシナプスの伝達効率が変化するシナプス可塑性は、記憶や学習に重要な役割を持つと考えられている。
シナプス前細胞とシナプス後細胞がともに高頻度で連続発火すると、持続的なEPSPによりシナプスの伝達効率が増加する。これを長期増強(LTP; Long Term Potentiation)という。また、低頻度の発火や、抑制性シナプス後細胞の連続発火によるIPSPの持続によって、シナプスの伝達効率が低下する現象を長期抑圧(LTD; Long Term Depression)という。近年では、シナプス前細胞とシナプス後細胞の発火時間差のみによっても結合強度に変化が見られることが分かっている。これをスパイクタイミング依存シナプス可塑性(STDP; Spike Timing Dependent Plasticity)という。
また、一旦LTPやLTDを起こしたシナプスに対して適切な刺激を与えると、そのLTPやLTDが消失する事も知られており、それぞれ脱増強 (Depotentiation)、脱抑圧 (Dedepression) などと呼ばれる。
電気シナプス
[編集]
電気シナプスとは、細胞間がイオンなどを通過させる分子で接着され、細胞間に直接イオン電流が流れることによって細胞間のシグナル伝達が行われるシナプスのことを指す。網膜の神経細胞間や心筋の筋繊維間などで広範に見られる。 化学シナプスのように方向づけられた伝達はできないが、それよりも高速な伝達が行われ、多くの細胞が協調して動作する現象を引き起こす。
電気シナプスは無脊椎動物の神経系では一般的にみられるが、長らく脊椎動物の中枢神経系では見出されておらず、脊椎動物の脳での神経伝達は化学シナプスのみによるものと考えられていた。 後になって海馬や大脳皮質の抑制性介在神経細胞の樹状突起間や下オリーブ核[1]そして視床[2]などでも発見され、伝達の遅延が問題になる中枢情報の重要な伝達手段となっていることが見出された。これにより同期した活動が大脳皮質に投射することが脳波として観察されることが明らかになった。
構造と機序
[編集]電気シナプスは一般に、コネクソンというタンパク質6量体が2つの細胞の細胞膜を貫通し、ギャップ結合と呼ばれる細胞間結合を形成している構造を持つ。コネクソンはコネキシンというタンパク質が六角形に配列した6量体構造で、中央に小孔が存在する。この小孔はカルシウムイオン濃度によってコネクソンが変形することで開閉する。小孔が開いているときには分子量が1000程度以下の分子を通過させ、濃度勾配圧などによって拡散する。 化学シナプスが数十 nm の間隔を持つのに対して、電気シナプスではコネクソンが両細胞膜の間隔を数 nm まで接近させており、極めて近接している。
形成
[編集]発生過程でのシナプスの形成は、伸長する軸索の先端に存在する成長円錐が標的に到達した時に開始する(軸索誘導、シナプス形成、神経回路形成)。
分布とシグナル伝達
[編集]

神経終末の末端(神経終末球)に神経インパルスが到達すると、神経伝達物質であるアセチルコリンが、筋形質膜と神経終末球の間に広がるシナプス間隙に放出される。筋形質膜の凹凸部を運動終板と呼ぶ。運動終板上にはアセチルコリン受容体が位置し、アセチルコリンを受け取ると、ナトリウムイオンチャネルが開き、ナトリウムイオンが流れ込む。すると筋活動電位が発生し、筋肉が収縮する。アセチルコリンはアセチルコリンエステラーゼによって急速に分解される。
脚注
[編集]出典
[編集]- ^ Llinas, R., Baker, R. and Sotelo, C. (1974), Electrotonic coupling between neurons in cat inferior olive, J. Neurophysiol., 37: 560 – 571
- ^ Condorelli D.F.Trovato-Salinaro A.Mudo G.Mirone M.B.Belluardo N.fCellular expression of connexins in the rat brain neuronal localization, effects of kainate-induced seizures and expression in apoptotic neuronal cells.Eur. J. Neurosci. 2003; 18: 1807-1827
